Igal inimesel on immuunsüsteem, mille eesmärk on ära tunda ja kaitsta keha võõrkehade eest. Immuunsuse lõppeesmärk on hävitada mikroorganismid, ebatüüpilised rakud, mis avaldavad negatiivset mõju inimese tervisele. Sõltuvalt päritolust eristatakse primaarset ja sekundaarset immuunpuudulikkust. Immuunpuudulikkuse korral on kõik infektsioonid ja haigused raskemad, sagedamini muutuvad need üle krooniline vorm ja neil on tüsistusi.
Mis on primaarne immuunpuudulikkus?
Primaarne immuunpuudulikkus on pärilik või loote arengu käigus omandatud seisund, mille puhul esineb tööprobleeme. immuunsussüsteem. Teisisõnu, laps sünnib ilma võimeta end kaitsta igasuguste nakkuste ja viiruste eest. Primaarne immuunpuudulikkus lastel diagnoositakse varases eas. Raske vormiga patsiendid tavaliselt surevad. Mõne haigusvormi puhul võib esimesi sümptomeid tuvastada juba täiskasvanueas. See juhtub siis, kui patsiendil on teatud haigusvormi puhul hea hüvitis. Kliinilist pilti väljendavad korduvad ja kroonilised nakkusprotsessid. Sageli mõjutab bronhopulmonaalsüsteemi, ENT organeid, nahka ja limaskesti. Primaarne immuunpuudulikkus võib põhjustada mädase lümfadeniidi, abstsessi, osteomüeliidi, meningiidi ja sepsise teket.
Mõned vormid avalduvad allergiates, autoimmuunhaigustes, võivad provotseerida arengut pahaloomulised kasvajad. Immunoloogia aitab ära tunda primaarseid immuunpuudulikkusi - teadus, mis uurib keha enesekaitse mehhanisme mis tahes kahjulike ainete eest.
Kaasasündinud immuunpuudulikkust on raske diagnoosida. Varajane diagnoosimine on oluline järgmistel põhjustel:
- õigeaegne diagnoosimine ja õigesti määratud ravi aitavad säilitada patsientide kõrget elukvaliteeti paljude aastate jooksul;
- esmase immuunpuudulikkuse diagnoosimine ja defektsete geenide äratundmine võimaldab pereliikmetele kättesaadaval kujul selgitada meditsiinilise geneetilise järelduse tulemusi ning teha sünnieelset diagnostikat.

Primaarsed immuunpuudulikkused: klassifikatsioon
Immuunpuudulikkus viitab püsivale muutusele immuunsüsteemis, mis on põhjustatud ühe või mitme immuunvastuse mehhanismi defektist. Seda on nelja tüüpi:
- Vanusega seotud, varases lapsepõlves või vanemas eas tekkiv.
- Omandatud.
- Nakkuslik, viiruse poolt esile kutsutud.
- Kaasasündinud (primaarsed immuunpuudulikkused).
Primaarse immuunpuudulikkuse klassifikatsioon on järgmine:
- Immuunpuudulikkus, mis on seotud mitut tüüpi rakkude kahjustusega:
● Retikulaarne düsgenees – seda iseloomustab tüvirakkude täielik puudumine. See haigusvorm ei sobi kokku eluga.
● Raske kombineeritud immuunpuudulikkus, mis on põhjustatud nii T-lümfotsüütide kui ka B-lümfotsüütide defektidest. - Peamiselt T-rakkude kahjustusest põhjustatud immuunpuudulikkus: Di George'i sündroom, mida iseloomustab harknääre puudumine või vähearenenud harknääre) ja kõrvalkilpnäärmed, kaasasündinud südamerikked, näo struktuuri deformatsioonid. Haigusega võivad kaasneda kõrvalekalded luustiku, neerude, närvisüsteem.
- Immuunpuudulikkus koos valdava B-rakkude kahjustusega.
- Müeloidrakkude lüüasaamine kutsub esile primaarse immuunpuudulikkuse. Kroonilisel granulomatoossel haigusel on reaktiivsete hapnikuliikide tootmisel ilmne defekt. Selle tulemusena tekivad kroonilised bakterite või seente põhjustatud infektsioonid.
- Immuunpuudulikkused, mis on seotud komplemendi süsteemi defektidega. Need vead toovad kaasa puudumise või täielik puudumine erinevad komplemendi komponendid.
Esineb ka rakulisi, raku-humoraalseid ja primaarseid humoraalseid immuunpuudulikkusi. Lümfotsüütide, makrofaagide ja plasmarakkude puudulikkusega seotud defekte võib seostada immuunpuudulikkuse rakulise vormiga. Humoraalne vorm on tingitud antikehade puudusest.
Mis on sekundaarne immuunpuudulikkus?
Seda tüüpi immuunpuudulikkus ei ole pärilik haigus. Seda omandatakse kogu elu jooksul. Bioloogiliste, keemiliste ja keskkonnategurite mõju võib põhjustada selle arengut. Ei ole kaitstud sekundaarse immuunpuudulikkuse ja ebatervisliku eluviisiga, alatoidetud, pidevas stressiseisundis olevate inimeste eest. Kõige sagedamini kannatavad täiskasvanud.
Sekundaarsete immuunpuudulikkuste klassifikatsioon
hulgas sekundaarsed olekud Immuunpuudulikkust on kolm vormi:
- omandatud, mille näide on AIDS, mille provotseerib immuunsüsteemi kahjustus inimese immuunpuudulikkuse viiruse poolt;
- indutseeritud, mis on tingitud kokkupuutest spetsiifiliste stiimulitega röntgenikiirte kujul, kortikosteroidide kasutamisest, traumadest ja kirurgilistest sekkumistest;
- spontaanne, mida iseloomustab ilmse põhjuse puudumine, mis viis immuunpuudulikkuse tekkeni.
Sekundaarsed immuunpuudulikkused jagunevad ka pöörduvateks ja pöördumatuteks. Pöörduva immuunpuudulikkuse variant võib olla nälg ja sellega seotud elutähtsate komponentide puudus. HIV-nakkus on näide immuunpuudulikkuse pöördumatust vormist.
Immuunpuudulikkuse tunnused
Haiguse peamine sümptom on inimese eelsoodumus sagedasteks haigusteks. nakkav iseloom. Primaarset immuunpuudulikkust iseloomustavad korduvad hingamisteede infektsioonid. Siin on vaja selgelt eristada immuunpuudulikkusega ja nõrgenenud immuunsusega inimesi.

Selle haiguse iseloomulikum sümptom on bakteriaalsete infektsioonide esinemine koos sagedaste ägenemistega. See väljendub korduvates kurguvaludes, nina sügeluses, mis viib kroonilise põskkoopapõletiku, bronhiidi ja keskkõrvapõletiku tekkeni. Ravi käigus olev keha ei suuda haiguse põhjustajast täielikult vabaneda ja seetõttu esineb retsidiive. Primaarne immuunpuudulikkus lastel võib põhjustada autoimmuunhaigusi, nagu autoimmuunne endokrinopaatia, hemolüütiline aneemia, reumatoidartriit. Selles seisundis lapsed on vastuvõtlikud mitmele nakkusetekitajale korraga. Sellele seisundile on tüüpiline ka seedesüsteemi häire. Täiskasvanute esmane immuunpuudulikkus võib väljenduda suure hulga tüükade ja papilloomide esinemises kehal.
Primaarse immuunpuudulikkuse diagnoosimine

Haiguse diagnoosimine algab anamneesi kogumisega. Arst peaks koguma perekonna ajalugu, eriti kui diagnoositakse esmase vormiga laps. Patsient tuleb üle vaadata, hinnata limaskesta ja naha seisundit, maksa ja põrna suurust. Sellist diagnoosi iseloomustavad ka ilmingud silmapõletiku, ninasõõrmete turse, kroonilise pikaajalise köha kujul.
Täpse diagnoosi tegemiseks tuleks teha üksikasjalik vereanalüüs, mis näitab erinevate rakkude arvu organismis, immunoglobuliini taset. Kohustuslik on analüüs, mis näitab valkude sisaldust veres, mis näitab keha võimet seista vastu erinevatele infektsioonidele.
Sünnieelne diagnoos
On kindlaks tehtud, et primaarne immuunpuudulikkus on pärilik haigus ja mitte nii haruldane, kui arvati. Tänaseks on saanud võimalikuks tuvastada muteerunud geeni kandja ja nõustada peresid, kes plaanivad sünnitada haigestumisriskiga last. Kui peres on juba selle haigusega laps, tehakse mutatsioonianalüüs, misjärel diagnostiline uuring embrüo. Selleks tehakse looterakke sisaldava amnionivedeliku molekulaaranalüüs.
Tüsistused pärast immuunpuudulikkust
Primaarsed ja sekundaarsed immuunpuudulikkused võivad põhjustada raskekujulisi tüsistusi nakkushaigused nagu sepsis, kopsupõletik ja abstsessid. Pidades silmas immuunpuudulikkusest põhjustatud haiguste üsna suurt hulka, võimalikud tüsistused tuleb määrata individuaalselt.
Immuunpuudulikkuse seisundi ravi

Primaarne immuunpuudulikkus, mille ravi on keeruline ja pikk protsess, nõuab ravi tervislik eluviis elu ja vältida nakkusi. Enne kompleksravi määramist tuleb immuunkaitsesüsteemi katkenud lüli kindlaksmääramise teel panna paika täpne diagnoos. Kui tuvastatakse immunoglobuliini puudus, viiakse asendusravi antikehi sisaldavate seerumitega läbi kogu elu. Nakkushaiguste tekkivaid tüsistusi ravitakse antibiootikumide, viirusevastaste ja seenevastaste ravimitega. Mõnel juhul ravitakse primaarset immuunpuudulikkust subkutaanselt või intravenoosselt manustatava immunoglobuliiniga.
Immunokorrektsioon viiakse läbi ka tänu luuüdi siirdamisele ja immunomodulaatorite kasutamisele.
Selle haigusega lapsi ei tohi vaktsineerida elusvaktsiinidega. Lapsega koos elavaid täiskasvanuid vaktsineeritakse ainult inaktiveeritud lastehalvatuse vaktsiiniga.
Sekundaarse immuunpuudulikkuse korral on immuunsüsteemi töös vähem väljendunud häired.
Seda haigust provotseerivad hematopoeetilise süsteemi häired, mis võivad olla kaasasündinud või omandatud. Luuüdi lihtsalt lõpetab vererakkude tootmise. Esineb erütrotsüütide, trombotsüütide ja leukotsüütide defitsiit.
Selle esinemise võib vallandada individuaalne talumatus, eriti teatud ravimite suhtes. Selle tundlikkuse põhjus ei ole alati selge, kuid see võib olla tingitud hematopoeetiliste rakkude geneetilisest defektist.
Muud põhjused võivad olla ka:

Aplastilise aneemia tunnused
Selle seisundi sümptomiteks on:
- pidev väsimus ja nõrkus;
- ebaregulaarne südamerütm;
- kahvatu nahk;
- sagedane verejooks ninast;
- pikaajaline verejooks pärast lõikeid;
- veritsevad igemed;
- sagedased nakkushaigused;
- pearinglus ja migreen.
Aplastilise aneemia ravi
Kerged haigusjuhud nõuavad ainult patsiendi pidevat jälgimist. Keerulisemates tingimustes kasutatakse vereülekannet, luuüdi siirdamist ja spetsiaalseid ravimeid, mis stimuleerivad vereloome rakke. Sageli kasutatakse ravi ajal immunosupressiivseid ravimeid, mis aitavad nõrgendada organismi immuunvastust, mistõttu immuunsüsteemi rakud ei reageeri luukoele. AT viimased aastadÜha enam kalduvad arstid kiirele luuüdi siirdamisele, mis väldib paljusid tüsistusi.
Primaarse immuunpuudulikkuse ennetamine
Primaarne immuunpuudulikkuse sündroom on pärilik haigus ja seetõttu puuduvad selle jaoks ennetavad meetmed. Immuunpuudulikkuse seisundi ilmingute vältimiseks tuleks tuvastada võimalik defektse geeni kandja positiivse ajalooga perekonnas. Sellise patoloogia nagu raske kombineeritud immuunpuudulikkuse korral on võimalik emakasisene diagnoos.

Sekundaarsete immuunpuudulikkuse ennetava meetmena tuleks järgida õiget elustiili, olla mõõdukas. füüsiline harjutus et vältida HIV-nakkuse sattumist organismi. Ja selleks peate vältima kaitsmata seksuaalsuhteid ja kasutama kindlasti steriilseid meditsiiniinstrumente. Immuunpuudulikkusest provotseeritud haigused on keerulised ja salakavalad mis tahes avaldumisvormis. Hoolikas suhtumine oma tervisesse, integreeritud lähenemine ja õigeaegne juurdepääs arstidele aitavad päästa meie tulevikku - meie lapsi.
Primaarsed immuunpuudulikkused (PID)- need on kaasasündinud immuunsüsteemi häired, mis on seotud ühe või mitme immuunsüsteemi komponendi geneetiliste defektidega, nimelt: komplement, fagotsütoos, humoraalne ja rakuline immuunsus. Kõikide PID tüüpide ühiseks tunnuseks on korduvad kroonilised infektsioonid, mis mõjutavad erinevaid elundeid ja kudesid ning on reeglina põhjustatud oportunistlikest või oportunistlikest mikroorganismidest, st madala virulentse taimestikuga. PID-d seostatakse sageli teiste kehasüsteemide anatoomiliste ja funktsionaalsete häiretega ning neil on mõned iseloomulikud tunnused, mis võimaldavad vastsündinutel teha esialgse diagnoosi ilma laboratoorse ja immunoloogilise uuringuta (vt tabelit).
| Küsitluse andmed | Esialgne diagnoos |
| Kaasasündinud südamerikked, hüpoparatüreoidism, tüüpiline nägu | DiGeorge'i sündroom |
| Külmad abstsessid, tüüpiline nägu, kopsu õhutsüst | Hüper-IgE sündroom |
| Nabahaava aeglane paranemine | Leukotsüütide adhesioonidefekt (LAD sündroom) |
| Ekseem + trombotsütopeenia | Wiskott-Aldrichi sündroom |
| Ataksia + telangiektaasia | Louis Bari sündroom |
| Silmade ja naha osaline albinism, hiiglaslikud graanulid fagotsüütides | Chediak-Higachi sündroom |
| Harknääre varju puudumine fluoroskoopial, kõrvalekalded ribide arengus | Adenosiindeaminaasi defekt |
| Naha ja limaskesta kandidoosi kahjustused, autoimmuunsed kandidoosi endokrinopaatiad | Krooniline mukokutaanne |
Immuunsüsteemi erinevad komponendid võivad makroorganismist mikroobide elimineerimisel ebavõrdselt osaleda. Järelikult oma olemuselt nakkusprotsess Samuti saab eelnevalt hinnata, milline immuunsuse komponent ei tööta piisavalt. Seega, kui lapse esimestel elupäevadel tekivad püogeensetest kookidest põhjustatud mädased-põletikulised protsessid nahal ja limaskestadel, on põhjust mõelda fagotsüütsüsteemi kaasasündinud defektide olemasolule. Neid iseloomustab ka nabahaava väga aeglane paranemine ja nabanöörist mahakukkumine. Antikehade tootmise defektiga seotud nakkusprotsessid arenevad reeglina lapse elu teisel poolel pärast ema immunoglobuliinide kadumist vereringest. Kõige sagedamini on need infektsioonid põhjustatud kapseldatud püogeensetest mikroorganismidest (streptokokid, pneumokokid, Haemophiuls influlenzae jne), mis mõjutavad ülemisi ja alumisi hingamisteid. Püsivad neisseriainfektsioonid on sageli seotud komplemendi komponentide C5-C9 sünnidefektidega. Viiruste ja teiste intratsellulaarsete patogeenide põhjustatud sagedased nakkusprotsessid viitavad immuunsuse T-süsteemi defektile. Sellele võib viidata ka mukokutaanne kandidoos. Kroonilise kopsupõletiku, pikaajalise, raskesti ravitava kõhulahtisuse ja kandidoosi kolmik on alati aluseks kaasasündinud T-lümfotsüütide defektide oletamisel. Immuunsuse T- ja B-süsteemide kombineeritud defekte iseloomustab ebatavaliselt raske nakkusprotsesside kulg, mis areneb lapse esimesel elukuul. Ilma asjakohase ravita sureb laps reeglina esimesel eluaastal.
Immuunsüsteemi spetsiifilise rikkumise tuvastamiseks ja kliinilise diagnoosi kinnitamiseks viiakse läbi laboratoorne ja immunoloogiline uuring. Esmase diagnoosi saab teha laboratoorsete sõeluuringute paneeli abil.
Sõeluuringu laboratoorsete testide paneeli kasutamine on võimalik peaaegu igas piirkondlikus või linnahaiglas, kus on kliinilise diagnostika labor. Kuid süvaanalüüsi saab läbi viia ainult spetsiaalses meditsiiniasutuses, kus on kaasaegne kliinilise immunoloogia labor. PID-i kahtlusega patsienti tuleb üksikasjalikult uurida funktsionaalne aktiivsus fagotsüüdid, immuunsuse T- ja B-süsteemid. Immuunsuse hindamise metoodilisi lähenemisviise kirjeldatakse üksikasjalikumalt vastavas jaotises.
Praeguseks on tuvastatud üle 70 immuunsüsteemi kaasasündinud defekti ja tõenäoliselt suureneb nende arv koos molekulaarse immunodiagnostika meetodite täiustumisega. PID-d on suhteliselt haruldased haigused: nende esinemissagedus on keskmiselt 1/25000-1/100000. Erandiks on selektiivne IgA puudulikkus, mis esineb sagedusega 1/500-1/700. PID-i uurimine pakub suurt huvi teoreetilise ja rakendusliku immunoloogia jaoks. Nende defektide aluseks olevate molekulaargeneetiliste mehhanismide analüüs võimaldab tuvastada põhimõtteliselt uusi immuunsüsteemi toimimise mehhanisme ja sellest tulenevalt välja töötada uusi lähenemisviise immuunsüsteemi häiretega seotud haiguste immuundiagnostikaks ja immunoteraapiaks.
Sekundaarsed immuunpuudulikkused (SID). Kliinilise immunoloogia jaoks pakub märkimisväärset huvi VID-ide uurimine, mis kvantitatiivses mõttes on immuunpuudulikkuse hulgas kahtlemata domineerivad. VID viitab immuunsüsteemi häiretele, mis tekivad hilises sünnitusjärgses perioodis või täiskasvanutel ja mida üldiselt ei arvata olevat mõne geneetilise defekti tagajärg. VID-i hulgas saab tinglikult eristada kolme vormi: omandatud, indutseeritud ja spontaanne. Esimese vormi markantseim näide on omandatud immuunpuudulikkuse sündroom (AIDS), mis tekib inimese lümfoidkoe kahjustuse tagajärjel vastava viiruse poolt. Indutseeritud VID on haigusseisundid, mis tekivad konkreetsel põhjusel: röntgenkiirgus, kortikosteroidid, tsütostaatikumid, traumad ja operatsioonid, samuti immuunsüsteemi häired, mis tekivad sekundaarselt põhihaigusest (diabeet, neeru- ja maksahaigused, pahaloomulised protsessid jne). ). Reeglina on VID indutseeritud vormid mööduvad ja kui põhjus on kõrvaldatud, taastub enamikul juhtudel immuunsus täielikult. Erinevalt indutseeritud vormist iseloomustab VID-i spontaanset vormi ilmse põhjuse puudumine, mis põhjustas immunoloogilise reaktiivsuse rikkumise. Sarnaselt PID-ga avaldub see immuunpuudulikkuse vorm krooniliste, korduvate, nakkuslike ja põletikuliste protsessidena bronhopulmonaarses aparatuuris ja paranasaalsetes ninakõrvalurgetes, urogenitaal- ja seedetraktis, silmades, nahas ja pehmetes kudedes, mis on sarnaselt PID-ga põhjustatud oportunistlikust haigusest. või oportunistlikud patogeenid, millel on ebatüüpilised bioloogilised omadused ja sageli mitmekordne antibiootikumiresistentsus. Kvantitatiivses mõttes on spontaanne vorm VID-i domineeriv vorm.
- Hinne immuunseisund immuunpuudulikkusega
Nagu juba märgitud, peaks immuunpuudulikkuse immuunseisundi uurimine hõlmama immuunsüsteemi peamiste komponentide koguse ja funktsionaalse aktiivsuse uurimist, mis mängivad olulist rolli keha infektsioonivastases kaitses. Nende hulka kuuluvad fagotsüütsüsteem, komplemendi süsteem, immuunsuse T- ja B-süsteemid. Nende süsteemide toimimise hindamiseks kasutatud meetodid jagavad tinglikult R. V. Petrovi jt. (1984) 1. ja 2. taseme testide jaoks. Nende autorite sõnul on 1. taseme testid soovituslikud ja on suunatud immuunsüsteemi raskete defektide tuvastamisele; 2. taseme testid on funktsionaalsed ja nende eesmärk on tuvastada immuunsüsteemi spetsiifiline "rikke". Peame silmas 1. taseme meetodite teste, mille eesmärk on tuvastada vastava immuunsüsteemi toimimise produkti, mis määrab selle antimikroobse toime. 2. taseme testid on valikulised. Need rikastavad oluliselt teavet vastava immuunsüsteemi toimimise kohta.
1. taseme testid fagotsütoosi hindamiseks hõlmavad järgmist:
- neutrofiilide ja monotsüütide absoluutarv;
- neutrofiilide ja monotsüütide mikroobide imendumise intensiivsus;
- fagotsüütide võime mikroobe tappa.
Fagotsütoosi protsess koosneb mitmest etapist: kemotaksis, adhesioon, imendumine, degranulatsioon, objekti tapmine ja hävitamine. Nende uuringul on teatav tähtsus fagotsüütilise protsessi hindamisel, kuna peaaegu igas etapis esineb immuunpuudulikkust, mis on seotud rikete esinemisega. Neutrofiilide ja monotsüütide töö peamine tulemus on mikroobi tapmine ja hävitamine, st täielik fagotsütoos. Tapmise hindamiseks on võimalik soovitada määrata reaktiivsete hapnikuliikide moodustumist fagotsütoosi protsessis. Kui kemoluminestsentsi abil ei ole võimalik reaktiivseid hapniku liike määrata, saab superoksiidradikaali moodustumist hinnata nitrosiintetrasooliumi redutseerimise järgi. Kuid sel juhul tuleb meeles pidada, et mikroobide tapmine fagotsüütides toimub nii hapnikust sõltuvate kui ka hapnikust sõltumatute mehhanismide abil, st reaktiivsete hapnikuliikide määramine ei anna selle protsessi kohta täielikku teavet.
Fagotsütoosi hindamise 2. taseme testid hõlmavad järgmist:
- fagotsüütide kemotaksise intensiivsus;
- adhesioonimolekulide (CD11a, CD11b, CD11c, CD18) ekspressioon neutrofiilide pinnamembraanil.
Immuunsuse B-süsteemi hindamise 1. taseme testid hõlmavad järgmist:
- immunoglobuliinid G, A, M vereseerumis;
- immunoglobuliin E vereseerumis;
- perifeerses veres B-lümfotsüütide (CD19, CD20) protsendi ja absoluutarvu määramine.
Immunoglobuliini taseme määramine on endiselt oluline ja usaldusväärne meetod B-süsteemi immuunsuse hindamiseks. Seda võib pidada peamiseks meetodiks kõigi antikehade biosünteesiga seotud immuunpuudulikkuse vormide diagnoosimiseks.
Immuunsuse B-süsteemi hindamise 2. taseme testid hõlmavad järgmist:
- immunoglobuliinide alamklassid, eriti IgG;
- sekretoorne IgA;
- kappa ja lambda ahelate suhted;
- spetsiifilised antikehad valgu- ja polüsahhariidantigeenide vastu;
- lümfotsüütide võime anda proliferatiivne reaktsioon B- (stafülokokk, enterobakterite lipopolüsahhariid) ja T-B- (laconos mitogen) mitogeenidele.
IgG alamklasside määratlus on diagnostilise väärtusega, kuna normaalse IgG taseme korral võib immunoglobuliinide alamklassides esineda puudujääke. Sellistel inimestel täheldatakse mõnel juhul immuunpuudulikkuse seisundeid, mis väljenduvad nakkusliku haigestumuse suurenemises. Seega on IgG2 immunoglobuliin G alamklass, mis sisaldab peamiselt kapseldatud bakterite (Haemophiluls influlenzae, Steptococculs pneulmoniae) polüsahhariidide vastaseid antikehi. Seetõttu põhjustab IgG2 ja IgA defitsiit hingamisteede infektsioonide esinemissageduse suurenemist. Häired IgA alamklasside vahekorras ning kappa ja lambda ahelate vahekorras võivad samuti olla immuunpuudulikkuse seisundite põhjuseks. Olulist teavet humoraalse immuunsuse seisundi kohta annab bakteriaalsete valkude ja polüsahhariidide antigeenide antikehade määramine, kuna keha kaitse aste selle konkreetse infektsiooni eest ei sõltu immunoglobuliinide üldisest tasemest, vaid antikehade hulgast. selle patogeenile. Seda näitavad eriti selgelt andmed, mis näitavad, et kroonilise sinusiidi ja keskkõrvapõletiku teke sõltub ainult Moraxella catarrhalis'e vastaste IgG3 antikehade puudulikkusest sellistel patsientidel. Teiseks illustreerivaks näiteks spetsiifiliste antikehade määramise tähtsusest võivad olla andmed, mis tõendavad, et inimestel, kes kannatavad sagedaste nakkusprotsesside all. hingamisteed, kõigi immunoglobuliinide klasside normaalsel tasemel on Haemophiuls influlenzae vastaste antikehade tiiter oluliselt vähenenud.
Väärtuslikku teavet humoraalse immuunsuse seisundi kohta saab mitte ainult immunoglobuliinide, nende alamklasside või teatud antigeenide vastaste antikehade taseme määramisel, vaid ka nende funktsionaalseid omadusi uurides. Esiteks peaksid need sisaldama sellist antikehade omadust nagu afiinsus, millest sõltub suuresti antikehade interaktsiooni tugevus antigeeniga. Madala afiinsusega antikehade tootmine võib viia immuunpuudulikkuse seisundi tekkeni. Oleme tõestanud, et inimestel, kes põevad sageli ja pikaajaliselt hingamisteede haigusi, on normaalse immunoglobuliinide tasemega, veidi suurenenud antikehade tase peptidoglükaani St.aulreuls, Str.pneulmoniae, Br.catarrhalis, afiinsus. nende mikroobide vastaste antikehade hulk on oluliselt vähenenud.
Oluline funktsionaalne omadus on immunoglobuliinide opsoniseeriv toime. Nagu juba märgitud, on neutrofiilidel keskne näitaja keha kaitses rakuväliste mikroobide vastu. Selle funktsiooni täitmine sõltub aga suuresti vereseerumi opsoneerivast aktiivsusest, kus immunoglobuliinid ja komplement mängivad selles tegevuses juhtivat rolli. Uuringus 30 gramnegatiivsete bakterite põhjustatud baktereemiaga patsiendiga leiti, et nende patsientide neutrofiilidel oli vähenenud E. coli hävitamise võime. See sõltus ainult patsientide vereseerumi võimetusest opsoniseerida, kuna tervete doonorite seerumi lisamine nende patsientide neutrofiilidele taastas täielikult neutrofiilide võime tappa E.coli.
Immuunsuse T-süsteemi hindamise 1. taseme testid hõlmavad järgmist:
- lümfotsüütide koguarv;
- küpsete T-lümfotsüütide (CD3) protsent ja absoluutarv ning nende kaks peamist alampopulatsiooni: abistaja/indutseerija (CD4) ja tapja/supressor (CD8);
- proliferatiivne reaktsioon peamistele T-mitogeenidele: fütohemaglutiniin ja konkanavaliin A.
Immuunsuse B-süsteemi hindamisel soovitasime 1. taseme testidena määrata B-lümfotsüütide arvu, aga ka immunoglobuliinide taset. Kuna viimased on B-rakkude peamine lõpp-produkt, võimaldab see hinnata B-immuunsüsteemi nii kvantitatiivselt kui ka funktsionaalselt. Sellist lähenemist on immuunsüsteemi T-süsteemi puhul endiselt raske rakendada, kuna tsütokiinid on T-lümfotsüütide peamine lõpp-produkt ja nende määramise süsteemid on kliinilise immunoloogia praktilistele laboritele endiselt halvasti kättesaadavad. Sellegipoolest on immuunsuse T-süsteemi funktsionaalse aktiivsuse hindamine erakordse tähtsusega ülesanne, kuna seda saab normaalse arvu T-rakkude ja nende alampopulatsioonide korral mõnikord isegi oluliselt vähendada. T-lümfotsüütide funktsionaalse aktiivsuse hindamise meetodid on üsna keerulised. Lihtsaim neist on meie arvates, milles kasutatakse kahte peamist T-mitogeeni: fütohemaglutiniini ja konkanaliin A. T-lümfotsüütide proliferatiivne reaktsioon mitogeenidele väheneb peaaegu kõigi krooniliste nakkus- ja põletikuliste protsesside, pahaloomuliste haiguste, eriti hematopoeetiline süsteem; igat tüüpi immunosupressiivse raviga, AIDS-i ja kõigi primaarsete T-rakuliste immuunpuudulikkustega.
Immuunsuse T-süsteemi hindamise 2. taseme testidele lisame määratluse:
- tsütokiinide tootmine (interleukiin-2, (IL-2), IL-4, IL-5, IL-6, gamma-interferoon, tuumori nekroosifaktor (TNF) jne);
- aktiveerimismolekulid T-lümfotsüütide pinnamembraanil (CD25, HLA-DR);
- adhesioonimolekulid (CD11a, CD18);
- proliferatiivne reaktsioon spetsiifilistele antigeenidele, kõige sagedamini difteeria ja teetanuse toksoididele;
- allergiline reaktsioon, kasutades nahateste mitmesuguste mikroobsete antigeenidega.
Kahtlemata peaks tsütokiinide produktsiooni määramine lümfotsüütide ja makrofaagide poolt saama immuunsüsteemi häiretega seotud haiguste immuundiagnostika peamiseks meetodiks. Tsütokiinide tuvastamine võimaldab mõnel juhul täpsemalt määrata haiguse diagnoosi ja immuunhäirete mehhanismi.
Samuti on oluline määrata sellised põletikueelsed tsütokiinid nagu TNF, IL-1 ja gamma-interferoon. Nende roll erinevate ägedate ja krooniliste nii nakkusliku kui ka autoimmuunse iseloomuga põletikuliste protsesside etiopatogeneesis on suur. Nende suurenenud moodustumine on septilise šoki peamine põhjus. Sepsise korral võib TNF-i tase veres ulatuda 1 ng / ml-ni. Kogutakse andmeid põletikueelsete tsütokiinide rolli kohta mittespetsiifilise haavandilise koliidi, hulgiskleroosi, reumatoidartriidi, insuliinsõltuva diabeedi jne etiopatogeneesis.
Peame immunodiagnostika jaoks oluliseks uurida aktivatsiooni- ja adhesioonimolekulide ekspressiooni T-lümfotsüütide pinnal. Nagu nimigi ütleb, annab aktivatsioonimolekulide tuvastamine olulist teavet T-rakkude aktivatsiooni astme kohta. IL-2 retseptori ekspressiooni halvenemist täheldatakse paljude pahaloomuliste verehaiguste - T-rakulise leukeemia, karvrakulise leukeemia, lümfogranulomatoos jne - ja autoimmuunprotsesside korral: reumatoidartriit, süsteemne erütematoosluupus, aplastiline aneemia, skleroderma, Crohni tõbi, sarkoidoos , insuliinsõltuv diabeet jne.
Meie arvates on eriline küsimus nahatestide kasutamisest T-rakulise immuunpuudulikkuse diagnoosimisel. Nagu juba märgitud, kasutatakse neid välisekspertide soovitusel ja vastavalt WHO ekspertide soovitustele sõeluuringuna või 1. taseme testidena immuunsuse T-süsteemi hindamiseks. See on tingitud kahest asjaolust. Esiteks on nahatestid kõige lihtsamad ja samal ajal informatiivsed testid, mis võimaldavad hinnata T-lümfotsüütide funktsionaalset aktiivsust. Positiivsed nahatestid mõne mikroobse antigeeniga suure tõenäosusega võimaldavad välistada T-rakulise immuunpuudulikkuse olemasolu patsiendil. Teiseks on mitmed lääne ettevõtted välja töötanud nahatestisüsteemid, mis sisaldavad T-rakkude immuunsuse mõõtmiseks olulisi antigeene. See võimaldab hinnata immuunsüsteemi T-süsteemi funktsionaalset aktiivsust rangelt kontrollitud tingimustes. Kahjuks Venemaal selliseid süsteeme pole ja seetõttu ei kasutata neid immuunsuse T-süsteemi hindamiseks praktiliselt.
Immuunsüsteemi hindamine inimestel, kellel on VID-i tunnused, võib lahendada mitmeid raskusi ja eelkõige seotud põhjuslike seoste hindamisega. Sageli on immuunsüsteemi parameetrite analüüsi käigus registreeritud muutused patoloogilise protsessi tagajärg, mitte põhjus. Seega on inimestel, kes on sageli ja pikaajaliselt hingamisteede infektsioonidega haiged, järsult suurenenud nende infektsioonide peamiste bakteriaalsete patogeenide antikehade tase. Sarnast olukorda täheldatakse AIDS-i patsientidel, kellel on hingamisteede nakkuslikud tüsistused. Loomulikult on hingamisteede patogeenide vastaste antikehade tiitrite tõus nii FDI-rühma patsientidel kui ka AIDS-i patsientidel immuunsüsteemi aktiveerumise tagajärg hingamisteede nakkus- ja põletikulise protsessi tulemusena. Teine raskus, millega arst võib krooniliste nakkus- ja põletikuliste protsessidega patsientide immuunseisundi hindamisel kokku puutuda, on adekvaatse metoodilise lähenemise ja uurimistööks piisava materjali valik. Kuigi teoreetilise ja kliinilise immunoloogia saavutusi on vaevalt võimalik üle hinnata ja immunoloogil on suur hulk kaasaegseid tehnikaid immuunsüsteemi seisundi määramiseks tuleb aga tõdeda, et immuunsüsteemi kui terviku toimimisest teame veel vähe. Konkreetset seost teatud haiguste arengu ja immuunsüsteemi erinevate osade rikkumise vahel ei ole piisavalt uuritud. Seetõttu sageli kasutamisel standardmeetodid fagotsütoosi, immuunsuse T- ja B-süsteemide hindamisel krooniliste nakkus- ja põletikuliste protsessidega patsientidel ei saa arst veenvat teavet nõrgenenud immuunsuse kohta. Nii näiteks ei tuvastanud me paranasaalsete siinuste krooniliste haigustega patsientidel immuunseisundi määramisel ülaltoodud parameetrite järgi olulisi kõrvalekaldeid. Samal ajal selgus, et sellistel patsientidel on Branhamella catarrhalis'e vastaste IgG3 antikehade sünteesi defekt ja see on patoloogilise protsessi arengu peamine põhjus. Nagu juba märgitud, suureneb bronhopulmonaarse aparaadi sagedaste nakkushaiguste all kannatavatel inimestel nende haiguste tekitajate vastaste antikehade tiiter. Selgus, et nende antikehade afiinsus on olulisel osal patsientidest oluliselt vähenenud. Ja madala afiinsusega antikehad on ebaefektiivsed patogeeni organismist eemaldamisel ja see võib olla üheks nakkusprotsessi kroonilisuse põhjuseks. Selliseid näiteid võiks tuua palju. Kõigil neil juhtudel on kliiniliselt selged immuunsüsteemi rikkumise tunnused, kuid need ei ole alati veenvalt kinnitatud immunolaboratooriumi uurimismeetoditega.
Teeme ettepaneku kaaluda kroonilist, korduvat, loid, raskesti traditsioonilist nakkushaiguste ravi. põletikulised protsessid täiskasvanud patsientidel tuvastatud mitmesugused lokalisatsioonid sekundaarse immuunpuudulikkuse seisundi ilminguna, olenemata sellest, kas selles laboris kasutatud testide abil tuvastati muutused immuunsüsteemis või mitte, st nendel juhtudel tuleks VID-i pidada puhtalt kliiniline kontseptsioon. Meil pole kahtlustki, et kroonilise nakkus-põletikulise protsessi esinemine on mingisuguse immuunsüsteemi ühe või mitme komponendi, mis kaitsevad organismi nakkuste eest, lagunemise tagajärg. Ja kui neid rikkeid ei tuvastatud, võib see, nagu just märgitud, olla ebaadekvaatse metodoloogilise lähenemise, ebapiisava materjali kasutamise tulemus uurimistöös või suutmatuse tuvastada olemasolevat riket teaduse arengu antud etapis. . Viimase olukorra tüüpiline näide on LAD-sündroom, mis seisneb adhesioonimolekulide ekspressiooni rikkumises fagotsüütilistel rakkudel. Selle avastamine sai võimalikuks ainult tänu hübridoomitehnoloogia tulekule ja monoklonaalsete antikehade tekkele.
Samas oleme teadlikud, et SIA spontaanse vormi väljatöötamine peab põhinema teatud kindlatel põhjustel. Nende põhjuste käsitlemiseks on asjakohane veel kord meelde tuletada, et inimese immuunsus on keerukas mitmekomponentne süsteem ning organismi nakkuste eest kaitsmisel osalevad nii kaasasündinud resistentsuse kui ka omandatud immuunsuse tegurid. Nakkusliku protsessi arengu varases staadiumis - esimese 96 tunni jooksul - kaitseb keha nakkustekitaja eest mittespetsiifiliste immuunsustegurite kombinatsiooniga, nagu komplemendi süsteem, ägeda faasi valgud, monokiinid, fagotsüüdid, looduslikud tapjad jne. Võimalik, et mõne nende süsteemide defekt ei pruugi mõnda aega kliiniliselt avalduda suurenenud nakkushaigestumisena, kuna kõik teised immuunsuse komponendid on normaalses funktsionaalses seisundis ja kompenseerivad selle defekti. Kuid muutused nendes kompenseerivates komponentides, mis toimuvad aja jooksul ja erinevate ebasoodsate tegurite mõjul, isegi kui need ei ole väga olulised, võivad avaldada kumulatiivset mõju, mis viib primaarse defekti fenotüübilise avaldumiseni ja haigestumuse suurenemiseni. Võib eeldada, et paljud ja võib-olla peaaegu kõik VID-i kliinilised vormid, mis avalduvad täiskasvanutel suurenenud nakkushaigestumuse kujul, põhinevad immuunsüsteemi mõne komponendi primaarsel immunoloogilisel puudulikkusel, mis on kompenseeritud kuni teatud aja jooksul. teiste normaalsele või kõrgele funktsionaalsele aktiivsusele.selle süsteemi komponendid. Seda võimalust võib kinnitada tavaline muutuv immuunpuudulikkus (CVID), mis avaldub kõige sagedamini bronhopulmonaarse aparatuuri ja ninakõrvalkoobaste kroonilistes korduvates infektsioonides. Seda haigust iseloomustab kõigi immunoglobuliinide klasside taseme langus. CVID-il on kaks tippu: esimene tipp areneb 6-10 aasta vahel, teine - 26-30 aasta vahel ja enne haiguse arengut on need patsiendid praktiliselt terved inimesed. On palju tõendeid selle kohta, et CVID-iga patsientide humoraalse immuunsuse defektil on geneetiline päritolu. Järelikult kompenseeriti see defekt teatud ajani immuunsüsteemi teiste komponentide normaalse või suurenenud funktsionaalse aktiivsuse tõttu, mis kaitsevad organismi nakkuste eest. Lisaks CVID-ile on mitmeid PID-ga seotud haigusi, kuid mõnikord ilmnevad need kliiniliselt täiskasvanueas. Nende hulka kuuluvad selektiivne IgA puudulikkus, IgG alamklasside puudulikkus, komplemendi süsteemi puudulikkus. Kirjeldatud on ainult lapsepõlves tüüpiliste PID-i täiskasvanute vormide esmase manifestatsiooni juhtumeid. Nende hulka kuuluvad adenosiindeaminaasi puudulikkus, Wiskott-Aldrichi sündroom, X-seotud agammaglobulineemia. Reeglina on nendel juhtudel haiguse sümptomite hilinenud ilmnemine selle isiku mõõduka geneetilise defekti tagajärg. Kuid ei saa välistada primaarse defekti kompenseerivat korrigeerimist immuunsuse muude komponentide tõttu. Nende muutumine ajas võimaldab esmasel, isegi kergel immuunsüsteemi defektil kliiniliselt avalduda.
- Immunomodulaatorite kasutamine immuunpuudulikkuse korral
Immunomoduleeriv ravi on PID-s ebaefektiivne või ebaefektiivne. Nende ravi peamised meetodid on antimikroobne ja asendusravi. Välismaal kasutatakse rekonstruktiivset ravi, mis seisneb luuüdi siirdamises haigetele lastele. Samuti arendatakse intensiivselt geeniteraapia meetodeid.
Immunomodulaatorite kasutamine on VID-is põhjendatum ja otstarbekam. Viimase määramine peaks alati toimuma kliinilise ja immunoloogilise läbivaatuse alusel. Sõltuvalt selle uuringu tulemustest võib eristada kahte inimrühma:
- kellel on nõrgenenud immuunsuse kliinilised tunnused koos immunoloogiliste meetodite abil tuvastatud parameetrite spetsiifiliste muutustega;
- millel on ainult nõrgenenud immuunsuse kliinilised tunnused, muutmata immuunsuse parameetreid.
Immunomodulaatorite määramise peamine kriteerium on kliiniline pilt. Immunomodulaatoreid võib (või tuleks) kasutada kompleksne teraapia nii esimese kui ka teise rühma patsiendid. Tekib küsimus, milliseid spetsiifilisi immunomodulaatoreid tuleks VID-i nähtude korral välja kirjutada? See probleem on eriti terav patsientidel, kellel ei ole tuvastatud immuunsüsteemi kõrvalekaldeid. Sellele küsimusele vastamiseks on vaja lühidalt analüüsida nakkusvastase kaitse peamisi mehhanisme, kuna immuunpuudulikkuse peamine ilming, nagu juba märgitud, on suurenenud nakkushaigus. Immunomodulaatorite kasutamise esmane eesmärk VID-i nähtudega patsientidel on suurendada organismi infektsioonivastast resistentsust.
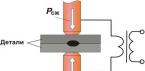
Tavapäraselt võib kõik mikroorganismid jagada rakuvälisteks ja intratsellulaarseteks. Peamised efektorrakud võitluses ekstratsellulaarsete patogeenide vastu on neutrofiilid. Nende imendumine ja bakteritsiidsed funktsioonid paranevad järsult komplemendi ja IgG juuresolekul, samuti siis, kui neid aktiveerib tuumori nekroosifaktor (TNF), interleukiin-1 (IL), IL-6 ja teised makrofaagide, NK poolt toodetud tsütokiinid. rakud ja T-lümfotsüüdid. Peamised efektorrakud võitluses intratsellulaarsete patogeenide vastu on makrofaagid, NK-rakud ja T-lümfotsüüdid. Nende mikrobitsiidsed ja tsütotoksilised omadused suurenevad järsult interferoonide, TNF-i ja teiste tsütokiinide mõjul, mis on toodetud pärast samade kolme rakupopulatsiooni aktiveerimist patogeeni antigeenide poolt. Esimene rakk, millega patogeen kokku puutub, on limaskestadest või nahast üle saanud, on koe makrofaag. Mikroobi kinni püüdnud makrofaag aktiveerub ja sünteesib mitmeid monokiine, mis suurendavad uute monotsüütide/makrofaagide, neutrofiilide ja NK-rakkude funktsionaalset aktiivsust. See makrofaag, mis on ensüümsüsteemi abil mikroobi poolitanud, esitleb oma antigeenseid determinante T- ja B-lümfotsüütidele, käivitades seeläbi humoraalsete ja rakuliste reaktsioonide arengu ning toodes mõningaid nende arenguks vajalikke tsütokiine.
Selle infektsioonivastase kaitse lihtsustatud skeemi (vt joonis) analüüsi põhjal võib järeldada, et selle stimuleerimiseks on kõige sobivam kasutada selliseid immunomodulaatoreid, mis toimivad peamiselt monotsüütide-makrofaagide süsteemi (MMS) rakkudele. ). Kui see süsteem on aktiveeritud, käivitatakse kogu keha nakkusvastase kaitse spetsiifiliste ja mittespetsiifiliste tegurite kogum. Varem jagasime kõik immunomodulaatorid kolme rühma: eksogeensed, endogeensed ja keemiliselt puhtad või polümeersed. Kõigis nendes kolmes immunomodulaatorite rühmas on saadaval ravimid, millel on MMC-rakkudele domineeriv toime. kõrgele jõudlusele ravimid uusim põlvkond, millel on valdav mõju MMS-rakkudele, on polüoksidoonium, lükopiid, müelopiid ja selle MP-3 fraktsioon.
Fagotsüütiliste rakkude neelduv ja mikrobitsiidne aktiivsus sõltuvad T-lümfotsüütide funktsionaalsest aktiivsusest ja täpsemalt nende võimest toota tsütokiine, mis neid rakke varustavad. Seetõttu stimuleerivad T-lümfotsüütidele domineeriva toimega ja neis selliste tsütokiinide sünteesi indutseerivad immunomodulaatorid neutrofiilsete leukotsüütide ja MMC-rakkude funktsionaalset aktiivsust, st aktiveerivad organismi infektsioonivastase kaitse. Immuunsüsteemi T-süsteemi mõjutavate immunomodulaatorite hulka kuuluvad mitmed veiste harknäärest saadud ravimid, aga ka nende esivanem - taktiviin. Viimase põlvkonna selle toimega immunomodulaatorid hõlmavad müelopiidi (selle MP-1 fraktsioon) ja immunofaani. Kui vaadelda makrofaagi kui immuunsüsteemi aktiveerimise keskset rakku, siis sellele rakule domineeriva toimega immunomodulaatorite kasutamisel aktiveerime immuunsüsteemi, mida võib tinglikult nimetada tsentrifugaalseks, s.t. see läheb keskelt edasi perifeeria. Immuunsuse T-süsteemile domineeriva toimega immunomodulaatoreid kasutades aktiveerime immuunsuse aktiveerimissignaali loomulikule liikumisele vastupidises suunas, s.t. me räägime tsentrifugaalaktiveerimise kohta. Lõppkokkuvõttes hakkab liikuma kogu immuunsüsteem, mille tulemusena suureneb organismi infektsioonivastane kaitse. Tohutu kliiniline praktika näitab, et mõlemat tüüpi immuunaktiveerimist saab edukalt kasutada VID-iga patsientide kompleksravis. Eriti selge näide on immunomodulaatorite kasutamine kirurgiliste infektsioonide raviks, mis võib olla tüüpiline näide VID-i indutseeritud vormist. Peaaegu kõik ravimid, mis mõjutavad immuunsüsteemi ja on heaks kiidetud meditsiiniliseks kasutamiseks(levamisooli, prodigiosaani, pürogenaali, naatriumnukleinaati, diutsifooni, taktiviini, tümogeeni jne) on nende infektsioonide raviks kasutatud ja kõik need näitasid üldiselt häid kliinilisi tulemusi. Praegu on immunoloogil suur valik immunomodulaatoreid VID-i raviks ja alles pärast kasutamist kliiniline praktika valib lõpuks kõige rohkem tõhusad ravimid, mis, nagu aspiriin, südameglükosiidid, antibiootikumid jm, jäävad pikaks ajaks immunoloogi arsenali. Reeglina määrab arst ägedas staadiumis krooniliste nakkus- ja põletikuliste protsesside korral antibiootikumid. Usume, et nendel juhtudel on soovitav samaaegselt määrata ka immunomodulaatoreid. Antibiootikumi ja immunomodulaatorite samaaegsel kasutamisel saavutatakse suurem terapeutiline toime kui nende eraldi manustamisega. Antibiootikum tapab või pärsib patogeeni funktsionaalset aktiivsust; immunomodulaator suurendab otseselt (polüoksidoonium, likopiid, müelopiid) või kaudselt (taktiviin, imunofaan jne) fagotsüütide funktsionaalset aktiivsust, tugevdades nende bakteritsiidset toimet. Haiguse tekitajale antakse topeltlöök, tänu millele saavutatakse kompleksravi suurem efektiivsus.
Ülaltoodut kokku võttes usume, et immunomodulaatorite kasutamine koos teiste ravimitega aitab immunoloogidel tõhusamalt ravida VID-i nähtudega patsiente.
Immuunpuudulikkusest üldiselt
Igasuguse immuunvastuse olemus seisneb antigeense iseloomuga võõrainete äratundmises ja organismist eemaldamises, mis on nii eksogeenselt tungivad (mikroorganismid) kui ka endogeenselt moodustunud (viirusega nakatunud rakud, ksenobiootikumidega modifitseeritud rakud, vananemine, kasvajarakud jne). ). Keha kaitset võõrainete eest viivad läbi kaasasündinud ja omandatud immuunsuse humoraalsed ja rakulised tegurid, mis moodustavad ühtse funktsionaalse kompleksi, mis täiendavad üksteist ning on pidevas kontaktis ja koostoimes.
Immuunsüsteemi toimimises, nagu ka igas teises kehasüsteemis, võivad tekkida häired, mis põhjustavad eelkõige sellele süsteemile iseloomulike haiguste väljakujunemist. Sellised rikkumised hõlmavad järgmist:
- võõraste ja oma antigeenide ebaõige äratundmine, mis põhjustab autoimmuunprotsesside arengut;
- hüperergiline või väärastunud immuunvastus, mis põhjustab allergiliste haiguste arengut;
- võimetus välja töötada normaalset immuunvastust, mis põhjustab immuunpuudulikkuse arengut
Märge!
Mõned immunoteraapia üldpõhimõtted patsientidel, kellel on VID-i tõendeid
- Immunomodulaatorite määramise peamine põhjus peaks olema kliiniline pilt, mida iseloomustab krooniliste, aeglaste ja raskesti ravitavate tavapäraselt nakkus- ja põletikuliste protsesside esinemine.
- Immunomodulaatoreid, välja arvatud mõned erandid, ei kasutata monoteraapiana, vaid reeglina on need kompleksravi lahutamatu osa.
- Manustamisel patsientidele, kellel on VID-i nähud, antibakteriaalne, seenevastane või viirusevastased ravimid soovitav on samaaegselt välja kirjutada immunomodulaatorid, millel on domineeriv toime MMC rakkudele
ARSTKU AIDAMISEKS
UDK 612.216-112
Saabunud 31.04.08
L.M. KARZAKOVA, O.M. MUTŠUKOV,
N.L. RASSKAZOVA
PRIMAARNE JA TEISENE IMMUNODEFIFITSUS
Vabariiklik kliiniline haigla,
Laste omad linna haigla№3, Cheboksary
Vaadeldakse immuunpuudulikkuse seisundite diagnostika ja ravi põhimõtteid. Suurt tähelepanu pööratakse primaarsetele immuunpuudulikkuse haigustele. Toodud koostatud autorid Registreeri esmane immuunpuudulikkused Tšuvašia.
Siin on immuunpuudulikkuse seisundite diagnoosimise ja ravi põhimõtted. Suurt tähelepanu köidavad esmased immuunpuudulikkuse haigused. See sisaldab autorite koostatud Tšuvašia esmaste immuunpuudulikkusega haiguste loetelu.
Immuunpuudulikkused, immuunvastuse häired, jagunevad kahte suurde rühma - esmased (kaasasündinud) ja sekundaarsed (omandatud), mis on põhjustatud erinevatest endogeensetest (haigused) ja eksogeensetest mõjudest (näiteks negatiivsed keskkonnategurid). Primaarsed immuunpuudulikkused (PID) on tavaliselt põhjustatud geneetilistest defektidest ja ainult mõnikord mittepärilikest defektidest, mis tekivad embrüonaalsel perioodil. PID tüüpiline ilming on infektsioonivastase resistentsuse rikkumine koos korduvate ja / või krooniliste erineva lokaliseerimisega infektsioonide tekkega. Nakkuslike patogeenide tüüp, mille suhtes organism on ülitundlik, sõltub immuunvastuse ühe või teise lüli defektist. Seega viib antikehade tootmise defekt (immuunvastuse humoraalse lüli puudulikkus) resistentsuse vähenemiseni peamiselt bakterite (stafülokokk, streptokokk, pneumokokk, E. coli, Proteus, Klebsiella) ja enteroviiruste suhtes. Suurenenud eelsoodumus viiruslikele, algloomade infektsioonidele, tuberkuloosile, krüptokokoosile ja leishmaniaasile on iseloomulik immuunvastuse rakulise sideme rikkumisele. Fagotsütoosi defektide korral on nakkussündroomi kõige levinum põhjus katalaasi tootvad mikroorganismid (stafülokokid, E. coli, Serratia marcescens, Nocardia, Aspergillus jt), enamik gramnegatiivseid baktereid ja seeni (Candida albicans, Aspergillus). Komplemendi süsteemi defekt avaldub kookide ja Neisseria põhjustatud infektsioonides. Immuunvastuse kombineeritud rikkumisega (kombineeritud immuunpuudulikkusega) põhjustavad nakkussündroomi nii bakterid kui viirused, seened ja algloomad.
Mõnel juhul on nakkussündroom kombineeritud mitteimmunoloogiliste ilmingutega - teiste elundite ja süsteemide selgelt määratletud sümptomitega. Niisiis, DiGeorge'i sündroom ei avaldu mitte ainult immuunsuse rakulise sideme rikkumises, vaid ka harknääre aplaasias või hüpoplaasias, kõrvalkilpnäärmete vananemises, südame ja suurte veresoonte väärarengutes, düsembriogeneesi häbimärgistamises (suulae lõhenemine, puudumine). kõrvanibudest jne). Louis-Bari sündroomi korral kombineeritakse kombineeritud immuunpuudulikkust (T-lümfotsüütide arvu vähenemine, IgA taseme langus) väikeaju ataksia ja telangiektaasiaga nahal ja silma kõvakestal. Wiskott-Aldrichi sündroomi korral esineb kombineeritud immuundefekt (T-lümfotsüütide arvu vähenemine, IgM taseme langus) koos ekseemi ja trombotsütopeeniaga.
Primaarsed immuunpuudulikkused
Esimest kaasasündinud immuunpuudulikkuse juhtumit (immunoglobuliinide tootmise geneetiliselt määratud häirest tingitud agammaglobulineemia) kirjeldas Bruton 1952. aastal. Sellest ajast alates on tuvastatud üle 100 erineva primaarse immuunsüsteemi defekti. Mõned PID-d on üsna tavalised. Näiteks selektiivse IgA puudulikkuse sagedus ulatub 1:500-ni. Enamiku teiste PID-de puhul on see näitaja 1:50 000 – 1:100 000. Arvukate väljaannete kohaselt on maailmas selgelt aladiagnoositud ja PID-diagnooside ajastus hilinenud. Jeffrey Model Foundationi (USA) ja ESID (European Society for the Study of Immunodeficiencies) eestvõttel on välja töötatud kriteeriumid PID-i kahtlustamiseks patsientidel.
PID kriteeriumid:
1. Sage keskkõrvapõletik (6-8 korda aastas).
2. Sagedased põsekoopapõletikud (4-6 korda aastas).
3. Rohkem kui kaks kinnitatud kopsupõletikku.
4. Naha ja siseorganite korduvad sügavad abstsessid.
5. Pikaajalise (üle 2 kuu) antibiootikumravi vajadus infektsiooni peatamiseks.
6. Intravenoossete antibiootikumide vajadus infektsiooni peatamiseks.
7. Rohkem kui kaks rasket infektsiooni (meningiit, osteomüeliit, sepsis).
8. Imiku mahajäämus pikkuses ja kaalus.
9. Üle 1 aasta vanune naha püsiv seeninfektsioon.
10. PID esinemine sugulastel, varajane surm raskete infektsioonide tõttu või mõni loetletud sümptomitest.
Rohkem kui ühe loetletud sümptomi tuvastamine patsiendil peaks hoiatama seoses PID-ga ja olema signaal immunoloogiliseks uuringuks. Suurt tähtsust omistatakse PID rollile ja kohale maailma haigestumuse ja suremuse struktuuris, mistõttu loodi Lääne-Euroopas, Ameerikas ja Austraalias PID-i riiklikud registrid. Registrites sisalduvate andmete analüüs võimaldab otsustada PID esinemissageduse üle maailma eri paigus, etnilistes populatsioonides, teha kindlaks domineerivad patoloogia vormid ning luua seeläbi eeldused haruldaste haigusvormide diagnoosimise kvaliteedi parandamiseks. uute juhtumite võrdlemine registris leiduvate analoogidega. Venemaal peetakse alates 1992. aastast ka PID-de registrit, mis põhineb haiglaravi juhtumite analüüsil ja patsientide pöördumisel Vene Föderatsiooni Riikliku Uurimiskeskuse "Immunoloogia Instituudi" osakondadesse. Paljud piirkondades diagnoositud PID-i juhtumid jäävad aga teadmata. Iga registri moodustamine peaks põhinema ühel haiguste klassifikatsioonil. PID-i uurimise ajaloo lühiduse tõttu ei ole selle klassifikatsioon endiselt lõplik. WHO teadusrühm avaldab iga 2-3 aasta tagant aruandeid ja soovitusi PID süstemaatika kohta, samas kui kaasaegsete diagnostikameetodite kasutuselevõtuga muutub oluliselt kirjeldatud haigusvormide arv ja nende klassifitseerimise järjekord. . WHO viimase klassifikatsiooni (2004) kohaselt on PID-d jagatud järgmistesse rühmadesse:
1. PID valdavalt antikehade defektidega (humoraalsed immuunpuudulikkused):
· X-seotud agammaglobulineemia (XVAGG);
tavaline muutuv immuunpuudulikkus (CVID);
agammaglobulineemia normaalse või suurenenud tase IgM;
selektiivne IgA puudulikkus;
Imikueas mööduv hüpogammaglobulineemia (hiline immunoloogiline algus).
2. Peamiselt T-rakkude defektidega PID:
- CD4+ rakkude esmane puudulikkus;
- IL-2 puudulikkus;
- mitme tsütokiini puudulikkus;
- signaali ülekande defekt + müopaatia;
- kaltsiumi sissevoolu defekt koos müopaatiaga.
3. Kombineeritud immuunpuudulikkuse seisundid:
- raske kombineeritud immuunpuudulikkus (SCID);
- Wiskott-Aldrichi sündroom;
- ataksia - leangiektaasia (Louis - Bari sündroom).
4. Fagotsütoosi defektid:
- krooniline granulomatoosne haigus;
- Chediak-Higashi sündroom.
5. Komplemendisüsteemi defektid.
6. Immuunpuudulikkused, mis on seotud muude suurte immuunsüsteemiväliste defektidega:
- hüper-IgE sündroom (Jobi sündroom);
- krooniline limaskestade kandidoos;
- soole lümfangiektaasia;
- enteropaatiline akrodermatiit.
7. Lümfoproliferatiivsete protsessidega seotud immuunpuudulikkus.
Kõige tavalisem järgmised vormid PID.
X-seotud agammaglobulineemiat ehk Brutoni tõbe (1:50 000) täheldatakse poistel 5.–9. elukuul, kui emade siirdamisel saadud immunoglobuliinid on ammendunud. Haigus avaldub korduvate püogeensete infektsioonide (kopsupõletik, sinusiit, mesotümpaniit, meningiit) kujul. Oluline diagnostiline sümptom on Lümfisõlmed, põrn ei reageeri põletikulise protsessi suurenemisega. Immunolaboratoorses uuringus tuvastatakse: 1) γ-globuliinide vähenemine või puudumine vereseerumis; 2) seerumi IgG taseme langus (alla 2 g / l) IgM ja IgA puudumisel või järsk langus; 3) B-lümfotsüütide (CD19+ või CD20+) puudumine või nende arvu järsk langus vereringes, alla 2%; 4) mandlite puudumine või hüpoplaasia; 5) lümfisõlmede väikesed suurused; 6) T-lümfotsüütide säilinud funktsioon.
CVID (1:10 000 - 1:50 000) on heterogeenne rühm haigusi, millel on defektid antikehade moodustumisel ja erinevat tüüpi pärilikkus. Mõiste "muutuv" tähendab haiguse avaldumist erinevas vanuses (lapsed, noorukid, täiskasvanud) koos immuunpuudulikkuse tüübi ja raskusastmega. Kliinilise pildi järgi sarnaneb CVID Brutoni tõvega, peamine erinevus haiguse avaldumise ajas: keskmine vanus CVID-25 kliinilised ilmingud, diagnoos - 28 aastat. Patsientide ellujäämine sõltub IgG taseme languse astmest ja immuunvastuse rakulise sideme puudulikkusest: mida rohkem neid ekspresseeritakse, seda varem CVID-iga patsiendid surevad. See PID vorm mõjutab võrdselt nii mehi kui ka naisi. Nagu kõik humoraalsed immuunpuudulikkused, avaldub CVID kliiniliselt korduva ja kroonilise kopsupõletikuna, põskkoopapõletikuna, keskkõrvapõletikuna, sageli tekivad bronhektaasid, pooltel juhtudel on seedetrakti kahjustatud malabsorptsiooni sümptomid, kaalulangus, kõhulahtisus, hüpoalbumineemia, vitamiinipuudus. Iseloomulikud kroonilised põletikulised protsessid soolestikus ( enteroviiruse infektsioonid) sõlmelise lümfoidse hüperplaasia tekkega. Umbes kolmandikul patsientidest on splenomegaalia ja/või difuusne lümfadenopaatia. 22% juhtudest tekivad autoimmuunsed ilmingud (kahjulikud või hemolüütiline aneemia, trombotsütopeenia, neutropeenia, reumatoidartriit, düsfunktsioon kilpnääre). Immunolaboratoorne uuring paljastab: 1) normaalse või mõnevõrra vähenenud ringlevate B-lümfotsüütide arvu; 2) seerumi IgG ja IgA taseme langus, vähemal määral - IgM tase; IgG + IgA + IgM kogukontsentratsiooni vähenemine alla 3 g / l; 3) T-rakkude koguarv on normaalne või veidi vähenenud T-abistaja alampopulatsiooni arvu vähenemise tõttu; 4) vähenenud immunoregulatoorne indeks CD4+/CD8+.
Selektiivset IgA puudulikkust (kaukaaslastel 1:700; jaapanlastel 1:18 500) iseloomustab seerumi IgA taseme langus 0,05 g / l ja alla selle (üsna sageli 0) teiste immunoglobuliinide klasside normaalse sisaldusega. Kui IgA kontsentratsioon on üle 0,05 g/l, kuid alla 0,2 g/l, siis tuleb panna diagnoos "osaline (osaline) IgA puudulikkus". Enamasti on IgA puudulikkus asümptomaatiline, kuid mõnel inimesel avaldub see sinopulmonaarsete infektsioonidena koos allergiliste ilmingutega ( atoopiline dermatiit, heinapalavik, bronhiaalastma, angioödeem jne) ja autoimmuunsed (sklerodermia, reumatoidartriit, vitiliigo, türeoidiit).
Laste mööduvat hüpogammaglobulineemiat ("aeglane immunoloogiline algus") iseloomustab immunoglobuliinide madal tase. Haigus algab 5-6 kuu vanuselt, kui laps hakkab ootamatult ilma nähtava põhjuseta haigestuma neerude ja hingamisteede korduvate püogeensete infektsioonidega. Selle põhjuseks on asjaolu, et ema IgG, mille laps saab siirdamise teel, on selles vanuses kataboliseeritud ja oma IgG tootmine, tavaliselt alates 4. kuust, on hiline. Selle immuunpuudulikkuse vormi korral on IgG ja IgA tase sageli vähenenud, samas kui IgM tase on normaalses vahemikus või isegi kõrgem. B-lümfotsüüdid, lümfisõlmed ja mandlid ei muutu. Seda mööduvat immuunpuudulikkust esineb 5–8% imikutel (tavaliselt enneaegsetel või nõrgenenud immuunpuudulikkusega lastel) ja see taandub tavaliselt ilma ravita 1,5–4-aastaselt.
Hüper-IgE sündroom (Jobi sündroom). "Jobi sündroomi" diagnoos põhineb korduval (vähemalt kahekordsel) seerumi üld-IgE kontsentratsiooni tõusul üle 1000 RÜ / ml dermatiidi ja korduvate sügavate mädaste infektsioonide korral koos "külmaga" kulg: naha, nahaaluskoe, lümfisõlmede abstsessid, keskkõrvapõletik. Eriti ohtlikud on rasked episoodid äge kopsupõletik, sealhulgas destruktiivsed, mille tulemuseks on pneumotseel, maksa abstsessid. Iseloomulikud on luustiku anomaaliad, toruluude spontaansed murrud, jämedad düsplastilised näojooned. Haiguse patogeneetiline mehhanism seisneb selles, et Th1 ei ole võimeline tootma γ-interferooni. See toob kaasa Th2 aktiivsuse suurenemise, mis väljendub IgE suurenenud tootmises. Viimane põhjustab histamiini vabanemise, mis blokeerib põletikulise reaktsiooni arengu (sellega on seotud külmade abstsesside teke). Lisaks pärsib histamiin neutrofiilide kemotaksist.
Krooniline limaskestade kandidoos. Seda iseloomustavad naha, limaskestade, küünte, peanaha kandidoossed kahjustused. Haigus põhineb unikaalsel defektil T-lümfotsüütides, mis seisneb selles, et need rakud ei suuda välja töötada normaalset vastust, eriti toota faktorit, mis pärsib makrofaagide migratsiooni (MYF) Candida albicansi antigeenile. Selle antigeeni HPRT nahatest on samuti negatiivne. Samal ajal on patsientidel normaalne T-lümfotsüütide arv ja nende reaktsioon teistele antigeenidele ei ole häiritud. Humoraalne reaktsioon Candida antigeenile ei muutu. Sündroom on kombineeritud autoimmuunse polüglandulaarse endokrinopaatiaga. Ravi on sümptomaatiline seenevastane ravi.
Krooniline granulomatoosne haigus (CGD). See on fagotsütoosi defekti kaasasündinud vorm. Neutrofiilidel on normaalne kemotaksis, absorptsiooni aktiivsus, kuid "hingamispurske" teke on häiritud. Katalaaspositiivsed mikroorganismid (Staphylococcus aureus, E. coli, Klebsiella, Serratia marcescens, Salmonella, Aspergillus seened) moodustavad granuloomid lümfisõlmedes, maksas, kopsudes ja seedetraktis. Iseloomustab korduva lümfadeniidi, abstsesside (maksa-, kopsu-, perirektaalne), osteomüeliit, haavandiline stomatiit, riniit, konjunktiviit. Mõned lapsepõlves diagnoositud CHB-ga patsiendid jäävad ellu kuni 30-aastaseks. Diagnoosi kinnitab NBT-test (nitroblue tetrasooliumi redutseerimise test), millel on vaadeldavas patoloogias nullväärtused. Ravi: stafülokokivastaste antibiootikumide igapäevane profülaktiline manustamine, interferoon-γ subkutaanselt 3 korda nädalas.
Vaatluste põhjal koostasime Tšuvašia PID-i registri, mis hõlmab 19 patsienti, kellel on 7 immuunpuudulikkuse vormi (tabel 1).
Tabel 1
Chuvashia esmaste immuunpuudulikkuste register
Rohkem kui 100 teadaolevast kontrollitud PID vormist oleme tuvastanud 7. Venemaa riiklikus registris on kirjeldatud 19 PID vormi. Tähelepanu juhitakse asjaolule, et registris toodud PID-dest 15 diagnoositi alles pärast patsientide üleminekut meditsiiniteenistuse täiskasvanute võrgustikku. Registrisse ei kuulu varajases eas mööduva hüpogammaglobulineemiaga lapsed. Selle põhjuseks on selgete kriteeriumide puudumine selle PID-i vormi diagnoosimiseks ja raskused sekundaarse immuunpuudulikkuse seisundiga eristamisel alla 3-aastastel lastel. Lisaks ei ole registris SCID-sid, mis on teadaolevalt põhjustatud nii immuunvastuse humoraalse kui ka rakulise mehhanismi defektidest ja mis põhjustavad laste surma väga varases eas. Tavaliselt diagnoositakse need tagasiulatuvalt lahkamisel kliinilise ja patoloogilise võrdluse teel. Kahjuks meie vabariigis patoanatoomilised bürood SCID-d ei registreeri, kirjutades maha teatud raskete infektsioonide (sepsis, meningiit jne) immuunsüsteemi väljendunud defektide juhtude surmavad tagajärjed. Ka vabariiklaste selektiivse IgA puudulikkuse esinemissagedus ei vasta tegelikkusele. Paljude autorite sõnul on selle PID-vormi levimus 1:500. Näiteks Lõuna-Uurali piirkonna PID-i registris on see haigus esinemissageduse poolest esikohal ja valdav enamus selektiivse IgA puudulikkusega on lapsed. Meie vabariiklikus registris on ainult kõnealuse PID-ga täiskasvanud patsiendid. Selektiivse IgA puudulikkuse vähene tuvastatavus on tõenäoliselt seotud immunoloogilise defekti kliiniliste ilmingute varieeruvusega, mis on sageli väga kerged. Märkimisväärsel arvul immunopatoloogiaga patsientidel esineb hingamisteede viirusnakkusi sagedamini. Märkimisväärne on see, et infektsioonide suurenenud sagedus, mida sageli täheldatakse varases lapsepõlves, väheneb järgnevatel aastatel märkimisväärselt. Rohkem kui 20% selektiivse IgA puudulikkusega patsientidest kannatavad allergiliste ja autoimmuunhaigused. Mõnedel patsientidel ei ilmne immunoloogiline defekt kliiniliselt. Tõenäoliselt on selektiivse IgA puudulikkuse madal esinemissagedus vabariiklikus registris tingitud selle ebapiisavast tuvastamisest spetsialistide poolt. Tšuvašias hästi tuvastatud PID-i näide on CVID, mis on Venemaa Föderatsiooni riiklikus registris selektiivse IgA puudulikkuse järel levinuim. CVID-i tõhusa avastamise põhjuseks on täiskasvanute võrguarstide hea teadlikkus selle patoloogia diagnoosimise kriteeriumidest, mis on tingitud patsientide korduvast demonstreerimisest Tšuvašia terapeutide ühingu kliinilistel ülevaadetel ja konverentsidel.
Seega on Tšuvašias kombineeritud immuunpuudulikkuse, selektiivse IgA puudulikkuse tuvastamine madal, mis ilmselt on seotud erinevate erialade arstide kliinilise immunoloogia alusteadmiste puudumisega (sh kliiniliste ilmingute, PID diagnoosimise küsimused), samuti arstide ebapiisav immunoloogiliste diagnostikameetodite kasutamine.
Sekundaarsed immuunpuudulikkused. Täiskasvanute hulgas on sekundaarsed immuunpuudulikkuse seisundid valdavalt levinud. Sagedamini täheldatakse rakulise immuunvastuse omandatud defekte, harvemini humoraalset. Ilmselt on selle põhjuseks see, et T-rakud on apoptootiliste tegurite suhtes tundlikumad kui B-rakud, mida kaitseb apoptootilise surma eest nende membraanil ekspresseeritud Bcl-proonkogeeni antigeen, ja apoptoos on teadaolevalt peamine immuunsüsteemi rakusurma mehhanism. ja immuunpuudulikkuse areng. Kõik tegurid, mis võivad esile kutsuda T-rakkude apoptoosi (ioniseeriv kiirgus, stress, glükokortikosteroidide ja etanooli taseme tõus, infektsioon jne), võivad mängida põhjuslikku rolli sekundaarse T-rakulise immuunpuudulikkuse tekkes. Humoraalse immuunvastuse sekundaarne puudulikkus areneb reeglina juba olemasoleva taustal. rasked haigused. Peamised tingimused, mis põhjustavad adaptiivse immuunsuse humoraalse mehhanismi omandatud puudulikkust, on järgmised:
1) malabsorptsiooni sündroomiga seotud valgupuudus, krooniline pankreatiit, tsöliaakia enteropaatia, põletushaigus (immunoglobuliini molekulide süntees on häiritud "ehitusmaterjali" - aminohapete - puudumise tõttu);
2) seisundid, mis põhjustavad immunoglobuliinide ja immunokompetentsete rakkude kadu - nefrootiline sündroom(glomerulonefriidi korral läbib glomerulaarfilter mitte ainult madala molekulmassiga valkude, vaid ka suure molekulmassiga valkude puhul - globuliinid, sealhulgas immunoglobuliinid), verejooks, lümforröa, põletused;
3) hulgimüeloom (müeloom - ebanormaalne B-lümfotsüütide kloon, mis on omandanud kontrollimatu kasvu omadused, toodab ühe klassi immunoglobuliine, ühe spetsiifilisusega, kasvav müeloom asendab normaalseid B-lümfotsüütide kloone luuüdis, toodab teiste immunoglobuliine , ligikaudu 108, erineva spetsiifilisusega, IgA müeloomide tekkega vähenes IgG ja IgM tase, IgG müeloomiga kaasneb IgA ja IgM vähenemine ning IgD müeloomi ja kerge ahela haiguse korral vähenevad kolm põhilist immunoglobuliinide klassi);
4) splenektoomia sündroom (põrna eemaldamisel kannatab rakuline immuunvastus vähemal määral, kuid humoraalne side on oluliselt pärsitud, kuna põrn on valdavalt antikehade tootmise organ).
Nendes tingimustes võib antikehade sisaldus väheneda hüpo-, agammaglobulineemia tasemeni. Erinevalt kaasasündinud vormidest varieerub immuunvastuse humoraalse mehhanismi sekundaarse defektiga immunoglobuliinide tase sõltuvalt põhiprotsessi käigust ja raskusastmest, nende sisaldus võib normaliseeruda (ilma immunoglobuliini asendusravita) remissiooni perioodil. põhihaigus.
WHO ekspertide andmetest lähtudes tuleks rakulise immuunvastuse sekundaarse puudulikkuse etiopatogeensete teguritena nimetada järgmist:
1) füüsikaliste ja keemiliste tegurite mõju:
- füüsiline (ioniseeriv kiirgus, mikrolaineahi, kõrge või madal õhutemperatuur kuivades kliimavööndites jne);
- kemikaalid (immunosupressorid, keemiaravi, kortikosteroidid, ravimid, herbitsiidid, pestitsiidid, inimtegevusest tingitud keskkonnareostus raskmetallide sooladega);
2) inimese kaasaegne eluviis (füüsiline passiivsus, teabe üleküllus koos "informatsiooni" haiguse tekkega);
3) alatoitumus (vajalike mikroelementide puudus igapäevases vee-toiduratsioonis - tsink, vask, raud, vitamiinid - retinool, askorbiinhape, alfa-tokoferool, foolhape; valgu-energia alatoitumus, alatoitumus, kahheksia, ainevahetushäired, rasvumine);
3) viirusnakkused:
- äge - leetrid, punetised, mumps, tuulerõuged, gripp, hepatiit, herpes jne;
- püsiv - krooniline B-hepatiit, alaäge skleroseeriv panentsefaliit, AIDS jne;
- kaasasündinud - tsütomegaalia, punetised (TORCH-kompleks);
4) algloomade invasioonid ja helmintiaasid (malaaria, toksoplasmoos, leishmaniaas, trihhinoos, askariaas jt);
5) bakteriaalsed infektsioonid (stafülokokk, pneumokokk, meningokokk, tuberkuloos jt);
6) pahaloomulised moodustised, eriti lümfoproliferatiivsed;
7) autoimmuunhaigused;
- seisundid, mis põhjustavad immuunkompetentsete rakkude kadu (verejooks, lümforröa);
- eksogeensed ja endogeensed mürgistused( mürgistus, türotoksikoos, dekompenseeritud diabeet);
- neurohormonaalse regulatsiooni rikkumine (stressiefektid - rasked traumad, operatsioonid, füüsilised, sealhulgas sport, ülekoormus, vaimne trauma);
- loomulikud immuunpuudulikkused - varajane lapsepõlv, gerontoloogiline vanus, rasedad naised (raseduse esimene pool).
Sekundaarsed immuunpuudulikkused on terav(põhjustatud ägedast nakkushaigusest, traumast, joobeseisundist, stressist vms) ja krooniline(areneb krooniliste mäda-põletikuliste haiguste, kasvajate, kroonilise stressi, immunosupressiivse ravi taustal, elades ebasoodsate keskkonna- ja geokeemiliste tingimustega piirkondades jne). Ägedaid immuunpuudulikkusi diagnoositakse immunogrammi parameetrite kõrvalekallete tuvastamise alusel - T-lümfotsüütide (CD3+), T-abistajate (CD4+) arvu vähenemine, immunoregulatoorse indeksi (CD4+/CD8+) langus. Need on reeglina mööduvad ja peatuvad järk-järgult soodsa kulgemise ja põhihaiguse adekvaatse etiopatogeneetilise raviga, millele lisanduvad tuntud, nn üldtugevdavad ravimid ja ained (vitamiinid, adaptageenid, füsioterapeutilised protseduurid jne). , samuti energia-metaboolne teraapia (wobensüüm, koensüüm Q10). Krooniline immuunpuudulikkus võib esineda kolmes variandis: 1) kliiniliste ja laboratoorsete tunnustega, 2) kliiniliste tunnustega laboratoorsete kõrvalekallete puudumisel, 3) põhjusliku teguriga (näiteks elamine ebasoodsates keskkonnatingimustes), kliiniliste ilmingute puudumine. ja immunoloogiliste häirete olemasolu. Esimene tüüp on tavalisem. Teise tüübi korral, kui immuunpuudulikkus avaldub ainult kliiniliselt, kuid tüüpilises immunogrammis muutusi ei leita, ei ole välistatud immuunsüsteemi talitluse rikkumine peenemal tasemel, mida rutiinse läbivaatuse käigus ei tuvastata. Formaalselt normaalväärtused immuunseisundi näitajad, mis peegeldavad immuunsüsteemi individuaalset vastust, võivad olla konkreetse indiviidi jaoks "patoloogilised", kes ei suuda tagada piisavalt kõrget organismi vastupanuvõimet. Kolmas tüüp, mis avaldub ainult immuunpuudulikkuse immunolaboratoorsete tunnustena, on sisuliselt eelhaigus, sekundaarse immuunpuudulikkusega seotud haiguste - nakkuslike, autoimmuunsete, onkoloogiliste jne - riskitegur. Sageli kaasnevad kolmanda tüüpi immuunpuudulikkusega sündroomi tunnused krooniline väsimus.
Kroonilise väsimuse ja immuunpuudulikkuse sündroom (CFS). Esmakordselt kirjeldasid A. Lloyd ja kaasautorid 1984. aastal ning iseloomustasid seda kui patsiendi kogetud kroonilist väsimust, mis ei kao pärast puhkamist ja viib aja jooksul nii vaimse kui ka füüsilise töövõime olulise languseni. Immuunsüsteemi väljendunud tasakaalustamatuse avastamine CFS-iga patsientidel oli aluseks haiguse nime muutmisele kroonilise väsimuse ja immuunpuudulikkuse sündroomiks. CFS-i registreeritakse peamiselt ökoloogiliselt ebasoodsates piirkondades, kus on kõrge keskkonnareostuse tase keemiliselt kahjulike ainetega või kõrgenenud kiirgustase. Need tegurid mõjutavad negatiivselt immuunsüsteemi seisundit (eeskätt adaptiivse immuunsuse rakulist mehhanismi), mis ilmselt toetab varjatud viiruste püsimist koos kesknärvisüsteemi kahjustusega ja latentsete viiruste (herpesviirus, Epstein-Barri viirus) aktiveerumist. ). CFS-i kliiniliste ilmingute tekkimine on reeglina seotud külmetusega, harvem emotsionaalse stressiga. CFS-i sümptomiteks on tugev väsimus, lihasnõrkus, mis ei kao pärast öist und, uinumisraskused, pealiskaudne uni koos õudusunenägudega ja perioodiliselt esinevad depressiooniseisundid. CFS-iga patsientidele, eriti noortele, on tüüpiline tundlikkus hingamisteede viirusnakkuste suhtes. Patsiendid kurdavad valu ja kurguvalu (mitteeksudatiivne farüngiit). Mõnedel patsientidel täheldatakse kehakaalu langust, kahvatut nahavärvi, turgori vähenemist. Mitmete teadlaste sõnul peituvad immunoloogilised häired CFS-i patofüsioloogilises aluses. Tõepoolest, enamikul patsientidest leitakse T-rakkude arvu vähenemist, nende proliferatiivse aktiivsuse vähenemist, NK-rakkude funktsiooni langust ja düsimmunoglobulineemiat. Kompleksne ravi CFS-iga patsiendid hõlmavad tritsükliliste antidepressantide, mittesteroidsete põletikuvastaste ravimite, immunomodulaatorite ja adaptogeenide määramist immunogrammide kontrolli all.
Immuunpuudulikkuse seisundite korrigeerimise põhimõtted. Humoraalse puudulikkuse korrigeerimine hõlmab asendusimmunoteraapia ja antikehade tootmise stimulaatorite määramist. Asendusimmunoteraapia on näidustatud, kui immunoglobuliinide üldkontsentratsioon on alla 5 g/l. Immunoglobuliinipreparaate (sandoglobuliin, oktagaam, intraglobiin või normaalne inimese immunoglobuliin intravenoosseks manustamiseks) manustatakse intravenoosselt 2 korda nädalas annuses 0,1-0,2 g/kg kuuannusega kuni 1,2 g/kg. Antikehade tootmise stimulandid on näidustatud CVID tüüpi agammaglobulineemia korral: müelopiidi 3 mg (0,3% lahus 1 ml) intramuskulaarselt ülepäeviti 6-8 süsti, naatriumnukleinaat - 0,2 g 3 korda päevas suukaudselt 21 päeva jooksul või Derinat 1,5% lahus 5 ml intervalliga 2-3 päeva 8-10 intramuskulaarset süsti.
Fagotsüütilise lüli kahjustuse korral kasutatakse: polüoksidoonium 0,006-0,012 g täiskasvanutele ülepäeviti, esimesed 5 süsti, seejärel 2-3-päevaste intervallidega, kuuriks 7-10 intramuskulaarset süsti; Licopid 1 tablett 1 kord päevas keele alla 10 päeva jooksul (täiskasvanutele mõeldud tablett - igaüks 0,01 g); Derinat 0,25% lahus - 2 tilka ninna 3-4 korda päevas 10 päeva jooksul.
Adaptiivse immuunsuse rakulise lingi defektide korral kasutatakse: 1) tüümuse päritolu preparaate (tümaliin 0,010-0,020 g / m öösel 7-10 süsti; tümogeen 0,01% -1 ml / m päevas - 3- 10 süsti; immunofaan 0,005% - 1,0 ml s / c või / m 5-7 süsti ülepäeviti või 2-3 päeva, 8-10 süstist koosnev kuur); 2) interferoonipreparaadid (inimese leukotsüütide interferoon 1 000 000 RÜ intramuskulaarselt 2 korda nädalas kuni 6 kuud; reaferoon 3 000 000-5 000 000 RÜ intramuskulaarselt 2 korda nädalas 4 nädalast 6 kuuni); 3) IL-2 rekombinantne analoog - ronkoleukiin 500 000-1 000 000 RÜ intravenoosselt tilguti või s / c intervalliga 48-72 tundi 3-5-10 süsti; 4) endogeense interferonogeneesi stimulandid (amiksiin 0,125 g - esimesel päeval 2 tabletti pärast sööki, seejärel igal teisel päeval 1 tablett; tsükloferoon - tabletid 0,15 g ja süstelahus 12,5% - 2 ml, mis on ette nähtud vastavalt põhiskeemile 1, 2, 4, 6, 8, 11, 14, 17, 20, 23, 26, 29 päeva).
BIBLIOGRAAFIA
- Kovaltšuk L.V., Tšeredejev A.N. Apoptootilised immuunpuudulikkused // Kaasaegsed küsimused allergoloogia, kliiniline immunoloogia ja immunofarmakoloogia: Toimetised. aruanne 2. rahvuslik kongress RAAKI. M., 1998. S. 615-619.
- Reznik I.B. Primaarsete immuunpuudulikkuste probleemi praegune seis // Pediaatria. 1996. nr 2. lk 4-14.
- Yartsev M.N., Jakovleva K.P. Vene Föderatsiooni tervishoiuministeeriumi immunoloogiainstituudi primaarsete immuunpuudulikkuse seisundite register // Immunoloogia. 2005. nr 3. lk 23-27.
- Bruton O.C. Agammaglobulineemia // Pediaatria. 1952 kd. 9. Lk 722-726.
- Cunningham-Rundles C. 103 tavalise muutuva immuunpuudulikkusega patsiendi kliiniline ja immunoloogiline analüüs// J. Clin. Immunol. 1989 kd. 9. Lk 22-33.
- Lloyd A.R. et al. Kroonilise väsimussündroomi immunoloogilised kõrvalekalded // Med. J. Aust. 1989 kd. 151. Lk 122-124.
- Matamoros F.N. et al. Primaarne immuunpuudulikkuse sündroom Hispaanias: laste ja täiskasvanute riikliku registri esimene aruanne // J. Clin. Immunol. 1997 kd. 17. Lk 333-339.
Immuunpuudulikkus on inimkeha kaitsefunktsioonide rikkumine, mis on tingitud immuunvastuse nõrgenemisest erineva iseloomuga patogeenidele. Teadus on kirjeldanud terve rea selliseid seisundeid. Seda haiguste rühma iseloomustab nakkushaiguste kulgemise sagenemine ja süvenemine. Immuunsuse töö tõrked on sel juhul seotud selle üksikute komponentide kvantitatiivsete või kvalitatiivsete omaduste muutumisega.
Immuunsuse omadused
Immuunsüsteemil on oluline roll organismi normaalses toimimises, kuna see on loodud avastama ja hävitama antigeene, mis võivad nii väliskeskkonnast tungida (nakkuslikud) kui ka olla oma rakkude kasvaja kasvu (endogeensed) tagajärjed. Kaitsefunktsiooni tagavad peamiselt kaasasündinud tegurid, nagu fagotsütoos ja komplemendi süsteem. Omandatud ja rakulised vastutavad keha kohanemisreaktsiooni eest. Kogu süsteemi side toimub spetsiaalsete ainete - tsütokiinide kaudu.
Sõltuvalt esinemise põhjusest jagatakse immuunpuudulikkuse seisund primaarseks ja sekundaarseks immuunpuudulikkuseks.
Mis on primaarne immuunpuudulikkus
Primaarsed immuunpuudulikkused (PID) on geneetilistest defektidest põhjustatud immuunvastuse häired. Enamasti on need pärilikud ja kaasasündinud patoloogiad. PID-d avastatakse kõige sagedamini varases eas, kuid mõnikord diagnoositakse neid alles noorukieas või isegi täiskasvanueas.
PID on erinevate kliiniliste ilmingutega kaasasündinud haiguste rühm. Rahvusvaheline klassifikatsioon haiguste hulka kuulub 36 kirjeldatud ja piisavalt uuritud primaarset immuunpuudulikkuse seisundit, kuid meditsiinilise kirjanduse andmetel on neid umbes 80. Tõsiasi on see, et kõigi haiguste puhul pole tuvastatud vastutavaid geene.
Ainult X-kromosoomi geenikoostist iseloomustab vähemalt kuus erinevat immuunpuudulikkust ja seega ka esinemissagedust sarnased haigused poisid on suurusjärgu võrra kõrgemad kui tüdrukud. On oletatud, et emakasisene infektsioon võib kaasasündinud immuunpuudulikkuse tekkele etioloogilist mõju avaldada, kuid seda väidet pole veel teaduslikult kinnitatud.

Kliiniline pilt
Primaarsete immuunpuudulikkuste kliinilised ilmingud on sama mitmekesised kui need seisundid ise, kuid on üks ühine tunnus - hüpertrofeerunud nakkuslik (bakteriaalne) sündroom.
Primaarsed ja sekundaarsed immuunpuudulikkused avalduvad patsientide kalduvuses sagedastele korduvatele (korduvatele) nakkusliku etioloogiaga haigustele, mida võivad põhjustada ebatüüpilised patogeenid.
Need haigused mõjutavad kõige sagedamini inimese bronhopulmonaarset süsteemi ja ENT organeid. Sageli on kahjustatud ka limaskestad ja nahk, mis võivad avalduda abstsesside ja sepsisena. Bakteriaalsed patogeenid põhjustavad bronhiiti ja sinusiiti. Immuunpuudulikkusega inimesed kogevad sageli varajast kiilaspäisust ja ekseemi ning mõnikord allergilisi reaktsioone. Samuti pole haruldased autoimmuunhäired ja kalduvus pahaloomulistele kasvajatele. Laste immuunpuudulikkus põhjustab peaaegu alati vaimse ja füüsilise arengu hilinemist.
Primaarsete immuunpuudulikkuste tekkemehhanism
Immuunpuudulikkuse seisundite uurimisel on kõige informatiivsem haiguste klassifikatsioon nende arengumehhanismi järgi.

Arstid jagavad kõik immuunhaigused nelja põhirühma:
Humoraalsed või B-rakud, mis hõlmavad Brutoni sündroomi (X-kromosoomiga seotud agammaglobulineemia), IgA või IgG puudulikkust, IgM ülemäärast üldist immunoglobuliinidefitsiiti, lihtsat muutuvat immuunpuudulikkust, vastsündinute mööduvat hüpogammaglobulineemia ja mitmeid muid humoraalse immuunsusega seotud haigusi .
T-raku primaarsed immuunpuudulikkused, mida sageli nimetatakse kombineeritud, kuna esimesed häired alati häirivad humoraalset immuunsust, näiteks tüümuse hüpoplaasia (Di George'i sündroom) või düsplaasia (T-lümfopeenia).
Fagotsütoosi defektidest põhjustatud immuunpuudulikkus.
Düsfunktsioonist tingitud immuunpuudulikkus
Vastuvõtlikkus infektsioonidele
Kuna immuunpuudulikkuse põhjus võib olla erinevate seoste rikkumine
immuunsüsteemi, siis ei ole vastuvõtlikkus nakkusetekitajate suhtes igal konkreetsel juhul sama. Näiteks humoraalsete haiguste korral on patsient altid streptokokkide ja stafülokokkide põhjustatud infektsioonidele, samas kui need mikroorganismid on sageli resistentsed antibakteriaalsed ravimid. Immuunpuudulikkuse kombineeritud vormide korral võivad bakterid kinnituda viirustele, näiteks herpesele või seentele, mida esindab peamiselt kandidoos. Fagotsüütilist vormi iseloomustavad peamiselt samad stafülokokid ja gramnegatiivsed bakterid.

Primaarsete immuunpuudulikkuste levimus
Pärilikud immuunpuudulikkused on inimestel üsna haruldased haigused. Seda tüüpi immuunsushäirete esinemissagedust tuleb hinnata iga konkreetse haiguse puhul, kuna nende levimus ei ole sama.
Keskmiselt kannatab kaasasündinud päriliku immuunpuudulikkuse all vaid üks vastsündinu viiekümne tuhandest. Selle rühma kõige levinum haigus on selektiivne IgA puudulikkus. Seda tüüpi kaasasündinud immuunpuudulikkust esineb keskmiselt ühel vastsündinul tuhandest. Veelgi enam, 70% kõigist IgA puudulikkuse juhtudest on seotud selle komponendi täieliku puudulikkusega. Samal ajal võivad mõned haruldasemad pärilikud immuunsüsteemi haigused jaotada vahekorras 1: 1 000 000.
Kui arvestada PID-haiguste esinemissagedust sõltuvalt mehhanismist, siis avaneb väga huvitav pilt. B-raku primaarsed immuunpuudulikkused või, nagu neid tavaliselt nimetatakse, antikehade moodustumise häired, on tavalisemad kui teised ja moodustavad 50–60% kõigist juhtudest. Samal ajal diagnoositakse 10-30% patsientidest T-rakulisi ja fagotsüütseid vorme. Kõige haruldasemad on komplemendi defektidest põhjustatud immuunsüsteemi haigused - 1-6%.
Samuti tuleb märkida, et andmed PID esinemissageduse kohta on erinevates riikides väga erinevad, mis võib olla tingitud konkreetse rahvusrühma geneetilisest eelsoodumusest teatud DNA mutatsioonidele.
Immuunpuudulikkuse diagnoosimine
Primaarne immuunpuudulikkus lastel määratakse kõige sagedamini enneaegselt, kuna
sellega, et kohaliku pediaatri tasemel on sellist diagnoosi üsna raske panna.

Tavaliselt viib see ravi hilinenud alguseni ja ravi halva prognoosini. Kui arst soovitas haiguse kliinilise pildi ja üldanalüüside tulemuste põhjal immuunpuudulikkuse seisundit, peaks ta esimese asjana suunama lapse immunoloogi konsultatsioonile.
Euroopas tegutseb selliste haiguste ravimeetodite uurimise ja väljatöötamisega tegelev immunoloogide ühendus, mida nimetatakse EOI-ks (European Society for Immunodeficiencies). Nad on loonud ja pidevalt täiendanud PID-haiguste andmebaasi ning kinnitanud diagnostilise algoritmi üsna kiireks diagnoosimiseks.
Diagnoos algab haiguse anamneesi kogumisega. Erilist tähelepanu tuleks pöörata genealoogilisele aspektile, kuna enamik kaasasündinud immuunpuudulikkust on pärilikud. Lisaks tehakse pärast füüsilise läbivaatuse läbiviimist ja üldistest kliinilistest uuringutest andmete saamist esialgne diagnoos. Edaspidi peab patsient arsti oletuse kinnitamiseks või ümberlükkamiseks läbima põhjaliku läbivaatuse selliste spetsialistide poolt nagu geneetik ja immunoloog. Alles pärast kõigi ülaltoodud manipulatsioonide läbiviimist saame rääkida lõpliku diagnoosi tegemisest.
Laboratoorsed uuringud

Kui diagnoosimisel kahtlustatakse primaarset immuunpuudulikkuse sündroomi, tuleb teha järgmised laboratoorsed uuringud:
Üksikasjaliku verevalemi koostamine (erilist tähelepanu pööratakse lümfotsüütide arvule);
Immunoglobuliinide sisalduse määramine vereseerumis;
B- ja T-lümfotsüütide kvantitatiivne loendamine.
Täiendavad uuringud
Lisaks juba eespool mainitud laboratoorsetele diagnostilistele uuringutele määratakse igal konkreetsel juhul individuaalsed lisauuringud. On riskirühmi, keda tuleb HIV-nakkuse või geneetiliste kõrvalekallete suhtes testida. Samuti näeb arst ette võimalust, et inimesel on 3 või 4 tüüpi immuunpuudulikkus, mille puhul ta nõuab patsiendi fagotsütoosi üksikasjalikku uurimist, seadistades testi tetrasoliinsinise indikaatoriga ja kontrollides komplemendi koostist. süsteem.
PID-i ravi
Ilmselgelt sõltub vajalik ravi eelkõige immuunhaigusest endast, kuid kahjuks ei saa kaasasündinud vormi täielikult kõrvaldada, mida ei saa öelda omandatud immuunpuudulikkuse kohta. Kaasaegse meditsiini arengule tuginedes püüavad teadlased leida moodust põhjuse kõrvaldamiseks geenitasandil. Kuni nende katsed olid edukad, võib väita, et immuunpuudulikkus on ravimatu seisund. Kaaluge rakendatava ravi põhimõtteid.

Asendusravi
Immuunpuudulikkuse ravi taandatakse tavaliselt asendusraviks. Nagu varem mainitud, ei suuda patsiendi organism iseseisvalt toota teatud immuunsüsteemi komponente või on nende kvaliteet oluliselt madalam kui vaja. Ravi seisneb sel juhul antikehade või immunoglobuliinide manustamises, mille loomulik tootmine on häiritud. Enamasti manustatakse ravimeid intravenoosselt, kuid mõnikord on võimalik ka subkutaanne manustamine, et muuta patsiendi elu lihtsamaks, kes sel juhul ei pea enam raviasutust külastama.
Asenduspõhimõte võimaldab patsientidel sageli elada peaaegu normaalset elu: õppida, töötada ja puhata. Loomulikult ei lase haigusest nõrgenenud immuunsus, humoraalsed ja rakulised tegurid ning pidev vajadus kalleid ravimeid manustada patsiendil täielikult lõõgastuda, kuid see on siiski parem kui elu survekambris.
ja ennetamine
Arvestades, et primaarse immuunpuudulikkuse rühma haigusega patsiendi jaoks võib terve inimese jaoks ebaoluline bakteriaalne või viirusnakkus lõppeda surmaga, tuleb ennetustööd korrektselt läbi viia. Siin tulevad mängu antibakteriaalsed, seene- ja viirusevastased ravimid. ravimid. tuleks teha spetsiaalselt ennetusmeetmeteks, sest nõrgenenud immuunsüsteem ei pruugi võimaldada kvaliteetset ravi.
Lisaks tuleb meeles pidada, et sellised patsiendid on altid allergilistele, autoimmuunsetele ja, mis veelgi hullem, kasvajahaigustele. Kõik see ilma täieliku meditsiinilise järelevalveta ei pruugi võimaldada inimesel täisväärtuslikku eluviisi juhtida.
Siirdamine
Kui spetsialistid otsustavad, et patsiendil pole muud valikut kui kirurgia saab teha luuüdi siirdamist. See protseduur on seotud mitme riskiga patsiendi elule ja tervisele ning praktikas ei suuda see isegi eduka tulemuse korral alati lahendada kõiki immuunhäire all kannatava inimese probleeme. Sellise operatsiooni käigus asendatakse kogu retsipient samaga, mille annab doonor.
Primaarsed immuunpuudulikkused on kaasaegse meditsiini kõige keerulisem probleem, mis pole kahjuks veel täielikult lahendatud. Seda tüüpi haiguste puhul on endiselt ebasoodne prognoos ja see on kahekordselt kurb, arvestades asjaolu, et lapsed kannatavad nende all kõige sagedamini. Sellegipoolest sobivad paljud immuunpuudulikkuse vormid täisväärtusliku eluga, kui need diagnoositakse õigeaegselt ja kasutatakse piisavat ravi.
A. Knutsen, T. Fischer
Vastupidavus infektsioonidele on tingitud mitmetest kaitsemehhanismidest. Esimest kaitseliini esindavad naha ja limaskestade mehaanilised barjäärid. Limaskestade barjäärifunktsiooni täiendavad ripsepiteeli toimimine, lima, lüsosüümi, laktoferriini ja interferoonide kaitseomadused.
Naha ja limaskestade kaudu tunginud mikroobide eemaldamisel osalevad komplement, neutrofiilid ja makrofaagid, mis kujutavad endast keha teist kaitseliini võõrkehade eest. Lisaks ülalloetletud mittespetsiifilistele kaitsefaktoritele osalevad infektsiooniresistentsuse kujunemises ka antikehad ja T-lümfotsüüdid.
Seletamatu põhjusega korduvad infektsioonid on immuunpuudulikkuse kõige levinum ilming. Need esinevad nii lastel kui ka täiskasvanutel, võivad olla esmased (sagedamini kaasasündinud) ja sekundaarsed. Sekundaarseid immuunpuudulikkusi täheldatakse pahaloomuliste kasvajate, sealhulgas hemoblastoosi, viirusnakkuste, nagu HIV-nakkuse või Epsteini-Barri viiruse põhjustatud infektsioonide, immunosupressiivse ravi, vananemise, ammendumise, immunoglobuliinide kadumise, nagu nefrootiline sündroom või eksudatiivne enteropaatia. Sekundaarse immuunpuudulikkuse peamine põhjus on tänapäeval HIV-nakkus. See avaldub krooniliste infektsioonide, sealhulgas oportunistlike mikroorganismide põhjustatud infektsioonide ja pahaloomulised kasvajad, peamiselt lümfoomid ja Kaposi sarkoom (vt 19. peatükk, lk I.B). Korduvate infektsioonidega patsientide uurimisel on oluline roll immuunseisundi hindamisel. Tuleb meeles pidada, et sagedaste infektsioonide põhjus pole mitte ainult immuunpuudulikkus (vt tabel 18.1). Seega tuleks ülemiste hingamisteede korduvate infektsioonidega lastel see välja jätta allergiline nohu ja bronhiaalastma. Sagedased infektsioonid on iseloomulikud ka tsüstilisele fibroosile ja primaarsele tsiliaarsele düskineesiale, mistõttu ei tohiks korduvate infektsioonide all kannatavate patsientide uurimine piirduda immuunseisundi hindamisega.
I. Primaarsete immuunpuudulikkuste klassifikatsioon. Primaarsete immuunpuudulikkuste kaasaegne klassifikatsioon põhineb ühe või teise immuunsuse lüli domineerival lüüasaamisel. Selle klassifikatsiooni järgi jagunevad esmased immuunpuudulikkused 5 rühma.
A. Humoraalse immuunsuse puudulikkus moodustab 50–60% kõigist primaarsetest immuunpuudulikkustest ja väljendub antikehade tootmise häiretes. Sellesse rühma kuuluvad isoleeritud IgA defitsiit (levimus - 1:500), teiste klasside immunoglobuliinide isoleeritud puudulikkus, mitmete klasside immunoglobuliinide puudulikkus. Võimalik humoraalse immuunsuse puudulikkus immunoglobuliinide normaalse kontsentratsiooniga. Selle põhjuseks on antikehade taseme langus teatud antigeenide rühma, näiteks bakteriseina süsivesikute antigeenide suhtes.
B. Rakulise immuunsuse puudulikkus moodustab 5-10% kõigist primaarsetest immuunpuudulikkustest ja väljendub T-lümfotsüütide proliferatsiooni ja diferentseerumise rikkumises. Rakulise immuunsuse esmase rikkumisega kaasneb enamikul juhtudel sekundaarne antikehade sünteesi rikkumine.
C. Humoraalse ja rakulise immuunsuse kombineeritud puudulikkus moodustab 20–25% kõigist primaarsetest immuunpuudulikkustest. Sellesse rühma kuuluvad haigused, mis on põhjustatud B- ja T-lümfotsüütide proliferatsiooni ja diferentseerumise esmasest rikkumisest.
Iseloomustab T-lümfotsüütide arvu ja immunoglobuliinide taseme langus veres, mis on kõige väljendunud raske kombineeritud immuunpuudulikkuse korral. Humoraalse ja rakulise immuunsuse kombineeritud puudulikkusega kaasnevad sageli muud kaasasündinud haigused, nagu trombotsütopeenia Wiskott-Aldrichi sündroomi korral või kaasasündinud südamedefektid ja hüpokaltseemia DiGeorge'i sündroomi korral.
D. Fagotsüütide puudulikkus moodustab 10-15% kõigist primaarsetest immuunpuudulikkustest. Fagotsüütide puudulikkus on tingitud neutrofiilide ja makrofaagide proliferatsiooni, diferentseerumise, kemotaksise ja tegeliku fagotsütoosi protsessi rikkumisest. Fagotsüütide puudulikkusega kaasnevad sageli rasked infektsioonid.
E. Komplemendi puudulikkus moodustab mitte rohkem kui 2% kõigist primaarsetest immuunpuudulikkustest, avaldub opsoniseerumise, fagotsütoosi ja mikroorganismide hävitamise rikkumisena ning sellega kaasnevad rasked infektsioonid kuni sepsiseni. Komplemendi puudulikkust täheldatakse sageli autoimmuunhaiguste, näiteks SLE korral.
II. Diagnostika. Koguge anamnees ja viige läbi füüsiline läbivaatus. See võimaldab oletada, milline immuunsüsteemi osa on valdavalt mõjutatud, ja planeerida laboriuuringuid. Immuunpuudulikkuse ravi efektiivsuse hindamisel on väga oluline füüsiline läbivaatus. Enamiku immuunpuudulikkuse etioloogia on teadmata. Primaarsed immuunpuudulikkused on tavaliselt kaasasündinud ja ilmnevad esimesel eluaastal. Primaarsete immuunpuudulikkuste peamised kliinilised ilmingud on toodud tabelis. 18.2.
A. Anamnees
1. Korduvad hingamisteede infektsioonid on tüüpiline immuunpuudulikkuse ilming. Kõige levinumad patogeenid on Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Staphylococcus aureus, Neisseria spp., Pseudomonas aeruginosa ja mõned anaeroobsed bakterid. Väiksematel lastel võib immuunpuudulikkuse puudumisel täheldada sagedasi ülemiste hingamisteede põletikke (kuni 6-10 korda aastas), näiteks lastel, kes põevad hingamisteede allergilisi haigusi, käivad koolieelsetes lasteasutustes või kellel on koolis vanemad õed-vennad. Järgnevalt on toodud hingamisteede infektsioonide tunnused immuunpuudulikkuse korral.
a. krooniline kulg tüsistused, nagu krooniline mädane keskkõrvapõletik, mastoidiit, bronhektaasia, kopsupõletik, meningiit, sepsis.
b. Ägenemiste pikaajaline iseloom, ravi ebaefektiivsus.
sisse. Rasked bakteriaalsed infektsioonid. Raske infektsiooni kordumine nõuab hoolikat hindamist, et välistada immuunpuudulikkus. Neisseria spp poolt põhjustatud korduvad rasked infektsioonid viitavad komplemendi komponentide puudumisele, mis osalevad membraanirünnaku kompleksi moodustamises (vt 1. peatüki punkt IV.D.3).
d) Oportunistlike patogeenide (Pneumocystis carinii, Aspergillus fumigatus, Candida albicans, Serratia marcescens) põhjustatud infektsioonid on iseloomulikud rakulise immuunsuse puudumisele ja fagotsütoosile.
2. Atoopilised haigused anamneesis (sh perekonna ajaloos) ei ole tüüpilised immuunpuudulikkusele. Tuleb meeles pidada, et atoopiliste haiguste ilmingud võivad olla sarnased immuunpuudulikkuse ilmingutega. Võrdlevad omadused immuunpuudulikkused ja atoopilised haigused on toodud tabelis. 18.3.
3. Arengu mahajäämus. Immuunpuudulikkuse korral täheldatakse sageli arengupeetust, kuid selle puudumine ei välista immuunpuudulikkust. Arengupeetus on kõige tüüpilisem ebapiisava rakulise immuunsusega lastele, eriti millega kaasneb krooniline kõhulahtisus. Teised immuunpuudulikkuse arengupeetuse põhjused on kroonilised infektsioonid.
4. Krooniline kõhulahtisus, sagedane oksendamine ja malabsorptsiooni sündroom on võimalikud mis tahes immuunpuudulikkuse korral ning need on tavaliselt põhjustatud infektsioonidest, mida põhjustavad Giardia lamblia, Cryptosporidium spp., Helicobacter pylori, enteropatogeensed Escherichia coli tüved või viirused, nagu rotaviirused või tsütomegaloviirused. Välistada muud seedetrakti häirete põhjused - disahharidaaside defitsiit, tsöliaakia, seedetrakti lümfoom.
5. Vajalik on üksikasjalik teave varasemate haiguste, varasema ravi, seksuaalelu, uimastitarbimise kohta. Erilist tähelepanu pööratakse järgmisele.
a. Ema haigus raseduse ajal. Sekundaarseid immuunpuudulikkusi põhjustavad HIV ja punetiste viirus: HIV põhjustab humoraalse ja rakulise immuunsuse puudulikkust ning punetiste viirus - humoraalset immuunsust.
b. Rasedusaeg ja sünnikaal. Enneaegsetel imikutel, kelle gestatsiooniaeg on alla 30–32 nädala, täheldatakse hüpogammaglobulineemiat, mis on tingitud platsenta kaudu manustatud ema IgG puudumisest. Madala sünnikaaluga imikud on nakkustele vastuvõtlikumad.
sisse. Verekomponentide ülekande tüsistused. Verekomponentide ülekandmine suurendab HIV-nakkuse riski ja kui rakuline immuunsus on ebapiisav, võib see põhjustada transplantaat-peremehe vastu haigust. HIV-nakkuse risk on eriti suur patsientidel, kes said vereülekandeid aastatel 1978–1985.
d) Vaktsineerimine elusviiruse vaktsiinidega võib ebapiisava rakulise immuunsusega patsientidel põhjustada nakkuslikke tüsistusi.
e. Antimikroobne ravi. Tuleb välja selgitada, kui sageli antimikroobset ravi läbi viidi ja milline oli selle efektiivsus, kas patsiendile määrati normaalsed või spetsiifilised immunoglobuliinid.
e. Kirurgilised sekkumised. Korduvate hingamisteede infektsioonide korral tehakse sageli kirurgilist ravi: tonsillektoomia, adenotoomia, ninakõrvalkoobaste äravool. Tulemuste retrospektiivne analüüs histoloogiline uuring palatine ja neelu mandlid paljastavad immuunpuudulikkusele iseloomulikud patoloogilised muutused, nagu paljunemiskeskuste või plasmarakkude puudumine.
ja. Seksuaalse sättumuse häired, sugulisel teel levivad haigused, vägistamine, narkomaania suurendavad HIV-nakkuse riski, mis võib kulgeda sarnaselt primaarse immuunpuudulikkusega (vt ptk 19, jaotis I.B).
6. Perekonna ajalugu. Primaarsete immuunpuudulikkuste pärilikkuse tüüp on toodud tabelis. 18.4. Enamik primaarseid immuunpuudulikkusi päritakse autosomaalselt retsessiivselt või X-seotud viisil. Perekonnaloo kogumisel on soovitav välja selgitada, kas perekonnas oli omavahel tihedalt seotud abielusid ja viia läbi genealoogiline uuring. Keskendutakse järgmisele teabele.
a. Surmad imikueas, korduvad ja kroonilised infektsioonid, hemoblastoosid, lähi- ja kaugemate sugulaste autoimmuunhaigused.
b. Pereliikmete allergilised haigused ja tsüstiline fibroos viitavad sellele, et lapse korduvad infektsioonid ei ole tõenäoliselt seotud primaarse immuunpuudulikkusega.
7. Võidujooks. Mõned haigused, nagu sirprakuline aneemia, on eriti levinud teatud rassi esindajate seas. Nende haiguste tuvastamine pereliikmetel viitab ka sellele, et lapse sagedased infektsioonid ei ole seotud immuunpuudulikkusega.
B. Füüsiline läbivaatus. Raske immuunpuudulikkusega patsiente iseloomustab kahvatus, letargia, ärrituvus ja kehakaalu langus. Lapse normaalse arengu ja kehalise aktiivsuse taseme korral on immuunpuudulikkuse diagnoosimine ebatõenäoline. Individuaalsele immuunpuudulikkusele iseloomulikud sümptomid on toodud tabelis. 18.5. Füüsilise läbivaatuse ajal pöörake tähelepanu järgmisele.
1. Lapse pikkus ja kaal. Rakulise immuunsuse puudulikkusega lapsed on sageli arengupeetusega, kuna neil on sageli krooniline kõhulahtisus. Enamik humoraalse immuunsuse puudulikkusega lapsi areneb normaalselt. Lapse füüsilise arengu dünaamika on immuunpuudulikkuse ravi efektiivsuse näitaja.
2. lümfisüsteem. Humoraalse ja rakulise immuunsuse puudulikkuse korral vähenevad või puuduvad palatiini ja neelu mandlid ning perifeersed lümfisõlmed. Mõne immuunpuudulikkuse korral, nagu Letterer-Siwe tõbi, IgM hüperproduktsiooni sündroom, tavaline varieeruv hüpogammaglobulineemia, Omenni sündroom, siiriku vastu peremeeshaigusest tingitud immuunpuudulikkus, lümfisõlmede suurenemine ja hepatosplenomegaalia.
3. Naha ja limaskestade kandidoos. Ebapiisava rakulise immuunsusega lastel (DiGeorge'i sündroom, Wiskott-Aldrichi sündroom, raske kombineeritud immuunpuudulikkus), erinevalt tervetest imikutest, iseloomustab suu kandidoosi raske ja pikaajaline kulg. Immuunpuudulikkuse taustal esinevale kandidoosile on iseloomulik: 1) eelsoodumustegurite puudumine (ravi antibiootikumide või kortikosteroididega, infektsioon imetamise ajal); 2) pikenenud kursus; 3) ravi ebaõnnestumine; 4) korduvkursus; 5) söögitoru kandidoos; 6) püsivad nahakahjustused.
4. Kõrva ja nina haigused. Sageli täheldatakse kroonilist mädast keskkõrvapõletikku, millega kaasneb perforatsioon ja trummikile muutused, mäda eritumine kõrvast, krooniline sinusiit ja riniit.
5. Trummipulkade sümptom, anteroposteriori suuruse suurenemine rind HIV-nakkusega laste lümfotsüütilise interstitsiaalse pneumoniidi korral täheldatakse püsivat vilistavat hingamist. Neid sümptomeid täheldatakse ka kroonilise bronhiidi ja bronhektaasia korral.
6. Fagotsüütide puudulikkuse korral täheldatakse sageli parodontiiti.
7. Naha ja limaskestade haavandid. Immuunpuudulikkusega, eriti rakulise immuunsuse raske puudulikkusega, kaasnevad sageli keele, suu limaskesta ja pärakuümbruse naha haavandid.
8. Fagotsüütide puudulikkusele on iseloomulikud naha ja nahaaluskoe mädased infektsioonid. Leukotsüütide adhesiooni ja IgE hüperproduktsiooni sündroomi rikkumise korral on võimalikud kroonilised abstsessid. Teiste hulgas naha ilmingud immuunpuudulikkuse hulka kuuluvad järgmised.
a. Seborroilise dermatiiditaoline lööve raske kombineeritud immuunpuudulikkuse, Letterer-Siwe tõve, Omenni sündroomi ja transplantaat-peremehe vastu haiguse korral.
b. Hajus neurodermatiit - raske kombineeritud immuunpuudulikkuse, Wiskott-Aldrichi sündroomi, IgE hüperproduktsiooni sündroomi ja hüpogammaglobulineemiaga.
sisse. Nahakahjustus, mis sarnaneb erütematoosluupusega, komplemendi komponentide C1q, C1r, C4, C2, C5, C6, C7 ja C8 puudulikkusega, isoleeritud IgA puudulikkusega ja tavalise muutuva hüpogammaglobulineemiaga.
d) Dermatomüosiit – X-seotud agammaglobulineemia ja mõnikord C2 puudulikkusega. X-seotud agammaglobulineemia dermatomüosiit näib olevat põhjustatud ECHO viirustega nakatumisest.
9. Viirusliku entsefaliidiga kaasnevad rasked neuroloogilised häired, hilinenud füüsiline ja vaimne areng ja võib lõppeda surmaga. Eriti sageli arenevad nad ebapiisava rakulise immuunsuse ja raske kombineeritud immuunpuudulikkusega. X-seotud agammaglobulineemia korral täheldatakse ECHO viiruste põhjustatud entsefalomüeliiti.
10. Humoraalse immuunsuse puudumisega kaasnevad sageli artriit ja artralgia.
11. Immuunpuudulikkuse korral on võimalik Haemophilus influenzae põhjustatud krooniline konjunktiviit.
12. Leukotsüütide adhesiooni rikkumisega täheldatakse nabanööri hilist kukkumist. See on põhjustatud CD11/CD18 rakuadhesioonimolekulide puudulikkusest leukotsüütide pinnal ja väljendub nende fagotsüütilise aktiivsuse vähenemises.
III. Põhilised laboriuuringud. Raskeid immuunpuudulikkusi saab tuvastada lihtsate laboriuuringud. Kui ajaloo ja füüsilise läbivaatuse tulemused viitavad immuunpuudulikkusele, võivad nad diagnoosi kinnitada. Kui diagnoos jääb ebaselgeks, viiakse läbi täiendavad uuringud (vt ptk 18, punkt IV). Immuunpuudulikkuse diagnoosimiseks kasutatud laboratoorsed uuringud on loetletud tabelis. 18,6 ja ptk. kakskümmend.
A. Täielik vereanalüüs näitab aneemiat, leukopeeniat või trombotsütopeeniat. Neutrofiilide koguarv peaks tavaliselt olema vähemalt 1800 µl–1, lümfotsüüdid – 1000 µl–1, alla 2-aastastel lastel peaks lümfotsüütide arv tavaliselt olema vähemalt 2800 µl–1. Kuna T-lümfotsüüdid moodustavad ligikaudu 75% kõigist vere lümfotsüütidest, viitab lümfopeenia peaaegu alati T-lümfotsüütide arvu vähenemisele. Neutropeenia ja lümfopeenia võivad olla sekundaarsed näiteks infektsioonide, autoimmuunhaiguste ja teatud ravimite, eriti immunosupressantide kasutamise tõttu. Neutropeenia või lümfopeenia tuvastamisel korratakse täielikku vereanalüüsi. Eosinofiiliat täheldatakse sageli ebapiisava rakulise immuunsusega patsientidel. Leukotsüütide adhesiooni rikkumisega kaasneb püsiv leukotsütoos. Wiskott-Aldrichi sündroomi iseloomustab trombotsüütide arvu ja suuruse vähenemine. Mõne immuunpuudulikkuse korral, nagu IgM hüperproduktsiooni sündroom ja raske kombineeritud immuunpuudulikkus, täheldatakse autoimmuunset trombotsütopeeniat.
B. IgG, IgM ja IgA kvantitatiivne määramine viiakse läbi lihtsate radiaalse immunodifusiooni ja nefelomeetria meetoditega. Tulemusi hinnatakse vanusenorme arvestades (vt lisa V). Normaalseks peetakse immunoglobuliini taset, mis on vanuse keskmisest 2 standardhälbe piires. Immunoglobuliinide taseme langusega enam kui 2 standardhälbe võrra vanuse normist diagnoositakse hüpogammaglobulineemia.
B. Seerumi üld-IgE taseme määramine RIA või tahkefaasi ELISA abil aitab eristada allergilist haigust immuunpuudulikkusest. Siiski võib IgE tase tõusta ka immuunpuudulikkuse korral, eriti ebapiisava rakulise immuunsuse korral. IgE taseme märkimisväärne tõus on iseloomulik helmintiaasidele ja allergilisele bronhopulmonaalsele aspergilloosile. Saadud tulemuste hindamisel võetakse arvesse IgE üldtaseme määramise meetodit ja patsiendi vanust (vt lisa IV).
D. Isohemaglutiniinide määramine võimaldab hinnata IgM taset seerumis. See lihtne uuring viiakse läbi peaaegu kõigis kliinilistes laborites. Tavaliselt ületab enamikul üle 6 kuu vanustel lastel erütrotsüütide antigeeni A vastaste antikehade tiiter 1:8, antigeeni B suhtes - 1:4 (välja arvatud AB-veregrupiga isikud). Üle 18 kuu vanustel lastel ületab erütrotsüütide antigeeni A antikehade tiiter tavaliselt 1:16, antigeeni B suhtes - 1:8. Uuringu tulemuste hindamine on keeruline, kui immunoglobuliinid määrati kuu jooksul enne uuringut. Alla 6 kuu vanustel lastel esinevad seerumis tavaliselt ema antikehad IgG-ga seotud erütrotsüütide antigeenide vastu, mistõttu on ka tulemuste hindamine raskendatud.
D. Lastel on kohustuslik määrata kloori tase higis ja hinnata kõhunäärme eksokriinset funktsiooni. See on eriti vajalik korduvate hingamisteede infektsioonide, malabsorptsiooni sündroomi ja arengupeetuse korral. Tavaliselt ei ületa kloori sisaldus higis 60 mekv/l. Kuna lastel on raske sisu kätte saada kaksteistsõrmiksool, pankrease eksokriinset funktsiooni neis hinnatakse tinglikult karotiini taseme järgi seerumis: kõhunäärme eksokriinse funktsiooni puudulikkuse korral see väheneb. Vastuolulistel juhtudel tehakse DNA analüüs geneetiliste defektide tuvastamiseks, mis esinevad 70-75% tsüstilise fibroosiga patsientidest.
E. Millal kroonilised infektsioonid määrake ESR ning viige läbi mikroskoopia ja külv patogeenide tuvastamiseks. Vajadusel tehakse röntgenuuring. Kolju külgprojektsioonis röntgenikiirte tegemisel võib tuvastada hüpogammaglobulineemiale iseloomuliku palatiini ja neelu mandlite vähenemist. Harknääre tuvastamine vastsündinutel rindkere röntgenülesvõtetel seab kahtluse alla raske rakulise immuunpuudulikkuse diagnoosi. Tuleb meeles pidada, et harknääre vähenemine on võimalik rasked haigused Seetõttu ei saa see olla primaarse immuunpuudulikkuse patognoomiline märk.
G. Rakulise immuunsuse hindamine viiakse läbi nahatestide abil, mis põhinevad hilinenud tüüpi allergilistel reaktsioonidel. Antigeenid testimiseks valitakse ajaloo põhjal. Positiivne reaktsioon võimaldab välistada rakulise immuunsuse tõsise puudulikkuse, samas kui negatiivne reaktsioon ei ole informatiivne, kui puudub anamnestiline teave kokkupuute kohta proovide moodustamiseks kasutatud antigeenidega. Ligikaudu 85% tervetest täiskasvanutest on ühe või mitme antigeeniga positiivne reaktsioon (mulli läbimõõt üle 5 mm). Lastel täheldatakse positiivseid reaktsioone samade antigeenidega harvemini kui täiskasvanutel, vanusega suureneb positiivsete reaktsioonide sagedus. Alla 2-aastastel lastel kasutatakse nahateste Candida albicansi antigeenide ja teetanuse toksoidi tuvastamiseks. Positiivne reaktsioon Candida albicansi antigeenidele esineb umbes 30% immuunpuudulikkuseta imikutel. Nagu juba märgitud, täheldatakse ebapiisava rakulise immuunsusega imikutel kandidoosi sagedamini kui tervetel samavanustel lastel, kuid Candida albicansi antigeenidega tehtud nahatestid on neil tavaliselt negatiivsed. Positiivset nahatesti teetanuse toksoidiga pärast teist immuniseerimist ADS-iga täheldati 67% tervetest lastest, pärast kolmandat - 97%. Positiivne reaktsioon nahatestide ajal välistab rakulise immuunsuse tõsise puudulikkuse, samas kui negatiivsel reaktsioonil pole diagnostilist väärtust. Antigeenide annused nahatestide jaoks on toodud tabelis. 18.7. Selle uuringu läbiviimisel tuleb järgida järgmisi reegleid.
1. Vajalik on kontrollida antigeeni aktiivsust, selleks tuleb esmalt teha nahatest sellele tundlikul tervel inimesel.
2. Tuleb meeles pidada, et immunosupressiivse ravi taustal tehtud testide läbiviimisel on võimalikud valenegatiivsed tulemused.
3. Tuleb kindlaks teha, kas patsient on varem proovide võtmisel kasutatud antigeenidega kokku puutunud ja kui jah, siis kas esines lokaalseid või süsteemseid reaktsioone. Raskete reaktsioonide anamneesis ei tehta selle antigeeniga nahateste või tehakse vähem kontsentreeritud antigeeniga.
4. Nahatestid tehakse järgmiselt.
a. Iga süsti jaoks kasutage eraldi steriilset tuberkuliinisüstalt mahuga 1 ml ja 27 G nõela pikkusega 13 mm.
b. Süstlasse tõmmatakse 0,1 ml antigeenilahust, õhumullid eemaldatakse.
sisse. Antigeen süstitakse intradermaalselt küünarvarre või selga.
d) Vahetult pärast antigeeni süstimist peaks süstekohta ilmuma 5-10 mm läbimõõduga blister. Kui blister ei ilmu, süstitakse mitte intradermaalselt, vaid s / c. Sel juhul süstitakse antigeen uuesti teise nahapiirkonda.
e) Süstekohale tehakse ring, näiteks pastapliiatsiga.
e. Tulemusi hinnatakse 24 ja 48 tunni pärast.Kui 24 tunni pärast on testi tulemus negatiivne, võite sisestada kontsentreerituma antigeenilahuse.
ja. Nahatestimiseks kasutatakse tavaliselt kaubanduslikku CMI Multitest komplekti, mis koosneb 7 antigeenist: Candida albicans, Trichophyton spp., Proteus spp., teetanuse toksoid, difteeria toksoid, streptokinaas ja puhastatud tuberkuliin. Tuleb märkida, et seda komplekti kasutades on uuringu tulemuste hindamine sageli keeruline, kuna positiivne reaktsioon blister võib olla väike (veidi üle 2 mm).
3. Komplemendi testimine ei ole esmane laboriuuring. Kui aga perekonnas on esinenud komplemendi puudulikkust ja autoimmuunhaigust või kliiniline pilt viitab komplemendi puudulikkusele, tuleks see uuring läbi viia võimalikult varakult.
1. Komplemendi hemolüütiline aktiivsus võimaldab hinnata selle aktiveerimise klassikalise raja (C1-C9) komponentide funktsionaalset aktiivsust. Komplemendi normaalne hemolüütiline aktiivsus ei välista selle üksikute komponentide puudulikkust ega alternatiivse aktivatsioonitee rikkumist.
3. Komplemendi puudulikkuse diagnoosimisel on kõige informatiivsem komplemendi hemolüütilise aktiivsuse ning C3 ja C4 tasemete samaaegne määramine.
a. C3 ja C4 tasemete ja komplemendi hemolüütilise aktiivsuse samaaegne langus näitab komplemendi aktiveerumist klassikalisel teel, näiteks ägeda viirushepatiidi viiruste või immuunkomplekside poolt.
b. Normaalne C3 tase koos madala C4 taseme ja vähenenud hemolüütilise komplemendi aktiivsusega näitab C4 puudulikkust. Seda täheldatakse mõnel SLE-ga patsiendil päriliku Quincke ödeemi, malaaria korral.
sisse. Näha on normaalsed C4 tasemed koos madala C3 tasemega ja komplemendi vähenenud hemolüütiline aktiivsus kaasasündinud puudulikkus C3, C3b inhibiitori puudulikkus ja komplemendi aktiveerimine alternatiivse raja kaudu, nagu gramnegatiivsed bakteriaalsed endotoksiinid. C3 tase väheneb ka vastsündinutel, kellel on ulatuslikud põletused ja alatoitumus.
d) C3 ja C4 normaalne sisaldus koos komplemendi vähenenud hemolüütilise aktiivsusega näitab teiste komplemendi komponentide puudulikkust. Sel juhul on näidustatud täiendavad laboriuuringud.
IV. Täiendavad laboratoorsed uuringud. Kui põhiliste laboratoorsete uuringute tulemused ei võimalda diagnoosi panna või kinnitada, tehakse keerulisemad laboriuuringud (vt ptk 20). Kuna immuunsüsteemi erinevate osade rikkumist täheldatakse sageli samaaegselt, on patoloogia tuvastamisel näidatud immuunsüsteemi täielik uuring. Tavaliselt viiakse see läbi spetsialiseeritud laborites. Kuni diagnoosi panemiseni ravi ei alustata.
A. Humoraalse immuunsuse uurimine
1. B-lümfotsüütide arvu määramine. Lümfotsüütide rakumembraanil on palju glükoproteiine, mida saab tuvastada voolutsütomeetria abil, kasutades monoklonaalseid antikehi. Mõned neist glükoproteiinidest on spetsiifilised teatud rakutüübile, nagu T-, B- ja NK-lümfotsüüdid, erinevad T-lümfotsüütide alampopulatsioonid, monotsüütided ja isegi nende küpsemise ja diferentseerumise teatud staadiumid. Neid molekule nimetatakse tavaliselt CD-deks. Paljude CD-de funktsioonid on praegu määratletud (vt tabel 18.8). Uuringu tulemuste hindamisel on vaja arvestada patsiendi vanust. Lisaks on vaja pidevalt jälgida reaktiivide kvaliteeti ja metoodikast kinnipidamist, kuna isegi selle kerge rikkumine moonutab uuringu tulemusi. B-lümfotsüütide määramine voolutsütomeetria abil põhineb rakupinnal fikseeritud immunoglobuliinide CD19 ja CD20 tuvastamisel (vt tabel 18.8). Vanematel lastel ja täiskasvanutel moodustavad B-lümfotsüüdid 10-20% kõigist vere lümfotsüütidest, väiksematel lastel on neid rohkem.
2. Antikehade tiitri määramine. Kui kahtlustatakse humoraalse immuunsuse puudumist, hinnatakse valgu- ja polüsahhariidantigeenide vastaste antikehade tiitrit. Tavaliselt määratakse need pärast vaktsineerimist või nakatumist.
a. Valgu antigeenide vastased antikehad. Enamasti uuritakse difteeria ja teetanuse toksoidide IgG-d enne ja 2-4 nädalat pärast vaktsineerimist DPT või DTP-ga. Kuna peaaegu kõik täiskasvanud on DTP-ga vaktsineeritud, on antikehade tase pärast revaktsineerimist sekundaarse immuunvastuse näitaja. PRP antigeeni vastaseid antikehi on võimalik tuvastada ka pärast Haemophilus influenzae tüüpi B vaktsiini manustamist. Kuigi see antigeen on polüsahhariid, toimib see konjugaatvaktsiinis valgu antigeenina. Mõnikord testitakse antikehi pärast immuniseerimist inaktiveeritud poliomüeliidi vaktsiiniga ja rekombinantse B-hepatiidi vaktsiiniga. Immuunpuudulikkuse kahtlusel elus viiruslikud vaktsiinid vastunäidustatud.
b. Polüsahhariidantigeenide vastased antikehad. Humoraalse immuunvastuse hindamiseks polüsahhariidantigeenidele kasutatakse pneumokoki ja meningokoki vaktsiine, mis ei sisalda valgukandjaid. Antikehade tiiter määratakse enne ja 3-4 nädalat pärast vaktsineerimist. Mõnes uurimislaboris kasutatakse selleks konjugeerimata vaktsiini Haemophilus influenzae tüüpi B vastu, mille tulemusi hinnatakse patsiendi vanust arvestades. Seega on alla 2-aastastel lastel immuunvastus polüsahhariidantigeenidele nõrk, mõnel lapsel jääb see kuni 5 aastaks. Sellega seoses on polüsahhariidvaktsiinide kasutamine väikelastel sobimatu ja isegi vastunäidustatud, kuna see võib vanemas eas põhjustada immunoloogilise tolerantsuse ja ebatõhusa revaktsineerimise.
sisse. Primaarse ja sekundaarse humoraalse immuunvastuse hindamine. Antigeeni kliirensi määramiseks kasutatakse valguantigeenina IgM (primaarses immuunvastuses) ja IgG (sekundaarses immuunvastuses) taset, bakteriofaagi fichi 174, mis on inimesele ohutu bakteriaalne viirus. Primaarse humoraalse immuunvastuse hindamiseks kasutatakse ka maojalgse hemotsüaniini, rekombinantset B-hepatiidi vaktsiini, monomeerset flagelliini, puukentsefaliidi vaktsiini.
d) Looduslikud antikehad (isohemaglutiniinid, streptolüsiin O vastased antikehad, heterofiilsed antikehad, näiteks oina erütrotsüütide vastased antikehad) esinevad tavaliselt peaaegu kõigi inimeste seerumis. Seda seetõttu, et antigeenid, mille vastu need antikehad on suunatud, on laialt levinud ja sisalduvad toiduained, sissehingatavad osakesed, hingamisteede mikrofloora.
3. IgG alamklasside määratlus. Kui korduvate bakteriaalsete hingamisteede infektsioonide korral on kogu IgG tase normaalne või veidi vähenenud või tuvastatakse isoleeritud IgA puudulikkus, on näidustatud IgG alamklass. See võimaldab tuvastada IgG2 puudulikkust (IgG2 moodustab umbes 20% IgG-st), mida saab eraldada või kombineerida IgA või IgG4 puudulikkusega. Tuleb meeles pidada, et humoraalse immuunvastuse funktsionaalne hindamine on informatiivsem uurimismeetod kui IgG alamklasside kvantitatiivne määramine. Seega väheneb IgG2 normaalse taseme korral sageli Streptococcus pneumoniae polüsahhariidantigeenide vastaste antikehade tase. Lisaks on immuunpuudulikkuse kliiniliste ilmingute puudumisel raskete ahelate sünteesi rikkumise tõttu võimalik kaasasündinud IgG2 puudulikkus.
4. IgA määramine. Sekretoorse IgA isoleeritud puudulikkus normaalse seerumi IgA-ga on haruldane. Reeglina esineb samaaegne sekretoorse ja seerumi IgA defitsiit. Isoleeritud IgA puudulikkus on kliiniliselt vaikne või sellega kaasnevad kerged ülemiste hingamisteede infektsioonid. See on tingitud asjaolust, et IgA puudulikkuse korral suureneb IgG tase seerumis ja IgM tase limaskestade sekretsioonis kompenseerivalt. IgA taset mõõdetakse pisarates, süljes ja teistes kehavedelikes. IgA-l on kaks alamklassi – IgA1 ja IgA2. Hingamisteede veres ja eritistes domineerib IgA1, seedetrakti saladustes - IgA2. IgA1 ja IgA2 normaalne tase.
5. Immunoglobuliinide süntees in vitro. See test mõõdab IgM, IgG ja IgA tootmist stimuleeritud B-lümfotsüütide poolt. Segades terveid ja haigeid erinevate stimulantidega töödeldud T- ja B-lümfotsüüte, on võimalik hinnata T-abistajate ja B-lümfotsüütide talitlust. Enamasti on antikehade puudulikkus tingitud B-lümfotsüütide plasmarakkudeks diferentseerumise häiretest.
6. Primaarse immuunpuudulikkuse kahtlusega lümfisõlmede biopsiat reeglina ei tehta. See on näidustatud ainult juhtudel, kui diagnoos on ebaselge ja patsiendil on suurenenud lümfisõlmed, mis nõuab hemoblastoosi välistamist. Biopsia tehakse tavaliselt 5-7 päeva pärast antigeenset stimulatsiooni. Antigeen süstitakse piirkonda, millest lümf voolab lümfisõlmede rühma, millest ühele tehakse biopsia. Humoraalse immuunsuse puudumisega lümfisõlmes väheneb plasmarakkude arv, suureneb primaarsete folliikulite arv, puuduvad sekundaarsed folliikulid, väheneb kortikaalse aine paksus, täheldatakse lümfisõlmede kudede ümberstruktureerimist, ja mõnikord suureneb makrofaagide ja dendriitrakkude arv.
7. Soole biopsia tehakse tavalise muutuva hüpogammaglobulineemia ja isoleeritud IgA puudulikkusega. Peensoole biopsia on näidustatud kroonilise kõhulahtisuse ja malabsorptsiooni sündroomi korral, et välistada limaskestade atroofia ja Cryptosporidium spp. põhjustatud infektsioonid. ja Giardia lamblia.
8. Antikehade eritumise kiirust uuritakse märgistatud immunoglobuliinide abil. See uuring on näidustatud immunoglobuliinide kahtluse korral seedetrakti kaudu.
B. Rakulise immuunsuse uurimine
1. T-lümfotsüütide pinnaantigeenide uurimine. T-lümfotsüütide pinnaantigeenide määramine voolutsütofluoromeetria abil võimaldab uurida nende küpsemist, diferentseerumist ja aktiveerumist (vt tabel 18.8 ja peatükk 2).
2. T-lümfotsüütide stimuleerimine in vitro. T-lümfotsüütide küpsemise ja diferentseerumise häired ebapiisava rakulise immuunsusega immuunpuudulikkuse korral esinevad erinevatel tasanditel. Seega on raske kombineeritud immuunpuudulikkuse korral häiritud T-lümfotsüütide küpsemine tüümuses, mis väljendub CD2 antigeeni puudumises T-lümfotsüütide pinnal. Selle haiguse korral on võimalik ka CD3, CD4 puudumine ja T-lümfotsüütide võimetus tsütokiine sünteesida. Palja lümfotsüütide sündroomi korral puuduvad aktiveeritud T-lümfotsüütide membraanil HLA II klassi antigeenid. Wiskott-Aldrichi sündroomi korral väheneb CD43 antigeeni ekspressioon, mis osaleb T-lümfotsüütide aktiveerimises. Raske immuunpuudulikkusega koos rakulise immuunsuse puudulikkusega kaasneb T-lümfotsüütide väljendunud düsfunktsioon, kuigi nende rakkude absoluutne ja suhteline arv võib olla normaalne.
a. T-lümfotsüütide in vitro stimuleerimiseks kasutatakse järgmisi aineid.
1) Mitogeenid – fütohemaglutiniin, konkanavaliin A jt – põhjustavad T-lümfotsüütide mittespetsiifilist (mitte antigeeni äratundvate retseptoritega seondumise tõttu) aktivatsiooni.
2) Lahustuvad antigeenid - Candida albicans'i, teetanuse toksoidi antigeenid - seostuvad mälu T-lümfotsüütide antigeeni äratundvate retseptoritega, põhjustavad nende rakkude spetsiifilist aktivatsiooni.
3) Allogeensed rakud (lümfotsüütide segakultuuris) aktiveerivad T-lümfotsüüte, kuna need kannavad oma pinnal HLA II klassi antigeene.
4) Nende aktiveerimises osalevate T-lümfotsüütide pinnaantigeenide antikehad - CD2, CD3, CD43.
5) Kemikaalid nagu forboolmüristaatatsetaat (aktiveerib proteiinkinaasi C) ja ionomütsiin (suurendab rakusisest kaltsiumi).
b. T-lümfotsüütide aktivatsiooni hinnatakse tavaliselt järgmiste näitajate järgi.
1) levik.
2) Tsütokiinide tootmine - interleukiinid-2, -4, -5, gamma-interferoon ja tuumori nekroosifaktor.
3) Aktivatsioonimarkerite ekspressioon - CD25 ja HLA II klassi antigeenid.
4) Tsütotoksilisus.
sisse. Mitogeenide, antigeenide ja allogeensete rakkude toimel aktiveeruvad puhkeolekus olevad T-lümfotsüüdid, muutuvad blastrakkudeks ja hakkavad jagunema. Seega saab lümfotsüütide aktivatsiooni hinnata 3H- või 14C-tümidiini DNA-sse inkorporeerimisega. Lümfotsüütide reaktsioon stimulaatorile varieerub sõltuvalt annusest ja inkubatsiooni kestusest, seetõttu on enne uuringu läbiviimist vaja joonistada normaalsed kõverad isotoopide kaasamise taseme sõltuvuse kohta stimulandi annusest ja inkubatsiooni ajast. lümfotsüütide inkubeerimine. Rakkude radioaktiivsuse tase määratakse stsintillatsiooniloenduriga ja seda väljendatakse impulsside arvuna minutis. Tulemust hinnatakse stimuleerimata (spontaanse proliferatsiooni) ja stimuleeritud lümfotsüütide radioaktiivsuse taseme, samuti stimulatsiooniindeksi järgi (stimuleeritud lümfotsüütide radioaktiivsuse taseme ja stimuleerimata lümfotsüütide radioaktiivsuse taseme suhe). Lisaks saab arvutada haige ja terve inimese stimuleeritud lümfotsüütide radioaktiivsuse tasemete suhte. Lümfotsüütide spontaanne proliferatsioon suureneb mitme vereülekandega patsientidel, allergiliste ja autoimmuunhaigustega, bakteriaalsete ja viirusnakkustega patsientidel, samuti vastsündinutel.
d) Lümfotsüütide segakultuuri kasutatakse selleks, et hinnata T-lümfotsüütide võimet ära tunda allogeensete B-lümfotsüütide ja monotsüütide HLA antigeene. Stimuleerivad rakud (allogeensed B-lümfotsüüdid) inaktiveeritakse kiiritamise või mitomütsiini abil. Patsiendi lümfotsüütide reaktsiooni hinnatakse märgistatud tümidiini lisamisega DNA-sse (vt 17. peatüki lõik II.A.3 ja 20. peatüki lõik III.B.2.a).
3. Mõnikord kasutatakse rakulise immuunsuse hindamiseks immuniseerimist dinitroklorobenseeniga. Seda manustatakse intradermaalselt ja ainult diagnostilistel eesmärkidel. Kuna dinitroklorobenseen on aga tugevalt ärritav ja kantserogeenne, tehakse seda testi harva.
4. Biokeemilised uuringud. Kui kahtlustatakse humoraalse ja rakulise immuunsuse kombineeritud puudulikkust, määratakse adenosiindeaminaasi ja puriinnukleosiidfosforülaasi (osaleb nukleosiidide metabolismis) aktiivsus. Ataksia-telangiektaasia korral on alfa-fetoproteiini tase seerumis peaaegu alati kõrgem, mis võimaldab seda haigust teistest närvihaigustest eristada. Haruldasele ainevahetushäired millega kaasneb rakulise immuunsuse puudulikkus, sealhulgas orootiline atsiduuria ja biotiinist sõltuv karboksülaasi puudulikkus (väljendub alopeetsia ja neuroloogiliste häiretega). Transkobalamiin II vaegus (osaleb B12-vitamiini transpordis) mõjutab kiiresti uuenevaid kudesid, mistõttu seda haigust iseloomustab humoraalse immuunsuse puudumine, vereloomehäired (aneemia, trombotsütopeenia), kõhulahtisus ja arengupeetus.
5. Geneetilised uuringud. Raske rakulise immuunsuse puudulikkusega patsientidel on võimalik kimäärsus (erineva genotüübi rakkude olemasolu ühes organismis). See tekib siis, kui ema vererakud satuvad loote verre, verekomponentide ülekandel ja luuüdi siirdamisel. Kui patsiendi veri sisaldab vastassoost inimrakke, on kimäärsust lihtne tuvastada, leides naiste ja meeste karüotüübiga rakke. Muudel juhtudel määratakse patsiendi vererakud vastavalt HLA-le. See uuring näitab ka HLA II klassi antigeenide puudumist aktiveeritud T-lümfotsüütidel palja lümfotsüütide sündroomi korral.
6. Skaneeriv elektronmikroskoopia paljastab T-lümfotsüüdid, mille pinnal puuduvad Wiskott-Aldrichi sündroomile omased mikrovillid.
7. Raske kombineeritud immuunpuudulikkuse diagnoosi kinnitamiseks tehakse mõnel juhul harknääre biopsia. Harknääre ebapiisava rakulise immuunsuse korral määratakse retikuloepiteelirakkude kogunemine, Hassali kehade puudumine ja selge piir ajukoore ja medulla vahel ning tümotsüütide arvu järsk vähenemine. Harknääre biopsia viivad läbi kirurgid, kes tunnevad selle operatsiooni tehnikat.
8. Lümfisõlmede biopsia. Rakulise immuunsuse puudulikkuse korral lümfisõlme biopsiaproovis ilmneb parakortikaalse tsooni kahjustus. Haavainfektsiooni ja anesteesia tüsistuste ohu tõttu tehakse lümfisõlmede biopsia ainult siis, kui muud laboratoorsed testid ei suuda diagnoosi kinnitada.
B. Fagotsüütide uuring on näidustatud krooniliste ja korduvate bakteriaalsete infektsioonide korral, kui humoraalse ja rakulise immuunsuse uuringus kõrvalekaldeid ei leitud. Fagotsüütide puudulikkuse põhjuseks võib olla migratsiooni, kemotaksise, fagotsüütide adhesiooni, aga ka fagotsütoosi enda rikkumine. Lisaks võib fagotsüütide puudulikkus olla tingitud opsoniinide (antikehade ja komplemendi) puudusest ja fagotsüütide metabolismi häiretest.
1. Nitroblue tetrasooliumi taastumistesti rakendatakse kroonilise granulomatoosse haiguse diagnoosimisel. Meetodi olemus on järgmine: fagotsüütidele lisatakse kollast värvi nitrosiintetrasooliumi, tavaliselt suureneb selle imendumisel fagotsüütide metaboolne aktiivsus, nitrosiintetrasoolium taastatakse, selle reaktsiooni produktid värvitakse siniseks. Fagotsüütide metabolismi rikkumist hinnatakse sinise värvumise intensiivsuse vähenemise järgi. Rikkumiste tuvastamisel määratakse tsütokroom b558 ja teiste fagotsüütide valkude tase.
2. Kemiluminestsents võimaldab hinnata ka fagotsüütide funktsionaalset aktiivsust. Tavaliselt ilmneb fagotsütoosi ajal suur hulk vabu hapnikuradikaale, mis oksüdeerivad substraati, näiteks bakteriraku seina komponente. Oksüdatsiooniga kaasneb nähtava või ultraviolettkiirguse kiirgamine. Fagotsüütide funktsionaalse aktiivsuse hindamiseks saab kasutada kiirguse intensiivsust.
3. Fagotsüütilise aktiivsuse hindamine on kõige informatiivsem viis opsoniinide ja fagotsüütide funktsionaalse seisundi uurimiseks.
a. Tehnika
1) Patsiendi verest eraldatud leukotsüüdid pestakse seerumist, loendatakse ja asetatakse söötmesse, mis sisaldab tervet või haiget seerumit (opsoniinide allikas) ja elusaid baktereid (tavaliselt Staphylococcus aureus või Escherichia coli).
2) Segu inkubeeritakse 37°C juures, proovide võtmine 0, 30, 60 ja 120 minuti pärast pärast inkubeerimise algust. Elujõuliste bakterite arvu määramiseks jahutatakse iga proov kiiresti ja inokuleeritakse.
3) 2 tundi pärast inkubeerimise algust segu tsentrifuugitakse. Leukotsüüdid ja fagotsütoositud bakterid settivad põhja, samas kui fagotsütoosita bakterid jäävad supernatanti. Elujõuliste bakterite arv määratakse settes ja supernatandis.
b. Tulemuste hindamine. Tavaliselt imendub umbes 95% bakteritest ja hävitatakse fagotsüütide poolt 2 tunni jooksul. Kroonilise granulomatoosse haiguse korral ei ületa hävitatud bakterite arv 10% ja leukotsüütide sees leidub elujõulisi baktereid. Elusbakterite esinemine leukotsüütides terve seerumiga inkubeerimise ajal näitab bakterite seedimise rikkumist, kui bakterite püüdmise võime ei vähene. Suurenenud sisu elujõulised bakterid supernatandis, kui neid inkubeeritakse patsiendi seerumiga, viitab opsoniinide puudulikkusele.
4. Leukotsüütide kemotaksis. Kemotaksise rikkumine võib olla tingitud fagotsüütide defektist, kemotaksise inhibiitorite olemasolust, seerumi või koe kemotaksise faktorite puudulikkusest.
a. Nahaakna meetod. Skalpelliga eemaldatakse epidermise pinnakiht pindalaga 4 mm2 (sel juhul peaks ilmuma väike kogus verd). Kahjustatud kohale asetatakse katteklaas. Päevasel ajal vahetatakse katteklaasi iga 0,5-2 tunni järel. Seejärel objektiklaasid värvitakse ja nendel olevaid valgeid vereliblesid uuritakse mikroskoobi all. Tavaliselt tekib esimese 2 tunni jooksul neutrofiilide sissevool vigastuskohta. Järgmise 12 tunni jooksul asenduvad neutrofiilid monotsüütidega.
b. Kemotaksise uurimine in vitro põhineb verest eraldatud fagotsüütide stimuleerimisel kemotaksise faktorite toimel. Fagotsüütide võimet suunatud migratsiooniks saab hinnata, asetades need agaroosiga Boydeni kambrisse või Petri tassi.
5. Leukotsüütide adhesioon. Leukotsüütide adhesiooni rikkumine on tingitud adhesioonimolekulide, näiteks CD11/CD18, ekspressiooni vähenemisest või puudumisest nende pinnal. Adhesioonimolekulide määramiseks kasutatakse voolutsütomeetriat. CD11/CD18 puudumine neutrofiilidel ja monotsüütidel väljendub nabanööri hilises irdumises, korduvas bakteriaalsed infektsioonid, parodontiit. Leukotsüütide adhesiooni saab hinnata ka nende võime järgi kleepuda endoteelirakkudele. Kuid see uuring viiakse läbi ainult mõnes uurimislaboris.
6. Asplenia diagnoosimine. Põrnal on oluline roll nakkuse eest kaitsmisel, kuna see sisaldab suur summa makrofaagid ja plasmarakud. Aspleniaga patsientidel täheldatakse sageli sepsist, vereproovides tuvastatakse deformeerunud erütrotsüüdid ja Govell-Jolly kehad. Asplenia tuvastatakse stsintigraafia ja muu abil instrumentaalsed meetodid uurimine.
7. Muud uuringud. Müeloperoksidaasi, glutatioonperoksidaasi, lüsosüümi, G-6-PD, püruvaatkinaasi ja elektronmikroskoopia aktiivsuse määramine viiakse läbi fagotsüütide väiksemate düsfunktsioonide tuvastamiseks ja teaduslikel eesmärkidel. Neutropeenia korral on näidustatud korduv leukotsüütide arvu määramine veres, leukotsüütide arvu määramine veres pärast kortikosteroidide, adrenaliini ja endotoksiini manustamist, leukotsüütide antikehade määramine, luuüdi uuring.
8. Luuüdi uuring viiakse läbi püsiva leukopeenia või leukotsütoosiga, leukotsüütide morfoloogia muutustega, blastvormide tuvastamisega veres.
D. Täiendage uuringut. Kui anamneesi (vt tabel 18.9) ja põhiliste laboratoorsete analüüside andmed viitavad komplemendi puudulikkusele, on näidustatud selle süvauuring. See hõlmab komplemendi komponentide kvantifitseerimist ja funktsionaalset hindamist, komplemendi aktiveerimise alternatiivse raja uurimist, opsoniinide ja seerumi kemotaksise faktorite määramist. Opsoniinide puudust uuritud seerumis tõendab selle võimetus normaalsete leukotsüütide poolt võimendada bakterite ja pärmseente fagotsütoosi.
D. Sünnieelne diagnostika ja geneetiline nõustamine. Praeguseks on kindlaks tehtud, et paljud immuunpuudulikkused on pärilikud haigused: on teada nende pärilikkuse tüüp, selgub defektse geeni lokaliseerimine, määratakse selle geeni produkt (vt tabel 18.4). Praeguseks on saanud võimalikuks defektse geeni kandmise tuvastamine. Niisiis saab ensüümi kodeeriva defektse geeni heterosügootset kandmist tuvastada selle ensüümi aktiivsuse vähenemisega, näiteks autosomaalse retsessiivse raske kombineeritud immuunpuudulikkuse korral on adenosiindeaminaasi aktiivsus vähenenud, kroonilise granulomatoosse haiguse korral - hingamisahela ensüümid , X-seotud agammaglobulineemia korral - türosiinkinaas B-lümfotsüütides. Samuti on tuvastatud mitmeid defekte, mis ei ole seotud ensüümide sünteesi rikkumisega, näiteks X-seotud raske kombineeritud immuunpuudulikkuse korral - interleukiin-2 retseptori gammaahela süntees on häiritud, IgM hüperproduktsiooni sündroom - süntees rakumembraani glükoproteiin gp39 - CD40 B-lümfotsüütide retseptori ligand. Tüdrukutel, kellel on X-seotud immuunpuudulikkus, mis väljendub lümfotsüütide diferentseerumise halvenemises (X-seotud agammaglobulineemia, X-seotud raske kombineeritud immuunpuudulikkus, Wiskott-Aldrichi sündroom), tuvastatakse veres nii diferentseerunud kui ka diferentseerumata lümfotsüüte. See on tingitud asjaolust, et defektset geeni kandev X-kromosoom inaktiveeritakse ainult mõnes rakus. Diferentseerumata lümfotsüütide olemasolu nende immuunpuudulikkuse kliiniliste ilmingute puudumisel näitab defektse geeni kandmist. Restriktsioonifragmendi pikkuse polümorfismi analüüs võimaldab tuvastada ka defektse geeni kandjaid perekonnas. Laboratoorsed meetodid sünnieelne diagnostika põhineb nabaväädivererakkude ja lootevee ning koorioni villi uurimisel. Seega ei esine nabaväädiveres kõigi raske kombineeritud immuunpuudulikkuse vormide korral T-lümfotsüüte, Wiskott-Aldrichi sündroomi korral leitakse trombotsütopeenia ja mikrovillita T-lümfotsüüdid. Tabelis. 18.4 näitab pärilikkuse tüüpi ja võimalust kasutada mõningate primaarsete immuunpuudulikkuste diagnoosimiseks geneetilisi meetodeid.
v. Üldised põhimõtted immuunpuudulikkuse ravi. Immuunpuudulikkusega patsiendid vajavad erilist tähelepanu ja vajavad mitte ainult pidevat arstiabi, vaid ka psühholoogilist ja sotsiaalset tuge.
A. Dieet. Malabsorptsiooni sündroomi puudumisel pole dieeti vaja. Seedetrakti häirete esinemisel on vajalik toitumisspetsialisti konsultatsioon. Normaalse kasvu ja arengu tagamiseks peaks toit vastama valkude, vitamiinide ja mikroelementide vajadusele ning olema kõrge kalorsusega. Alatoitumine immuunpuudulikkuse korral võib viia immuunsuse veelgi suurema allasurumiseni.
B. Infektsioonide profülaktika on näidustatud kõigile immuunpuudulikkusega patsientidele, eriti raske kombineeritud immuunpuudulikkusega patsientidele.
1. Raske kombineeritud immuunpuudulikkusega imikute täielik isoleerimine ja steriilsetes kastides hoidmine välistab kokkupuute mikroobidega, kuid nõuab erivarustust ja suuri materjalikulusid. Mittetäielik isoleerimine on vähem efektiivne, kuna immuunpuudulikkuse raskeid infektsioone põhjustavad isegi mikroorganismid, mis ei ole tervetele inimestele patogeensed. Koduse nakatumisohu vähendamiseks on vajalik, et patsient magaks eraldi voodis, tal oleks oma tuba, välditakse kokkupuudet nakkushaigetega, eriti kui nakkuse põhjustajaks on herpes simplex viirused või tuulerõuged.
2. Asendusravi immunoglobuliinidega võimaldab paljudel humoraalse immuunsuse puudumisega patsientidel elada normaalset elu. Haige lapse vanematele selgitatakse, et ta ei vaja liigset hoolt, ei tohiks vältida käimist värskes õhus, saab mängida koos teiste lastega ning käia koolieelsetes lasteasutustes ja koolis.
B. Infektsioonide ravi
1. Kroonilist keskkõrvapõletikku ravitakse antimikroobsete ainetega. Vajadusel viiakse läbi kirurgiline ravi. Kuulmislanguse varaseks avastamiseks ja raviks tehakse regulaarselt kuulmiskontrolli.
2. Hingamisteede kroonilised infektsioonid. Vähemalt kord aastas (kui halveneb - sagedamini) kontrollige funktsiooni väline hingamine ja teha rindkere röntgen. Bronhoektaasi korral pööratakse erilist tähelepanu kehahoiaku drenaažile ja inhalatsioonidele, mida saab teha kodus (vt 7. peatüki lõiked V.A.6–7).
3. Sinusiit. Ägenemise korral on ette nähtud antimikroobsed ja vasokonstriktorid. Kui medikamentoosne ravi on ebaefektiivne, määratakse infektsiooni põhjustaja ja ninakõrvalurgete tühjendamine. Muud ninakõrvalkoobaste operatsioonid on haruldased, eriti väikelastel.
D. Psühhosotsiaalne tugi on eriti vajalik raske immuunpuudulikkusega patsientidele, kuna neil on tõsised psühholoogilised ja rahalised raskused. Kooliõpetajad peaksid olema teadlikud lapse haigusest ja hoolitsema temaga koos täiendavate tundide eest. Immuunpuudulikkuse fond ja Riiklik Haruldaste Haiguste Organisatsioon pakuvad õppekirjandust ja muud abi immuunpuudulikkusega inimestele.
D. Ettevaatusabinõud
1. Kui kahtlustatakse rakulise immuunsuse puudulikkust, tuleks vältida täisvereülekannet, sest doonori lümfotsüüdid võivad põhjustada transplantaat-peremehe vastu haigust. Kui vereülekanne on vajalik, kiiritatakse seda doosis 30 Gy. Lisaks kontrollitakse hoolikalt kõiki verekomponente tsütomegaloviiruse ning B-, C- ja D-hepatiidi viiruste esinemise suhtes.
2. Elusviiruse vaktsiinid, nagu poliomüeliidi elusvaktsiin, leetrite, mumpsi ja punetiste vaktsiin ning BCG, on immuunpuudulikkusega patsientidele vastunäidustatud. Varem, kui rõugevaktsiini laialdaselt kasutati, ei manustatud seda isegi patsiendi pereliikmetele. Praegu välditakse patsiendi pereliikmete vaktsineerimist poliomüeliidi elusvaktsiiniga, selle asemel kasutatakse inaktiveeritud poliomüeliidi vaktsiini (vt tabel 21.5). Inaktiveeritud vaktsiinid on üldiselt ohutud ja neid saab kasutada isegi diagnostilistel eesmärkidel. Vaktsiinid peavad olema hästi puhastatud. Halvasti puhastatud inaktiveeritud kõhutüüfuse vaktsiini kasutamisel Wiskott-Aldrichi sündroomiga patsientidel on kirjeldatud anafülaktilise šoki juhtumeid. Anafülaktiline šokk on antud juhul ilmselt tingitud endotoksiini segunemisest vaktsiinis ja seda blokeerivate antikehade puudusest.
3. Tonsillektoomia ja adenotoomia tehakse rangete näidustuste järgi. Splenektoomia tehakse Wiskott-Aldrichi sündroomiga äärmiselt harvadel juhtudel, kui verejooksu ei saa peatada. Muudel juhtudel on see vastunäidustatud, kuna see suurendab raske infektsiooni riski.
4. Kortikosteroide ja teisi immunosupressante kasutatakse harva.
E. Antimikroobsed ained
1. Infektsioonide ravi. Palaviku ja muude infektsiooni ilmingute korral alustatakse viivitamatult antimikroobset ravi, ootamata külvamise ja patogeeni tundlikkuse määramise tulemusi. Kui ravi on ebaefektiivne, määratakse külvamise ja patogeeni tundlikkuse määramise tulemuste põhjal teine ravim. Ravirežiimid on samad, mis normaalse immuunsusega patsientidel. Kui antimikroobsed ained on ebaefektiivsed, tuleb kahtlustada mükobakteriaalset, viiruslikku, algloomset või seeninfektsiooni.
2. Ennetav kasutamine antimikroobsed ained on tõhusad immuunpuudulikkuse korral, millega kaasnevad rasked infektsioonid, nagu Wiskott-Aldrichi sündroom. Pikaajaliseks antimikroobseks profülaktikaks on palju skeeme. Neist ühe kohaselt määratakse samaaegselt mitu antimikroobset ainet 1-2-kuuliste kursuste vahedega. See skeem tagab nakkuse mahasurumise ja takistab resistentsete mikroorganismitüvede teket. Lastele määratakse tavaliselt amoksitsilliin/klavulanaat, erütromütsiin ja TMP/SMX või mis tahes ravim tsefalosporiinide rühmast, täiskasvanutele - amoksitsilliin/klavulanaat, TMP/SMX ja mis tahes tetratsükliini või tsefalosporiini rühma ravim.
VI. Individuaalsete immuunpuudulikkuste ravi
A. Humoraalse immuunsuse puudulikkus
1. Raske humoraalse immuunsuse puudulikkuse peamine ravi on asendusravi normaalsete immunoglobuliinidega. Asendusravi eesmärk on toetada normaalne tase IgG. Tavalisi immunoglobuliine manustatakse annuses, mis on piisav sepsise vältimiseks ja KOK-i põhjustavate hingamisteede infektsioonide raviks. Need ravimid on näidustatud X-seotud agammaglobulineemia, tavalise muutuva hüpogammaglobulineemia, IgM hüperproduktsiooni sündroomi, raske kombineeritud immuunpuudulikkuse, Wiskott-Aldrichi sündroomi korral. Lastel esinev mööduv hüpogammaglobulineemia ei vaja enamikul juhtudel ravi tavaliste immunoglobuliinidega. Normaalsed immunoglobuliinid on vastunäidustatud isoleeritud IgA puudulikkuse korral (tingituna kõrge riskiga anafülaktiline šokk, mis on tingitud IgE tootmisest eksogeense IgA vastu).
1) Määrake normaalne immunoglobuliin intravenoosseks manustamiseks. Sellel on tavalise immunoglobuliini ees järgmised eelised: 1) immunoglobuliini intravenoosne manustamine on vähem valus kui intramuskulaarne süstimine; 2) in / in saate sisestada ravimi suurema annuse; 3) intravenoossel manustamisel saavutatakse kõrgem IgG tase seerumis. Intravenoosseks manustamiseks on palju normaalse immunoglobuliini preparaate (vt tabel 18.10). Enamik neist ravimitest on hästi talutavad ja tõhusad immuunpuudulikkuse korral. Algannus on tavaliselt 300-400 mg / kg / kuus. Minimaalne IgG tase seerumis pärast 4-nädalast ravi peaks lähenema normi alumisele piirile ja olema vähemalt 500 mg%. Mõned uuringud on näidanud, et tavalise intravenoosse immunoglobuliini suuremad annused (kuni 600 mg/kg/kuus) on efektiivsed krooniliste hingamisteede infektsioonide korral. Ravimi annus ja manustamissagedus valitakse individuaalselt, võttes arvesse ravi efektiivsust ja IgG minimaalset taset seerumis.
2) Normaalne immunoglobuliin. Säilitusannus on tavaliselt 100 mg/kg/kuus (0,6 ml/kg/kuus), küllastades 2-3 korda säilitusannusest. Säilitusannus manustatakse iga 3-4 nädala järel. Kui olete täiskasvanud, võite sisestada mitte rohkem kui 20 ml normaalset immunoglobuliini, kuu jooksul - rohkem kui 40 ml. Normaalse immunoglobuliini suure annuse sisseviimine on üsna valus, nii et vanemad lapsed ja täiskasvanud jagavad ühekordse annuse ja süstivad 5 ml erinevatesse piirkondadesse, korrates süste iga 1-2 nädala järel. Kõige parem on ravimit süstida tuharasse ja reie esiosasse. Nakkuse vältimiseks ja seerumi IgG taseme hoidmiseks üle 200 mg% on efektiivsem tavalise immunoglobuliini sagedane manustamine. Seerumi IgG taseme sagedane mõõtmine normaalse immunoglobuliini efektiivsuse hindamiseks on ebapraktiline, kuna erinevatel patsientidel suureneb IgG tase seerumis pärast ravimi manustamist ebaühtlaselt ja sõltub imendumise kiirusest, süstekoha proteolüüsist ja kudedes jaotumisest. . Kell äge infektsioon immunoglobuliinide metabolism suureneb, sellega seoses on sageli vaja manustada täiendav annus ravimit.
b. Kõrvalmõjud
1) Lokaalsed reaktsioonid on eriti väljendunud normaalse immunoglobuliini kasutamisel. Nende hulka kuuluvad süstekoha hellus, aseptiline abstsess, fibroos, vigastus istmikunärv(esineb harva). Hemorraagilise sündroomi korral on normaalne immunoglobuliin vastunäidustatud.
2) Süsteemsed reaktsioonid. Tavaliste immunoglobuliinide kasutamisel on võimalik palavik, külmavärinad, iiveldus, oksendamine ja seljavalu. Süsteemsete reaktsioonide oht sõltub ravimi manustamiskiirusest ja kaasuva infektsiooni olemasolust. Raskemad reaktsioonid nagu anafülaktiline šokk ja bronhospasm on haruldane. Need võivad olla tingitud intravaskulaarsest IgG agregatsioonist (eriti normaalse immunoglobuliini juhusliku intravaskulaarse manustamise korral) või normaalsetes immunoglobuliinides sisalduva IgA vastu suunatud IgE sünteesist. Anafülaktiliste reaktsioonide ravi on kirjeldatud peatükis. 11, lk V. Kui normaalsete immunoglobuliinide suhtes on esinenud raskeid anafülaktilisi reaktsioone, tuleb järgida järgmisi reegleid.
a) Vaata üle vastuvõtu näidustused ja põhjenda normaalsete immunoglobuliinidega ravi vajadust.
b) Vajadusel süstitakse esmalt erinevate ettevõtete ravimeid annuses 0,02 ml ja hinnatakse kohalikke ja süsteemseid reaktsioone. Mõned laborid määravad IgE ja IgG IgA-ks. Kui reaktsioon on tingitud nendest antikehadest, manustatakse ravimi testannus, mis sisaldab kõige vähem IgA lisandit. Tuleb meeles pidada, et sama ettevõtte ravimi erinevad partiid võivad IgA sisalduse poolest erineda. Kui testitav annus ei põhjusta lokaalset või süsteemset reaktsiooni, süstige kogu annus ettevaatlikult. Anafülaktiliste reaktsioonide suure riski tõttu manustatakse tavalisi immunoglobuliine sellistele patsientidele ainult haiglas.
c) Mõned autorid soovitavad manustada kortikosteroide või difenhüdramiini 1 tund enne normaalsete immunoglobuliinide manustamist. Kuid need meetmed ei hoia alati ära anafülaktilist reaktsiooni ja võivad lisaks varjata selle varajasi ilminguid.
d) riski ja tõsiduse vähendamiseks kõrvalmõjud Tavalist immunoglobuliini süstitakse mõnikord intramuskulaarselt kiirusega 2-3 ml/h ja normaalset intravenoosseks manustamiseks mõeldud immunoglobuliini manustatakse nahaaluselt 24 tunni jooksul Manustamiseks kasutatakse 23 G liblikanõela ja infusioonipumpa.
e) Kui süsteemseid reaktsioone ei ole võimalik vältida, viiakse tavaliste immunoglobuliinide asemel üle lähisugulase, tavaliselt isa plasma.
2. Spetsiifilised immunoglobuliinid saadakse tervete inimeste verest, kes on immuunsed mis tahes nakkuse suhtes. Spetsiifilise immunoglobuliini, mis sisaldab antikehi mis tahes patogeeni vastu, kasutuselevõtt võib ennetada selle põhjustatud infektsiooni või vähendada selle raskust (vt ptk 21, lk XV.B).
3. Värskelt külmutatud plasma. Kui anamneesis on esinenud raskeid süsteemseid reaktsioone normaalsetele immunoglobuliinidele, süstitakse humoraalse immuunsuse puudulikkusega patsientidele mõnikord värsket külmutatud plasmat.
a. Värskelt külmutatud plasmal on tavaliste immunoglobuliinide ees järgmised eelised.
1) See sisaldab kõigi klasside immunoglobuliine, mitte ainult IgG-d.
2) Pärast doonori immuniseerimist on võimalik saada spetsiifilise patogeeni vastaste antikehade kõrge sisaldusega plasma.
b. Värskelt külmutatud plasma peamiseks puuduseks on nakkuse edasikandumise ja transfusioonireaktsioonide oht. Nakatumise ohtu saab minimeerida, piirates plasmadoonorite arvu ja sobitades need patsiendi pereliikmete hulka. Doonor peab olema välistatud HIV-nakkusest, B- ja C-hepatiidist. Infektsiooni edasikandumise ohu, aga ka normaalsete immunoglobuliinide olemasolu tõttu tehakse värskelt külmutatud plasma transfusiooni immuunpuudulikkuse korral praegu harva.
sisse. Annused. Värskelt külmutatud plasmat manustatakse annuses 15-20 ml / kg IV iga 3-4 nädala järel, sõltuvalt patsiendi seisundist. Küllastav annus ületab säilitusannust 2-3 korda. Mahu ülekoormuse vältimiseks manustatakse küllastusannus mitme annusena mitme päeva jooksul. Igakuine säilitusannus manustatakse mitme tunni jooksul. Rakulise immuunsuse puudulikkuse korral kiiritatakse siirik-peremees-haiguse vältimiseks värskelt külmutatud plasmat doosiga 30 Gy.
B. Rakulise immuunsuse puudulikkus. Kuna rakulise immuunsuse puudulikkus, eriti raske kombineeritud immuunpuudulikkuse korral, võib olla tingitud erinevad mehhanismid, ei ole selle immuunpuudulikkuse rühma jaoks ühtset raviskeemi. Ebapiisava rakulise immuunsusega patsiente ravitakse reeglina spetsialiseeritud keskustes.
1. Luuüdi siirdamine. Luuüdi sisaldab nii pluripotentseid tüvirakke (erütrotsüütide, lümfotsüütide, granulotsüütide, makrofaagide, megakarüotsüütide eelkäijad) kui ka küpseid T- ja B-lümfotsüüte. Luuüdi siirdamist kasutatakse edukalt raske kombineeritud immuunpuudulikkuse, Wiskott-Aldrichi sündroomi ja teiste rakulise immuunpuudulikkusega immuunpuudulikkuse, samuti aplastilise aneemia, ägeda müeloidleukeemia ja lümfotsüütilise leukeemia, kroonilise granulomatoosse haiguse ja kaasasündinud neutropeenia korral. Need patsiendid vajavad intensiivset ravi nii enne kui ka pärast luuüdi siirdamist. Luuüdi siirdamine toimub ainult spetsialiseeritud keskustes.
a. HLA-ga sobitatud kogu luuüdi siirdamine. Siirdamise tehnika on järgmine. Under üldanesteesia teostada väikeste koguste luuüdi mitmekordne aspiratsioon doonori niudeluuharjast. Siirdamiseks vajalik luuüdi maht määratakse kiirusega 10 ml/kg retsipiendi kehakaalu kohta, lümfotsüütide ja monotsüütide arv - kiirusega 300-500 miljonit rakku 1 kg retsipiendi kehakaalu kohta. Luuüdi kogutakse hepariinimahutisse ja filtreeritakse läbi peene traatvõrgu, et eemaldada väikesed luufragmendid. Filtreeritud luuüdi süstitakse retsipiendile intravenoosselt. Edukaks luuüdi siirdamiseks ja transplantaat-peremeeshaiguse ennetamiseks on vajalik HLA antigeenide põhjal doonori hoolikas tüpiseerimine ja valimine. Luuüdi doonoreid võrreldakse tavaliselt retsipiendi õdede-vendade vahel ja vastendatakse retsipiendiga, kasutades HLA antigeenide geneetilise tüpiseerimise meetodeid. Hiljuti on tehtud katseid siirdamiseks kasutada luuüdi, mis on võetud mitterelatiivsest ja tüpiseeritud HLA jaoks seroloogiliste meetoditega. Kuid sellise siirdamise korral on siiriku-peremehe vastu haiguse risk üsna suur (vt 17. peatükk).
b. HLA-ga sobitatud T-lümfotsüütide vaesestatud luuüdi siirdamist on raske rakulise immuunsuse puudulikkuse raviks kasutatud alates 1981. aastast. Luuüdi doonoriteks on sel juhul tavaliselt retsipiendi vanemad. Selliseks siirdamiseks on vaja suurt hulka (tavaliselt 1 liiter) doonori luuüdi. Küpsete T-lümfotsüütide eemaldamiseks luuüdist kasutatakse järgmisi meetodeid: 1) aglutineerimine sojalektiiniga; 2) roseti moodustumine oina erütrotsüütidega; 3) antikehade ja komplemendi poolt vahendatud T-lümfotsüütide hävitamine. Pärast küpsete T-lümfotsüütide eemaldamist jäävad tüvirakud ja küpsed B-lümfotsüüdid luuüdi. Raske kombineeritud immuunpuudulikkuse korral taastab T-lümfotsüütide vaba luuüdi siirdamine rakulise immuunsuse, kuid antikehade tootmine jääb häiritud. Selline siirdamine ei ole efektiivne kõigil patsientidel, kellel on ebapiisav rakuline immuunsus. Seega ei too adenosiindeaminaasi ja puriinnukleosiidfosforülaasi puudulikkusega kaasa rakulise immuunsuse taastumist. T-lümfotsüütidest puhastatud luuüdi siirdamine suurendab Burkitti lümfoomi riski.
2. Asendusravi. Asendusravi eesmärk rakulise immuunsuse puudulikkuse korral on puudulikkuse kompenseerimine bioloogiliselt. toimeaineid vajalik T-lümfotsüütide normaalseks funktsioneerimiseks, tutvustamata patsiendile nende ainete allikat – elujõulisi doonorrakke.
a. Asendusravi ensüümidega. Nagu eespool märgitud, on autosoom-retsessiivne raske kombineeritud immuunpuudulikkus tingitud adenosiindeaminaasi puudulikkusest. Selle ensüümi allikana võib kasutada kiiritatud erütrotsüütide massi. Kuigi see ei too kaasa subjektiivset paranemist, suurendab see erütrotsüütide arvu veres ja immunoglobuliinide taset ning stimuleerib ka lümfotsüütide proliferatiivset vastust mitogeenidele ja allogeensetele rakkudele. Hiljuti on adenosiindeaminaasi asendusraviks kasutatud veise polüetüleenglükooliga konjugeeritud ensüümi. Võrreldes erütrotsüütide massiga suurendab see ravim märkimisväärselt plasma adenosiindeaminaasi aktiivsust. Veise adenosiindeaminaasi kasutuselevõtt ei normaliseeri immunoloogilisi parameetreid, vaid toob kaasa subjektiivse paranemise. Adenosiini deaminaasi asendusravi puuduseks on see, et see põhjustab ainult ajutist paranemist.
b. Geenitehnoloogia. USA riiklikus terviseinstituudis rakendati eksperimentaalset meetodit autosoom-retsessiivse raske kombineeritud immuunpuudulikkuse raviks. Meetodi olemus seisneb adenosiindeaminaasi kodeeriva geeni ülekandmises patsientide T-lümfotsüütide genoomi. Selle ravimeetodi efektiivsust ei ole piisavalt uuritud. Praegu üritatakse adenosiindeaminaasi geeni viia tüviraku genoomi. Võib-olla võimaldab geenitehnoloogia tulevikus edukalt ravida erinevaid esmaseid immuunpuudulikkusi.
sisse. Ülekandefaktor on väikese molekulmassiga (molekulmass mitte üle 10 000) bioloogiliselt aktiivsete ainete segu, mis on eraldatud hävitatud leukotsüütidest. Immuunpuudulikkuse korral kasutatav ülekandefaktor saadakse tervete doonorite leukotsüütidest, kes on immuniseeritud tavaliste antigeenidega, näiteks mükobakterite ja seente antigeenidega. Siirdefaktori toimemehhanisme ei ole uuritud, kuid on teada, et see põhjustab nii spetsiifilist kui ka mittespetsiifilist rakulise immuunsuse aktivatsiooni. Usaldusväärsed andmed ülekandeteguri efektiivsuse kohta puuduvad, kontrollitud uuringuid pole läbi viidud. Siiski on tõestatud, et see parandab naha ja limaskestade kroonilise kandidoosiga patsientide seisundit. Raske kombineeritud immuunpuudulikkuse korral on ülekandefaktor ebaefektiivne. Ülekandefaktoriga ravi ajal on registreeritud mitmeid hemoblastoosi juhtumeid. Kuigi selget seost nende arengu ja ravi vahel ei ole kindlaks tehtud, tuleb ülekandefaktorit määrata äärmise ettevaatusega.
d) Harknääre hormoonid. Harknääre peptiidhormoonidel (tümosiin, tümopoetiin ja teised) põhinevad mitmed ravimid. Tümosiin on 28 aminohappest koosnev peptiid, mis on ekstraheeritud veise harknäärest. Ilmselt ei mõjuta tümosiin kõiki T-lümfotsüütide eellasi. Enamiku raske kombineeritud immuunpuudulikkusega patsientide puhul on tümosiin ebaefektiivne. Leebemate immuunpuudulikkuse korral koos rakulise immuunsuse puudulikkusega, eriti Wiskott-Aldrichi sündroomi, alümfotsütoosi ja DiGeorge'i sündroomiga, olid esimesed tümosiiniravi tulemused aga julgustavad. DiGeorge'i sündroomi ja alümfotsütoosi korral täheldati mõningast paranemist tümopentiini, tümopoetiini fragmendiga sarnase sünteetilise pentapeptiidi (32. kuni 36. aminohappejäägi) kasutuselevõtuga. Timopentiinil ei ole tõsiseid kõrvaltoimeid, kuid ligikaudu 30% patsientidest täheldatakse selle manustamisel lokaalseid reaktsioone.
e) Tsütokiinid on suur hulk vahendajaid, mida toodavad erinevad rakud ja mis osalevad immuunsüsteemi funktsioonide reguleerimises (vt 1. peatüki punkt IV.B ja tabel 1.3). Raske kombineeritud immuunpuudulikkuse korral koos interleukiin-2 sünteesi häirega kasutatakse rekombinantset interleukiin-2. Mõnel juhul on ravi tõhus. IgE hüperproduktsiooni ja difuusse neurodermatiidi sündroomi korral kasutatakse gamma-interferooni. See pärsib interleukiinide-4 ja -5 sünteesi T-abistajate poolt. Interferoon alfa on efektiivne Burkitti lümfoomi korral. Filgrastiimi, molgramostiimi ja interleukiin-3 kasutatakse neutrofiilide ja monotsüütide küpsemise stimuleerimiseks luuüdis pärast immunosupressiivset ravi.
e. Mikroelemendid. Kaasasündinud tsingi malabsorptsioon seedetraktis põhjustab tõsist humoraalse ja rakulise immuunsuse puudulikkust koos enteropaatilise akrodermatiidiga. Haigus avaldub naha ja seedetrakti tõsiste kahjustustena ning sellega kaasnevad malabsorptsiooni sündroom, kõhulahtisus ja vaimsed häired, ilma ravita viib surma. Tsingi preparaadid kõrvaldavad kõik selle haiguse ilmingud.
3. Eksperimentaalsed ravimeetodid
a. Harknääre epiteelirakkude kultuur. Üks eksperimentaalseid ravimeetodeid on harknääre epiteelirakkude siirdamine (R. Hong, 1986). Harknääre kude saadakse normaalse immuunsusega lastelt (vanemate kirjalikul nõusolekul) kaasasündinud südamerikete kirurgilise ravi käigus. Harknääre epiteelirakkude siirdamine on efektiivne immuunpuudulikkuse korral, mis on põhjustatud tüümuse lümfotsüütide küpsemise halvenemisest. Rikkudes lümfotsüütide küpsemist luuüdis, on see ebaefektiivne.
b. Loote harknääre siirdamine. Selle ravimeetodi parimad tulemused saavutatakse DiGeorge'i sündroomiga patsientidel. Transplantaadi vastu peremeeshaiguse riski vähendamiseks võetakse harknääre kude lootelt, kelle rasedusaeg on alla 14 nädala. Harknääre siirdamiseks on mitu võimalust: 1) harknääre koe siirdamine eesmise kõhuseina lihasesse; 2) harknäärerakkude suspensiooni intraperitoneaalne või intraperitoneaalne manustamine; 3) väikeste tüümuse fragmentide intraperitoneaalne süstimine.
sisse. Raske kombineeritud immuunpuudulikkuse korral kasutatakse loote maksa siirdamist. Seda ravi seostatakse raske siiriku-peremehe vastu haiguse suure riskiga, eriti maksa siirdamisel lootele, kelle rasedusaeg on üle 12 nädala. Loomkatsed ja kliinilised uuringud on näidanud immuunsuse taastumist maksarakkude intraperitoneaalse manustamisega. Doonori T-lümfotsüütide siirdamist maksa ja loote harknääre siirdamise ajal täheldatakse ligikaudu 25% raske kombineeritud immuunpuudulikkusega patsientidest. Nende elundite siirdamist aga tänapäeval peaaegu ei kasutata. Enamikul juhtudel tehakse rakulise immuunsuse puudulikkuse korral luuüdi siirdamine lähisugulaselt, kes ühildub HLA antigeenide suhtes retsipiendiga.
B. Fagotsüütide puudulikkus. Praegu puuduvad usaldusväärsed asendusravi meetodid fagotsüütide puudulikkuse, näiteks kroonilise granulomatoosse haiguse, müeloperoksüdaasi puudulikkuse, Chediak-Higashi sündroomi korral. Hiljuti on näidatud, et gamma-interferoon on kroonilise granulomatoosse haiguse korral efektiivne. Selle haiguse, aga ka kaasasündinud neutropeenia korral kasutatakse tavaliselt luuüdi siirdamist. Eeldatakse, et erinevate ensüümide puudulikkuse tõttu on kroonilise granulomatoosse haiguse mitu vormi. Nende defektide tuvastamine võimaldab tulevikus välja töötada asendusravi. Praegu ravitakse fagotsüütide puudulikkust gamma-interferooni, antimikroobsete ainete, askorbiinhappe ja leukotsüütide massiülekandega.
1. Kroonilise granulomatoosse haiguse korral soovitatakse gamma-interferooni. Selle haiguse X-seotud vormis (tsütokroom b 558 puudulikkuse tõttu) suurendab see ravim tsütokroom b 558 aktiivsust neutrofiilides, millega kaasneb bakterite rakusisese hävitamise aktiveerimine ja vähendab infektsioonide riski. Gamma-interferoon on näidustatud ka kroonilise granulomatoosse haiguse autosomaalsete retsessiivsete vormide korral.
2. Antimikroobne ravi
a. Infektsioonide korral määratakse antimikroobsed ained võimalikult varakult ja võimalusel manustatakse neid intravenoosselt, kuna fagotsüütide puudulikkus on seotud suure fulminantse sepsise riskiga. Seejärel määratakse antimikroobsed ained, võttes arvesse patogeeni tundlikkust.
b. Infektsioonide vältimiseks on ette nähtud sulfoonamiidid või muud antimikroobsed ained, mis on aktiivsed stafülokokkide vastu. Pikaajalised antimikroobse profülaktika kursused on efektiivsed enamikul fagotsüütide puudulikkusega patsientidel.
3. Raske infektsiooni korral on leukotsüütide ülekanne kombinatsioonis antimikroobse raviga efektiivne.
4. Askorbiinhape, 500 mg / päevas suukaudselt, on ette nähtud patsientidele, kellel on Chediak-Higashi sündroom (albinism, neutropeenia, hiiglaslikud graanulid ja fagotsüütide bakteritsiidse aktiivsuse kahjustus, korduvad mädased infektsioonid). Askorbiinhape suurendab fagotsüütide funktsionaalset aktiivsust ja vähendab nakkusohtu.
D. Komplemendi puudus
1. Värskelt külmutatud plasmat kasutatakse nende eraldatud defitsiidi korral komplemendi komponentide allikana. Selle ülekandmine patsientidele, kellel on C5, C3 ja C3b inhibiitori puudulikkus, parandab nende seisundit ja normaliseerib laboratoorseid näitajaid. See on efektiivne ka päriliku Quincke ödeemi korral (vt 10. peatüki jaotist VIII.A). C1-esteraasi inhibiitori kontsentraat on praegu selle haiguse raviks kliinilistes uuringutes.