प्रत्येक व्यक्ति के पास एक प्रतिरक्षा प्रणाली होती है जिसे शरीर को विदेशी पदार्थों से पहचानने और उनकी रक्षा करने के लिए डिज़ाइन किया गया है। प्रतिरक्षा का अंतिम लक्ष्य सूक्ष्मजीवों, असामान्य कोशिकाओं को नष्ट करना है जो मानव स्वास्थ्य पर नकारात्मक प्रभाव डालते हैं। उत्पत्ति के आधार पर, प्राथमिक और माध्यमिक इम्युनोडेफिशिएंसी को प्रतिष्ठित किया जाता है। इम्युनोडेफिशिएंसी के साथ, सभी संक्रमण और रोग अधिक कठिन होते हैं, अधिक बार वे बदल जाते हैं जीर्ण रूपऔर जटिलताएं हैं।
प्राथमिक प्रतिरक्षा की कमी क्या है?
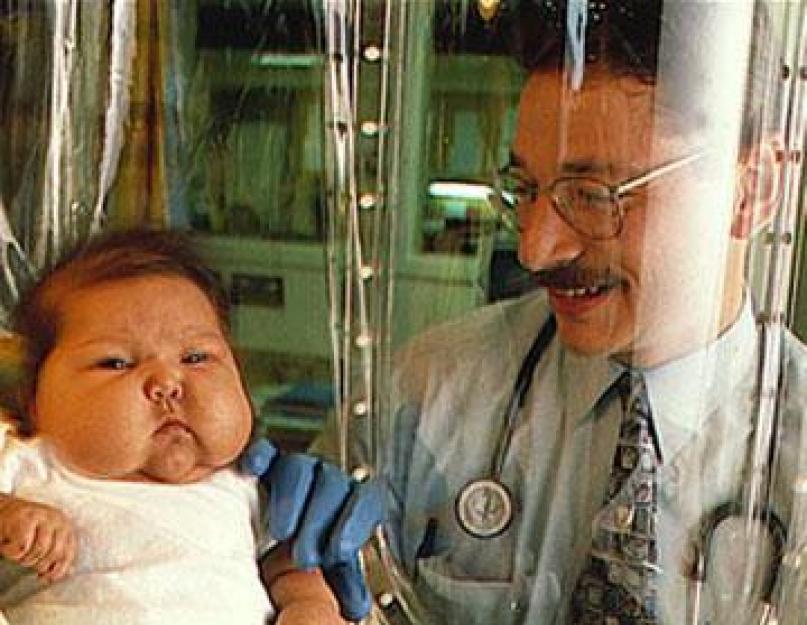
प्राथमिक इम्युनोडेफिशिएंसी एक वंशानुगत या भ्रूण के विकास की स्थिति के दौरान अधिग्रहित होती है जिसमें काम में समस्याएं होती हैं प्रतिरक्षा तंत्र. दूसरे शब्दों में, एक बच्चा किसी भी संक्रमण और वायरस से अपनी रक्षा करने की क्षमता के बिना पैदा होता है। बच्चों में प्राथमिक इम्युनोडेफिशिएंसी का निदान कम उम्र में किया जाता है। गंभीर रूप वाले रोगी आमतौर पर मर जाते हैं। रोग के कुछ रूपों में, पहले लक्षणों का पहले से ही वयस्कता में पता लगाया जा सकता है। यह तब होता है जब रोगी को बीमारी के एक निश्चित रूप के लिए अच्छा मुआवजा मिलता है। नैदानिक तस्वीर बार-बार और पुरानी संक्रामक प्रक्रियाओं द्वारा व्यक्त की जाती है। अक्सर ब्रोन्कोपल्मोनरी सिस्टम, ईएनटी अंगों, त्वचा और श्लेष्मा झिल्ली को प्रभावित करता है। प्राथमिक इम्युनोडेफिशिएंसी से प्यूरुलेंट लिम्फैडेनाइटिस, फोड़ा, ऑस्टियोमाइलाइटिस, मेनिन्जाइटिस और सेप्सिस का विकास हो सकता है।
कुछ रूप एलर्जी से प्रकट होते हैं, ऑटोइम्यून रोग, विकास को भड़का सकते हैं घातक ट्यूमर. इम्यूनोलॉजी प्राथमिक इम्युनोडेफिशिएंसी को पहचानने में मदद करेगी - एक विज्ञान जो किसी भी हानिकारक पदार्थों से शरीर की आत्मरक्षा के तंत्र का अध्ययन करता है।
जन्मजात इम्युनोडेफिशिएंसी का निदान करना मुश्किल है। निम्नलिखित कारणों से शीघ्र निदान आवश्यक है:
- समय पर निदान और सही ढंग से निर्धारित चिकित्सा कई वर्षों तक रोगियों में जीवन की उच्च गुणवत्ता बनाए रखने में योगदान करती है;
- प्राथमिक प्रतिरक्षा की कमी का निदान और दोषपूर्ण जीन की पहचान से परिवार के सदस्यों को एक सुलभ रूप में चिकित्सा आनुवंशिक निष्कर्ष के परिणामों की व्याख्या करना और प्रसव पूर्व निदान करना संभव हो जाता है।

प्राथमिक इम्युनोडेफिशिएंसी: वर्गीकरण
इम्युनोडेफिशिएंसी एक या एक से अधिक प्रतिरक्षा प्रतिक्रिया तंत्र में दोष के कारण प्रतिरक्षा प्रणाली में लगातार परिवर्तन को संदर्भित करता है। इसके चार प्रकार हैं:
- आयु से संबंधित, बचपन में या बुढ़ापे में उत्पन्न होना।
- अधिग्रहीत।
- संक्रामक, एक वायरस द्वारा उकसाया।
- जन्मजात (प्राथमिक इम्युनोडेफिशिएंसी)।
प्राथमिक प्रतिरक्षा की कमी का वर्गीकरण इस प्रकार है:
- कई प्रकार की कोशिकाओं को नुकसान से जुड़ी प्रतिरक्षा की कमी:
जालीदार रोगजनन - स्टेम कोशिकाओं की पूर्ण अनुपस्थिति की विशेषता। रोग का यह रूप जीवन के साथ असंगत है।
टी-लिम्फोसाइटों और बी-लिम्फोसाइटों दोनों में दोषों के कारण गंभीर संयुक्त प्रतिरक्षाविहीनता। - मुख्य रूप से टी-सेल क्षति के कारण प्रतिरक्षा की कमी: डि जॉर्ज सिंड्रोम, जो थाइमस की अनुपस्थिति या अविकसितता की विशेषता है ( थाइमस) तथा पैराथाइराइड ग्रंथियाँ, जन्मजात हृदय दोष, चेहरे की संरचना में विकृति। रोग कंकाल, गुर्दे के विकास में असामान्यताओं के साथ हो सकता है, तंत्रिका प्रणाली.
- प्रतिरक्षा की कमी, बी-कोशिकाओं के प्रमुख घाव के साथ।
- मायलोइड कोशिकाओं की हार प्राथमिक इम्युनोडेफिशिएंसी को भड़काती है। प्रतिक्रियाशील ऑक्सीजन प्रजातियों के उत्पादन में क्रोनिक ग्रैनुलोमेटस रोग का एक स्पष्ट दोष है। नतीजतन, बैक्टीरिया या कवक द्वारा उकसाए गए पुराने संक्रमण होते हैं।
- पूरक प्रणाली में दोषों से जुड़ी इम्यूनोडिफ़िशिएंसी। इन दोषों के कारण कमी या पूर्ण अनुपस्थितिविभिन्न पूरक घटक।
कोशिकीय, कोशिकीय-हास्य और प्राथमिक हास्य प्रतिरक्षण क्षमताएं भी हैं। लिम्फोसाइट्स, मैक्रोफेज और प्लाज्मा कोशिकाओं की कमी से जुड़े दोषों को प्रतिरक्षा की कमी के सेलुलर रूप के लिए जिम्मेदार ठहराया जा सकता है। विनोदी रूप एंटीबॉडी की कमी के कारण होता है।
सेकेंडरी इम्युनोडेफिशिएंसी क्या है?
इस प्रकार की इम्युनोडेफिशिएंसी वंशानुगत बीमारी नहीं है। यह जीवन भर अर्जित किया जाता है। जैविक, रासायनिक और पर्यावरणीय कारकों के प्रभाव से इसका विकास हो सकता है। माध्यमिक इम्युनोडेफिशिएंसी से सुरक्षित नहीं और एक अस्वास्थ्यकर जीवन शैली का नेतृत्व करने वाले, कुपोषित, लगातार तनाव की स्थिति में। सबसे अधिक प्रभावित वयस्क हैं।
माध्यमिक इम्युनोडेफिशिएंसी का वर्गीकरण
के बीच माध्यमिक राज्यप्रतिरक्षा की कमी के तीन रूप हैं:
- अधिग्रहित, जिसका एक उदाहरण एड्स है, जो मानव इम्युनोडेफिशिएंसी वायरस द्वारा प्रतिरक्षा प्रणाली की हार से उकसाया जाता है;
- प्रेरित, एक्स-रे के रूप में विशिष्ट उत्तेजनाओं के संपर्क के परिणामस्वरूप, कॉर्टिकोस्टेरॉइड्स का उपयोग, आघात और सर्जिकल हस्तक्षेप;
- सहज, एक स्पष्ट कारण की अनुपस्थिति की विशेषता है जिसके कारण प्रतिरक्षा की कमी की शुरुआत हुई।
माध्यमिक इम्युनोडेफिशिएंसी को भी प्रतिवर्ती और अपरिवर्तनीय में विभाजित किया गया है। प्रतिवर्ती प्रतिरक्षा की कमी का एक प्रकार भुखमरी और महत्वपूर्ण घटकों की संबंधित कमी हो सकती है। एचआईवी संक्रमण इम्युनोडेफिशिएंसी के अपरिवर्तनीय रूप का एक उदाहरण है।
इम्युनोडेफिशिएंसी के लक्षण
रोग का मुख्य लक्षण व्यक्ति में बार-बार होने वाली बीमारियों की प्रवृत्ति है। संक्रामक प्रकृति. प्राथमिक इम्युनोडेफिशिएंसी की विशेषता आवर्ती श्वसन संक्रमण है। यहां स्पष्ट रूप से इम्युनोडेफिशिएंसी वाले लोगों और कमजोर प्रतिरक्षा वाले लोगों के बीच अंतर करना आवश्यक है।

इस बीमारी का एक अधिक विशिष्ट लक्षण बार-बार होने वाले बैक्टीरियल संक्रमणों की घटना है। यह बार-बार गले में खराश, नाक में खुजली में प्रकट होता है, जो क्रोनिक साइनसिसिस, ब्रोंकाइटिस और ओटिटिस मीडिया के विकास की ओर जाता है। उपचार की प्रक्रिया में शरीर रोग के प्रेरक एजेंट से पूरी तरह से छुटकारा पाने में सक्षम नहीं है, और इसलिए रिलेपेस होते हैं। बच्चों में प्राथमिक इम्युनोडेफिशिएंसी से ऑटोइम्यून रोग हो सकते हैं जैसे ऑटोइम्यून एंडोक्रिनोपैथी, हेमोलिटिक एनीमिया, रूमेटाइड गठिया. इस राज्य में बच्चे एक साथ कई संक्रामक एजेंटों के लिए अतिसंवेदनशील होते हैं। इस स्थिति के लिए विशिष्ट पाचन तंत्र का विकार भी है। वयस्कों में प्राथमिक इम्युनोडेफिशिएंसी शरीर पर बड़ी संख्या में मौसा और पेपिलोमा की उपस्थिति से प्रकट हो सकती है।
प्राथमिक प्रतिरक्षा की कमी का निदान

रोग का निदान इतिहास के संग्रह के साथ शुरू होता है। डॉक्टर को पारिवारिक इतिहास लेना चाहिए, खासकर अगर प्राथमिक रूप वाले बच्चे का निदान किया जा रहा है। रोगी की जांच की जानी चाहिए, म्यूकोसा और त्वचा की स्थिति, यकृत और प्लीहा के आकार का आकलन किया जाना चाहिए। इस तरह के निदान को आंखों की सूजन, नाक की सूजन, पुरानी लंबी खांसी के रूप में अभिव्यक्तियों की विशेषता है।
एक सटीक निदान करने के लिए, एक विस्तृत रक्त परीक्षण किया जाना चाहिए, जो शरीर में विभिन्न कोशिकाओं की संख्या, इम्युनोग्लोबुलिन के स्तर को दिखाएगा। अनिवार्य एक विश्लेषण है जो रक्त में प्रोटीन की सामग्री दिखाएगा, जो विभिन्न संक्रमणों का विरोध करने के लिए शरीर की क्षमता को इंगित करता है।
प्रसव पूर्व निदान
यह स्थापित किया गया है कि प्राथमिक इम्युनोडेफिशिएंसी एक वंशानुगत बीमारी है और उतनी दुर्लभ नहीं है जितनी कि यह सोचा गया था। आज तक, एक उत्परिवर्तित जीन और परामर्शदाता परिवारों की पहचान करना संभव हो गया है, जो बीमारी के विकास के जोखिम वाले बच्चे को जन्म देने की योजना बना रहे हैं। यदि परिवार में पहले से ही इस स्थिति वाला बच्चा है, तो उत्परिवर्तन विश्लेषण किया जाता है, जिसके बाद नैदानिक अध्ययनभ्रूण. इसके लिए, भ्रूण कोशिकाओं वाले एमनियोटिक द्रव का आणविक विश्लेषण किया जाता है।
इम्युनोडेफिशिएंसी के बाद जटिलताएं
प्राथमिक और माध्यमिक इम्युनोडेफिशिएंसी गंभीर रूप में जटिलताएं पैदा कर सकती हैं संक्रामक रोगजैसे सेप्सिस, निमोनिया और फोड़े। इम्युनोडेफिशिएंसी के कारण होने वाली बीमारियों की व्यापक विविधता को देखते हुए, संभावित जटिलताएंव्यक्तिगत रूप से निर्धारित किया जाना चाहिए।
एक इम्युनोडेफिशिएंसी राज्य का उपचार

प्राथमिक इम्युनोडेफिशिएंसी, जिसका उपचार एक जटिल और लंबी प्रक्रिया है, के लिए प्रबंधन की आवश्यकता होती है स्वस्थ जीवन शैलीजीवन और किसी भी संक्रमण से बचें। जटिल उपचार निर्धारित करने से पहले, प्रतिरक्षा रक्षा प्रणाली में टूटी हुई कड़ी का निर्धारण करके एक सटीक निदान स्थापित किया जाना चाहिए। यदि इम्युनोग्लोबुलिन की कमी का पता चला है, तो सीरा युक्त एंटीबॉडी के साथ प्रतिस्थापन चिकित्सा जीवन भर की जाती है। संक्रामक रोगों में परिणामी जटिलताओं का इलाज एंटीबायोटिक दवाओं, एंटीवायरल और एंटिफंगल दवाओं के साथ किया जाता है। कुछ मामलों में, प्राथमिक इम्युनोडेफिशिएंसी का इलाज इम्युनोग्लोबुलिन के साथ किया जाता है जो चमड़े के नीचे या अंतःशिरा में दिया जाता है।
अस्थि मज्जा प्रत्यारोपण और इम्युनोमोड्यूलेटर के उपयोग के लिए धन्यवाद भी प्रतिरक्षण किया जाता है।
इस रोग से ग्रस्त बच्चों को जीवित टीकों का टीका नहीं लगवाना चाहिए। एक बच्चे के साथ रहने वाले वयस्कों को केवल निष्क्रिय पोलियो वैक्सीन का टीका लगाया जाता है।
माध्यमिक इम्युनोडेफिशिएंसी में प्रतिरक्षा प्रणाली के कामकाज में कम स्पष्ट गड़बड़ी होती है।
यह रोग हेमटोपोइएटिक प्रणाली में विकारों से उकसाया जाता है, जो या तो जन्मजात या अधिग्रहित हो सकता है। अस्थि मज्जा बस रक्त कोशिकाओं का उत्पादन बंद कर देता है। एरिथ्रोसाइट्स, प्लेटलेट्स और ल्यूकोसाइट्स में कमी है।
घटना को व्यक्तिगत असहिष्णुता से शुरू किया जा सकता है, विशेष रूप से कुछ दवाओं के लिए। इस संवेदनशीलता का कारण हमेशा स्पष्ट नहीं होता है, लेकिन यह हेमटोपोइएटिक कोशिकाओं में आनुवंशिक दोष के कारण हो सकता है।
अन्य कारण भी हो सकते हैं:

अप्लास्टिक एनीमिया के लक्षण
इस स्थिति के लक्षणों में शामिल हैं:
- लगातार थकान और कमजोरी;
- अनियमित हृदय ताल;
- पीली त्वचा;
- नाक से लगातार खून बह रहा है;
- कटौती के बाद लंबे समय तक खून बह रहा है;
- मसूड़ों से खून बहना;
- लगातार संक्रामक रोग;
- चक्कर आना और माइग्रेन।
अप्लास्टिक एनीमिया का उपचार
रोग के हल्के मामलों में केवल रोगी की निरंतर निगरानी की आवश्यकता होती है। अधिक जटिल परिस्थितियों में, रक्त आधान, अस्थि मज्जा प्रत्यारोपण, और विशेष दवाएं जो हेमटोपोइएटिक कोशिकाओं को उत्तेजित करती हैं, का उपयोग किया जाता है। अक्सर, उपचार के दौरान इम्यूनोसप्रेसिव दवाओं का उपयोग किया जाता है, जो शरीर की प्रतिरक्षा प्रतिक्रिया को कमजोर करने में मदद करते हैं, जिससे प्रतिरक्षा प्रणाली की कोशिकाएं हड्डी के ऊतकों पर प्रतिक्रिया नहीं कर पाती हैं। पर पिछले साल कातेजी से, डॉक्टरों का झुकाव तेजी से अस्थि मज्जा प्रत्यारोपण के लिए होता है, जो कई जटिलताओं से बचा जाता है।
प्राथमिक प्रतिरक्षा की कमी की रोकथाम
प्राथमिक इम्युनोडेफिशिएंसी सिंड्रोम एक वंशानुगत बीमारी है, और तदनुसार, इसके लिए कोई निवारक उपाय नहीं हैं। एक इम्युनोडेफिशिएंसी राज्य की अभिव्यक्तियों से बचने के लिए, एक सकारात्मक इतिहास वाले परिवार में एक दोषपूर्ण जीन के संभावित वाहक की पहचान की जानी चाहिए। गंभीर संयुक्त इम्युनोडेफिशिएंसी जैसी विकृति के लिए, अंतर्गर्भाशयी निदान संभव है।

माध्यमिक इम्युनोडेफिशिएंसी की घटना के लिए एक निवारक उपाय के रूप में, एक सही जीवन शैली का नेतृत्व करना चाहिए, मध्यम होना चाहिए शारीरिक व्यायामताकि शरीर में एचआईवी संक्रमण न हो। और इसके लिए असुरक्षित यौन संबंधों से बचना चाहिए और यह सुनिश्चित करना चाहिए कि बाँझ चिकित्सा उपकरणों का उपयोग किया जाता है। प्रतिरक्षा की कमी से उत्पन्न रोग किसी भी अभिव्यक्ति में जटिल और कपटी होते हैं। आपके स्वास्थ्य के प्रति सावधान रवैया, एक एकीकृत दृष्टिकोण और डॉक्टरों तक समय पर पहुंच हमारे भविष्य - हमारे बच्चों को बचाने में मदद करेगी।
प्राथमिक इम्युनोडेफिशिएंसी (पीआईडी)- ये प्रतिरक्षा प्रणाली के एक या एक से अधिक घटकों में आनुवंशिक दोषों से जुड़े प्रतिरक्षा प्रणाली के जन्मजात विकार हैं, अर्थात्: पूरक, फागोसाइटोसिस, हास्य और सेलुलर प्रतिरक्षा। सभी प्रकार के पीआईडी की एक सामान्य विशेषता विभिन्न अंगों और ऊतकों को प्रभावित करने वाले आवर्तक, पुराने संक्रमणों की उपस्थिति है और, एक नियम के रूप में, अवसरवादी या अवसरवादी सूक्ष्मजीवों, यानी कम-विषाणु वनस्पतियों के कारण होता है। पीआईडी अक्सर अन्य शरीर प्रणालियों के शारीरिक और कार्यात्मक विकारों से जुड़े होते हैं और कुछ विशिष्ट विशेषताएं होती हैं जो प्रयोगशाला और प्रतिरक्षाविज्ञानी परीक्षा के बिना नवजात शिशुओं में प्रारंभिक निदान करना संभव बनाती हैं (तालिका देखें)।
| सर्वेक्षण डेटा | प्रारंभिक निदान |
| जन्मजात हृदय दोष, हाइपोपैरथायरायडिज्म, विशिष्ट चेहरा | डिजॉर्ज सिंड्रोम |
| शीत फोड़े, विशिष्ट चेहरा, फेफड़े की वायु पुटी | हाइपर आईजीई सिंड्रोम |
| नाभि घाव का धीमा उपचार | ल्यूकोसाइट आसंजन दोष (एलएडी सिंड्रोम) |
| एक्जिमा + थ्रोम्बोसाइटोपेनिया | विस्कॉट-एल्ड्रिच सिंड्रोम |
| गतिभंग + टेलैंगिएक्टेसिया | लुई बार सिंड्रोम |
| आंखों और त्वचा का आंशिक ऐल्बिनिज़म, फागोसाइट्स में विशाल कणिकाएं | चेदिएक-हिगाच सिंड्रोम |
| फ्लोरोस्कोपी पर थाइमस की छाया का अभाव, पसलियों के विकास में असामान्यताएं | एडेनोसाइन डेमिनमिनस दोष |
| त्वचा और म्यूकोसल कैंडिडा घाव, ऑटोइम्यून कैंडिडिआसिस एंडोक्रिनोपैथिस | क्रोनिक म्यूकोक्यूटेनियस |
प्रतिरक्षा प्रणाली के विभिन्न घटक मैक्रोऑर्गेनिज्म से रोगाणुओं के उन्मूलन में असमान भाग ले सकते हैं। इसलिए, स्वभाव से संक्रामक प्रक्रियाकोई भी प्रारंभिक रूप से यह तय कर सकता है कि प्रतिरक्षा का कौन सा घटक पर्याप्त रूप से काम नहीं करता है। तो, एक बच्चे के जीवन के पहले दिनों के दौरान त्वचा और श्लेष्मा झिल्ली की प्यूरुलेंट-भड़काऊ प्रक्रियाओं के विकास के साथ, पाइोजेनिक कोक्सी के कारण, फागोसाइटिक प्रणाली में जन्मजात दोषों की उपस्थिति के बारे में सोचने का कारण है। उन्हें गर्भनाल के घाव के बहुत धीमी गति से ठीक होने और गर्भनाल के गिरने की भी विशेषता है। रक्तप्रवाह से मातृ इम्युनोग्लोबुलिन के गायब होने के बाद, एक बच्चे के जीवन के दूसरे भाग में, एक नियम के रूप में, एंटीबॉडी उत्पादन में दोष से जुड़ी संक्रामक प्रक्रियाएं विकसित होती हैं। अक्सर, ये संक्रमण एनकैप्सुलेटेड पाइोजेनिक सूक्ष्मजीवों (स्ट्रेप्टोकोकी, न्यूमोकोकी, हीमोफिलुल्स इन्फ्लुएंजा, आदि) के कारण होते हैं जो ऊपरी और निचले श्वसन पथ को प्रभावित करते हैं। लगातार नीसरियल संक्रमण अक्सर पूरक घटकों C5-C9 में जन्म दोषों से जुड़ा होता है। वायरस और अन्य इंट्रासेल्युलर रोगजनकों के कारण बार-बार होने वाली संक्रामक प्रक्रियाएं प्रतिरक्षा के टी-सिस्टम में एक दोष की उपस्थिति का सुझाव देती हैं। यह म्यूकोक्यूटेनियस कैंडिडिआसिस द्वारा भी इंगित किया जा सकता है। क्रोनिक निमोनिया, लंबे समय तक, मुश्किल से इलाज होने वाले दस्त, और कैंडिडिआसिस का त्रय हमेशा जन्मजात टी-लिम्फोसाइट दोषों की धारणा का आधार होता है। प्रतिरक्षा के टी- और बी-सिस्टम के संयुक्त दोष संक्रामक प्रक्रियाओं के असामान्य रूप से गंभीर पाठ्यक्रम की विशेषता है जो बच्चे के जीवन के पहले महीने में विकसित होते हैं। उचित उपचार के बिना, जीवन के पहले वर्ष के दौरान, एक नियम के रूप में, बच्चे की मृत्यु हो जाती है।
प्रतिरक्षा प्रणाली के एक विशिष्ट उल्लंघन की पहचान करने और नैदानिक निदान की पुष्टि करने के लिए प्रयोगशाला और प्रतिरक्षाविज्ञानी परीक्षा की जाती है। स्क्रीनिंग प्रयोगशाला परीक्षणों के एक पैनल का उपयोग करके प्राथमिक निदान किया जा सकता है।
स्क्रीनिंग प्रयोगशाला परीक्षणों के एक पैनल का उपयोग लगभग किसी भी क्षेत्रीय या शहर के अस्पताल में संभव है जहां एक नैदानिक नैदानिक प्रयोगशाला है। हालांकि, नैदानिक प्रतिरक्षा विज्ञान की आधुनिक प्रयोगशाला के साथ एक विशेष चिकित्सा संस्थान में ही गहन विश्लेषण किया जा सकता है। संदिग्ध पीआईडी वाले रोगी की विस्तार से जांच की जानी चाहिए कार्यात्मक गतिविधिफागोसाइट्स, टी- और बी-प्रतिरक्षा प्रणाली। प्रतिरक्षा का आकलन करने के लिए पद्धतिगत दृष्टिकोणों को संबंधित अनुभाग में अधिक विस्तार से वर्णित किया जाएगा।
वर्तमान में, प्रतिरक्षा प्रणाली के 70 से अधिक जन्मजात दोषों की पहचान की गई है, और आणविक इम्यूनोडायग्नोस्टिक्स में सुधार के रूप में उनकी संख्या बढ़ने की संभावना है। पीआईडी अपेक्षाकृत दुर्लभ रोग हैं: उनकी आवृत्ति औसत 1/25000-1/100000 है। अपवाद चयनात्मक IgA कमी है, जो 1/500-1/700 की आवृत्ति के साथ होती है। पीआईडी का अध्ययन सैद्धांतिक और अनुप्रयुक्त प्रतिरक्षा विज्ञान के लिए बहुत रुचि का है। इन दोषों के अंतर्निहित आणविक आनुवंशिक तंत्रों का विश्लेषण प्रतिरक्षा प्रणाली के कामकाज के मौलिक रूप से नए तंत्रों की पहचान करना संभव बनाता है और इसके परिणामस्वरूप, प्रतिरक्षा प्रणाली विकारों से जुड़े रोगों के प्रतिरक्षण और प्रतिरक्षा चिकित्सा के लिए नए दृष्टिकोण विकसित करना।
माध्यमिक इम्युनोडेफिशिएंसी (एसआईडी)।नैदानिक प्रतिरक्षा विज्ञान के लिए काफी रुचि VIDs का अध्ययन है, जो मात्रात्मक शब्दों में, निस्संदेह इम्युनोडेफिशिएंसी के बीच प्रमुख हैं। वीआईडी प्रतिरक्षा प्रणाली के विकारों को संदर्भित करता है जो देर से प्रसवोत्तर अवधि में या वयस्कों में विकसित होते हैं और आमतौर पर कुछ आनुवंशिक दोष का परिणाम नहीं माना जाता है। VID के बीच, तीन रूपों को सशर्त रूप से प्रतिष्ठित किया जा सकता है: अधिग्रहित, प्रेरित और सहज। पहले रूप का सबसे महत्वपूर्ण उदाहरण एक्वायर्ड इम्युनोडेफिशिएंसी सिंड्रोम (एड्स) है, जो संबंधित वायरस द्वारा मानव लिम्फोइड ऊतक को नुकसान के परिणामस्वरूप विकसित होता है। प्रेरित वीआईडी ऐसी स्थितियां हैं जो एक विशिष्ट कारण के कारण होती हैं: एक्स-रे एक्सपोजर, कॉर्टिकोस्टेरॉइड्स, साइटोस्टैटिक्स, आघात और सर्जरी, साथ ही प्रतिरक्षा विकार जो अंतर्निहित बीमारी (मधुमेह, गुर्दे और यकृत रोग, घातक प्रक्रियाएं इत्यादि) के लिए माध्यमिक विकसित होते हैं। ) एक नियम के रूप में, वीआईडी के प्रेरित रूप क्षणिक होते हैं, और जब कारण समाप्त हो जाता है, तो ज्यादातर मामलों में, प्रतिरक्षा की पूर्ण बहाली होती है। प्रेरित के विपरीत, वीआईडी का सहज रूप एक स्पष्ट कारण की अनुपस्थिति की विशेषता है जो प्रतिरक्षात्मक प्रतिक्रिया के उल्लंघन का कारण बनता है। पीआईडी के साथ, इम्युनोडेफिशिएंसी का यह रूप ब्रोन्कोपल्मोनरी तंत्र और परानासल परानासल साइनस, मूत्रजननांगी और जठरांत्र संबंधी मार्ग, आंखों, त्वचा और कोमल ऊतकों की पुरानी, आवर्तक, संक्रामक और भड़काऊ प्रक्रियाओं के रूप में प्रकट होता है, जो पीआईडी की तरह, अवसरवादी द्वारा होता है। या अवसरवादी रोगजनकों में असामान्य जैविक गुण होते हैं और अक्सर कई एंटीबायोटिक प्रतिरोध के साथ। मात्रात्मक शब्दों में, स्वतःस्फूर्त रूप VID का प्रमुख रूप है।
- श्रेणी प्रतिरक्षा स्थितिइम्युनोडेफिशिएंसी के साथ
जैसा कि पहले ही उल्लेख किया गया है, इम्युनोडेफिशिएंसी में प्रतिरक्षा स्थिति के अध्ययन में प्रतिरक्षा प्रणाली के मुख्य घटकों की मात्रा और कार्यात्मक गतिविधि का अध्ययन शामिल होना चाहिए, जो शरीर के संक्रमण-विरोधी सुरक्षा में एक प्रमुख भूमिका निभाते हैं। इनमें फागोसाइटिक प्रणाली, पूरक प्रणाली, टी- और बी-प्रतिरक्षा प्रणाली शामिल हैं। इन प्रणालियों के कामकाज का मूल्यांकन करने के लिए इस्तेमाल की जाने वाली विधियों को सशर्त रूप से आर. वी. पेट्रोव एट अल द्वारा विभाजित किया गया है। (1984) पहले और दूसरे स्तरों के परीक्षणों के लिए। इन लेखकों के अनुसार, स्तर 1 परीक्षण सांकेतिक हैं और इसका उद्देश्य प्रतिरक्षा प्रणाली में सकल दोषों की पहचान करना है; स्तर 2 परीक्षण कार्यात्मक हैं और इसका उद्देश्य प्रतिरक्षा प्रणाली में एक विशिष्ट "ब्रेकडाउन" की पहचान करना है। हम संबंधित प्रतिरक्षा प्रणाली के कामकाज के उत्पाद की पहचान करने के उद्देश्य से प्रथम स्तर के तरीकों के परीक्षणों का उल्लेख करते हैं, जो इसके रोगाणुरोधी प्रभाव को निर्धारित करता है। स्तर 2 परीक्षण वैकल्पिक हैं। वे संबंधित प्रतिरक्षा प्रणाली के कामकाज के बारे में जानकारी को महत्वपूर्ण रूप से समृद्ध करते हैं।
फागोसाइटोसिस का आकलन करने के लिए स्तर 1 परीक्षणों में यह निर्धारित करना शामिल है:
- न्यूट्रोफिल और मोनोसाइट्स की पूर्ण संख्या;
- न्यूट्रोफिल और मोनोसाइट्स द्वारा रोगाणुओं के अवशोषण की तीव्रता;
- रोगाणुओं को मारने के लिए फागोसाइट्स की क्षमता।
फागोसाइटोसिस की प्रक्रिया में कई चरण होते हैं: केमोटैक्सिस, आसंजन, अवशोषण, गिरावट, वस्तु की हत्या और विनाश। फागोसाइटिक प्रक्रिया का आकलन करने में उनके अध्ययन का एक निश्चित महत्व है, क्योंकि लगभग हर चरण में टूटने की उपस्थिति से जुड़े इम्यूनोडेफिशियेंसी हैं। न्यूट्रोफिल और मोनोसाइट के काम का मुख्य परिणाम सूक्ष्म जीव की हत्या और विनाश है, यानी पूर्ण फागोसाइटोसिस। हत्या का आकलन करने के लिए, फागोसाइटोसिस की प्रक्रिया में प्रतिक्रियाशील ऑक्सीजन प्रजातियों के गठन का निर्धारण करने की सिफारिश करना संभव है। यदि केमिलुमिनेसेंस का उपयोग करके प्रतिक्रियाशील ऑक्सीजन प्रजातियों को निर्धारित करना संभव नहीं है, तो नाइट्रोसाइन टेट्राजोलियम की कमी से सुपरऑक्साइड रेडिकल के गठन का न्याय किया जा सकता है। लेकिन इस मामले में, यह याद रखना चाहिए कि फागोसाइट में रोगाणुओं की हत्या ऑक्सीजन-निर्भर और ऑक्सीजन-स्वतंत्र तंत्र दोनों का उपयोग करके की जाती है, अर्थात प्रतिक्रियाशील ऑक्सीजन प्रजातियों का निर्धारण इस प्रक्रिया के बारे में पूरी जानकारी प्रदान नहीं करता है।
फागोसाइटोसिस के आकलन के लिए दूसरे स्तर के परीक्षणों में इसकी परिभाषा शामिल है:
- फागोसाइट्स के केमोटैक्सिस की तीव्रता;
- न्यूट्रोफिल की सतह झिल्ली पर आसंजन अणुओं (CD11a, CD11b, CD11c, CD18) की अभिव्यक्ति।
प्रतिरक्षा की बी-प्रणाली का आकलन करने के लिए प्रथम स्तर के परीक्षणों में इसकी परिभाषा शामिल है:
- रक्त सीरम में इम्युनोग्लोबुलिन जी, ए, एम;
- रक्त सीरम में इम्युनोग्लोबुलिन ई;
- परिधीय रक्त में बी-लिम्फोसाइटों (CD19, CD20) के प्रतिशत और निरपेक्ष संख्या का निर्धारण।
बी-सिस्टम प्रतिरक्षा का आकलन करने के लिए इम्युनोग्लोबुलिन स्तर का निर्धारण अभी भी एक महत्वपूर्ण और विश्वसनीय तरीका है। इसे एंटीबॉडी के जैवसंश्लेषण से जुड़े सभी प्रकार की इम्युनोडेफिशिएंसी के निदान के लिए मुख्य विधि माना जा सकता है।
प्रतिरक्षा की बी-प्रणाली का आकलन करने के लिए दूसरे स्तर के परीक्षणों में इसकी परिभाषा शामिल है:
- इम्युनोग्लोबुलिन के उपवर्ग, विशेष रूप से आईजीजी;
- स्रावी आईजीए;
- कप्पा और लैम्ब्डा श्रृंखलाओं का अनुपात;
- प्रोटीन और पॉलीसेकेराइड एंटीजन के लिए विशिष्ट एंटीबॉडी;
- लिम्फोसाइटों की क्षमता बी- (स्टैफिलोकोकस, एंटरोबैक्टीरिया लिपोपॉलीसेकेराइड) और टीबी- (लैकोनोस मिटोजेन) माइटोजेंस के लिए एक प्रोलिफेरेटिव प्रतिक्रिया देने के लिए।
IgG उपवर्गों की परिभाषा कुछ नैदानिक महत्व की है, क्योंकि IgG के सामान्य स्तर के साथ इम्युनोग्लोबुलिन उपवर्गों में कमियां हो सकती हैं। ऐसे लोगों में, कुछ मामलों में, इम्युनोडेफिशिएंसी राज्य देखे जाते हैं, जो संक्रामक रुग्णता में वृद्धि में प्रकट होते हैं। इस प्रकार, IgG2 इम्युनोग्लोबुलिन जी का एक उपवर्ग है, जिसमें मुख्य रूप से इनकैप्सुलेटेड बैक्टीरिया (हीमोफिलुल्स इन्फ्लुएंजा, स्टेप्टोकोकल न्यूमोनिया) के पॉलीसेकेराइड के खिलाफ एंटीबॉडी होते हैं। इसलिए, IgG2 के साथ-साथ IgA से जुड़ी कमी से श्वसन संक्रमण की घटनाओं में वृद्धि होती है। IgA उपवर्गों के अनुपात में और कप्पा और लैम्ब्डा श्रृंखलाओं के अनुपात में गड़बड़ी भी इम्युनोडेफिशिएंसी राज्यों का कारण हो सकती है। बैक्टीरियल प्रोटीन और पॉलीसेकेराइड एंटीजन के लिए एंटीबॉडी के निर्धारण द्वारा हास्य प्रतिरक्षा की स्थिति के बारे में महत्वपूर्ण जानकारी प्रदान की जाती है, क्योंकि इस विशेष संक्रमण से शरीर की सुरक्षा की डिग्री इम्युनोग्लोबुलिन के सामान्य स्तर पर निर्भर नहीं करती है, लेकिन एंटीबॉडी की संख्या पर निर्भर करती है। इसके रोगज़नक़ को। यह विशेष रूप से डेटा द्वारा स्पष्ट रूप से प्रदर्शित किया गया है जो दर्शाता है कि पुरानी साइनसिसिटिस और ओटिटिस मीडिया का विकास केवल आईजीजी 3 एंटीबॉडी के ऐसे रोगियों में मोराक्सेला कैटरलिस की कमी पर निर्भर करता है। विशिष्ट एंटीबॉडी का निर्धारण करने के महत्व का एक और उदाहरण उदाहरण डेटा साबित हो सकता है कि लगातार संक्रामक प्रक्रियाओं से पीड़ित व्यक्तियों में श्वसन तंत्र, इम्युनोग्लोबुलिन के सभी वर्गों के सामान्य स्तर पर, हीमोफिलुल्स इन्फ्लुएंजा के एंटीबॉडी का अनुमापांक काफी कम हो जाता है।
ह्यूमर इम्युनिटी की स्थिति के बारे में मूल्यवान जानकारी न केवल इम्युनोग्लोबुलिन के स्तर, उनके उपवर्गों या कुछ एंटीजन के प्रति एंटीबॉडी का निर्धारण करके प्राप्त की जा सकती है, बल्कि उनके कार्यात्मक गुणों का अध्ययन करके भी प्राप्त की जा सकती है। सबसे पहले, उन्हें आत्मीयता के रूप में एंटीबॉडी की ऐसी संपत्ति को शामिल करना चाहिए, जिस पर एंटीजन के साथ एंटीबॉडी की बातचीत की ताकत काफी हद तक निर्भर करती है। कम आत्मीयता एंटीबॉडी के उत्पादन से एक इम्युनोडेफिशिएंसी राज्य का विकास हो सकता है। हमने यह साबित कर दिया है कि जो लोग अक्सर और लंबे समय तक श्वसन पथ के रोगों से पीड़ित होते हैं, उनमें इम्युनोग्लोबुलिन के सामान्य स्तर के साथ, पेप्टिडोग्लाइकन सेंट ऑलर्यूल्स, स्ट्र.न्यूल्मोनी, ब्र.कैटरहलिस के प्रति एंटीबॉडी का थोड़ा बढ़ा हुआ स्तर होता है, की आत्मीयता इन रोगाणुओं के प्रति एंटीबॉडी काफी कम हो जाते हैं।
एक महत्वपूर्ण कवकनाशी गुण इम्युनोग्लोबुलिन की ऑप्सोनाइजिंग गतिविधि है। जैसा कि पहले ही उल्लेख किया गया है, न्यूट्रोफिल बाह्य रोगाणुओं के खिलाफ शरीर की रक्षा में एक केंद्रीय आंकड़ा है। हालांकि, इस कार्य का इसका प्रदर्शन काफी हद तक रक्त सीरम की ऑप्सोनाइजिंग गतिविधि पर निर्भर करता है, जहां इम्युनोग्लोबुलिन और पूरक इस गतिविधि में एक प्रमुख भूमिका निभाते हैं। ग्राम-नेगेटिव बैक्टीरिया के कारण होने वाले बैक्टरेरिया वाले 30 रोगियों के एक अध्ययन में यह पाया गया कि इन रोगियों के न्यूट्रोफिल में ई. कोलाई को मारने की क्षमता कम थी। यह केवल रोगियों के रक्त सीरम को ऑप्सोनाइज करने में असमर्थता पर निर्भर करता था, क्योंकि इन रोगियों के न्यूट्रोफिल में स्वस्थ दाताओं के सीरम को जोड़ने से ई. कोलाई को मारने के लिए न्यूट्रोफिल की क्षमता को पूरी तरह से बहाल कर दिया गया था।
प्रतिरक्षा की टी-प्रणाली का आकलन करने के लिए प्रथम स्तर के परीक्षणों में इसकी परिभाषा शामिल है:
- लिम्फोसाइटों की कुल संख्या;
- परिपक्व टी-लिम्फोसाइटों (सीडी3) और उनकी दो मुख्य उप-जनसंख्या का प्रतिशत और निरपेक्ष संख्या: हेल्पर/इंड्यूसर (सीडी4) और किलर/सप्रेसर (सीडी8);
- मुख्य टी-माइटोजेन्स के लिए प्रोलिफ़ेरेटिव रिस्पांस: फाइटोहेमाग्लगुटिनिन और कॉन्कानावलिन ए।
बी-प्रतिरक्षा प्रणाली का आकलन करते समय, हमने पहले स्तर के परीक्षणों के रूप में बी-लिम्फोसाइटों की संख्या, साथ ही इम्युनोग्लोबुलिन के स्तर के निर्धारण की सिफारिश की। चूंकि उत्तरार्द्ध बी-कोशिकाओं के मुख्य अंत उत्पाद हैं, इससे बी-प्रतिरक्षा प्रणाली का मात्रात्मक और कार्यात्मक रूप से मूल्यांकन करना संभव हो जाता है। प्रतिरक्षा के टी-सिस्टम के संबंध में इस तरह के दृष्टिकोण को लागू करना अभी भी मुश्किल है, क्योंकि साइटोकिन्स टी-लिम्फोसाइटों का मुख्य अंत उत्पाद है, और उनके निर्धारण के लिए सिस्टम अभी भी नैदानिक इम्यूनोलॉजी की व्यावहारिक प्रयोगशालाओं के लिए खराब रूप से उपलब्ध हैं। फिर भी, प्रतिरक्षा की टी-प्रणाली की कार्यात्मक गतिविधि का मूल्यांकन असाधारण महत्व का कार्य है, क्योंकि इसे सामान्य संख्या में टी-कोशिकाओं और उनकी उप-जनसंख्या के साथ, कभी-कभी महत्वपूर्ण रूप से भी कम किया जा सकता है। टी-लिम्फोसाइटों की कार्यात्मक गतिविधि का आकलन करने के तरीके काफी जटिल हैं। उनमें से सबसे सरल, हमारी राय में, दो मुख्य टी-माइटोजेन्स का उपयोग करके ब्लास्ट ट्रांसफॉर्मेशन की प्रतिक्रिया है: फाइटोहेमग्लगुटिनिन और कॉनकैनावलिन ए। माइटोजेन के लिए टी-लिम्फोसाइटों की प्रोलिफ़ेरेटिव प्रतिक्रिया लगभग सभी पुरानी संक्रामक और भड़काऊ प्रक्रियाओं, घातक बीमारियों में कम हो जाती है। विशेष रूप से हेमटोपोइएटिक प्रणाली; एड्स के साथ और सभी प्राथमिक टी-सेल इम्युनोडेफिशिएंसी के साथ सभी प्रकार की प्रतिरक्षादमनकारी चिकित्सा के साथ।
प्रतिरक्षा की टी-प्रणाली के आकलन के लिए दूसरे स्तर के परीक्षणों में, हम इसकी परिभाषा शामिल करते हैं:
- साइटोकिन्स का उत्पादन (इंटरल्यूकिन -2, (आईएल -2), आईएल -4, आईएल -5, आईएल -6, गामा-इंटरफेरॉन, ट्यूमर नेक्रोसिस फैक्टर (टीएनएफ), आदि);
- टी-लिम्फोसाइटों की सतह झिल्ली पर सक्रियण अणु (CD25, HLA-DR);
- आसंजन अणु (CD11a, CD18);
- विशिष्ट प्रतिजनों के लिए प्रोलिफ़ेरेटिव प्रतिक्रिया, सबसे अधिक बार डिप्थीरिया और टेटनस टॉक्सोइड्स के लिए;
- माइक्रोबियल एंटीजन की एक श्रृंखला के साथ त्वचा परीक्षणों का उपयोग करके एलर्जी की प्रतिक्रिया।
बिना किसी संदेह के, लिम्फोसाइटों और मैक्रोफेज द्वारा साइटोकिन उत्पादन का निर्धारण प्रतिरक्षा प्रणाली के विकारों से जुड़े रोगों के प्रतिरक्षण निदान में मुख्य तरीका होना चाहिए। कुछ मामलों में साइटोकिन्स की पहचान रोग के निदान और प्रतिरक्षा विकारों के तंत्र को अधिक सटीक रूप से स्थापित करना संभव बनाती है।
TNF, IL-1 और गामा-इंटरफेरॉन जैसे प्रो-इंफ्लेमेटरी साइटोकिन्स को निर्धारित करना भी महत्वपूर्ण है। संक्रामक और ऑटोइम्यून प्रकृति दोनों की विभिन्न तीव्र और पुरानी भड़काऊ प्रक्रियाओं के एटियोपैथोजेनेसिस में उनकी भूमिका महान है। उनका बढ़ा हुआ गठन सेप्टिक शॉक का मुख्य कारण है। सेप्सिस के साथ, रक्त में टीएनएफ का स्तर 1 एनजी / एमएल तक पहुंच सकता है। गैर-विशिष्ट अल्सरेटिव कोलाइटिस, मल्टीपल स्केलेरोसिस, रुमेटीइड गठिया, इंसुलिन पर निर्भर मधुमेह, आदि के एटियोपैथोजेनेसिस में प्रो-इंफ्लेमेटरी साइटोकिन्स की भूमिका पर डेटा जमा करना।
हम इम्यूनोडायग्नोस्टिक्स के लिए टी-लिम्फोसाइटों की सतह पर सक्रियण और आसंजन अणुओं की अभिव्यक्ति का अध्ययन करना महत्वपूर्ण मानते हैं। जैसा कि नाम से पता चलता है, सक्रियण अणुओं की पहचान टी-सेल सक्रियण की डिग्री के बारे में महत्वपूर्ण जानकारी प्रदान करती है। IL-2 रिसेप्टर की बिगड़ा हुआ अभिव्यक्ति कई घातक रक्त रोगों - टी-सेल ल्यूकेमिया, बालों वाली कोशिका ल्यूकेमिया, लिम्फोग्रानुलोमैटोसिस, आदि - और ऑटोइम्यून प्रक्रियाओं में देखी जाती है: संधिशोथ, प्रणालीगत ल्यूपस एरिथेमेटोसस, अप्लास्टिक एनीमिया, स्क्लेरोडर्मा, क्रोहन रोग, सारकॉइडोसिस , इंसुलिन पर निर्भर मधुमेह और आदि।
विशेष, हमारी राय में, टी-सेल इम्युनोडेफिशिएंसी के निदान में त्वचा परीक्षणों के उपयोग का सवाल है। जैसा कि पहले ही उल्लेख किया गया है, विदेशी विशेषज्ञों की सिफारिश पर और डब्ल्यूएचओ विशेषज्ञों की सिफारिशों के अनुसार, उन्हें टी-सिस्टम प्रतिरक्षा का आकलन करने के लिए स्क्रीनिंग या स्तर 1 परीक्षणों के रूप में उपयोग किया जाता है। यह दो परिस्थितियों के कारण है। सबसे पहले, त्वचा परीक्षण सबसे सरल और एक ही समय में सूचनात्मक परीक्षण हैं जो हमें टी-लिम्फोसाइटों की कार्यात्मक गतिविधि का मूल्यांकन करने की अनुमति देते हैं। उच्च स्तर की संभावना वाले कुछ माइक्रोबियल एंटीजन के साथ सकारात्मक त्वचा परीक्षण एक रोगी में टी-सेल इम्युनोडेफिशिएंसी की उपस्थिति को बाहर करने की अनुमति देता है। दूसरे, कई पश्चिमी फर्मों ने त्वचा परीक्षण प्रणाली विकसित की है जिसमें टी-सेल प्रतिरक्षा निर्धारित करने के लिए मुख्य एंटीजन शामिल हैं। यह कड़ाई से नियंत्रित परिस्थितियों में प्रतिरक्षा टी-सिस्टम की कार्यात्मक गतिविधि का मूल्यांकन करना संभव बनाता है। दुर्भाग्य से, रूस में ऐसी कोई प्रणाली नहीं है और इसलिए, वे व्यावहारिक रूप से प्रतिरक्षा की टी-प्रणाली का आकलन करने के लिए उपयोग नहीं की जाती हैं।
वीआईडी के लक्षण वाले लोगों में प्रतिरक्षा प्रणाली का मूल्यांकन कई कठिनाइयों को पूरा कर सकता है, और सबसे ऊपर कारण संबंधों के आकलन से संबंधित है। अक्सर, वे परिवर्तन जो प्रतिरक्षा प्रणाली के मापदंडों के विश्लेषण के दौरान दर्ज किए जाते हैं, परिणाम होते हैं, न कि रोग प्रक्रिया का कारण। इस प्रकार, उन व्यक्तियों में जो श्वसन संक्रमण से अक्सर और लंबे समय तक बीमार रहते हैं, इन संक्रमणों के मुख्य जीवाणु रोगजनकों के प्रति एंटीबॉडी का स्तर तेजी से बढ़ जाता है। इसी तरह की स्थिति एड्स रोगियों में श्वसन पथ से संक्रामक जटिलताओं के साथ देखी जाती है। स्वाभाविक रूप से, एफडीआई समूह के रोगियों और एड्स रोगियों में श्वसन रोगजनकों के लिए एंटीबॉडी टाइटर्स में वृद्धि श्वसन पथ में एक संक्रामक-भड़काऊ प्रक्रिया के परिणामस्वरूप प्रतिरक्षा प्रणाली की सक्रियता का परिणाम है। पुरानी संक्रामक और भड़काऊ प्रक्रियाओं वाले रोगियों में प्रतिरक्षा स्थिति का आकलन करते समय एक और कठिनाई का सामना करना पड़ सकता है, जो एक पर्याप्त पद्धतिगत दृष्टिकोण और अनुसंधान के लिए पर्याप्त सामग्री का चुनाव है। यद्यपि सैद्धांतिक और नैदानिक प्रतिरक्षा विज्ञान की उपलब्धियों को शायद ही कम करके आंका जा सकता है, और प्रतिरक्षाविज्ञानी के पास का एक बड़ा समूह है आधुनिक तकनीकप्रतिरक्षा प्रणाली की स्थिति का निर्धारण करने के लिए, हालांकि, यह माना जाना चाहिए कि हम अभी भी समग्र रूप से प्रतिरक्षा प्रणाली के कामकाज के बारे में बहुत कम जानते हैं। कुछ रोगों के विकास और प्रतिरक्षा प्रणाली के विभिन्न भागों के उल्लंघन के बीच विशिष्ट संबंध का पर्याप्त अध्ययन नहीं किया गया है। इसलिए, अक्सर उपयोग करते समय मानक तरीकेपुरानी संक्रामक और भड़काऊ प्रक्रियाओं वाले रोगियों में फागोसाइटोसिस, टी- और बी-प्रतिरक्षा प्रणाली का मूल्यांकन, डॉक्टर को बिगड़ा प्रतिरक्षा के बारे में ठोस जानकारी प्राप्त नहीं होती है। इसलिए, उदाहरण के लिए, परानासल साइनस के पुराने रोगों वाले रोगियों में उपरोक्त मापदंडों के अनुसार प्रतिरक्षा स्थिति का निर्धारण करते समय, हमने महत्वपूर्ण विचलन प्रकट नहीं किए। उसी समय, यह पता चला कि ऐसे रोगियों में ब्रांहैमेला कैटरलिस के लिए IgG3 एंटीबॉडी के संश्लेषण में एक दोष है, और यह अंतर्निहित रोग प्रक्रिया के विकास का मुख्य कारण है। जैसा कि पहले ही उल्लेख किया गया है, ब्रोन्कोपल्मोनरी तंत्र के लगातार संक्रामक रोगों से पीड़ित व्यक्तियों में, इन रोगों के प्रेरक एजेंटों के लिए एंटीबॉडी का अनुमापांक बढ़ जाता है। यह पता चला कि रोगियों के एक महत्वपूर्ण अनुपात में इन एंटीबॉडी की आत्मीयता काफी कम हो गई है। और कम आत्मीयता एंटीबॉडी शरीर से रोगज़नक़ को खत्म करने में अप्रभावी हैं, और यह संक्रामक प्रक्रिया की पुरानीता के कारणों में से एक हो सकता है। ऐसे कई उदाहरण दिए जा सकते हैं। इन सभी मामलों में, प्रतिरक्षा प्रणाली के उल्लंघन के नैदानिक रूप से स्पष्ट संकेत हैं, लेकिन इम्यूनोलैबोरेटरी अनुसंधान विधियों का उपयोग करके हमेशा उनकी पुष्टि नहीं की जाती है।
हम संक्रामक रोगों के पुराने, आवर्तक, सुस्त, पारंपरिक उपचार के लिए कठिन पर विचार करने का प्रस्ताव करते हैं। भड़काऊ प्रक्रियाएंइस प्रयोगशाला में उपयोग किए गए परीक्षणों का उपयोग करके प्रतिरक्षा प्रणाली में परिवर्तन का पता लगाया गया था या नहीं, इस पर ध्यान दिए बिना वयस्क रोगियों में एक माध्यमिक इम्यूनोडेफिशियेंसी राज्य की अभिव्यक्ति के रूप में विभिन्न प्रकार के स्थानीयकरण पाए गए, यानी, इन मामलों में वीआईडी को विशुद्ध रूप से नैदानिक अवधारणा के रूप में मानें। इसमें कोई संदेह नहीं है कि एक पुरानी संक्रामक-भड़काऊ प्रक्रिया की उपस्थिति प्रतिरक्षा प्रणाली के एक या अधिक घटकों में किसी प्रकार के टूटने का परिणाम है जो शरीर को संक्रमण से बचाती है। और अगर इन टूटने की पहचान नहीं की गई थी, तो यह, जैसा कि अभी संकेत दिया गया है, अपर्याप्त कार्यप्रणाली दृष्टिकोण, अनुसंधान के लिए अपर्याप्त सामग्री का उपयोग, या विज्ञान के विकास में किसी दिए गए चरण में मौजूदा टूटने की पहचान करने में असमर्थता का परिणाम हो सकता है। . बाद की स्थिति का एक विशिष्ट उदाहरण एलएडी सिंड्रोम है, जिसमें फागोसाइटिक कोशिकाओं पर आसंजन अणुओं की अभिव्यक्ति का उल्लंघन होता है। इसकी खोज हाइब्रिडोमा तकनीक के आगमन और मोनोक्लोनल एंटीबॉडी के उद्भव के कारण ही संभव हो पाई।
साथ ही, हम इस बात से अवगत हैं कि SIA के एक स्वतःस्फूर्त रूप का विकास कुछ विशिष्ट कारणों पर आधारित होना चाहिए। इन कारणों पर विचार करने के लिए, एक बार फिर यह याद रखना उचित होगा कि मानव प्रतिरक्षा एक जटिल बहु-घटक प्रणाली है, और शरीर को संक्रमण से बचाने के लिए जन्मजात प्रतिरोध और अधिग्रहित प्रतिरक्षा दोनों के कारक शामिल हैं। एक संक्रामक प्रक्रिया के विकास के प्रारंभिक चरणों में - पहले 96 घंटों में - शरीर को एक संक्रामक एजेंट से गैर-विशिष्ट प्रतिरक्षा कारकों के संयोजन से सुरक्षित किया जाता है, जैसे कि पूरक प्रणाली, तीव्र चरण प्रोटीन, मोनोकाइन, फागोसाइट्स, प्राकृतिक हत्यारे , आदि। यह संभव है कि इन प्रणालियों में से एक में दोष कुछ समय के लिए बढ़ी हुई संक्रामक रुग्णता के रूप में नैदानिक रूप से प्रकट नहीं हो सकता है, क्योंकि प्रतिरक्षा के अन्य सभी घटक सामान्य कार्यात्मक अवस्था में हैं और इस दोष की भरपाई करते हैं। हालांकि, समय के साथ और विभिन्न प्रतिकूल कारकों के प्रभाव में होने वाले इन प्रतिपूरक घटकों में परिवर्तन, भले ही बहुत महत्वपूर्ण न हों, एक संचयी प्रभाव हो सकता है जिससे प्राथमिक दोष की फेनोटाइपिक अभिव्यक्ति और बढ़ी हुई रुग्णता का विकास हो सकता है। यह माना जा सकता है कि कई, और शायद लगभग सभी नैदानिक रूप, जो वयस्कों में बढ़े हुए संक्रामक रुग्णता के रूप में प्रकट होते हैं, प्रतिरक्षा प्रणाली के कुछ घटक की प्राथमिक प्रतिरक्षाविज्ञानी कमी पर आधारित होते हैं, जिनकी भरपाई एक निश्चित समय तक की जाती है। दूसरों की सामान्य या उच्च कार्यात्मक गतिविधि के लिए इस प्रणाली के घटक। इस संभावना की पुष्टि सामान्य परिवर्तनशील प्रतिरक्षा कमी (सीवीआईडी) द्वारा की जा सकती है, जो अक्सर ब्रोन्कोपल्मोनरी तंत्र और परानासल साइनस के पुराने, आवर्तक संक्रमणों में प्रकट होती है। यह रोग इम्युनोग्लोबुलिन के सभी वर्गों के स्तर में कमी की विशेषता है। सीवीआईडी के दो शिखर हैं: पहली चोटी 6-10 साल के बीच विकसित होती है, दूसरी - 26-30 साल के बीच, और बीमारी के विकास से पहले, ये रोगी व्यावहारिक रूप से स्वस्थ लोग होते हैं। इस बात के काफी प्रमाण हैं कि सीवीआईडी के रोगियों में ह्यूमर इम्युनिटी में दोष का एक आनुवंशिक मूल है। नतीजतन, प्रतिरक्षा प्रणाली के अन्य घटकों की सामान्य या बढ़ी हुई कार्यात्मक गतिविधि के कारण एक निश्चित समय तक इस दोष की भरपाई की गई, जो शरीर को संक्रमण से बचाते हैं। सीवीआईडी के अलावा, पीआईडी से संबंधित कई बीमारियां हैं, लेकिन कभी-कभी वयस्कता में चिकित्सकीय रूप से प्रकट होती हैं। इनमें चयनात्मक IgA की कमी, IgG उपवर्गों की कमी, पूरक प्रणाली की कमी शामिल हैं। केवल बचपन के लिए विशिष्ट पीआईडी के वयस्क रूपों में प्राथमिक अभिव्यक्ति के मामलों का वर्णन किया गया है। इनमें एडेनोसिन डेमिनमिनस की कमी, विस्कॉट-एल्ड्रिच सिंड्रोम, एक्स-लिंक्ड एग्माग्लोबुलिनमिया शामिल हैं। एक नियम के रूप में, इन मामलों में, रोग के लक्षणों की शुरुआत में देरी इस व्यक्ति में एक मध्यम आनुवंशिक दोष की उपस्थिति का परिणाम है। लेकिन प्रतिरक्षा के अन्य घटकों के कारण प्राथमिक दोष के प्रतिपूरक सुधार को बाहर नहीं किया जा सकता है। समय के साथ उनका परिवर्तन वह है जो प्राथमिक, यहां तक कि एक हल्के, प्रतिरक्षा प्रणाली में दोष के लिए खुद को चिकित्सकीय रूप से प्रकट करना संभव बनाता है।
- इम्युनोडेफिशिएंसी में इम्युनोमोड्यूलेटर का उपयोग
इम्यूनोमॉड्यूलेटरी थेरेपी पीआईडी में अप्रभावी या अप्रभावी है। उनके उपचार के मुख्य तरीके रोगाणुरोधी और प्रतिस्थापन चिकित्सा हैं। विदेश में, पुनर्निर्माण चिकित्सा का उपयोग किया जाता है, जिसमें बीमार बच्चों को अस्थि मज्जा का प्रत्यारोपण होता है। जीन थेरेपी विधियों को भी गहन रूप से विकसित किया जा रहा है।
वीआईडी में इम्युनोमोड्यूलेटर का उपयोग अधिक उचित और उपयुक्त है। उत्तरार्द्ध की नियुक्ति हमेशा नैदानिक और प्रतिरक्षाविज्ञानी परीक्षा के आधार पर की जानी चाहिए। इस सर्वेक्षण के परिणामों के आधार पर, लोगों के दो समूहों को प्रतिष्ठित किया जा सकता है:
- प्रतिरक्षाविज्ञानी विधियों का उपयोग करके पहचाने गए इसके मापदंडों में विशिष्ट परिवर्तनों के साथ संयोजन में बिगड़ा हुआ प्रतिरक्षा के नैदानिक लक्षण होना;
- प्रतिरक्षा के मापदंडों को बदले बिना केवल बिगड़ा हुआ प्रतिरक्षा के नैदानिक संकेत होना।
इम्युनोमोड्यूलेटर की नियुक्ति के लिए मुख्य मानदंड है नैदानिक तस्वीर. इम्युनोमोड्यूलेटर का उपयोग (या चाहिए) में किया जा सकता है जटिल चिकित्सापहले और दूसरे दोनों समूहों के रोगी। सवाल उठता है कि वीआईडी के संकेतों की उपस्थिति में कौन से विशिष्ट इम्युनोमोड्यूलेटर निर्धारित किए जाने चाहिए? प्रतिरक्षा प्रणाली में पहचान की गई असामान्यताओं के बिना रोगियों में यह समस्या विशेष रूप से तीव्र है। इस प्रश्न का उत्तर देने के लिए, संक्रामक-विरोधी सुरक्षा के मुख्य तंत्रों का संक्षेप में विश्लेषण करना आवश्यक है, क्योंकि इम्युनोडेफिशिएंसी की मुख्य अभिव्यक्ति, जैसा कि पहले ही उल्लेख किया गया है, एक बढ़ी हुई संक्रामक रुग्णता है। वीआईडी के लक्षणों वाले रोगियों में इम्युनोमोड्यूलेटर का उपयोग करने का प्राथमिक लक्ष्य शरीर के संक्रमण-रोधी प्रतिरोध को बढ़ाना है।
परंपरागत रूप से, सभी सूक्ष्मजीवों को बाह्य और इंट्रासेल्युलर में विभाजित किया जा सकता है। बाह्य रोगजनकों के खिलाफ लड़ाई में मुख्य प्रभावकारी कोशिकाएं न्यूट्रोफिल हैं। उनके अवशोषण और जीवाणुनाशक कार्यों को पूरक और आईजीजी की उपस्थिति में तेजी से बढ़ाया जाता है, साथ ही जब वे ट्यूमर नेक्रोसिस फैक्टर - (टीएनएफ), इंटरल्यूकिन -1 (आईएल), आईएल -6 और मैक्रोफेज, एनके द्वारा उत्पादित अन्य साइटोकिन्स द्वारा सक्रिय होते हैं। कोशिकाओं और टी-लिम्फोसाइटों... इंट्रासेल्युलर रोगजनकों के खिलाफ लड़ाई में मुख्य प्रभावकारी कोशिकाएं मैक्रोफेज, एनके कोशिकाएं और टी लिम्फोसाइट्स हैं। रोगजनक प्रतिजनों द्वारा समान तीन सेल आबादी के सक्रियण के बाद उत्पादित इंटरफेरॉन, टीएनएफ, और अन्य साइटोकिन्स के प्रभाव में उनके माइक्रोबायसाइडल और साइटोटोक्सिक गुण तेजी से बढ़ते हैं। एक रोगज़नक़ द्वारा सामना की जाने वाली पहली कोशिका जो श्लेष्म या त्वचा के आवरण को दूर कर लेती है, एक ऊतक मैक्रोफेज है। माइक्रोब को पकड़ने वाला मैक्रोफेज सक्रिय हो जाता है और कई मोनोकाइन को संश्लेषित करता है जो नए मोनोसाइट्स / मैक्रोफेज, न्यूट्रोफिल और एनके कोशिकाओं की कार्यात्मक गतिविधि को बढ़ाता है। यह मैक्रोफेज, अपने एंजाइम प्रणाली की मदद से सूक्ष्म जीव को विभाजित करके, अपने एंटीजेनिक निर्धारकों को टी- और बी-लिम्फोसाइटों को प्रस्तुत करता है, जिससे हास्य और सेलुलर प्रतिक्रियाओं के विकास की शुरुआत होती है और उनके विकास के लिए आवश्यक कुछ साइटोकिन्स का उत्पादन होता है।
संक्रमण-रोधी सुरक्षा की इस सरलीकृत योजना के विश्लेषण के आधार पर (आंकड़ा देखें), यह निष्कर्ष निकाला जा सकता है कि इसकी उत्तेजना के लिए, ऐसे इम्युनोमोड्यूलेटर का उपयोग सबसे उपयुक्त है जो मुख्य रूप से मोनोसाइट-मैक्रोफेज सिस्टम (एमएमएस) की कोशिकाओं पर कार्य करते हैं। ) जब यह प्रणाली सक्रिय होती है, तो संक्रमण के खिलाफ शरीर की रक्षा के विशिष्ट और गैर-विशिष्ट कारकों का पूरा सेट गति में आ जाता है। पहले, हमने सभी इम्युनोमोड्यूलेटर को तीन समूहों में विभाजित किया था: बहिर्जात, अंतर्जात और रासायनिक रूप से शुद्ध या बहुलक। एमएमसी कोशिकाओं पर प्रमुख प्रभाव डालने वाली दवाएं इम्युनोमोड्यूलेटर के इन तीनों समूहों में उपलब्ध हैं। उच्च प्रदर्शन के लिए औषधीय उत्पादएमएमएस कोशिकाओं पर प्रमुख प्रभाव वाली नवीनतम पीढ़ी में पॉलीऑक्सिडोनियम, लाइकोपिड, मायलोपिड, इसका एमपी-3 अंश शामिल है।
फागोसाइटिक कोशिकाओं की अवशोषण और माइक्रोबायसाइड गतिविधि दोनों टी-लिम्फोसाइटों की कार्यात्मक गतिविधि पर निर्भर करती है और विशेष रूप से, इन कोशिकाओं को बांटने वाले साइटोकिन्स का उत्पादन करने की उनकी क्षमता पर निर्भर करती है। इसलिए, टी-लिम्फोसाइटों पर एक प्रमुख प्रभाव वाले इम्युनोमोड्यूलेटर और उनमें ऐसे साइटोकिन्स के संश्लेषण को प्रेरित करने से न्युट्रोफिलिक ल्यूकोसाइट्स और एमएमसी कोशिकाओं की कार्यात्मक गतिविधि को प्रोत्साहित किया जाएगा, अर्थात, शरीर की संक्रामक-विरोधी सुरक्षा को सक्रिय किया जाएगा। प्रतिरक्षा के टी-सिस्टम पर काम करने वाले इम्यूनोमॉड्यूलेटर्स में मवेशियों के थाइमस से प्राप्त कई दवाएं शामिल हैं, साथ ही उनके पूर्वज - टैक्टीविन भी शामिल हैं। इस आशय के इम्युनोमोड्यूलेटर की नवीनतम पीढ़ी में मायलोपिड (इसका एमपी -1 अंश) और इम्यूनोफैन शामिल हैं। यदि हम प्रतिरक्षा प्रणाली की सक्रियता में एक मैक्रोफेज को केंद्रीय कोशिका के रूप में मानते हैं, तो इस कोशिका पर प्रमुख प्रभाव वाले इम्युनोमोड्यूलेटर का उपयोग करते समय, हम प्रतिरक्षा प्रणाली को सक्रिय करते हैं, जिसे सशर्त रूप से केन्द्रापसारक के रूप में नामित किया जा सकता है, अर्थात, केंद्र से परिधि। प्रतिरक्षा के टी-सिस्टम पर एक प्रमुख प्रभाव वाले इम्युनोमोड्यूलेटर का उपयोग करते हुए, हम सक्रियण संकेत के प्राकृतिक आंदोलन के विपरीत दिशा में प्रतिरक्षा को सक्रिय करते हैं, अर्थात। हम बात कर रहे हेकेन्द्रापसारक सक्रियण के बारे में। अंतत: पूरा इम्यून सिस्टम हिलने लगता है, जिसके परिणामस्वरूप शरीर की संक्रमण-रोधी रक्षा बढ़ जाती है। विशाल नैदानिक अभ्यास से पता चलता है कि वीआईडी के रोगियों के जटिल उपचार में दोनों प्रकार की प्रतिरक्षा सक्रियता का सफलतापूर्वक उपयोग किया जा सकता है। एक विशेष रूप से स्पष्ट उदाहरण सर्जिकल संक्रमणों के उपचार के लिए इम्युनोमोड्यूलेटर का उपयोग है, जो वीआईडी के एक प्रेरित रूप के एक विशिष्ट उदाहरण के रूप में काम कर सकता है। लगभग सभी दवाएं जो प्रतिरक्षा प्रणाली को प्रभावित करती हैं और इसके लिए स्वीकृत हैं चिकित्सा उपयोगइन संक्रमणों के इलाज के लिए (लेविमिसोल, प्रोडिगियोसन, पाइरोजेनल, सोडियम न्यूक्लिनेट, डाइयूसिफॉन, टैक्टीविन, थाइमोजेन, आदि) का उपयोग किया गया है, और इन सभी ने आम तौर पर अच्छे नैदानिक परिणाम दिखाए हैं। वर्तमान में, एक प्रतिरक्षाविज्ञानी के पास वीआईडी के उपचार के लिए इम्युनोमोड्यूलेटर का एक बड़ा चयन होता है, और केवल में उपयोग के बाद क्लिनिकल अभ्यासअंततः सबसे अधिक का चयन करेगा प्रभावी दवाएं, जो, एस्पिरिन, कार्डियक ग्लाइकोसाइड्स, एंटीबायोटिक्स आदि की तरह, लंबे समय तक एक प्रतिरक्षाविज्ञानी के शस्त्रागार में शामिल रहेंगे। एक नियम के रूप में, तीव्र चरण में पुरानी संक्रामक और भड़काऊ प्रक्रियाओं में, डॉक्टर एंटीबायोटिक्स निर्धारित करता है। हम मानते हैं कि इन मामलों में एक साथ इम्युनोमोड्यूलेटर्स को निर्धारित करने की भी सलाह दी जाती है। एंटीबायोटिक और इम्युनोमोड्यूलेटर के एक साथ उपयोग के साथ, उनके अलग-अलग प्रशासन की तुलना में अधिक चिकित्सीय प्रभाव प्राप्त किया जाता है। एंटीबायोटिक रोगज़नक़ की कार्यात्मक गतिविधि को मारता है या रोकता है; इम्युनोमोड्यूलेटर सीधे (पॉलीऑक्सिडोनियम, लाइकोपिड, माइलोपिड) या परोक्ष रूप से (टैक्टिविन, इम्यूनोफैन, आदि) फागोसाइट्स की कार्यात्मक गतिविधि को बढ़ाता है, उनके जीवाणुनाशक प्रभाव को बढ़ाता है। रोग के प्रेरक एजेंट पर दोहरा झटका लगाया जाता है, जिसके कारण जटिल उपचार की अधिक प्रभावशीलता प्राप्त होती है।
उपरोक्त को संक्षेप में, हम मानते हैं कि अन्य दवाओं के साथ संयोजन में इम्युनोमोड्यूलेटर का उपयोग प्रतिरक्षाविज्ञानी को वीआईडी के लक्षणों वाले रोगियों का अधिक प्रभावी ढंग से इलाज करने में मदद करेगा।
सामान्य तौर पर इम्युनोडेफिशिएंसी के बारे में
किसी भी प्रतिरक्षा प्रतिक्रिया का सार एक एंटीजेनिक प्रकृति के विदेशी पदार्थों के शरीर से मान्यता और उन्मूलन में निहित है, दोनों बहिर्जात मर्मज्ञ (सूक्ष्मजीव) और अंतर्जात रूप से गठित (वायरस से संक्रमित कोशिकाएं, ज़ेनोबायोटिक्स द्वारा संशोधित कोशिकाएं, उम्र बढ़ने, ट्यूमर कोशिकाएं, आदि। ) विदेशी पदार्थों से शरीर की सुरक्षा जन्मजात और अधिग्रहित प्रतिरक्षा के विनोदी और सेलुलर कारकों द्वारा की जाती है, जो एक एकल कार्यात्मक परिसर का गठन करते हैं, एक दूसरे के पूरक होते हैं और निरंतर संपर्क और संपर्क में रहते हैं।
प्रतिरक्षा प्रणाली के कामकाज में, शरीर की किसी भी अन्य प्रणाली की तरह, गड़बड़ी हो सकती है जो इस प्रणाली की मुख्य रूप से विशेषता वाले रोगों के विकास की ओर ले जाती है। इस तरह के उल्लंघन में शामिल हैं:
- विदेशी और स्वयं के एंटीजन की गलत पहचान, जिससे ऑटोइम्यून प्रक्रियाओं का विकास होता है;
- हाइपरर्जिक या विकृत प्रतिरक्षा प्रतिक्रिया, जो एलर्जी रोगों के विकास की ओर ले जाती है;
- एक सामान्य प्रतिरक्षा प्रतिक्रिया विकसित करने में विफलता, जिससे इम्युनोडेफिशिएंसी का विकास होता है
टिप्पणी!
VID के साक्ष्य वाले मरीजों के लिए इम्यूनोथेरेपी के कुछ सामान्य सिद्धांत
- इम्युनोमोड्यूलेटर की नियुक्ति का मुख्य कारण नैदानिक तस्वीर होना चाहिए, जो पारंपरिक रूप से संक्रामक और भड़काऊ प्रक्रियाओं का इलाज करने के लिए पुरानी, सुस्त और मुश्किल की उपस्थिति की विशेषता है।
- इम्यूनोमॉड्यूलेटर्स, कुछ अपवादों के साथ, मोनोथेरेपी के रूप में उपयोग नहीं किए जाते हैं, लेकिन, एक नियम के रूप में, जटिल उपचार का एक अभिन्न अंग हैं।
- वीआईडी, जीवाणुरोधी, एंटिफंगल या के लक्षणों वाले रोगियों को निर्धारित करते समय एंटीवायरल ड्रग्सएमएमसी कोशिकाओं पर एक प्रमुख प्रभाव वाले इम्युनोमोड्यूलेटर को एक साथ निर्धारित करने की सलाह दी जाती है
व्यवसायी की मदद करने के लिए
यूडीसी 612.216-112
प्राप्त 31.04.08
एल.एम. करज़ाकोवा, ओ.एम. मुचुकोव,
एन.एल. रास्काज़ोवा
प्राथमिक और माध्यमिक प्रतिरक्षा:
रिपब्लिकन क्लिनिकल अस्पताल,
बच्चों के शहर का अस्पताल 3, चेबोक्सरी
इम्यूनोडिफ़िशिएंसी राज्यों के निदान और उपचार के सिद्धांतों पर विचार किया जाता है। प्राथमिक इम्यूनोडिफीसिअन्सी रोगों पर बहुत ध्यान दिया जाता है। लाया खींचा लेखकों पंजीकरण करवाना मुख्य प्रतिरक्षा की कमी चुवाशिया.
यहाँ प्रतिरक्षा की कमी वाले राज्यों के निदान और उपचार के सिद्धांत दिए गए हैं। प्राथमिक इम्यूनो-कमी वाली बीमारियों पर बहुत ध्यान आकर्षित किया जाता है। इसमें लेखकों द्वारा बनाई गई चुवाशिया में प्राथमिक प्रतिरक्षा-कमी रोगों की सूची है।
इम्युनोडेफिशिएंसी, प्रतिरक्षा प्रतिक्रिया के विकार, दो बड़े समूहों में विभाजित हैं - प्राथमिक (जन्मजात) और माध्यमिक (अधिग्रहित), जो विभिन्न अंतर्जात (बीमारियों) और बहिर्जात प्रभावों (उदाहरण के लिए, नकारात्मक पर्यावरणीय कारकों) के कारण होता है। प्राथमिक इम्युनोडेफिशिएंसी (पीआईडी) आमतौर पर आनुवंशिक दोषों के कारण होती है और केवल कभी-कभी गैर-वंशानुगत लोगों के कारण होती है जो भ्रूण की अवधि में उत्पन्न होती हैं। पीआईडी की एक विशिष्ट अभिव्यक्ति विभिन्न स्थानीयकरण के आवर्तक और / या पुराने संक्रमणों के विकास के साथ संक्रामक-विरोधी प्रतिरोध का उल्लंघन है। संक्रामक रोगजनकों का प्रकार जिसके लिए शरीर अतिसंवेदनशील है, प्रतिरक्षा प्रतिक्रिया के एक या दूसरे लिंक के दोष पर निर्भर करता है। इस प्रकार, एंटीबॉडी उत्पादन में एक दोष (प्रतिरक्षा प्रतिक्रिया के हास्य लिंक की अपर्याप्तता) मुख्य रूप से बैक्टीरिया (स्टैफिलोकोकस, स्ट्रेप्टोकोकस, न्यूमोकोकस, ई। कोलाई, प्रोटीस, क्लेबसिएला) और एंटरोवायरस के खिलाफ प्रतिरोध में कमी की ओर जाता है। प्रतिरक्षा प्रतिक्रिया के सेलुलर लिंक का उल्लंघन वायरल, प्रोटोजोअल संक्रमण, तपेदिक, क्रिप्टोकॉकोसिस, लीशमैनियासिस के लिए एक बढ़ी हुई प्रवृत्ति की विशेषता है। फागोसाइटोसिस में दोषों के साथ, संक्रामक सिंड्रोम का सबसे आम कारण सूक्ष्मजीव हैं जो उत्प्रेरित (स्टेफिलोकोसी, ई। कोलाई, सेराटिया मार्सेसेंस, नोकार्डिया, एस्परगिलस, आदि), अधिकांश ग्राम-नकारात्मक बैक्टीरिया और कवक (कैंडिडा अल्बिकन्स, एस्परगिलस) उत्पन्न करते हैं। पूरक प्रणाली में एक दोष कोक्सी और निसेरिया के कारण होने वाले संक्रमण से प्रकट होता है। प्रतिरक्षा प्रतिक्रिया (संयुक्त इम्युनोडेफिशिएंसी) के संयुक्त उल्लंघन के साथ, संक्रामक सिंड्रोम बैक्टीरिया और वायरस, कवक और प्रोटोजोआ दोनों के कारण होता है।
कुछ मामलों में, संक्रामक सिंड्रोम को गैर-इम्यूनोलॉजिकल अभिव्यक्तियों के साथ जोड़ा जाता है - अन्य अंगों और प्रणालियों से स्पष्ट रूप से परिभाषित लक्षणों के साथ। इस प्रकार, DiGeorge सिंड्रोम न केवल प्रतिरक्षा के सेलुलर लिंक के उल्लंघन में प्रकट होता है, बल्कि थाइमस के अप्लासिया या हाइपोप्लासिया में भी, पैराथायरायड ग्रंथियों की पीड़ा, हृदय और बड़े जहाजों के विकृतियों, डिसेम्ब्रायोजेनेसिस स्टिग्मास (तालु की दरार, अनुपस्थिति) में प्रकट होता है। इयरलोब, आदि)। लुई-बार सिंड्रोम में, संयुक्त प्रतिरक्षा कमी (टी-लिम्फोसाइटों की संख्या में कमी, आईजीए के स्तर में कमी) त्वचा और आंखों के श्वेतपटल पर अनुमस्तिष्क गतिभंग और टेलैंगिएक्टेसिया के साथ संयुक्त है। विस्कॉट-एल्ड्रिच सिंड्रोम में एक्जिमा और थ्रोम्बोसाइटोपेनिया के संयोजन में एक संयुक्त प्रतिरक्षा दोष (टी-लिम्फोसाइटों की संख्या में कमी, आईजीएम के स्तर में कमी) होता है।
प्राथमिक इम्युनोडेफिशिएंसी
1952 में ब्रूटन द्वारा जन्मजात इम्युनोडेफिशिएंसी (इम्युनोग्लोबुलिन के उत्पादन में आनुवंशिक रूप से निर्धारित विकार के कारण एग्माग्लोबुलिनमिया) का पहला मामला वर्णित किया गया था। तब से, 100 से अधिक विभिन्न प्राथमिक प्रतिरक्षा प्रणाली दोषों को पहचाना गया है। कुछ पीआईडी काफी सामान्य हैं। उदाहरण के लिए, चयनात्मक IgA की कमी की आवृत्ति 1:500 तक पहुँच जाती है। अधिकांश अन्य पीआईडी के लिए, यह आंकड़ा 1:50,000 - 1:100,000 है। कई प्रकाशनों के अनुसार, दुनिया में पीआईडी निदान के समय में एक स्पष्ट अल्पनिदान और अंतराल है। जेफरी मॉडल फाउंडेशन (यूएसए) और ईएसआईडी (यूरोपियन सोसाइटी फॉर द स्टडी ऑफ इम्यूनोडेफिशिएंसी) की पहल पर, रोगियों में पीआईडी पर संदेह करने के लिए मानदंड विकसित किए गए हैं।
पीआईडी मानदंड:
1. बार-बार ओटिटिस मीडिया (वर्ष में 6-8 बार)।
2. बार-बार साइनस का संक्रमण (साल में 4-6 बार)।
3. दो से अधिक पुष्ट निमोनिया।
4. त्वचा और आंतरिक अंगों के बार-बार गहरे फोड़े।
5. संक्रमण को रोकने के लिए एंटीबायोटिक दवाओं के साथ दीर्घकालिक चिकित्सा (2 महीने से अधिक) की आवश्यकता।
6. संक्रमण को रोकने के लिए अंतःशिरा एंटीबायोटिक दवाओं की आवश्यकता।
7. दो से अधिक गंभीर संक्रमण (मेनिन्जाइटिस, ऑस्टियोमाइलाइटिस, सेप्सिस)।
8. ऊंचाई और वजन में शिशु का बैकलॉग।
9. 1 साल से अधिक उम्र में त्वचा का लगातार फंगल इंफेक्शन होना।
10. रिश्तेदारों में पीआईडी की उपस्थिति, गंभीर संक्रमण से जल्दी मौत, या सूचीबद्ध लक्षणों में से एक।
एक रोगी में सूचीबद्ध लक्षणों में से एक से अधिक का पता लगाना पीआईडी के संबंध में सतर्क होना चाहिए और एक प्रतिरक्षाविज्ञानी अध्ययन के लिए एक संकेत होना चाहिए। विश्व में रुग्णता और मृत्यु दर की संरचना में PID की भूमिका और स्थान को बहुत महत्व दिया जाता है, जो पश्चिमी यूरोप, अमेरिका और ऑस्ट्रेलिया में PID के राष्ट्रीय रजिस्टरों के निर्माण का कारण था। रजिस्टरों में शामिल आंकड़ों के विश्लेषण से दुनिया के विभिन्न हिस्सों, जातीय आबादी में पीआईडी की घटनाओं का न्याय करना संभव हो जाता है, ताकि विकृति के प्रचलित रूपों को स्थापित किया जा सके और इस तरह दुर्लभ प्रकार के रोगों के निदान की गुणवत्ता में सुधार के लिए पूर्वापेक्षाएँ तैयार की जा सकें। रजिस्टर में उपलब्ध एनालॉग्स के साथ नए मामलों की तुलना करके। रूस में, 1992 से, अस्पताल में भर्ती होने के मामलों के विश्लेषण और रूसी संघ के राज्य वैज्ञानिक केंद्र "इंस्टीट्यूट ऑफ इम्यूनोलॉजी" के विभागों के लिए रोगियों की अपील के आंकड़ों के आधार पर, पीआईडी का एक रजिस्टर भी बनाए रखा गया है। हालांकि, क्षेत्रों में निदान किए गए पीआईडी के कई मामले बेहिसाब हैं। किसी भी रजिस्टर का निर्माण रोगों के एकल वर्गीकरण पर आधारित होना चाहिए। पीआईडी के अध्ययन के इतिहास की संक्षिप्तता के कारण, इसका वर्गीकरण अभी भी अंतिम नहीं है। WHO साइंटिफिक ग्रुप हर 2-3 साल में PID के सिस्टमैटिक्स पर रिपोर्ट और सिफारिशें प्रकाशित करता है, जबकि जैसे ही आधुनिक डायग्नोस्टिक तरीके पेश किए जाते हैं, बीमारी के वर्णित रूपों की संख्या और उनके वर्गीकरण का क्रम काफी बदल जाता है। . नवीनतम डब्ल्यूएचओ वर्गीकरण (2004) के अनुसार, पीआईडी को निम्नलिखित समूहों में विभाजित किया गया है:
1. पीआईडी मुख्य रूप से एंटीबॉडी दोषों के साथ (हास्य इम्युनोडेफिशिएंसी):
· एक्स-लिंक्ड एग्माग्लोबुलिनमिया (XVAGG);
सामान्य परिवर्तनीय प्रतिरक्षा कमी (सीवीआईडी);
सामान्य के साथ agammaglobulinemia or बढ़ा हुआ स्तरआईजीएम;
IgA की चयनात्मक कमी;
शैशवावस्था के क्षणिक हाइपोगैमाग्लोबुलिनमिया (देर से प्रतिरक्षाविज्ञानी शुरुआत)।
2. मुख्य रूप से टी-सेल दोषों के साथ पीआईडी:
- सीडी4+ कोशिकाओं की प्राथमिक कमी;
- आईएल-2 की कमी;
- एकाधिक साइटोकिन की कमी;
- संकेत पारगमन दोष + मायोपैथी;
- मायोपथी के साथ कैल्शियम का प्रवाह दोष।
3. संयुक्त इम्युनोडेफिशिएंसी राज्य:
- गंभीर संयुक्त इम्यूनोडेफिशियेंसी (एससीआईडी);
- विस्कॉट-एल्ड्रिच सिंड्रोम;
- गतिभंग - लेंगिएक्टेसिया (लुई - बार सिंड्रोम)।
4. फागोसाइटोसिस में दोष:
- पुरानी ग्रैनुलोमेटस बीमारी;
- चेदिएक-हिगाशी सिंड्रोम।
5. पूरक प्रणाली में दोष।
6. प्रतिरक्षा प्रणाली के बाहर अन्य प्रमुख दोषों से जुड़ी इम्युनोडेफिशिएंसी:
- हाइपर-आईजीई सिंड्रोम (जॉब सिंड्रोम);
- क्रोनिक म्यूकोक्यूटेनियस कैंडिडिआसिस;
- आंतों के लिम्फैंगिएक्टेसिया;
- एंटरोपैथिक एक्रोडर्माटाइटिस।
7. लिम्फोप्रोलिफेरेटिव प्रक्रियाओं से जुड़ी इम्युनोडेफिशिएंसी।
सबसे आम निम्नलिखित रूप:पीआईडी।
एक्स-लिंक्ड एग्माग्लोबुलिनमिया, या ब्रूटन की बीमारी (1:50,000), लड़कों में जीवन के 5-9वें महीने में देखी जाती है, जब प्रत्यारोपण से प्राप्त मातृ इम्युनोग्लोबुलिन की कमी होती है। रोग आवर्तक पाइोजेनिक संक्रमण (निमोनिया, साइनसिसिस, मेसोटिम्पैनाइटिस, मेनिन्जाइटिस) द्वारा प्रकट होता है। एक महत्वपूर्ण नैदानिक लक्षण है लिम्फ नोड्स, प्लीहा भड़काऊ प्रक्रिया में वृद्धि के साथ प्रतिक्रिया नहीं करता है। एक इम्युनोलैबोरेटरी अध्ययन से पता चलता है: 1) रक्त सीरम में -globulins की कमी या अनुपस्थिति; 2) सीरम आईजीजी के स्तर में कमी (2 ग्राम / एल से कम) अनुपस्थिति में या आईजीएम और आईजीए के स्तर में तेज कमी; 3) संचलन में बी-लिम्फोसाइटों (CD19+ या CD20+) की संख्या में कमी या तेज कमी, 2% से कम; 4) टॉन्सिल की अनुपस्थिति या हाइपोप्लासिया; 5) लिम्फ नोड्स का छोटा आकार; 6) टी-लिम्फोसाइटों का संरक्षित कार्य।
CVID (1:10,000 - 1:50,000) एंटीबॉडी गठन में दोष और एक अलग प्रकार की विरासत के साथ रोगों का एक विषम समूह है। "वैरिएबल" शब्द का अर्थ विभिन्न उम्र (बच्चों, किशोरों, वयस्कों) में रोग की अभिव्यक्ति है, जिसमें इम्युनोडेफिशिएंसी के प्रकार और गंभीरता में अलग-अलग बदलाव होते हैं। नैदानिक तस्वीर के अनुसार, सीवीआईडी ब्रूटन रोग जैसा दिखता है, रोग के प्रकट होने के समय में मुख्य अंतर: औसत उम्रसीवीआईडी की नैदानिक अभिव्यक्तियाँ - 25, निदान - 28 वर्ष। रोगियों की उत्तरजीविता आईजीजी के स्तर में कमी और प्रतिरक्षा प्रतिक्रिया के सेलुलर लिंक की अपर्याप्तता पर निर्भर करती है: जितना अधिक वे व्यक्त किए जाते हैं, उतनी ही पहले सीवीआईडी के रोगी मर जाते हैं। पीआईडी का यह रूप पुरुषों और महिलाओं दोनों को समान रूप से प्रभावित करता है। सभी ह्यूमर इम्युनोडेफिशिएंसी की तरह, सीवीआईडी नैदानिक रूप से आवर्तक और पुरानी निमोनिया, साइनसाइटिस, ओटिटिस मीडिया द्वारा प्रकट होता है, ब्रोन्किइक्टेसिस अक्सर बनता है, आधे मामलों में जठरांत्र संबंधी मार्ग कुअवशोषण, वजन घटाने, दस्त, हाइपोएल्ब्यूमिनमिया, विटामिन की कमी के लक्षणों से प्रभावित होता है। आंतों में पुरानी सूजन प्रक्रियाओं द्वारा विशेषता ( एंटरोवायरल संक्रमण) गांठदार लिम्फोइड हाइपरप्लासिया के विकास के साथ। लगभग एक तिहाई रोगियों में स्प्लेनोमेगाली और/या फैलाना लिम्फैडेनोपैथी है। 22% मामलों में, ऑटोइम्यून अभिव्यक्तियाँ विकसित होती हैं (हानिकारक या) हीमोलिटिक अरक्तता, थ्रोम्बोसाइटोपेनिया, न्यूट्रोपेनिया, रुमेटीइड गठिया, शिथिलता थाइरॉयड ग्रंथि) एक इम्युनोलैबोरेटरी अध्ययन से पता चलता है: 1) परिसंचारी बी-लिम्फोसाइटों की एक सामान्य या कुछ हद तक कम संख्या; 2) आईजीजी और आईजीए के सीरम स्तर में कुछ हद तक कमी - आईजीएम का स्तर; आईजीजी + आईजीए + आईजीएम की कुल एकाग्रता में कमी 3 जी / एल से कम; 3) टी-हेल्पर उप-जनसंख्या की संख्या में कमी के कारण टी-कोशिकाओं की कुल संख्या सामान्य या थोड़ी कम है; 4) इम्यूनोरेगुलेटरी इंडेक्स सीडी4+/सीडी8+ में कमी।
चयनात्मक IgA की कमी (कोकेशियान में 1:700; जापानी में 1:18,500) सीरम IgA के स्तर में 0.05 g / l और नीचे (काफी अक्सर 0) की कमी होती है, जिसमें इम्युनोग्लोबुलिन के अन्य वर्गों की सामान्य सामग्री होती है। यदि IgA सांद्रता 0.05 g/l से ऊपर है, लेकिन 0.2 g/l से कम है, तो "आंशिक (आंशिक) IgA की कमी" का निदान किया जाना चाहिए। ज्यादातर मामलों में, IgA की कमी स्पर्शोन्मुख है, हालांकि, कुछ व्यक्तियों में यह एलर्जी की अभिव्यक्तियों के साथ संयोजन में साइनोपल्मोनरी संक्रमण के रूप में प्रकट होता है ( ऐटोपिक डरमैटिटिस, हे फीवर, ब्रोन्कियल अस्थमा, एंजियोएडेमा, आदि) और ऑटोइम्यून (स्क्लेरोडर्मा, रुमेटीइड गठिया, विटिलिगो, थायरॉयडिटिस)।
बच्चों में क्षणिक हाइपोगैमाग्लोबुलिनमिया ("धीमी प्रतिरक्षाविज्ञानी शुरुआत") इम्युनोग्लोबुलिन के निम्न स्तर की विशेषता है। रोग की शुरुआत 5-6 महीने से होती है, जब बच्चा अचानक, बिना किसी स्पष्ट कारण के, गुर्दे और श्वसन पथ के बार-बार होने वाले पाइोजेनिक संक्रमण से बीमार होने लगता है। यह इस तथ्य के कारण है कि बच्चे द्वारा प्रत्यारोपित रूप से प्राप्त मातृ आईजीजी, इस उम्र तक अपचयित हो जाते हैं, और स्वयं के आईजीजी का उत्पादन, आमतौर पर चौथे महीने से शुरू होता है, देर से होता है। इम्युनोडेफिशिएंसी के इस रूप में, IgG और IgA का स्तर अक्सर कम हो जाता है, जबकि IgM का स्तर सामान्य सीमा के भीतर या यहां तक कि ऊंचा हो जाता है। बी-लिम्फोसाइट्स, लिम्फ नोड्स और टॉन्सिल नहीं बदले जाते हैं। यह क्षणिक इम्युनोडेफिशिएंसी 5-8% शिशुओं (आमतौर पर समय से पहले या इम्युनोकॉम्प्रोमाइज्ड बच्चों) में होती है और आमतौर पर 1.5-4 साल की उम्र तक उपचार के बिना हल हो जाती है।
हाइपर-आईजीई सिंड्रोम (जॉब सिंड्रोम)। "जॉब सिंड्रोम" का निदान जिल्द की सूजन की उपस्थिति में 1000 IU / ml से ऊपर कुल IgE की सीरम सांद्रता में बार-बार (कम से कम दो गुना) वृद्धि के आधार पर किया जाता है और "ठंड" के साथ बार-बार गहरे प्युलुलेंट संक्रमण होते हैं। कोर्स: त्वचा के फोड़े, चमड़े के नीचे के ऊतक, लिम्फ नोड्स, ओटिटिस मीडिया। गंभीर एपिसोड विशेष रूप से खतरनाक होते हैं तीव्र निमोनिया, एक न्यूमोसेले, यकृत फोड़े में परिणाम के साथ विनाशकारी सहित। कंकाल की विसंगतियाँ, ट्यूबलर हड्डियों के सहज फ्रैक्चर, मोटे डिसप्लास्टिक चेहरे की विशेषताएं विशेषता हैं। रोग का रोगजनक तंत्र यह है कि Th1 इंटरफेरॉन-γ का उत्पादन करने में सक्षम नहीं है। इससे Th2 गतिविधि में वृद्धि होती है, जो IgE के बढ़े हुए उत्पादन में प्रकट होती है। उत्तरार्द्ध हिस्टामाइन की रिहाई का कारण बनता है, जो एक भड़काऊ प्रतिक्रिया के विकास को रोकता है (ठंड फोड़े का गठन इसके साथ जुड़ा हुआ है)। इसके अलावा, हिस्टामाइन न्यूट्रोफिल केमोटैक्सिस को रोकता है।
क्रोनिक म्यूकोक्यूटेनियस कैंडिडिआसिस। यह त्वचा, श्लेष्मा झिल्ली, नाखून, खोपड़ी के स्पष्ट घावों की विशेषता है। रोग टी-लिम्फोसाइटों के एक अद्वितीय दोष पर आधारित है, जिसमें यह तथ्य शामिल है कि ये कोशिकाएं एक सामान्य प्रतिक्रिया विकसित करने में सक्षम नहीं हैं, विशेष रूप से, एक कारक उत्पन्न करने के लिए जो मैक्रोफेज (एमवाईएफ) के कैंडिडा अल्बिकन्स में प्रवास को रोकता है। प्रतिजन। इस प्रतिजन के लिए एचपीआरटी त्वचा परीक्षण भी नकारात्मक है। इसी समय, रोगियों में टी-लिम्फोसाइट्स की सामान्य संख्या होती है, और अन्य एंटीजन के प्रति उनकी प्रतिक्रिया खराब नहीं होती है। कैंडिडा एंटीजन के लिए हास्य प्रतिक्रिया में कोई बदलाव नहीं। सिंड्रोम को ऑटोइम्यून पॉलीग्लैंडुलर एंडोक्रिनोपैथी के साथ जोड़ा जाता है। उपचार रोगसूचक एंटिफंगल चिकित्सा है।
क्रॉनिक ग्रैनुलोमेटस डिजीज (सीजीडी)। यह फागोसाइटोसिस में एक दोष का जन्मजात रूप है। न्यूट्रोफिल में सामान्य केमोटैक्सिस, अवशोषण गतिविधि होती है, लेकिन "श्वसन फटने" का गठन बिगड़ा हुआ है। कैटालेज-पॉजिटिव सूक्ष्मजीव (स्टैफिलोकोकस ऑरियस, ई। कोलाई, क्लेबसिएला, सेराटिया मार्सेसेन्स, साल्मोनेला, एस्परगिलस कवक) लिम्फ नोड्स, यकृत, फेफड़े और जठरांत्र संबंधी मार्ग में ग्रैनुलोमा बनाते हैं। आवर्तक लिम्फैडेनाइटिस, फोड़े (यकृत, फुफ्फुसीय, पेरिरेक्टल), ऑस्टियोमाइलाइटिस, अल्सरेटिव स्टामाटाइटिस, राइनाइटिस, नेत्रश्लेष्मलाशोथ के विकास द्वारा विशेषता। बचपन में निदान सीएचबी वाले कुछ रोगी 30 वर्ष की आयु तक जीवित रहते हैं। निदान की पुष्टि एनएसटी-टेस्ट (नाइट्रोब्लू टेट्राजोलियम रिडक्शन टेस्ट) द्वारा की जाती है, जिसमें विचाराधीन पैथोलॉजी में शून्य मान हैं। उपचार: एंटीस्टाफिलोकोकल एंटीबायोटिक दवाओं के दैनिक रोगनिरोधी प्रशासन, इंटरफेरॉन-γ सप्ताह में 3 बार चमड़े के नीचे।
अवलोकनों के आधार पर, हमने चुवाशिया के पीआईडी का रजिस्टर बनाया, जिसमें 19 रोगी शामिल हैं जिनमें 7 प्रकार की प्रतिरक्षा कमी (तालिका 1) है।
तालिका एक
चुवाशिया की प्राथमिक प्रतिरक्षण क्षमता का रजिस्टर
पीआईडी के 100 से अधिक ज्ञात सत्यापित रूपों में से, हमने 7 की पहचान की है। रूस के राष्ट्रीय रजिस्टर में, पीआईडी के 19 रूपों का वर्णन किया गया है। इस तथ्य पर ध्यान आकर्षित किया जाता है कि रजिस्टर में प्रस्तुत 15 पीआईडी का निदान चिकित्सा सेवा के वयस्क नेटवर्क में रोगियों के संक्रमण के बाद ही किया गया था। रजिस्ट्री में कम उम्र के क्षणिक हाइपोगैमाग्लोबुलिनमिया वाले बच्चे शामिल नहीं हैं। यह पीआईडी के इस रूप के निदान के लिए स्पष्ट मानदंडों की कमी और 3 साल से कम उम्र के बच्चों में माध्यमिक इम्युनोडेफिशिएंसी राज्यों के साथ अंतर करने में कठिनाइयों के कारण है। इसके अलावा, रजिस्ट्री में कोई एससीआईडी नहीं हैं, जो प्रतिरक्षा प्रतिक्रिया के हास्य और सेलुलर तंत्र दोनों में दोषों के कारण जाने जाते हैं, और बहुत कम उम्र में बच्चों की मृत्यु का कारण बनते हैं। उन्हें आमतौर पर नैदानिक और रोग संबंधी तुलना द्वारा शव परीक्षा में पूर्वव्यापी रूप से निदान किया जाता है। दुर्भाग्य से, हमारे गणतंत्र में, पैथोएनाटोमिकल ब्यूरो एससीआईडी पंजीकृत नहीं करते हैं, कुछ गंभीर संक्रमणों (सेप्सिस, मेनिन्जाइटिस, आदि) के लिए प्रतिरक्षा प्रणाली में स्पष्ट दोषों के मामलों के घातक परिणामों को लिखते हैं। चयनात्मक IgA की कमी की रिपब्लिकन घटना दर भी वास्तविकता के अनुरूप नहीं है। कई लेखकों के अनुसार, पीआईडी के इस रूप की व्यापकता 1:500 है। उदाहरण के लिए, दक्षिण यूराल क्षेत्र में पीआईडी के रजिस्टर में, यह रोग घटना की आवृत्ति के मामले में पहले स्थान पर है, और चयनात्मक IgA की कमी वाले विशाल बहुमत बच्चे हैं। हमारी गणतांत्रिक रजिस्ट्री में विचाराधीन पीआईडी वाले केवल वयस्क रोगी शामिल हैं। चयनात्मक IgA की कमी की कम पता लगाने की क्षमता सबसे अधिक संभावना है कि प्रतिरक्षाविज्ञानी दोष के नैदानिक अभिव्यक्तियों की परिवर्तनशीलता से जुड़ा हुआ है, जो अक्सर बहुत हल्के होते हैं। इम्यूनोपैथोलॉजी वाले रोगियों की एक महत्वपूर्ण संख्या में श्वसन वायरल संक्रमण की आवृत्ति में वृद्धि हुई है। महत्वपूर्ण रूप से, संक्रमण की बढ़ी हुई आवृत्ति, जिसे अक्सर बचपन में नोट किया जाता है, बाद के वर्षों में काफी कम हो जाती है। चयनात्मक IgA की कमी वाले 20% से अधिक रोगी एलर्जी से पीड़ित हैं और स्व - प्रतिरक्षित रोग. कुछ रोगियों में, प्रतिरक्षाविज्ञानी दोष चिकित्सकीय रूप से प्रकट नहीं होता है। संभवतः, रिपब्लिकन रजिस्टर में चयनात्मक IgA की कमी के प्रतिनिधित्व की कम आवृत्ति विशेषज्ञों द्वारा इसकी अपर्याप्त पहचान के कारण है। चुवाशिया में एक अच्छी तरह से ज्ञात पीआईडी का एक उदाहरण सीवीआईडी है, जो चयनात्मक आईजीए की कमी के बाद व्यापकता के मामले में रूसी संघ के राष्ट्रीय रजिस्टर में दूसरे स्थान पर है। सीवीआईडी की प्रभावी पहचान का कारण इस विकृति के निदान के मानदंडों के बारे में वयस्क नेटवर्क डॉक्टरों की अच्छी जागरूकता है, जो नैदानिक समीक्षाओं और एसोसिएशन ऑफ थेरेपिस्ट्स ऑफ चुवाशिया के सम्मेलनों में रोगियों के बार-बार प्रदर्शन के कारण है।
इस प्रकार, चुवाशिया में, संयुक्त इम्युनोडेफिशिएंसी का पता लगाना, चयनात्मक IgA की कमी कम है, जो, जाहिरा तौर पर, विभिन्न विशिष्टताओं के डॉक्टरों (नैदानिक अभिव्यक्तियों से संबंधित मुद्दों, PID के निदान सहित) के बीच नैदानिक इम्यूनोलॉजी में बुनियादी ज्ञान की कमी से जुड़ा है। साथ ही डॉक्टरों द्वारा इम्यूनोलॉजिकल डायग्नोस्टिक विधियों का अपर्याप्त उपयोग।
माध्यमिक इम्युनोडेफिशिएंसी। वयस्क दल में, माध्यमिक इम्युनोडेफिशिएंसी राज्य मुख्य रूप से आम हैं। सेलुलर प्रतिरक्षा प्रतिक्रिया में अधिग्रहित दोष अधिक बार देखे जाते हैं, कम अक्सर हास्य में। इसका कारण, जाहिरा तौर पर, यह है कि टी कोशिकाएं एपोप्टोजेनिक कारकों के प्रति अधिक संवेदनशील होती हैं, बी कोशिकाओं की तुलना में उनकी झिल्ली पर व्यक्त बीसीएल प्रोनकोजीन एंटीजन द्वारा एपोप्टोटिक मृत्यु से सुरक्षित होती हैं, और एपोप्टोसिस को प्रतिरक्षा प्रणाली की कोशिका मृत्यु का मुख्य तंत्र माना जाता है। और विकास प्रतिरक्षा की कमी। कोई भी कारक जो टी-सेल एपोप्टोसिस (आयनीकरण विकिरण, तनाव, ग्लूकोकार्टिकोस्टेरॉइड्स और इथेनॉल के बढ़े हुए स्तर, संक्रमण, आदि) को प्रेरित कर सकता है, माध्यमिक टी-सेल इम्युनोडेफिशिएंसी की घटना में एक प्रेरक भूमिका निभा सकता है। हास्य प्रतिरक्षा प्रतिक्रिया की माध्यमिक अपर्याप्तता, एक नियम के रूप में, पहले से मौजूद की पृष्ठभूमि के खिलाफ विकसित होती है गंभीर रोग. अनुकूली प्रतिरक्षा के हास्य तंत्र की अधिग्रहित अपर्याप्तता का कारण बनने वाली मुख्य स्थितियां इस प्रकार हैं:
1) मैलाबॉस्पशन सिंड्रोम से जुड़ी प्रोटीन की कमी, पुरानी अग्नाशयशोथ, सीलिएक एंटरोपैथी, बर्न डिजीज ("निर्माण सामग्री" - अमीनो एसिड की कमी के कारण इम्युनोग्लोबुलिन अणुओं का संश्लेषण बिगड़ा हुआ है);
2) इम्युनोग्लोबुलिन और इम्युनोकोम्पेटेंट कोशिकाओं के नुकसान की ओर ले जाने वाली स्थितियां - गुर्दे का रोग(ग्लोमेरुलोनेफ्राइटिस के साथ, ग्लोमेरुलर फिल्टर न केवल कम आणविक भार प्रोटीन के लिए, बल्कि उच्च आणविक भार वाले - ग्लोब्युलिन, इम्युनोग्लोबुलिन सहित), रक्तस्राव, लिम्फोरिया, जलन के लिए पारित किया जाता है;
3) मल्टीपल मायलोमा (मायलोमा - बी-लिम्फोसाइटों का एक असामान्य क्लोन जिसने अनियंत्रित वृद्धि के गुणों को हासिल कर लिया है, एक वर्ग, एक विशिष्टता के इम्युनोग्लोबुलिन का उत्पादन करता है, बढ़ता हुआ मायलोमा अस्थि मज्जा में बी-लिम्फोसाइटों के सामान्य क्लोनों की जगह लेता है, अन्य के इम्युनोग्लोबुलिन का उत्पादन करता है। , लगभग 108, विभिन्न विशिष्टताएं, विकास के साथ IgA मायलोमा IgG और IgM के स्तर को कम करता है, IgG myeloma IgA और IgM में कमी के साथ होता है, और IgD मायलोमा और प्रकाश श्रृंखला रोग में, इम्युनोग्लोबुलिन के तीन मुख्य वर्ग कम हो जाते हैं);
4) स्प्लेनेक्टोमी सिंड्रोम (जब प्लीहा को हटा दिया जाता है, तो सेलुलर प्रतिरक्षा प्रतिक्रिया कुछ हद तक प्रभावित होती है, लेकिन ह्यूमरल लिंक काफी बाधित होता है, क्योंकि प्लीहा मुख्य रूप से एंटीबॉडी उत्पादन का एक अंग है)।
इन स्थितियों में, एंटीबॉडी की सामग्री में हाइपो-, एगैमाग्लोबुलिनमिया के स्तर में कमी हो सकती है। जन्मजात रूपों के विपरीत, प्रतिरक्षा प्रतिक्रिया के हास्य तंत्र में एक माध्यमिक दोष के साथ, इम्युनोग्लोबुलिन का स्तर अंतर्निहित प्रक्रिया के पाठ्यक्रम और गंभीरता के आधार पर भिन्न होता है, उनकी सामग्री सामान्य हो सकती है (इम्यूनोग्लोबुलिन प्रतिस्थापन चिकित्सा के बिना) की छूट की अवधि के दौरान अंतर्निहित रोग।
डब्ल्यूएचओ विशेषज्ञों के डेटा द्वारा निर्देशित, सेलुलर प्रतिरक्षा प्रतिक्रिया की माध्यमिक अपर्याप्तता के एटियोपैथोजेनिक कारकों के रूप में, निम्नलिखित का उल्लेख किया जाना चाहिए:
1) भौतिक और रासायनिक कारकों का प्रभाव:
- भौतिक (आयनीकरण विकिरण, माइक्रोवेव, शुष्क जलवायु क्षेत्रों में उच्च या निम्न वायु तापमान, आदि);
- रासायनिक (इम्यूनोसप्रेसर्स, कीमोथेरेपी, कॉर्टिकोस्टेरॉइड्स, ड्रग्स, शाकनाशी, कीटनाशक, भारी धातु लवण के साथ मानव निर्मित पर्यावरण प्रदूषण);
2) किसी व्यक्ति के जीवन का आधुनिक तरीका (शारीरिक निष्क्रियता, "सूचना" रोग के विकास के साथ सूचना की अधिकता);
3) कुपोषण (दैनिक पानी और भोजन राशन में आवश्यक सूक्ष्म पोषक तत्वों की कमी - जस्ता, तांबा, लोहा, विटामिन - रेटिनॉल, एस्कॉर्बिक एसिड, अल्फा-टोकोफेरोल, फोलिक एसिड; प्रोटीन-ऊर्जा कुपोषण, कुपोषण, कैशेक्सिया, चयापचय संबंधी विकार, मोटापा);
3) वायरल संक्रमण:
- तीव्र - खसरा, रूबेला, कण्ठमाला, चिकनपॉक्स, इन्फ्लूएंजा, हेपेटाइटिस, दाद, आदि;
- लगातार - क्रोनिक हेपेटाइटिस बी, सबस्यूट स्क्लेरोजिंग पैनेंसेफलाइटिस, एड्स, आदि;
- जन्मजात - साइटोमेगाली, रूबेला (टॉर्च-कॉम्प्लेक्स);
4) प्रोटोजोअल आक्रमण और कृमिनाशक (मलेरिया, टोक्सोप्लाज़मोसिज़, लीशमैनियासिस, ट्राइकिनोसिस, एस्कारियासिस, आदि);
5) जीवाणु संक्रमण (स्टैफिलोकोकल, न्यूमोकोकल, मेनिंगोकोकल, तपेदिक, आदि);
6) घातक संरचनाएं, विशेष रूप से लिम्फोप्रोलिफेरेटिव वाले;
7) ऑटोइम्यून रोग;
- प्रतिरक्षात्मक कोशिकाओं (रक्तस्राव, लिम्फोरिया) के नुकसान की ओर ले जाने वाली स्थितियां;
- बहिर्जात और अंतर्जात नशा(विषाक्तता, थायरोटॉक्सिकोसिस, विघटित) मधुमेह);
- न्यूरोहोर्मोनल विनियमन का उल्लंघन (तनाव प्रभाव - गंभीर आघात, संचालन, शारीरिक, खेल सहित, अधिभार, मानसिक आघात);
- प्राकृतिक इम्युनोडेफिशिएंसी - प्रारंभिक बचपन, जेरोन्टोलॉजिकल उम्र, गर्भवती महिलाएं (गर्भावस्था की पहली छमाही)।
माध्यमिक इम्युनोडेफिशिएंसी हैं तीखा(एक तीव्र संक्रामक रोग, आघात, नशा, तनाव, आदि के कारण) और दीर्घकालिक(पुरानी प्युलुलेंट-इंफ्लेमेटरी बीमारियों, ट्यूमर, क्रोनिक स्ट्रेस, इम्यूनोसप्रेसिव थेरेपी की पृष्ठभूमि के खिलाफ विकास, प्रतिकूल पारिस्थितिक और भू-रासायनिक स्थितियों वाले क्षेत्रों में रहना, आदि)। तीव्र इम्युनोडेफिशिएंसी का निदान इम्युनोग्राम मापदंडों में असामान्यताओं की पहचान के आधार पर किया जाता है - टी-लिम्फोसाइट्स (सीडी3+), टी-हेल्पर्स (सीडी4+) की संख्या में कमी, और इम्यूनोरेगुलेटरी इंडेक्स (सीडी4+/सीडी8+) में कमी। वे, एक नियम के रूप में, क्षणिक हैं और धीरे-धीरे एक अनुकूल पाठ्यक्रम और अंतर्निहित बीमारी के पर्याप्त एटियोपैथोजेनेटिक उपचार के साथ प्रसिद्ध, तथाकथित सामान्य मजबूत करने वाली दवाओं और एजेंटों (विटामिन, अनुकूलन, फिजियोथेरेप्यूटिक प्रक्रियाएं, आदि) के साथ बंद हो जाते हैं। , साथ ही ऊर्जा-चयापचय चिकित्सा (वोबेंज़िम, कोएंजाइम Q10)। क्रोनिक इम्युनोडेफिशिएंसी तीन प्रकारों में हो सकती है: 1) नैदानिक और प्रयोगशाला संकेतों के साथ, 2) प्रयोगशाला असामान्यताओं की अनुपस्थिति में नैदानिक संकेतों के साथ, 3) एक महत्वपूर्ण कारक के साथ (उदाहरण के लिए, पर्यावरणीय रूप से प्रतिकूल परिस्थितियों में रहना), नैदानिक की अनुपस्थिति अभिव्यक्तियाँ और प्रतिरक्षाविज्ञानी विकारों की उपस्थिति। पहला प्रकार अधिक सामान्य है। दूसरे प्रकार में, जब इम्युनोडेफिशिएंसी केवल नैदानिक रूप से प्रकट होती है, लेकिन एक विशिष्ट इम्युनोग्राम में कोई परिवर्तन नहीं पाया जाता है, तो अधिक सूक्ष्म स्तर पर प्रतिरक्षा प्रणाली के कामकाज का उल्लंघन, जो नियमित परीक्षा के दौरान नहीं पाया जाता है, से इंकार नहीं किया जाता है। औपचारिक रूप से सामान्य मानप्रतिरक्षा स्थिति के संकेतक, जो प्रतिरक्षा प्रणाली की व्यक्तिगत प्रतिक्रिया का प्रतिबिंब हैं, किसी दिए गए व्यक्ति के लिए "पैथोलॉजिकल" हो सकते हैं, जो शरीर के प्रतिरोध का पर्याप्त उच्च स्तर प्रदान करने में असमर्थ हैं। तीसरा प्रकार, जो खुद को केवल इम्युनोडेफिशिएंसी के इम्युनोलैबोरेटरी संकेतों के रूप में प्रकट करता है, संक्षेप में, एक पूर्व-बीमारी है, माध्यमिक इम्युनोडेफिशिएंसी से जुड़े रोगों के लिए एक जोखिम कारक - संक्रामक, ऑटोइम्यून, ऑन्कोलॉजिकल, आदि। अक्सर तीसरे प्रकार की इम्युनोडेफिशिएंसी सिंड्रोम के लक्षणों के साथ होती है अत्यंत थकावट.
क्रोनिक थकान और प्रतिरक्षा रोग सिंड्रोम (सीएफएस)। 1984 में ए. लॉयड और सह-लेखकों द्वारा पहली बार वर्णित और रोगी द्वारा अनुभव की जाने वाली पुरानी थकान के रूप में वर्णित है, जो आराम के बाद गायब नहीं होती है और समय के साथ मानसिक और शारीरिक दोनों तरह के प्रदर्शन में उल्लेखनीय कमी आती है। सीएफएस के रोगियों में प्रतिरक्षा प्रणाली के एक स्पष्ट असंतुलन की खोज रोग के नाम को पुरानी थकान और प्रतिरक्षा रोग के सिंड्रोम में बदलने का आधार थी। सीएफएस मुख्य रूप से पारिस्थितिक रूप से प्रतिकूल क्षेत्रों में पंजीकृत है जहां उच्च स्तर का पर्यावरण प्रदूषण रासायनिक रूप से हानिकारक पदार्थों के साथ या विकिरण के बढ़े हुए स्तर के साथ है। ये कारक प्रतिरक्षा प्रणाली (मुख्य रूप से, अनुकूली प्रतिरक्षा के सेलुलर तंत्र) की स्थिति को नकारात्मक रूप से प्रभावित करते हैं, जो स्पष्ट रूप से केंद्रीय तंत्रिका तंत्र को नुकसान और गुप्त वायरस (दाद वायरस, एपस्टीन-बार वायरस) की सक्रियता के साथ गुप्त वायरस की दृढ़ता का समर्थन करता है। ) सीएफएस की नैदानिक अभिव्यक्तियों की शुरुआत, एक नियम के रूप में, ठंड से जुड़ी होती है, कम अक्सर भावनात्मक तनाव के साथ। सीएफएस के लक्षणों में गंभीर थकान, मांसपेशियों की कमजोरी जो रात की नींद के बाद दूर नहीं होती है, सोने में कठिनाई, बुरे सपने के साथ सतही नींद और समय-समय पर अवसाद की स्थिति होती है। सीएफएस के रोगियों के लिए, विशेष रूप से युवा लोगों के लिए, श्वसन वायरल संक्रमण के प्रति संवेदनशीलता विशिष्ट है। मरीजों को दर्द और गले में खराश (गैर-एक्सयूडेटिव ग्रसनीशोथ) की शिकायत होती है। कुछ रोगियों में, वजन कम होना, त्वचा का पीलापन, कम होना नोट किया जाता है। कई शोधकर्ताओं के अनुसार, सीएफएस के पैथोफिजियोलॉजिकल आधार में प्रतिरक्षा संबंधी विकार निहित हैं। दरअसल, अधिकांश रोगियों में, टी कोशिकाओं की संख्या में कमी, उनकी प्रोलिफेरेटिव गतिविधि में कमी, एनके कोशिकाओं के कार्य में कमी और डिस्म्यूनोग्लोबुलिनमिया पाए जाते हैं। जटिल उपचारसीएफएस के रोगियों में इम्युनोग्राम के नियंत्रण में ट्राइसाइक्लिक एंटीडिप्रेसेंट्स, नॉन-स्टेरायडल एंटी-इंफ्लेमेटरी ड्रग्स, इम्युनोमोड्यूलेटर और एडाप्टोजेन्स की नियुक्ति शामिल है।
इम्युनोडेफिशिएंसी राज्यों के सुधार के सिद्धांत। हास्य अपर्याप्तता के सुधार में प्रतिस्थापन इम्यूनोथेरेपी और एंटीबॉडी उत्पादन उत्तेजक की नियुक्ति शामिल है। रिप्लेसमेंट इम्यूनोथेरेपी का संकेत तब दिया जाता है जब इम्युनोग्लोबुलिन की कुल सांद्रता 5 ग्राम / लीटर से कम हो। इम्युनोग्लोबुलिन की तैयारी (सैंडोग्लोबुलिन, ऑक्टागम, इंट्राग्लोबिन या अंतःशिरा प्रशासन के लिए सामान्य मानव इम्युनोग्लोबुलिन) को सप्ताह में 2 बार 0.1-0.2 ग्राम / किग्रा की खुराक पर 1.2 ग्राम / किग्रा तक की मासिक खुराक पर प्रशासित किया जाता है। सीवीआईडी प्रकार के एग्माग्लोबुलिनमिया के लिए एंटीबॉडी उत्पादन के उत्तेजक संकेत दिए गए हैं: मायलोपिड 3 मिलीग्राम (0.3% घोल 1 मिली) इंट्रामस्क्युलर रूप से हर दूसरे दिन 6-8 इंजेक्शन, सोडियम न्यूक्लिनेट - 0.2 ग्राम दिन में 3 बार मौखिक रूप से 21 दिनों के लिए या डेरिनैट 1.5% समाधान 2-3 दिनों के अंतराल पर 5 मिली 8-10 इंट्रामस्क्युलर इंजेक्शन।
फागोसाइटिक लिंक को नुकसान के मामले में, निम्नलिखित का उपयोग किया जाता है: पॉलीऑक्सिडोनियम 0.006-0.012 ग्राम वयस्कों के लिए हर दूसरे दिन, पहले 5 इंजेक्शन, फिर 2-3 दिनों के अंतराल पर, 7-10 इंट्रामस्क्युलर इंजेक्शन के लिए; 10 दिनों के लिए जीभ के नीचे प्रति दिन 1 टैबलेट 1 बार (वयस्कों के लिए टैबलेट - 0.01 ग्राम प्रत्येक); डेरिनैट 0.25% घोल - 10 दिनों के लिए दिन में 3-4 बार नाक में 2 बूँदें।
अनुकूली प्रतिरक्षा के सेलुलर लिंक में दोषों के मामले में, निम्नलिखित का उपयोग किया जाता है: 1) थाइमिक मूल की दवाएं (थायमालिन 0.010-0.020 ग्राम / मी रात में 7-10 इंजेक्शन; थाइमोजेन 0.01% -1 मिली / मी दैनिक - 3- 10 इंजेक्शन; इम्यूनोफैन 0.005% - 1.0 मिली s / c या / m 5-7 इंजेक्शन हर दूसरे दिन या 2-3 दिन, 8-10 इंजेक्शन के कोर्स के लिए); 2) इंटरफेरॉन की तैयारी (मानव ल्यूकोसाइट इंटरफेरॉन 1,000,000 आईयू इंट्रामस्क्युलर रूप से सप्ताह में 2 बार 6 महीने तक; रीफेरॉन 3,000,000-5,000,000 आईयू इंट्रामस्क्युलर रूप से सप्ताह में 2 बार 4 सप्ताह से 6 महीने तक); 3) आईएल -2 का पुनः संयोजक एनालॉग - रोनकोल्यूकिन 500,000-1,000,000 आईयू ड्रिप या एस / सी द्वारा 48-72 घंटे 3-5-10 इंजेक्शन के अंतराल के साथ; 4) अंतर्जात इंटरफेरोजेनेसिस के उत्तेजक (एमिक्सिन 0.125 ग्राम - भोजन के बाद पहले दिन 2 गोलियां, फिर हर दूसरे दिन 1 टैबलेट; साइक्लोफेरॉन - गोलियां 0.15 ग्राम और इंजेक्शन समाधान 12.5% - 2 मिली, के लिए मूल योजना के अनुसार निर्धारित) 1, 2, 4, 6, 8, 11, 14, 17, 20, 23, 26, 29 दिन)।
ग्रंथ सूची
- कोवलचुक एल.वी., चेरेडीव ए.एन.एपोप्टोटिक इम्युनोडेफिशिएंसी // समकालीन मुद्दोंएलर्जी, क्लिनिकल इम्यूनोलॉजी और इम्यूनोफार्माकोलॉजी: कार्यवाही। रिपोर्ट good दूसरा राष्ट्रीय कांग्रेस राकी। एम।, 1998। एस। 615-619।
- रेजनिक आई.बी.प्राथमिक इम्युनोडेफिशिएंसी के मुद्दे की वर्तमान स्थिति // बाल रोग। 1996. नंबर 2. पीपी. 4-14.
- यार्तसेव एम.एन., याकोवलेवा के.पी.रूसी संघ के स्वास्थ्य मंत्रालय के इम्यूनोलॉजी संस्थान के प्राथमिक इम्युनोडेफिशिएंसी राज्यों का रजिस्टर // इम्यूनोलॉजी। 2005. नंबर 3. पीपी. 23-27.
- ब्रूटन ओ.सी.एगामाग्लोबुलिनमिया // बाल रोग। 1952 वॉल्यूम। 9. पी। 722-726।
- कनिंघम-रंडल्स सी.सामान्य चर इम्युनोडेफिशिएंसी // जे। क्लिन के साथ 103 रोगियों का नैदानिक और प्रतिरक्षाविज्ञानी विश्लेषण। इम्यूनोल। 1989 वॉल्यूम। 9. पी। 22-33।
- लॉयड ए.आर. और अन्य।क्रोनिक थकान सिंड्रोम में इम्यूनोलॉजिकल असामान्यताएं // मेड। जे ऑस्ट। 1989 वॉल्यूम। 151. पी। 122-124।
- मैटामोरोस एफ.एन. और अन्य. स्पेन में प्राथमिक इम्युनोडेफिशिएंसी सिंड्रोम: बच्चों और वयस्कों में राष्ट्रीय रजिस्ट्री की पहली रिपोर्ट // जे। क्लिन। इम्यूनोल। 1997 वॉल्यूम। 17. पी. 333-339।
विभिन्न प्रकृति के रोगजनकों के लिए प्रतिरक्षा प्रतिक्रिया के कमजोर होने के कारण, इम्यूनोडेफिशियेंसी मानव शरीर के सुरक्षात्मक कार्यों का उल्लंघन है। विज्ञान ने ऐसे राज्यों की एक पूरी श्रृंखला का वर्णन किया है। रोगों के इस समूह को संक्रामक रोगों के पाठ्यक्रम में वृद्धि और वृद्धि की विशेषता है। इस मामले में प्रतिरक्षा के काम में विफलताएं इसके व्यक्तिगत घटकों की मात्रात्मक या गुणात्मक विशेषताओं में बदलाव से जुड़ी हैं।
प्रतिरक्षा के गुण
प्रतिरक्षा प्रणाली शरीर के सामान्य कामकाज में एक महत्वपूर्ण भूमिका निभाती है, क्योंकि इसे एंटीजन का पता लगाने और नष्ट करने के लिए डिज़ाइन किया गया है जो बाहरी वातावरण (संक्रामक) से प्रवेश कर सकते हैं और स्वयं की कोशिकाओं (अंतर्जात) के ट्यूमर के विकास का परिणाम हो सकते हैं। सुरक्षात्मक कार्य मुख्य रूप से फैगोसाइटोसिस और पूरक प्रणाली जैसे जन्मजात कारकों द्वारा प्रदान किया जाता है। एक्वायर्ड और सेल्युलर शरीर की अनुकूली प्रतिक्रिया के लिए जिम्मेदार होते हैं। पूरे सिस्टम का संचार विशेष पदार्थों - साइटोकिन्स के माध्यम से होता है।
घटना के कारण के आधार पर, प्रतिरक्षा विकारों की स्थिति को प्राथमिक और माध्यमिक इम्युनोडेफिशिएंसी में विभाजित किया जाता है।
प्राथमिक इम्युनोडेफिशिएंसी क्या है
प्राथमिक इम्युनोडेफिशिएंसी (पीआईडी) आनुवंशिक दोषों के कारण होने वाली प्रतिरक्षा प्रतिक्रिया के विकार हैं। ज्यादातर मामलों में, वे विरासत में मिले हैं और जन्मजात विकृति हैं। पीआईडी का अक्सर कम उम्र में पता चल जाता है, लेकिन कभी-कभी किशोरावस्था या यहां तक कि वयस्कता तक उनका निदान नहीं किया जाता है।
पीआईडी विभिन्न नैदानिक अभिव्यक्तियों के साथ जन्मजात रोगों का एक समूह है। अंतर्राष्ट्रीय वर्गीकरणरोगों में 36 वर्णित और पर्याप्त रूप से अध्ययन किए गए प्राथमिक इम्युनोडेफिशिएंसी राज्य शामिल हैं, हालांकि, चिकित्सा साहित्य के अनुसार, उनमें से लगभग 80 हैं। तथ्य यह है कि सभी बीमारियों के लिए जिम्मेदार जीन की पहचान नहीं की गई है।
केवल एक्स गुणसूत्र की जीन संरचना कम से कम छह अलग-अलग इम्युनोडेफिशिएंसी की विशेषता है, और इसलिए घटना की आवृत्ति इसी तरह के रोगलड़के लड़कियों की तुलना में अधिक परिमाण का एक क्रम हैं। एक धारणा है कि अंतर्गर्भाशयी संक्रमण का जन्मजात इम्युनोडेफिशिएंसी के विकास पर एक एटियलॉजिकल प्रभाव हो सकता है, लेकिन इस कथन की अभी तक वैज्ञानिक रूप से पुष्टि नहीं हुई है।

नैदानिक तस्वीर
प्राथमिक इम्युनोडेफिशिएंसी की नैदानिक अभिव्यक्तियाँ इन स्थितियों की तरह ही विविध हैं, लेकिन एक सामान्य विशेषता है - एक हाइपरट्रॉफाइड संक्रामक (बैक्टीरियल) सिंड्रोम।
प्राथमिक इम्युनोडेफिशिएंसी, साथ ही माध्यमिक वाले, संक्रामक एटियलजि के लगातार आवर्तक (आवर्तक) रोगों के रोगियों की प्रवृत्ति से प्रकट होते हैं, जो एटिपिकल रोगजनकों के कारण हो सकते हैं।
ये रोग सबसे अधिक बार किसी व्यक्ति के ब्रोन्कोपल्मोनरी सिस्टम और ईएनटी अंगों को प्रभावित करते हैं। श्लेष्मा झिल्ली और त्वचा भी अक्सर प्रभावित होती है, जो फोड़े और सेप्सिस के रूप में प्रकट हो सकती है। जीवाणु रोगजनक ब्रोंकाइटिस और साइनसिसिस का कारण बनते हैं। प्रतिरक्षाविहीन लोगों को अक्सर जल्दी गंजापन और एक्जिमा, और कभी-कभी एलर्जी का अनुभव होता है। ऑटोइम्यून विकार और घातक नवोप्लाज्म की प्रवृत्ति भी असामान्य नहीं है। बच्चों में प्रतिरक्षा की कमी लगभग हमेशा मानसिक और शारीरिक विकास में देरी का कारण बनती है।
प्राथमिक इम्युनोडेफिशिएंसी के विकास का तंत्र
इम्यूनोडिफ़िशिएंसी राज्यों के अध्ययन के मामले में उनके विकास के तंत्र के अनुसार रोगों का वर्गीकरण सबसे अधिक जानकारीपूर्ण है।

डॉक्टर प्रतिरक्षा प्रकृति के सभी रोगों को 4 मुख्य समूहों में विभाजित करते हैं:
ह्यूमरल या बी-सेल, जिसमें ब्रूटन सिंड्रोम (एक्स क्रोमोसोम के साथ एगम्माग्लोबुलिनमिया), आईजीए या आईजीजी की कमी, सामान्य इम्युनोग्लोबुलिन की कमी में अतिरिक्त आईजीएम, साधारण चर इम्युनोडेफिशिएंसी, नवजात शिशुओं के क्षणिक हाइपोगैमाग्लोबुलिनमिया और कई अन्य रोग शामिल हैं।
टी-सेल प्राथमिक इम्युनोडेफिशिएंसी, जिन्हें अक्सर संयुक्त कहा जाता है, क्योंकि पहले विकार हमेशा ह्यूमर इम्युनिटी को बाधित करते हैं, जैसे कि हाइपोप्लासिया (डि जॉर्ज सिंड्रोम) या थाइमस के डिसप्लेसिया (टी-लिम्फोपेनिया)।
फागोसाइटोसिस में दोषों के कारण होने वाली इम्युनोडेफिशिएंसी।
रोग के कारण प्रतिरक्षण की कमी
संक्रमण के लिए संवेदनशीलता
चूंकि इम्युनोडेफिशिएंसी का कारण विभिन्न लिंक का उल्लंघन हो सकता है
प्रतिरक्षा प्रणाली, तो संक्रामक एजेंटों की संवेदनशीलता प्रत्येक विशिष्ट मामले के लिए समान नहीं होगी। इसलिए, उदाहरण के लिए, हास्य रोगों के मामले में, रोगी को स्ट्रेप्टोकोकी, स्टेफिलोकोसी के कारण होने वाले संक्रमण का खतरा होता है, जबकि ये सूक्ष्मजीव अक्सर प्रतिरोध दिखाते हैं जीवाणुरोधी दवाएं. इम्युनोडेफिशिएंसी के संयुक्त रूपों में, बैक्टीरिया को वायरस से जोड़ा जा सकता है, जैसे कि दाद या कवक, जो मुख्य रूप से कैंडिडिआसिस द्वारा दर्शाए जाते हैं। फागोसाइटिक रूप मुख्य रूप से एक ही स्टेफिलोकोसी और ग्राम-नकारात्मक बैक्टीरिया द्वारा विशेषता है।

प्राथमिक इम्युनोडेफिशिएंसी की व्यापकता
वंशानुगत इम्युनोडेफिशिएंसी काफी दुर्लभ मानव रोग हैं। प्रत्येक विशिष्ट बीमारी के लिए इस प्रकार के प्रतिरक्षा विकारों की घटना की आवृत्ति का आकलन किया जाना चाहिए, क्योंकि उनकी व्यापकता समान नहीं है।
औसतन, पचास हजार में से केवल एक नवजात शिशु जन्मजात वंशानुगत प्रतिरक्षाविहीनता से पीड़ित होगा। इस समूह में सबसे आम बीमारी चयनात्मक IgA की कमी है। इस प्रकार की जन्मजात इम्युनोडेफिशिएंसी औसतन एक हजार नवजात शिशुओं में से एक में होती है। इसके अलावा, IgA की कमी के सभी मामलों में से 70% इस घटक की पूर्ण अपर्याप्तता से संबंधित हैं। साथ ही, प्रतिरक्षा प्रकृति के कुछ दुर्लभ मानव रोग, जो विरासत में मिले हैं, 1:1,000,000 के अनुपात में वितरित किए जा सकते हैं।
यदि हम तंत्र के आधार पर पीआईडी-बीमारियों के घटित होने की आवृत्ति पर विचार करें, तो एक बहुत ही रोचक तस्वीर उभरती है। बी-सेल प्राथमिक इम्युनोडेफिशिएंसी, या, जैसा कि उन्हें आमतौर पर एंटीबॉडी गठन विकार भी कहा जाता है, दूसरों की तुलना में अधिक सामान्य हैं और सभी मामलों में 50-60% के लिए जिम्मेदार हैं। इसी समय, प्रत्येक 10-30% रोगियों में टी-सेल और फागोसाइटिक रूपों का निदान किया जाता है। पूरक दोषों के कारण प्रतिरक्षा प्रणाली के सबसे दुर्लभ रोग हैं - 1-6%।
यह भी ध्यान दिया जाना चाहिए कि पीआईडी की घटनाओं पर डेटा अलग-अलग देशों में बहुत भिन्न होता है, जो कि एक विशेष राष्ट्रीय समूह के कुछ डीएनए उत्परिवर्तन के लिए आनुवंशिक प्रवृत्ति के कारण हो सकता है।
इम्युनोडेफिशिएंसी का निदान
बच्चों में प्राथमिक इम्युनोडेफिशिएंसी अक्सर असामयिक रूप से निर्धारित की जाती है,
इस तथ्य के साथ कि स्थानीय बाल रोग विशेषज्ञ के स्तर पर ऐसा निदान करना काफी कठिन है।

यह आमतौर पर उपचार की देरी से शुरू होने और चिकित्सा के खराब पूर्वानुमान की ओर जाता है। यदि चिकित्सक, रोग की नैदानिक तस्वीर और सामान्य परीक्षणों के परिणामों के आधार पर, एक प्रतिरक्षाविहीनता की स्थिति का सुझाव देता है, तो उसे सबसे पहले बच्चे को प्रतिरक्षाविज्ञानी के परामर्श के लिए रेफर करना चाहिए।
यूरोप में, इम्यूनोलॉजिस्ट का एक संघ है, जो इस तरह की बीमारियों के इलाज के तरीकों के अध्ययन और विकास से संबंधित है, जिसे ईओआई (यूरोपियन सोसाइटी फॉर इम्यूनोडेफिशिएंसी) कहा जाता है। उन्होंने पीआईडी रोगों के डेटाबेस को बनाया और लगातार अद्यतन किया है और काफी त्वरित निदान के लिए नैदानिक एल्गोरिथम को मंजूरी दी है।
निदान रोग के इतिहास के संग्रह के साथ शुरू होता है। वंशावली पहलू पर विशेष ध्यान दिया जाना चाहिए, क्योंकि अधिकांश जन्मजात प्रतिरक्षाविहीनता वंशानुगत होती है। इसके अलावा, एक शारीरिक परीक्षण करने और सामान्य नैदानिक अध्ययनों से डेटा प्राप्त करने के बाद, एक प्रारंभिक निदान किया जाता है। भविष्य में, डॉक्टर की धारणा की पुष्टि या खंडन करने के लिए, रोगी को एक आनुवंशिकीविद् और प्रतिरक्षाविज्ञानी जैसे विशेषज्ञों द्वारा पूरी तरह से जांच से गुजरना होगा। उपरोक्त सभी जोड़तोड़ करने के बाद ही हम अंतिम निदान करने के बारे में बात कर सकते हैं।
प्रयोगशाला अनुसंधान

यदि निदान के दौरान प्राथमिक इम्युनोडेफिशिएंसी सिंड्रोम का संदेह है, तो निम्नलिखित प्रयोगशाला परीक्षण किए जाने चाहिए:
एक विस्तृत रक्त सूत्र की स्थापना (लिम्फोसाइटों की संख्या पर विशेष ध्यान दिया जाता है);
रक्त सीरम में इम्युनोग्लोबुलिन की सामग्री का निर्धारण;
बी- और टी-लिम्फोसाइटों की मात्रात्मक गणना।
अतिरिक्त शोध
ऊपर वर्णित प्रयोगशाला निदान परीक्षणों के अतिरिक्त, प्रत्येक विशिष्ट मामले में व्यक्तिगत अतिरिक्त परीक्षण निर्धारित किए जाएंगे। ऐसे जोखिम समूह हैं जिन्हें एचआईवी संक्रमण या आनुवंशिक असामान्यताओं के लिए परीक्षण करने की आवश्यकता है। डॉक्टर इस संभावना का भी अनुमान लगाता है कि 3 या 4 प्रकार की मानव इम्युनोडेफिशिएंसी है, जिसमें वह टेट्राज़ोलिन नीले रंग के संकेतक के साथ एक परीक्षण स्थापित करके और पूरक के घटक संरचना की जांच करके रोगी के फागोसाइटोसिस के विस्तृत अध्ययन पर जोर देगा। व्यवस्था।
पीआईडी के लिए उपचार
जाहिर है, आवश्यक चिकित्सा मुख्य रूप से प्रतिरक्षा रोग पर ही निर्भर करेगी, लेकिन, दुर्भाग्य से, जन्मजात रूप को पूरी तरह से समाप्त नहीं किया जा सकता है, जिसे अधिग्रहित इम्युनोडेफिशिएंसी के बारे में नहीं कहा जा सकता है। आधुनिक चिकित्सा विकास के आधार पर, वैज्ञानिक जीन स्तर पर कारण को खत्म करने का एक तरीका खोजने की कोशिश कर रहे हैं। जब तक उनके प्रयास सफल नहीं हो जाते, तब तक यह कहा जा सकता है कि इम्युनोडेफिशिएंसी एक लाइलाज स्थिति है। लागू चिकित्सा के सिद्धांतों पर विचार करें।

रिप्लेसमेंट थेरेपी
इम्यूनोडिफीसिअन्सी का उपचार आमतौर पर प्रतिस्थापन चिकित्सा के लिए कम किया जाता है। जैसा कि पहले उल्लेख किया गया है, रोगी का शरीर स्वतंत्र रूप से प्रतिरक्षा प्रणाली के कुछ घटकों का उत्पादन करने में सक्षम नहीं है, या उनकी गुणवत्ता आवश्यकता से काफी कम है। इस मामले में थेरेपी एंटीबॉडी या इम्युनोग्लोबुलिन के दवा प्रशासन में शामिल होगी, जिसका प्राकृतिक उत्पादन बिगड़ा हुआ है। अक्सर, दवाओं को अंतःशिरा रूप से प्रशासित किया जाता है, लेकिन कभी-कभी रोगी के लिए जीवन को आसान बनाने के लिए चमड़े के नीचे का मार्ग भी संभव होता है, जिसे इस मामले में एक बार फिर चिकित्सा सुविधा का दौरा नहीं करना पड़ता है।
प्रतिस्थापन का सिद्धांत अक्सर रोगियों को लगभग सामान्य जीवन जीने की अनुमति देता है: अध्ययन, काम और आराम। बेशक, रोग, हास्य और सेलुलर कारकों से कमजोर प्रतिरक्षा, और महंगी दवाओं को प्रशासित करने की निरंतर आवश्यकता रोगी को पूरी तरह से आराम करने की अनुमति नहीं देगी, लेकिन यह अभी भी एक दबाव कक्ष में जीवन से बेहतर है।
और रोकथाम
यह देखते हुए कि प्राथमिक इम्युनोडेफिशिएंसी समूह की बीमारी वाले रोगी के लिए स्वस्थ व्यक्ति के लिए महत्वहीन कोई भी जीवाणु या वायरल संक्रमण घातक हो सकता है, रोकथाम को सक्षम रूप से करना आवश्यक है। यह वह जगह है जहां जीवाणुरोधी, एंटिफंगल और एंटीवायरल दवाएं खेल में आती हैं। दवाओं. निवारक उपायों के लिए विशेष रूप से किया जाना चाहिए, क्योंकि एक कमजोर प्रतिरक्षा प्रणाली उच्च गुणवत्ता वाले उपचार की अनुमति नहीं दे सकती है।
इसके अलावा, यह याद रखना चाहिए कि ऐसे रोगियों को एलर्जी, ऑटोइम्यून और इससे भी बदतर, ट्यूमर की स्थिति का खतरा होता है। पूर्ण चिकित्सा पर्यवेक्षण के बिना यह सब किसी व्यक्ति को पूर्ण जीवन शैली का नेतृत्व करने की अनुमति नहीं दे सकता है।
ट्रांसप्लांटेशन
जब विशेषज्ञ तय करते हैं कि रोगी के पास करने के अलावा कोई विकल्प नहीं है शल्य चिकित्सा संबंधी व्यवधानअस्थि मज्जा प्रत्यारोपण किया जा सकता है। यह कार्यविधिरोगी के जीवन और स्वास्थ्य के लिए कई जोखिमों से जुड़ा है और व्यवहार में, सफल परिणाम के मामले में भी, यह हमेशा एक प्रतिरक्षा विकार से पीड़ित व्यक्ति की सभी समस्याओं का समाधान नहीं कर सकता है। इस तरह के एक ऑपरेशन के दौरान, पूरे प्राप्तकर्ता को दाता द्वारा प्रदान किए गए उसी से बदल दिया जाता है।
प्राथमिक इम्युनोडेफिशिएंसी आधुनिक चिकित्सा की सबसे कठिन समस्या है, जो दुर्भाग्य से, अभी तक पूरी तरह से हल नहीं हुई है। इस तरह की बीमारियों के लिए एक प्रतिकूल पूर्वानुमान अभी भी बना हुआ है, और यह दोगुना दुखद है, इस तथ्य को देखते हुए कि बच्चे अक्सर उनसे पीड़ित होते हैं। फिर भी, प्रतिरक्षा की कमी के कई रूप पूर्ण जीवन के अनुकूल हैं, बशर्ते कि उनका समय पर निदान किया जाए और पर्याप्त चिकित्सा का उपयोग किया जाए।
ए. नुटसन, टी. फिशर
संक्रमणों का प्रतिरोध कई सुरक्षात्मक तंत्रों के कारण होता है। रक्षा की पहली पंक्ति त्वचा और श्लेष्मा झिल्ली के यांत्रिक अवरोधों द्वारा दर्शायी जाती है। श्लेष्मा झिल्ली का बाधा कार्य रोमक उपकला के कामकाज, बलगम, लाइसोजाइम, लैक्टोफेरिन और इंटरफेरॉन के सुरक्षात्मक गुणों से पूरित होता है।
त्वचा और श्लेष्मा झिल्ली में प्रवेश करने वाले रोगाणुओं को हटाने में, पूरक, न्यूट्रोफिल और मैक्रोफेज शामिल होते हैं, जो विदेशी के खिलाफ शरीर की रक्षा की दूसरी पंक्ति का प्रतिनिधित्व करते हैं। ऊपर सूचीबद्ध गैर-विशिष्ट रक्षा कारकों के अलावा, एंटीबॉडी और टी-लिम्फोसाइट्स संक्रमण के प्रतिरोध के विकास में शामिल हैं।
अस्पष्टीकृत आवर्तक संक्रमण इम्युनोडेफिशिएंसी की सबसे आम अभिव्यक्ति है। वे बच्चों और वयस्कों दोनों में होते हैं, प्राथमिक (अधिक बार जन्मजात) और माध्यमिक हो सकते हैं। माध्यमिक इम्युनोडेफिशिएंसी घातक नियोप्लाज्म में देखी जाती है, जिसमें हेमोब्लास्टोस, वायरल संक्रमण, जैसे एचआईवी संक्रमण या एपस्टीन-बार वायरस के कारण संक्रमण, इम्यूनोसप्रेसिव थेरेपी, उम्र बढ़ने, कमी, इम्युनोग्लोबुलिन की हानि, जैसे नेफ्रोटिक सिंड्रोम या एक्सयूडेटिव एंटरोपैथी शामिल हैं। माध्यमिक इम्युनोडेफिशिएंसी का प्रमुख कारण आज एचआईवी संक्रमण है। यह पुराने संक्रमणों से प्रकट होता है, जिनमें अवसरवादी सूक्ष्मजीवों के कारण भी शामिल हैं, और प्राणघातक सूजन, मुख्य रूप से लिम्फोमा और कपोसी का सारकोमा (अध्याय 19, पी। आई.बी देखें)। आवर्तक संक्रमण वाले रोगियों की परीक्षा में एक महत्वपूर्ण भूमिका प्रतिरक्षा स्थिति के आकलन द्वारा निभाई जाती है। यह याद रखना चाहिए कि बार-बार होने वाले संक्रमण का कारण केवल इम्युनोडेफिशिएंसी नहीं है (तालिका देखें। 18.1)। इस प्रकार, ऊपरी श्वसन पथ के आवर्तक संक्रमण वाले बच्चों में, इसे बाहर रखा जाना चाहिए एलर्जी रिनिथिसतथा दमा. बार-बार संक्रमण भी सिस्टिक फाइब्रोसिस और प्राथमिक सिलिअरी डिस्केनेसिया की विशेषता है, इसलिए बार-बार होने वाले संक्रमण से पीड़ित रोगियों की जांच प्रतिरक्षा स्थिति का आकलन करने तक सीमित नहीं होनी चाहिए।
I. प्राथमिक इम्युनोडेफिशिएंसी का वर्गीकरण। प्राथमिक इम्युनोडेफिशिएंसी का आधुनिक वर्गीकरण प्रतिरक्षा के एक या दूसरे लिंक की प्रमुख हार पर आधारित है। इस वर्गीकरण के अनुसार, प्राथमिक इम्युनोडेफिशिएंसी को 5 समूहों में विभाजित किया गया है।
ए। सभी प्राथमिक इम्युनोडेफिशिएंसी के 50-60% के लिए हास्य प्रतिरक्षा की अपर्याप्तता और बिगड़ा हुआ एंटीबॉडी उत्पादन द्वारा प्रकट होता है। इस समूह में IgA की पृथक कमी (प्रचलन - 1:500), अन्य वर्गों के इम्युनोग्लोबुलिन की पृथक कमी, कई वर्गों के इम्युनोग्लोबुलिन की कमी शामिल है। इम्युनोग्लोबुलिन की सामान्य एकाग्रता के साथ हास्य प्रतिरक्षा की संभावित अपर्याप्तता। यह एंटीजन के एक निश्चित समूह के लिए एंटीबॉडी के स्तर में कमी के कारण है, उदाहरण के लिए, बैक्टीरिया की दीवार के कार्बोहाइड्रेट एंटीजन के लिए।
बी। सेलुलर प्रतिरक्षा की अपर्याप्तता सभी प्राथमिक इम्युनोडेफिशिएंसी के 5-10% के लिए होती है और टी-लिम्फोसाइटों के प्रसार और भेदभाव के उल्लंघन से प्रकट होती है। ज्यादातर मामलों में सेलुलर प्रतिरक्षा की प्राथमिक हानि एंटीबॉडी संश्लेषण की एक माध्यमिक हानि के साथ होती है।
बी। सभी प्राथमिक इम्युनोडेफिशिएंसी के 20-25% के लिए हास्य और सेलुलर प्रतिरक्षा की संयुक्त कमी है। इस समूह में बी- और टी-लिम्फोसाइटों के प्रसार और भेदभाव के प्राथमिक उल्लंघन के कारण होने वाली बीमारियां शामिल हैं।
टी-लिम्फोसाइटों की संख्या में कमी और रक्त में इम्युनोग्लोबुलिन के स्तर की विशेषता है, जो गंभीर संयुक्त इम्युनोडेफिशिएंसी में सबसे अधिक स्पष्ट है। ह्यूमरल और सेल्युलर इम्युनिटी की संयुक्त अपर्याप्तता अक्सर अन्य जन्मजात बीमारियों के साथ होती है, जैसे कि विस्कॉट-एल्ड्रिच सिंड्रोम में थ्रोम्बोसाइटोपेनिया या डिजॉर्ज सिंड्रोम में जन्मजात हृदय दोष और हाइपोकैल्सीमिया।
डी. फागोसाइट्स की अपर्याप्तता सभी प्राथमिक इम्युनोडेफिशिएंसी का 10-15% है। फागोसाइट्स की अपर्याप्तता प्रसार, विभेदन, न्यूट्रोफिल और मैक्रोफेज के केमोटैक्सिस और फागोसाइटोसिस की वास्तविक प्रक्रिया के उल्लंघन के कारण है। फागोसाइट की कमी अक्सर गंभीर संक्रमण के साथ होती है।
ई। सभी प्राथमिक इम्युनोडेफिशिएंसी के 2% से अधिक के लिए पूरक कमी खाते, खुद को ऑप्सोनाइजेशन, फागोसाइटोसिस और सूक्ष्मजीवों के विनाश के उल्लंघन के रूप में प्रकट करते हैं और सेप्सिस तक गंभीर संक्रमण के साथ होते हैं। पूरक कमी अक्सर एसएलई जैसे ऑटोइम्यून रोगों में देखी जाती है।
द्वितीय. निदान। इतिहास एकत्र करें और एक शारीरिक परीक्षा आयोजित करें। यह हमें यह अनुमान लगाने की अनुमति देता है कि प्रतिरक्षा प्रणाली का कौन सा हिस्सा मुख्य रूप से प्रभावित है, और प्रयोगशाला अध्ययनों की योजना बनाने के लिए। इम्युनोडेफिशिएंसी के उपचार की प्रभावशीलता का आकलन करने के लिए शारीरिक परीक्षा बहुत महत्वपूर्ण है। अधिकांश इम्युनोडेफिशिएंसी का एटियलजि अज्ञात है। प्राथमिक इम्युनोडेफिशिएंसी आमतौर पर जन्मजात होती हैं और जीवन के पहले वर्ष में दिखाई देती हैं। प्राथमिक इम्युनोडेफिशिएंसी की मुख्य नैदानिक अभिव्यक्तियाँ तालिका में दी गई हैं। 18.2.
ए अनामनेसिस
1. आवर्तक श्वसन पथ के संक्रमण इम्युनोडेफिशिएंसी की एक विशिष्ट अभिव्यक्ति है। सबसे आम रोगजनकों में स्ट्रेप्टोकोकस न्यूमोनिया, हीमोफिलस इन्फ्लुएंजा, मोराक्सेला कैटरलिस, स्टैफिलोकोकस ऑरियस, निसेरिया एसपीपी।, स्यूडोमोनास एरुगिनोसा और कुछ एनारोबिक बैक्टीरिया हैं। छोटे बच्चों में, ऊपरी श्वसन पथ के संक्रमण (वर्ष में 6-10 बार तक) को इम्युनोडेफिशिएंसी की अनुपस्थिति में देखा जा सकता है, उदाहरण के लिए, एलर्जी संबंधी श्वसन रोगों से पीड़ित बच्चों में, पूर्वस्कूली संस्थानों में भाग लेने वाले या बड़े भाइयों और बहनों में भाग लेने वाले बच्चों में स्कूल। इम्युनोडेफिशिएंसी में श्वसन पथ के संक्रमण की विशेषताएं निम्नलिखित हैं।
एक। क्रोनिक कोर्सजटिलताओं, जैसे कि क्रोनिक सपुरेटिव ओटिटिस मीडिया, मास्टोइडाइटिस, ब्रोन्किइक्टेसिस, निमोनिया, मेनिन्जाइटिस, सेप्सिस।
बी। उत्तेजना की लंबी प्रकृति, उपचार की अप्रभावीता।
में। गंभीर जीवाणु संक्रमण। गंभीर संक्रमण की किसी भी पुनरावृत्ति के लिए प्रतिरक्षा की कमी को दूर करने के लिए सावधानीपूर्वक मूल्यांकन की आवश्यकता होती है। निसेरिया एसपीपी के कारण बार-बार होने वाले गंभीर संक्रमण मेम्ब्रेन अटैक कॉम्प्लेक्स के निर्माण में शामिल पूरक घटकों की कमी का संकेत देते हैं (अध्याय 1, पृष्ठ IV.D.3 देखें)।
घ. अवसरवादी रोगजनकों (न्यूमोसिस्टिस कैरिनी, एस्परगिलस फ्यूमिगेटस, कैंडिडा अल्बिकन्स, सेराटिया मार्सेसेन्स) के कारण होने वाले संक्रमण सेलुलर प्रतिरक्षा और फागोसाइटोसिस की कमी की विशेषता हैं।
2. इतिहास में एटोपिक रोग (पारिवारिक इतिहास सहित) इम्युनोडेफिशिएंसी के लिए विशिष्ट नहीं हैं। यह ध्यान में रखा जाना चाहिए कि एटोपिक रोगों की अभिव्यक्तियाँ इम्युनोडेफिशिएंसी के समान हो सकती हैं। तुलनात्मक विशेषताएंइम्युनोडेफिशिएंसी और एटोपिक रोग तालिका में दिए गए हैं। 18.3.
3. विकासात्मक देरी। इम्युनोडेफिशिएंसी में, विकासात्मक देरी अक्सर देखी जाती है, लेकिन इसकी अनुपस्थिति इम्युनोडेफिशिएंसी को बाहर नहीं करती है। अपर्याप्त सेलुलर प्रतिरक्षा वाले बच्चों के लिए विकासात्मक देरी सबसे विशिष्ट है, विशेष रूप से पुराने दस्त के साथ। इम्युनोडेफिशिएंसी में विकासात्मक देरी के अन्य कारण पुराने संक्रमण हैं।
4. क्रोनिक डायरिया, बार-बार उल्टी होना, और कुपोषण सिंड्रोम किसी भी इम्युनोडेफिशिएंसी के साथ संभव है और आमतौर पर जिआर्डिया लैम्ब्लिया, क्रिप्टोस्पोरिडियम एसपीपी, हेलिकोबैक्टर पाइलोरी, एस्चेरिचिया कोलाई के एंटरोपैथोजेनिक स्ट्रेन, या वायरस, जैसे रोटावायरस या साइटोमेगालोवायरस के कारण होने वाले संक्रमण के कारण होते हैं। गैस्ट्रोइंटेस्टाइनल विकारों के अन्य कारणों को छोड़ दें - डिसैकराइडेस की कमी, सीलिएक रोग, जठरांत्र संबंधी मार्ग का लिंफोमा।
5. पिछली बीमारियों, पिछले उपचार, यौन जीवन, नशीली दवाओं के उपयोग के बारे में विस्तृत जानकारी की आवश्यकता है। निम्नलिखित पर विशेष ध्यान दिया जाता है।
एक। गर्भावस्था के दौरान मातृ रोग। माध्यमिक इम्युनोडेफिशिएंसी एचआईवी और रूबेला वायरस के कारण होते हैं: एचआईवी हास्य और सेलुलर प्रतिरक्षा की कमी का कारण बनता है, और रूबेला वायरस - ह्यूमर इम्युनिटी।
बी। गर्भकालीन आयु और जन्म का वजन। प्रीटरम शिशुओं में जिनकी गर्भकालीन आयु 30-32 सप्ताह से कम है, हाइपोगैमाग्लोबुलिनमिया को प्लेसेंटा के माध्यम से वितरित मातृ आईजीजी की कमी के कारण नोट किया जाता है। जन्म के समय कम वजन वाले शिशुओं में संक्रमण की संभावना अधिक होती है।
में। रक्त घटकों के आधान की जटिलताओं। रक्त घटकों के आधान से एचआईवी संक्रमण का खतरा बढ़ जाता है, और यदि सेलुलर प्रतिरक्षा अपर्याप्त है, तो यह ग्राफ्ट-बनाम-होस्ट रोग का कारण बन सकता है। एचआईवी संक्रमण का जोखिम उन रोगियों में विशेष रूप से अधिक है, जिन्हें 1978 और 1985 के बीच रक्त आधान प्राप्त हुआ था।
घ. जीवित वायरस टीकों के साथ टीकाकरण अपर्याप्त सेलुलर प्रतिरक्षा वाले रोगियों में संक्रामक जटिलताओं का कारण बन सकता है।
ई. रोगाणुरोधी चिकित्सा। यह पता लगाना आवश्यक है कि रोगाणुरोधी चिकित्सा कितनी बार की गई और इसकी प्रभावशीलता क्या थी, क्या रोगी को सामान्य या विशिष्ट इम्युनोग्लोबुलिन निर्धारित किए गए थे।
इ। सर्जिकल हस्तक्षेप. श्वसन पथ के आवर्तक संक्रमण के साथ, सर्जिकल उपचार अक्सर किया जाता है: टॉन्सिल्लेक्टोमी, एडेनोटॉमी, परानासल साइनस का जल निकासी। परिणामों का पूर्वव्यापी विश्लेषण ऊतकीय परीक्षातालु और ग्रसनी टॉन्सिल रोग संबंधी परिवर्तनों को प्रकट करते हैं जो इम्युनोडेफिशिएंसी की विशेषता है, जैसे कि प्रजनन केंद्रों या प्लाज्मा कोशिकाओं की अनुपस्थिति।
तथा। यौन अभिविन्यास विकार, यौन संचारित रोग, बलात्कार, नशीली दवाओं की लत एचआईवी संक्रमण के जोखिम को बढ़ाती है, जो प्राथमिक इम्यूनोडिफीसिअन्सी के समान आगे बढ़ सकती है (देखें अध्याय 19, खंड I.B)।
6. पारिवारिक इतिहास। प्राथमिक इम्युनोडेफिशिएंसी की विरासत का प्रकार तालिका में दिया गया है। 18.4. अधिकांश प्राथमिक इम्युनोडेफिशिएंसी एक ऑटोसोमल रिसेसिव या एक्स-लिंक्ड तरीके से विरासत में मिली हैं। पारिवारिक इतिहास एकत्र करते समय, यह पता लगाना वांछनीय है कि क्या परिवार में निकट से संबंधित विवाह थे और वंशावली अध्ययन करें। निम्नलिखित जानकारी पर ध्यान केंद्रित किया गया है।
एक। शैशवावस्था में मृत्यु, आवर्तक और जीर्ण संक्रमण, हेमोब्लास्टोस, निकट और दूर के रिश्तेदारों में ऑटोइम्यून रोग।
बी। परिवार के सदस्यों में एलर्जी संबंधी बीमारियों और सिस्टिक फाइब्रोसिस से पता चलता है कि एक बच्चे में बार-बार होने वाले संक्रमण प्राथमिक इम्युनोडेफिशिएंसी से जुड़े नहीं होते हैं।
7. दौड़। कुछ रोग, जैसे सिकल सेल एनीमिया, विशेष रूप से एक विशेष जाति के सदस्यों में आम हैं। परिवार के सदस्यों में इन बीमारियों की पहचान से यह भी पता चलता है कि बच्चे में बार-बार होने वाले संक्रमण इम्यूनोडिफ़िशिएंसी से जुड़े नहीं हैं।
बी शारीरिक परीक्षा। गंभीर इम्युनोडेफिशिएंसी वाले मरीजों को पीलापन, सुस्ती, चिड़चिड़ापन और वजन घटाने की विशेषता होती है। बच्चे के सामान्य विकास और शारीरिक गतिविधि के स्तर के साथ, इम्युनोडेफिशिएंसी के निदान की संभावना नहीं है। व्यक्तिगत इम्युनोडेफिशिएंसी के लक्षण तालिका में दिए गए हैं। 18.5. शारीरिक परीक्षण के दौरान निम्नलिखित बातों पर ध्यान दें।
1. बच्चे की ऊंचाई और वजन। सेलुलर प्रतिरक्षा की कमी वाले बच्चों में अक्सर विकास में देरी होती है क्योंकि उन्हें अक्सर पुराने दस्त होते हैं। हास्य प्रतिरक्षा की कमी वाले अधिकांश बच्चे सामान्य रूप से विकसित होते हैं। बच्चे के शारीरिक विकास की गतिशीलता इम्युनोडेफिशिएंसी के उपचार की प्रभावशीलता के संकेतक के रूप में कार्य करती है।
2. लसीका प्रणाली. हास्य और सेलुलर प्रतिरक्षा की कमी के साथ, तालु और ग्रसनी टॉन्सिल और परिधीय लिम्फ नोड्स कम या अनुपस्थित हैं। हालांकि, कुछ इम्युनोडेफिशिएंसी में, जैसे लेटरर-सीवे रोग, आईजीएम हाइपरप्रोडक्शन सिंड्रोम, कॉमन वेरिएबल हाइपोगैमाग्लोबुलिनमिया, ओमेन सिंड्रोम, ग्राफ्ट-बनाम-होस्ट रोग के कारण इम्युनोडेफिशिएंसी, लिम्फ नोड इज़ाफ़ा और हेपेटोसप्लेनोमेगाली मनाया जाता है।
3. त्वचा और श्लेष्मा झिल्ली के कैंडिडिआसिस। अपर्याप्त सेलुलर प्रतिरक्षा वाले बच्चों में (डिजॉर्ज सिंड्रोम, विस्कॉट-एल्ड्रिच सिंड्रोम, गंभीर संयुक्त इम्युनोडेफिशिएंसी), स्वस्थ शिशुओं के विपरीत, मौखिक कैंडिडिआसिस एक गंभीर और लंबे समय तक पाठ्यक्रम की विशेषता है। इम्युनोडेफिशिएंसी की पृष्ठभूमि के खिलाफ होने वाली कैंडिडिआसिस के लिए, निम्नलिखित विशेषता है: 1) पूर्वगामी कारकों की अनुपस्थिति (एंटीबायोटिक्स या कॉर्टिकोस्टेरॉइड्स के साथ उपचार, स्तनपान के दौरान संक्रमण); 2) लंबा कोर्स; 3) उपचार विफलता; 4) आवर्तक पाठ्यक्रम; 5) अन्नप्रणाली के कैंडिडिआसिस; 6) लगातार त्वचा के घाव।
4. कान और नाक के रोग। क्रोनिक प्युलुलेंट ओटिटिस मीडिया अक्सर मनाया जाता है, साथ में वेध और टाम्पैनिक झिल्ली में सिकाट्रिकियल परिवर्तन, कान से मवाद का निर्वहन, पुरानी साइनसाइटिसऔर राइनाइटिस।
5. ड्रम स्टिक्स के लक्षण, ऐंटरोपोस्टीरियर आकार में वृद्धि छातीऔर एचआईवी संक्रमित बच्चों में लिम्फोसाइटिक इंटरस्टिशियल न्यूमोनाइटिस में लगातार घरघराहट देखी जाती है। ये लक्षण क्रोनिक ब्रोंकाइटिस और ब्रोन्किइक्टेसिस में भी देखे जाते हैं।
6. फागोसाइट्स की अपर्याप्तता के मामले में, पीरियोडोंटाइटिस अक्सर मनाया जाता है।
7. त्वचा और श्लेष्मा झिल्ली का अल्सर। इम्युनोडेफिशिएंसी, विशेष रूप से सेलुलर प्रतिरक्षा की गंभीर कमी, अक्सर जीभ, मौखिक श्लेष्म और गुदा के आसपास की त्वचा के अल्सरेशन के साथ होती है।
8. त्वचा और चमड़े के नीचे के ऊतकों के पुरुलेंट संक्रमण फागोसाइट की कमी की विशेषता है। ल्यूकोसाइट्स के आसंजन और आईजीई के हाइपरप्रोडक्शन के सिंड्रोम के उल्लंघन में, पुरानी फोड़े संभव हैं। दूसरों के बीच त्वचा की अभिव्यक्तियाँइम्युनोडेफिशिएंसी में निम्नलिखित शामिल हैं।
एक। गंभीर संयुक्त इम्युनोडेफिशिएंसी में सेबोरहाइक डर्मेटाइटिस जैसे दाने, लेटरर-सीवे रोग, ओमेन सिंड्रोम और ग्राफ्ट-बनाम-होस्ट रोग।
बी। डिफ्यूज़ न्यूरोडर्माेटाइटिस - गंभीर संयुक्त इम्युनोडेफिशिएंसी, विस्कॉट-एल्ड्रिच सिंड्रोम, आईजीई हाइपरप्रोडक्शन सिंड्रोम और हाइपोगैमाग्लोबुलिनमिया के साथ।
में। पूरक घटकों C1q, C1r, C4, C2, C5, C6, C7 और C8 की कमी के साथ ल्यूपस एरिथेमेटोसस जैसा दिखने वाला एक त्वचा घाव, पृथक IgA की कमी और सामान्य चर हाइपोगैमाग्लोबुलिनमिया।
घ. डर्माटोमायोसिटिस - एक्स-लिंक्ड एग्माग्लोबुलिनमिया के साथ और कभी-कभी सी 2 की कमी के साथ। एक्स-लिंक्ड एग्माग्लोबुलिनमिया में डर्माटोमायोसिटिस ईसीएचओ वायरस के संक्रमण के कारण होता है।
9. वायरल एन्सेफलाइटिस गंभीर तंत्रिका संबंधी विकारों के साथ है, शारीरिक देरी से और मानसिक विकासऔर मौत का कारण बन सकता है। विशेष रूप से अक्सर वे अपर्याप्त सेलुलर प्रतिरक्षा और गंभीर संयुक्त प्रतिरक्षाविहीनता के साथ विकसित होते हैं। ईसीएचओ वायरस के कारण होने वाला एन्सेफेलोमाइलाइटिस एक्स-लिंक्ड एग्माग्लोबुलिनमिया में देखा जाता है।
10. गठिया और गठिया अक्सर हास्य प्रतिरक्षा की कमी के साथ होते हैं।
11. इम्युनोडेफिशिएंसी के साथ, हेमोफिलस इन्फ्लुएंजा के कारण होने वाला क्रोनिक नेत्रश्लेष्मलाशोथ संभव है।
12. ल्यूकोसाइट्स के आसंजन के उल्लंघन में गर्भनाल का देर से गिरना देखा जाता है। यह ल्यूकोसाइट्स की सतह पर CD11/CD18 सेल आसंजन अणुओं की कमी के कारण होता है और उनकी फागोसाइटिक गतिविधि में कमी से प्रकट होता है।
III. बुनियादी प्रयोगशाला अनुसंधान। गंभीर इम्युनोडेफिशिएंसी का पता सरल से लगाया जा सकता है प्रयोगशाला अनुसंधान. यदि इतिहास और शारीरिक परीक्षा के निष्कर्ष इम्यूनोडिफ़िशिएंसी का सुझाव देते हैं, तो वे निदान की पुष्टि कर सकते हैं। यदि निदान अस्पष्ट रहता है, तो अतिरिक्त अध्ययन किए जाते हैं (अध्याय 18, आइटम IV देखें)। इम्युनोडेफिशिएंसी के निदान के लिए उपयोग किए जाने वाले प्रयोगशाला अध्ययन तालिका में सूचीबद्ध हैं। 18.6 और चौ. बीस।
ए. पूर्ण रक्त गणना से एनीमिया, ल्यूकोपेनिया या थ्रोम्बोसाइटोपेनिया का पता चलता है। न्यूट्रोफिल की कुल संख्या सामान्य रूप से कम से कम 1800 μl-1, लिम्फोसाइट्स - 1000 μl-1 होनी चाहिए, 2 वर्ष से कम उम्र के बच्चों में, लिम्फोसाइटों की संख्या सामान्य रूप से कम से कम 2800 μl-1 होनी चाहिए। चूंकि टी-लिम्फोसाइट्स सभी रक्त लिम्फोसाइटों का लगभग 75% बनाते हैं, लिम्फोपेनिया लगभग हमेशा टी-लिम्फोसाइटों की संख्या में कमी का संकेत देता है। न्यूट्रोपेनिया और लिम्फोपेनिया माध्यमिक हो सकते हैं, उदाहरण के लिए, संक्रमण, ऑटोइम्यून रोग, और कुछ दवाओं का उपयोग, विशेष रूप से इम्यूनोसप्रेसेन्ट। यदि न्यूट्रोपेनिया या लिम्फोपेनिया का पता चला है, तो एक पूर्ण रक्त गणना दोहराई जाती है। ईोसिनोफिलिया अक्सर अपर्याप्त सेलुलर प्रतिरक्षा वाले रोगियों में मनाया जाता है। ल्यूकोसाइट्स के आसंजन का उल्लंघन लगातार ल्यूकोसाइटोसिस के साथ होता है। विस्कॉट-एल्ड्रिच सिंड्रोम को प्लेटलेट्स की संख्या और आकार में कमी की विशेषता है। कुछ इम्युनोडेफिशिएंसी में, जैसे कि आईजीएम हाइपरप्रोडक्शन सिंड्रोम और गंभीर संयुक्त इम्युनोडेफिशिएंसी, ऑटोइम्यून थ्रोम्बोसाइटोपेनिया मनाया जाता है।
बी। आईजीजी, आईजीएम और आईजीए का मात्रात्मक निर्धारण सरल रेडियल इम्यूनोडिफ्यूजन और नेफेलोमेट्री विधियों द्वारा किया जाता है। परिणामों का मूल्यांकन आयु मानदंडों को ध्यान में रखते हुए किया जाता है (देखें परिशिष्ट V)। एक इम्युनोग्लोबुलिन स्तर जो उम्र के लिए माध्य के 2 मानक विचलन के भीतर है, सामान्य माना जाता है। उम्र के मानदंड से 2 से अधिक मानक विचलन से इम्युनोग्लोबुलिन के स्तर में कमी के साथ, हाइपोगैमाग्लोबुलिनमिया का निदान किया जाता है।
बी. आरआईए या सॉलिड-फेज एलिसा का उपयोग करके कुल सीरम आईजीई स्तरों का निर्धारण एलर्जी की बीमारी को इम्युनोडेफिशिएंसी से अलग करने में मदद करता है। हालांकि, इम्युनोडेफिशिएंसी में भी IgE का स्तर ऊंचा किया जा सकता है, खासकर अपर्याप्त सेलुलर प्रतिरक्षा के मामलों में। आईजीई के स्तर में उल्लेखनीय वृद्धि हेल्मिन्थियसिस और एलर्जी ब्रोंकोपुलमोनरी एस्परगिलोसिस की विशेषता है। प्राप्त परिणामों का मूल्यांकन करते समय, IgE के कुल स्तर और रोगी की आयु का निर्धारण करने की विधि को ध्यान में रखा जाता है (परिशिष्ट IV देखें)।
डी. आइसोहेमाग्लगुटिनिन का निर्धारण आपको सीरम में आईजीएम के स्तर का आकलन करने की अनुमति देता है। यह सरल अध्ययन लगभग सभी नैदानिक प्रयोगशालाओं में किया जाता है। आम तौर पर, 6 महीने से अधिक उम्र के अधिकांश बच्चों में, एरिथ्रोसाइट एंटीजन ए के लिए एंटीबॉडी का टिटर 1:8 से अधिक होता है, एंटीजन बी -1:4 (रक्त प्रकार एबी वाले व्यक्तियों के अपवाद के साथ)। 18 महीने से अधिक उम्र के बच्चों में, एरिथ्रोसाइट एंटीजन ए के एंटीबॉडी का टिटर आमतौर पर 1:16 से अधिक होता है, एंटीजन बी -1: 8। अध्ययन के एक महीने के भीतर इम्युनोग्लोबुलिन निर्धारित किए जाने पर अध्ययन के परिणामों का मूल्यांकन मुश्किल है। 6 महीने से कम उम्र के बच्चों में, आईजीजी से संबंधित एरिथ्रोसाइट एंटीजन के लिए मातृ एंटीबॉडी आमतौर पर सीरम में मौजूद होते हैं, जिससे परिणामों का मूल्यांकन करना भी मुश्किल हो जाता है।
डी. बच्चों में, पसीने में क्लोरीन का स्तर निर्धारित करना और अग्न्याशय के बहिःस्रावी कार्य का मूल्यांकन करना अनिवार्य है। यह आवर्तक श्वसन पथ के संक्रमण, कुअवशोषण सिंड्रोम और विकासात्मक देरी में विशेष रूप से आवश्यक है। आम तौर पर, पसीने में क्लोरीन का स्तर 60 mEq/L से अधिक नहीं होता है। चूंकि बच्चों के लिए सामग्री प्राप्त करना कठिन है ग्रहणी, उनमें अग्न्याशय के बहिःस्रावी कार्य का सीरम में कैरोटीन के स्तर द्वारा अस्थायी रूप से मूल्यांकन किया जाता है: अग्न्याशय के बहिःस्रावी कार्य की अपर्याप्तता के मामले में, यह कम हो जाता है। विवादास्पद मामलों में, सिस्टिक फाइब्रोसिस वाले 70-75% रोगियों में होने वाले आनुवंशिक दोषों की पहचान करने के लिए डीएनए विश्लेषण किया जाता है।
ई. कब जीर्ण संक्रमणईएसआर का निर्धारण और रोगजनकों की पहचान करने के लिए माइक्रोस्कोपी और संस्कृति का संचालन करें। यदि आवश्यक हो, तो एक्स-रे परीक्षा की जाती है। पार्श्व प्रक्षेपण में खोपड़ी का एक्स-रे करते समय, तालु और ग्रसनी टॉन्सिल में कमी, हाइपोगैमाग्लोबुलिनमिया की विशेषता का पता लगाया जा सकता है। नवजात शिशुओं में छाती के रेडियोग्राफ पर थाइमस का पता लगाना गंभीर सेलुलर प्रतिरक्षा की कमी के निदान पर संदेह करता है। यह याद रखना चाहिए कि थाइमस में कमी संभव है गंभीर रोगइसलिए, प्राथमिक इम्युनोडेफिशिएंसी के पैथोग्नोमोनिक संकेत के रूप में काम नहीं कर सकता है।
जी। विलंबित प्रकार की एलर्जी प्रतिक्रियाओं के आधार पर त्वचा परीक्षणों का उपयोग करके सेलुलर प्रतिरक्षा का आकलन किया जाता है। इतिहास के आधार पर परीक्षण के लिए एंटीजन का चयन किया जाता है। एक सकारात्मक प्रतिक्रिया सेलुलर प्रतिरक्षा की एक गंभीर कमी को बाहर करना संभव बनाती है, जबकि एक नकारात्मक जानकारीपूर्ण नहीं है यदि नमूनों को स्थापित करने के लिए उपयोग किए जाने वाले एंटीजन के साथ संपर्क के बारे में कोई इतिहास संबंधी जानकारी नहीं है। लगभग 85% स्वस्थ वयस्कों में एक या अधिक एंटीजन (5 मिमी से अधिक ब्लिस्टर व्यास) के साथ सकारात्मक प्रतिक्रिया होती है। बच्चों में, वयस्कों की तुलना में समान एंटीजन के साथ सकारात्मक प्रतिक्रियाएं कम बार देखी जाती हैं, उम्र के साथ, सकारात्मक प्रतिक्रियाओं की आवृत्ति बढ़ जाती है। 2 वर्ष से कम उम्र के बच्चों में, कैंडिडा एल्बीकैंस एंटीजन और टेटनस टॉक्साइड के लिए त्वचा परीक्षण का उपयोग किया जाता है। कैंडिडा एल्बिकैंस एंटीजन के प्रति सकारात्मक प्रतिक्रिया लगभग 30% गैर-प्रतिरक्षादक्ष शिशुओं में होती है। जैसा कि पहले ही उल्लेख किया गया है, अपर्याप्त सेलुलर प्रतिरक्षा वाले शिशुओं में कैंडिडिआसिस एक ही उम्र के स्वस्थ बच्चों की तुलना में अधिक बार मनाया जाता है, हालांकि, कैंडिडा अल्बिकन्स एंटीजन के साथ त्वचा परीक्षण आमतौर पर उनमें नकारात्मक होते हैं। एडीएस के साथ दूसरे टीकाकरण के बाद टेटनस टॉक्साइड के साथ एक सकारात्मक त्वचा परीक्षण 67% स्वस्थ बच्चों में देखा गया है, तीसरे के बाद - 97% में। त्वचा परीक्षण के दौरान एक सकारात्मक प्रतिक्रिया सेलुलर प्रतिरक्षा की गंभीर कमी को बाहर करती है, जबकि एक नकारात्मक प्रतिक्रिया का कोई नैदानिक मूल्य नहीं होता है। त्वचा परीक्षण के लिए एंटीजन की खुराक तालिका में दी गई है। 18.7. इस अध्ययन का संचालन करते समय, निम्नलिखित नियमों का पालन किया जाना चाहिए।
1. एंटीजन की गतिविधि को सत्यापित करना आवश्यक है, जिसके लिए पहले एक स्वस्थ व्यक्ति में त्वचा परीक्षण किया जाना चाहिए जो इसके प्रति संवेदनशील है।
2. यह ध्यान में रखा जाना चाहिए कि इम्यूनोसप्रेसेरिव थेरेपी की पृष्ठभूमि के खिलाफ परीक्षण करते समय, गलत-नकारात्मक परिणाम संभव हैं।
3. यह निर्धारित किया जाना चाहिए कि क्या रोगी का अतीत में नमूने में इस्तेमाल किए गए एंटीजन के साथ संपर्क रहा है, और यदि हां, तो क्या कोई स्थानीय या प्रणालीगत प्रतिक्रियाएं थीं। इतिहास में गंभीर प्रतिक्रियाओं के मामले में, इस एंटीजन के साथ त्वचा परीक्षण कम केंद्रित एंटीजन के साथ नहीं किया जाता है या नहीं किया जाता है।
4. त्वचा परीक्षण निम्नानुसार किए जाते हैं।
एक। प्रत्येक इंजेक्शन के लिए 1 मिली की मात्रा के साथ एक अलग बाँझ ट्यूबरकुलिन सिरिंज और 13 मिमी की लंबाई के साथ 27 जी सुई का उपयोग करें।
बी। 0.1 मिलीलीटर प्रतिजन समाधान सिरिंज में खींचा जाता है, हवा के बुलबुले हटा दिए जाते हैं।
में। एंटीजन को अंतःस्रावी रूप से प्रकोष्ठ या पीठ में इंजेक्ट किया जाता है।
डी. एंटीजन के इंजेक्शन के तुरंत बाद, इंजेक्शन स्थल पर 5-10 मिमी के व्यास वाला एक छाला दिखाई देना चाहिए। यदि छाला दिखाई नहीं देता है, तो इंजेक्शन अंतर्गर्भाशयी नहीं, बल्कि s / c बनाया जाता है। इस मामले में, एंटीजन को त्वचा के दूसरे क्षेत्र में फिर से इंजेक्ट किया जाता है।
ई. इंजेक्शन साइट को गोल किया जाता है, उदाहरण के लिए, बॉलपॉइंट पेन के साथ।
ई. 24 और 48 घंटों के बाद परिणामों का मूल्यांकन किया जाता है। यदि 24 घंटों के बाद परीक्षा परिणाम नकारात्मक है, तो अधिक केंद्रित एंटीजन समाधान प्रशासित किया जा सकता है।
तथा। त्वचा परीक्षण के लिए, आमतौर पर एक वाणिज्यिक सीएमआई मल्टीटेस्ट किट का उपयोग किया जाता है, जिसमें 7 एंटीजन होते हैं: कैंडिडा अल्बिकन्स, ट्राइकोफाइटन एसपीपी।, प्रोटीस एसपीपी।, टेटनस टॉक्साइड, डिप्थीरिया टॉक्सोइड, स्ट्रेप्टोकिनेज और शुद्ध ट्यूबरकुलिन। यह ध्यान दिया जाना चाहिए कि इस किट का उपयोग करके अध्ययन के परिणामों का मूल्यांकन अक्सर मुश्किल होता है, क्योंकि सकारात्मक प्रतिक्रियाछाला छोटा हो सकता है (2 मिमी से थोड़ा अधिक)।
3. पूरक परीक्षण प्राथमिक प्रयोगशाला परीक्षण नहीं है। हालांकि, अगर पूरक कमी और ऑटोइम्यून बीमारी का पारिवारिक इतिहास है, या नैदानिक तस्वीर पूरक कमी का सुझाव देती है, तो यह जांच जल्द से जल्द की जानी चाहिए।
1. पूरक की हेमोलिटिक गतिविधि इसकी सक्रियता (सी 1-सी 9) के शास्त्रीय मार्ग के घटकों की कार्यात्मक गतिविधि का आकलन करना संभव बनाती है। पूरक की सामान्य हेमोलिटिक गतिविधि इसके व्यक्तिगत घटकों की अपर्याप्तता या सक्रियण के वैकल्पिक मार्ग के उल्लंघन को बाहर नहीं करती है।
3. पूरक कमी के निदान में सबसे अधिक जानकारीपूर्ण पूरक की हेमोलिटिक गतिविधि और सी 3 और सी 4 के स्तर का एक साथ निर्धारण है।
एक। C3 और C4 के स्तर में एक साथ कमी और पूरक की हेमोलिटिक गतिविधि शास्त्रीय मार्ग के साथ पूरक की सक्रियता को इंगित करती है, उदाहरण के लिए, तीव्र वायरल हेपेटाइटिस में वायरस या प्रतिरक्षा परिसरों द्वारा।
बी। कम C4 स्तर और कम हेमोलिटिक पूरक गतिविधि के साथ एक सामान्य C3 स्तर C4 की कमी को इंगित करता है। यह एसएलई वाले कुछ रोगियों में वंशानुगत क्विन्के एडिमा, मलेरिया में देखा जाता है।
में। निम्न C3 स्तरों के साथ सामान्य C4 स्तर और पूरक की घटी हुई हेमोलिटिक गतिविधि देखी जाती है जन्मजात अपर्याप्तता C3, C3b अवरोधक की कमी, और एक वैकल्पिक मार्ग के माध्यम से सक्रियण पूरक, जैसे कि ग्राम-नकारात्मक जीवाणु एंडोटॉक्सिन। व्यापक रूप से जलने और कुपोषण के साथ नवजात शिशुओं में भी C3 का स्तर कम हो जाता है।
घ. पूरक की कम हेमोलिटिक गतिविधि के साथ C3 और C4 की सामान्य सामग्री अन्य पूरक घटकों की कमी को इंगित करती है। इस मामले में, अतिरिक्त प्रयोगशाला परीक्षणों का संकेत दिया जाता है।
चतुर्थ। अतिरिक्त प्रयोगशाला अध्ययन। यदि बुनियादी प्रयोगशाला परीक्षणों के परिणाम निदान करने या पुष्टि करने की अनुमति नहीं देते हैं, तो अधिक जटिल प्रयोगशाला परीक्षण किए जाते हैं (अध्याय 20 देखें)। चूंकि प्रतिरक्षा प्रणाली के विभिन्न भागों का उल्लंघन अक्सर एक साथ देखा जाता है, जब एक विकृति का पता लगाया जाता है, तो प्रतिरक्षा प्रणाली का पूरा अध्ययन दिखाया जाता है। यह आमतौर पर विशेष प्रयोगशालाओं में किया जाता है। जब तक निदान नहीं किया जाता है, तब तक उपचार शुरू नहीं होता है।
A. हास्य प्रतिरक्षा का अध्ययन
1. बी-लिम्फोसाइटों की संख्या का निर्धारण। लिम्फोसाइटों की कोशिका झिल्ली पर कई ग्लाइकोप्रोटीन होते हैं जिन्हें मोनोक्लोनल एंटीबॉडी का उपयोग करके फ्लो साइटोमेट्री द्वारा पता लगाया जा सकता है। इनमें से कुछ ग्लाइकोप्रोटीन एक विशेष सेल प्रकार के लिए विशिष्ट हैं, जैसे कि टी-, बी- और एनके-लिम्फोसाइट्स, टी-लिम्फोसाइट्स के विभिन्न उप-जनसंख्या, मोनोसाइट्स और यहां तक कि उनकी परिपक्वता और भेदभाव के कुछ चरणों तक। इन अणुओं को आमतौर पर सीडी के रूप में जाना जाता है। कई सीडी के कार्य वर्तमान में परिभाषित हैं (तालिका 18.8 देखें)। अध्ययन के परिणामों का मूल्यांकन करते समय, रोगी की उम्र को ध्यान में रखना आवश्यक है। इसके अलावा, अभिकर्मकों की गुणवत्ता और कार्यप्रणाली के पालन की लगातार निगरानी करना आवश्यक है, क्योंकि इसका मामूली उल्लंघन भी अध्ययन के परिणामों को विकृत करता है। फ्लो साइटोमेट्री का उपयोग करके बी-लिम्फोसाइटों का निर्धारण कोशिका की सतह, सीडी19 और सीडी20 पर तय इम्युनोग्लोबुलिन का पता लगाने पर आधारित है (तालिका 18.8 देखें)। बड़े बच्चों और वयस्कों में, बी-लिम्फोसाइट्स सभी रक्त लिम्फोसाइटों का 10-20% बनाते हैं, छोटे बच्चों में वे अधिक होते हैं।
2. एंटीबॉडी अनुमापांक का निर्धारण। यदि ह्यूमर इम्युनिटी की कमी का संदेह है, तो प्रोटीन और पॉलीसेकेराइड एंटीजन के एंटीबॉडी के टिटर का आकलन किया जाता है। आमतौर पर वे टीकाकरण या संक्रमण के बाद निर्धारित होते हैं।
एक। प्रोटीन प्रतिजनों के लिए एंटीबॉडी। ज्यादातर मामलों में, आईजीजी से डिप्थीरिया और टेटनस टॉक्सोइड्स की जांच डीपीटी या डीटीपी के साथ टीकाकरण से पहले और 2-4 सप्ताह बाद की जाती है। चूंकि लगभग सभी वयस्कों को डीटीपी का टीका लगाया जाता है, इसलिए टीकाकरण के बाद एंटीबॉडी का स्तर द्वितीयक प्रतिरक्षा प्रतिक्रिया का एक संकेतक है। हेमोफिलस इन्फ्लुएंजा टाइप बी वैक्सीन के प्रशासन के बाद पीआरपी एंटीजन के प्रति एंटीबॉडी का पता लगाना भी संभव है। हालांकि यह एंटीजन एक पॉलीसेकेराइड है, यह संयुग्म वैक्सीन में प्रोटीन एंटीजन के रूप में कार्य करता है। कभी-कभी निष्क्रिय पोलियो वैक्सीन और पुनः संयोजक हेपेटाइटिस बी वैक्सीन के साथ टीकाकरण के बाद एंटीबॉडी का परीक्षण किया जाता है। यदि इम्युनोडेफिशिएंसी का संदेह है, तो लाइव वायरल टीके contraindicated।
बी। पॉलीसेकेराइड एंटीजन के लिए एंटीबॉडी। पॉलीसेकेराइड प्रतिजनों के लिए हास्य प्रतिरक्षा प्रतिक्रिया का आकलन करने के लिए, न्यूमोकोकल और मेनिंगोकोकल टीके जिनमें प्रोटीन वाहक नहीं होते हैं, का उपयोग किया जाता है। एंटीबॉडी टिटर टीकाकरण से पहले और 3-4 सप्ताह बाद निर्धारित किया जाता है। कुछ शोध प्रयोगशालाओं में, हेमोफिलस इन्फ्लुएंजा टाइप बी के खिलाफ एक गैर-संयुग्मित टीके का उपयोग इस उद्देश्य के लिए किया जाता है। परिणामों का मूल्यांकन रोगी की उम्र को ध्यान में रखकर किया जाता है। तो, 2 साल से कम उम्र के बच्चों में, पॉलीसेकेराइड एंटीजन के प्रति प्रतिरक्षा प्रतिक्रिया कमजोर होती है, कुछ बच्चों में यह 5 साल तक बनी रहती है। इस संबंध में, छोटे बच्चों में पॉलीसेकेराइड टीकों का उपयोग अनुचित है और यहां तक कि contraindicated भी है, क्योंकि इससे बड़ी उम्र में प्रतिरक्षात्मक सहिष्णुता और अप्रभावी पुनर्विकास हो सकता है।
में। प्राथमिक और माध्यमिक हास्य प्रतिरक्षा प्रतिक्रिया का आकलन। प्रतिजन की निकासी निर्धारित करने के लिए, IgM (प्राथमिक प्रतिरक्षा प्रतिक्रिया में) और IgG (द्वितीयक प्रतिरक्षा प्रतिक्रिया में), बैक्टीरियोफेज फिची 174, एक जीवाणु वायरस जो मनुष्यों के लिए सुरक्षित है, का स्तर प्रोटीन प्रतिजन के रूप में उपयोग किया जाता है। गैस्ट्रोपॉड हेमोसायनिन, पुनः संयोजक हेपेटाइटिस बी वैक्सीन, मोनोमेरिक फ्लैगेलिन, टिक-जनित एन्सेफलाइटिस वैक्सीन का उपयोग प्राथमिक हास्य प्रतिरक्षा प्रतिक्रिया का आकलन करने के लिए भी किया जाता है।
घ. प्राकृतिक एंटीबॉडी (आइसोहेमाग्लगुटिनिन, स्ट्रेप्टोलिसिन ओ के प्रति एंटीबॉडी, हेटरोफाइल एंटीबॉडी, जैसे कि राम एरिथ्रोसाइट्स के एंटीबॉडी) सामान्य रूप से लगभग सभी लोगों के सीरम में मौजूद होते हैं। इसका कारण यह है कि जिन एंटीजन के खिलाफ इन एंटीबॉडी को निर्देशित किया जाता है वे व्यापक हैं और इसमें निहित हैं खाद्य उत्पाद, साँस के कण, श्वसन पथ के माइक्रोफ्लोरा।
3. आईजीजी उपवर्गों की परिभाषा। यदि, श्वसन पथ के बार-बार होने वाले जीवाणु संक्रमण में, कुल IgG स्तर सामान्य या थोड़ा कम हो जाता है, या पृथक IgA की कमी का पता चलता है, तो IgG उपवर्ग का संकेत दिया जाता है। यह IgG2 की कमी का पता लगा सकता है (IgG2 IgG का लगभग 20% बनाता है), जिसे अलग किया जा सकता है या IgA या IgG4 की कमी के साथ जोड़ा जा सकता है। यह याद रखना चाहिए कि हास्य प्रतिरक्षा प्रतिक्रिया का कार्यात्मक मूल्यांकन आईजीजी उपवर्गों के मात्रात्मक निर्धारण की तुलना में अधिक जानकारीपूर्ण अनुसंधान पद्धति है। तो, आईजीजी 2 के सामान्य स्तर के साथ, स्ट्रेप्टोकोकस न्यूमोनिया के पॉलीसेकेराइड एंटीजन के एंटीबॉडी का स्तर अक्सर कम हो जाता है। इसके साथ ही, भारी जंजीरों के संश्लेषण के उल्लंघन के कारण, इम्युनोडेफिशिएंसी के किसी भी नैदानिक अभिव्यक्तियों के अभाव में, जन्मजात IgG2 की कमी संभव है।
4. आईजीए का निर्धारण। सामान्य सीरम IgA के साथ स्रावी IgA की पृथक कमी दुर्लभ है। एक नियम के रूप में, स्रावी और सीरम IgA की एक साथ कमी होती है। पृथक IgA की कमी चिकित्सकीय रूप से मौन है या हल्के ऊपरी श्वसन पथ के संक्रमण के साथ है। यह इस तथ्य के कारण है कि आईजीए की कमी के साथ, सीरम में आईजीजी और श्लेष्म झिल्ली के स्राव में आईजीएम का स्तर प्रतिपूरक बढ़ जाता है। IgA का स्तर आँसू, लार और शरीर के अन्य तरल पदार्थों में मापा जाता है। IgA के दो उपवर्ग हैं - IgA1 और IgA2। रक्त और श्वसन पथ के स्राव में, IgA1 गैस्ट्रोइंटेस्टाइनल ट्रैक्ट - IgA2 के रहस्यों में प्रबल होता है। IgA1 और IgA2 का सामान्य स्तर।
5. इन विट्रो में इम्युनोग्लोबुलिन का संश्लेषण। यह परीक्षण उत्तेजित बी-लिम्फोसाइटों द्वारा आईजीएम, आईजीजी और आईजीए के उत्पादन को मापता है। स्वस्थ और बीमार टी- और बी-लिम्फोसाइटों को विभिन्न उत्तेजक पदार्थों के साथ मिलाकर, टी-हेल्पर्स और बी-लिम्फोसाइटों के कार्य का मूल्यांकन करना संभव है। ज्यादातर मामलों में, एंटीबॉडी की कमी प्लाज्मा कोशिकाओं में बी-लिम्फोसाइटों के बिगड़ा भेदभाव के कारण होती है।
6. एक नियम के रूप में, संदिग्ध प्राथमिक इम्युनोडेफिशिएंसी के साथ लिम्फ नोड्स की बायोप्सी नहीं की जाती है। यह केवल उन मामलों में इंगित किया जाता है जहां निदान स्पष्ट नहीं है और रोगी के लिम्फ नोड्स बढ़े हुए हैं, जिसके लिए हेमोब्लास्टोसिस को बाहर करने की आवश्यकता होती है। बायोप्सी आमतौर पर एंटीजेनिक उत्तेजना के 5-7 दिनों के बाद की जाती है। एंटीजन को उस क्षेत्र में इंजेक्ट किया जाता है, जिसमें से लिम्फ लिम्फ नोड्स के समूह में बहता है, जिनमें से एक बायोप्सी के अधीन होता है। लिम्फ नोड में ह्यूमर इम्युनिटी की कमी के साथ, प्लाज्मा कोशिकाओं की संख्या कम हो जाती है, प्राथमिक रोम की संख्या बढ़ जाती है, द्वितीयक रोम अनुपस्थित होते हैं, कॉर्टिकल पदार्थ की मोटाई कम हो जाती है, लिम्फ नोड ऊतक का पुनर्गठन देखा जाता है, और कभी-कभी मैक्रोफेज और डेंड्राइटिक कोशिकाओं की संख्या बढ़ जाती है।
7. सामान्य परिवर्तनशील हाइपोगैमाग्लोबुलिनमिया और पृथक IgA की कमी के साथ आंतों की बायोप्सी की जाती है। म्यूकोसल विलस एट्रोफी और क्रिप्टोस्पोरिडियम एसपीपी के कारण होने वाले संक्रमणों को बाहर करने के लिए क्रोनिक डायरिया और मैलाबॉस्पशन सिंड्रोम में छोटी आंत की बायोप्सी का संकेत दिया जाता है। और जिआर्डिया लैम्ब्लिया।
8. लेबल वाले इम्युनोग्लोबुलिन का उपयोग करके एंटीबॉडी के उत्सर्जन की दर का अध्ययन किया जाता है। यह अध्ययन जठरांत्र संबंधी मार्ग के माध्यम से इम्युनोग्लोबुलिन के संदिग्ध नुकसान के लिए संकेत दिया गया है।
बी सेलुलर प्रतिरक्षा का अध्ययन
1. टी-लिम्फोसाइटों के सतही प्रतिजनों का अध्ययन। प्रवाह साइटोमेट्री का उपयोग करके टी-लिम्फोसाइटों के सतह प्रतिजनों का निर्धारण आपको उनकी परिपक्वता, भेदभाव और सक्रियण का अध्ययन करने की अनुमति देता है (तालिका 18.8 और अध्याय 2 देखें)।
2. इन विट्रो में टी-लिम्फोसाइटों की उत्तेजना। अपर्याप्त सेलुलर प्रतिरक्षा के साथ इम्युनोडेफिशिएंसी में परिपक्वता और टी-लिम्फोसाइटों के भेदभाव का उल्लंघन विभिन्न स्तरों पर होता है। तो, गंभीर संयुक्त इम्युनोडेफिशिएंसी में, थाइमस में टी-लिम्फोसाइटों की परिपक्वता बाधित होती है, जो टी-लिम्फोसाइटों की सतह पर सीडी 2 एंटीजन की अनुपस्थिति से प्रकट होती है। इस रोग में सीडी3, सीडी4 की अनुपस्थिति और टी-लिम्फोसाइटों की साइटोकिन्स को संश्लेषित करने में असमर्थता भी संभव है। नग्न लिम्फोसाइट सिंड्रोम में, सक्रिय टी-लिम्फोसाइटों की झिल्ली में एचएलए वर्ग II एंटीजन की कमी होती है। विस्कॉट-एल्ड्रिच सिंड्रोम में, टी-लिम्फोसाइटों के सक्रियण में शामिल सीडी43 एंटीजन की अभिव्यक्ति कम हो जाती है। सेलुलर प्रतिरक्षा की अपर्याप्तता के साथ गंभीर इम्युनोडेफिशिएंसी टी-लिम्फोसाइटों की एक स्पष्ट शिथिलता के साथ होती है, हालांकि इन कोशिकाओं की पूर्ण और सापेक्ष संख्या सामान्य हो सकती है।
एक। इन विट्रो में टी-लिम्फोसाइटों को उत्तेजित करने के लिए निम्नलिखित पदार्थों का उपयोग किया जाता है।
1) मिटोजेन्स - फाइटोहेमाग्लगुटिनिन, कॉनकानावलिन ए, आदि - टी-लिम्फोसाइटों के गैर-विशिष्ट (एंटीजन-पहचानने वाले रिसेप्टर्स के लिए बाध्य होने के कारण नहीं) सक्रियण का कारण बनते हैं।
2) घुलनशील एंटीजन - कैंडिडा एल्बिकैंस के एंटीजन, टेटनस टॉक्सोइड - मेमोरी टी-लिम्फोसाइटों के एंटीजन-पहचानने वाले रिसेप्टर्स के लिए बाध्यकारी, इन कोशिकाओं के विशिष्ट सक्रियण का कारण बनते हैं।
3) एलोजेनिक कोशिकाएं (लिम्फोसाइटों की मिश्रित संस्कृति में) टी-लिम्फोसाइटों को सक्रिय करती हैं, क्योंकि वे अपनी सतह पर एचएलए वर्ग II एंटीजन ले जाती हैं।
4) उनके सक्रियण में शामिल टी-लिम्फोसाइटों के सतह प्रतिजनों के लिए एंटीबॉडी - सीडी 2, सीडी 3, सीडी 43।
5) रसायन जैसे कि फोर्बोल मिरिस्टेट एसीटेट (प्रोटीन किनसे सी को सक्रिय करता है) और आयनोमाइसिन (इंट्रासेल्युलर कैल्शियम को बढ़ाता है)।
बी। टी-लिम्फोसाइटों की सक्रियता का आकलन आमतौर पर निम्नलिखित संकेतकों द्वारा किया जाता है।
1) प्रसार।
2) साइटोकिन्स का उत्पादन - इंटरल्यूकिन्स-2, -4, -5, इंटरफेरॉन गामा और ट्यूमर नेक्रोसिस फैक्टर।
3) सक्रियण मार्करों की अभिव्यक्ति - सीडी 25 और एचएलए वर्ग II एंटीजन।
4) साइटोटोक्सिसिटी।
में। माइटोजेन, एंटीजन और एलोजेनिक कोशिकाओं की कार्रवाई के तहत, आराम करने वाले टी-लिम्फोसाइट्स सक्रिय होते हैं, ब्लास्ट कोशिकाओं में बदल जाते हैं और विभाजित होने लगते हैं। इस प्रकार, डीएनए में 3H- या 14C-thymidine को शामिल करके लिम्फोसाइट सक्रियण का आकलन किया जा सकता है। उत्तेजक के लिए लिम्फोसाइटों की प्रतिक्रिया खुराक और ऊष्मायन की अवधि के आधार पर भिन्न होती है, इसलिए, अध्ययन करने से पहले, उत्तेजक की खुराक और समय पर आइसोटोप समावेशन के स्तर की निर्भरता के सामान्य वक्रों को प्लॉट करना आवश्यक है। लिम्फोसाइटों का ऊष्मायन। कोशिकाओं की रेडियोधर्मिता का स्तर एक जगमगाहट काउंटर का उपयोग करके निर्धारित किया जाता है और प्रति मिनट दालों की संख्या में व्यक्त किया जाता है। परिणाम का मूल्यांकन अस्थिर (सहज प्रसार) और उत्तेजित लिम्फोसाइटों की रेडियोधर्मिता के स्तर के साथ-साथ उत्तेजना सूचकांक (उत्तेजित लिम्फोसाइटों की रेडियोधर्मिता के स्तर का अनुपात अस्थिर लिम्फोसाइटों की रेडियोधर्मिता के स्तर) द्वारा किया जाता है। इसके अलावा, एक बीमार और स्वस्थ व्यक्ति के उत्तेजित लिम्फोसाइटों की रेडियोधर्मिता के स्तर के अनुपात की गणना की जा सकती है। लिम्फोसाइटों का सहज प्रसार उन रोगियों में बढ़ जाता है जिन्होंने कई रक्त आधान किया है, एलर्जी और ऑटोइम्यून बीमारियों वाले रोगियों में, जीवाणु और वायरल संक्रमण के साथ-साथ नवजात शिशुओं में भी।
डी. एलोजेनिक बी-लिम्फोसाइट्स और मोनोसाइट्स के एचएलए एंटीजन को पहचानने के लिए टी-लिम्फोसाइटों की क्षमता का मूल्यांकन करने के लिए लिम्फोसाइटों की मिश्रित संस्कृति का उपयोग किया जाता है। उत्तेजक कोशिकाएं (एलोजेनिक बी-लिम्फोसाइट्स) विकिरण या माइटोमाइसिन द्वारा निष्क्रिय होती हैं। रोगी के लिम्फोसाइटों की प्रतिक्रिया का आकलन डीएनए में लेबल किए गए थाइमिडीन को शामिल करके किया जाता है (अध्याय 17, पैराग्राफ II.A.3 और अध्याय 20, पैराग्राफ III.B.2.a देखें)।
3. कभी-कभी डिनिट्रोक्लोरोबेंजीन के साथ टीकाकरण का उपयोग सेलुलर प्रतिरक्षा का आकलन करने के लिए किया जाता है। यह अंतःस्रावी रूप से और केवल नैदानिक उद्देश्यों के लिए प्रशासित किया जाता है। हालांकि, क्योंकि डाइनिट्रोक्लोरोबेंजीन एक मजबूत अड़चन और एक कार्सिनोजेन है, यह परीक्षण शायद ही कभी किया जाता है।
4. जैव रासायनिक अनुसंधान। यदि हास्य और सेलुलर प्रतिरक्षा की एक संयुक्त कमी का संदेह है, तो एडेनोसिन डेमिनमिनस और प्यूरीन न्यूक्लियोसाइड फॉस्फोरिलेज़ (न्यूक्लियोसाइड्स के चयापचय में शामिल) की गतिविधि निर्धारित की जाती है। गतिभंग-टेलैंगिएक्टेसिया के साथ, सीरम में अल्फा-भ्रूणप्रोटीन का स्तर लगभग हमेशा ऊंचा होता है, जिससे इस रोग को अन्य तंत्रिका रोगों से अलग करना संभव हो जाता है। दुर्लभ करने के लिए चयापचयी विकारसेलुलर प्रतिरक्षा की अपर्याप्तता के साथ, ऑरोटिक एसिडुरिया और कार्बोक्सिलेज की बायोटिन-निर्भर अपर्याप्तता (खालित्य और तंत्रिका संबंधी विकारों द्वारा प्रकट) शामिल हैं। ट्रांसकोबालामिन II की कमी (विटामिन बी 12 के परिवहन में भाग लेता है) के साथ, तेजी से नवीकरण करने वाले ऊतक प्रभावित होते हैं, इसलिए, इस रोग को हास्य प्रतिरक्षा, हेमटोपोइएटिक विकारों (एनीमिया, थ्रोम्बोसाइटोपेनिया), दस्त और विकासात्मक देरी की कमी की विशेषता है।
5. आनुवंशिक अनुसंधान। कोशिकीय प्रतिरक्षा की गंभीर कमी वाले रोगियों में, चिमरवाद संभव है (एक जीव में विभिन्न जीनोटाइप की कोशिकाओं का अस्तित्व)। यह तब होता है जब मातृ रक्त कोशिकाएं भ्रूण के रक्त में प्रवेश करती हैं, रक्त घटकों का आधान और अस्थि मज्जा प्रत्यारोपण। यदि रोगी के रक्त में विपरीत लिंग की मानव कोशिकाएं होती हैं, तो महिला और पुरुष कैरियोटाइप वाली कोशिकाओं को ढूंढकर काइमेरिज्म की पहचान करना आसान होता है। अन्य मामलों में, रोगी की रक्त कोशिकाओं को एचएलए के अनुसार टाइप किया जाता है। इस अध्ययन से नग्न लिम्फोसाइट सिंड्रोम में सक्रिय टी-लिम्फोसाइटों पर एचएलए वर्ग II एंटीजन की अनुपस्थिति का भी पता चलता है।
6. स्कैनिंग इलेक्ट्रॉन माइक्रोस्कोपी से टी-लिम्फोसाइट्स का पता चलता है, जिसकी सतह पर कोई माइक्रोविली नहीं होती है, जो कि विस्कॉट-एल्ड्रिच सिंड्रोम के लिए विशिष्ट है।
7. गंभीर संयुक्त इम्यूनोडिफ़िशिएंसी के निदान की पुष्टि करने के लिए कुछ मामलों में थाइमस बायोप्सी की जाती है। थाइमस में अपर्याप्त सेलुलर प्रतिरक्षा के साथ, रेटिकुलोएपिथेलियल कोशिकाओं का संचय, हसल के शरीर की अनुपस्थिति और कॉर्टिकल और मज्जा के बीच एक स्पष्ट सीमा, और थाइमोसाइट्स की संख्या में तेज कमी निर्धारित की जाती है। थाइमस बायोप्सी उन सर्जनों द्वारा की जाती है जो इस ऑपरेशन की तकनीक जानते हैं।
8. लिम्फ नोड्स की बायोप्सी। लिम्फ नोड के बायोप्सी नमूने में सेलुलर प्रतिरक्षा की अपर्याप्तता के मामले में, पैराकोर्टिकल ज़ोन की तबाही का पता चलता है। घाव के संक्रमण और संज्ञाहरण जटिलताओं के जोखिम के कारण, लिम्फ नोड बायोप्सी केवल तब की जाती है जब अन्य प्रयोगशाला परीक्षण निदान की पुष्टि नहीं कर सकते।
बी। फागोसाइट्स के अध्ययन को पुराने और आवर्तक जीवाणु संक्रमण के लिए संकेत दिया जाता है, यदि हास्य और सेलुलर प्रतिरक्षा के अध्ययन से असामान्यताएं प्रकट नहीं होती हैं। फागोसाइट्स की अपर्याप्तता प्रवास के उल्लंघन, केमोटैक्सिस, फागोसाइट्स के आसंजन के साथ-साथ फागोसाइटोसिस के उल्लंघन के कारण हो सकती है। इसके अलावा, फागोसाइट की कमी ऑप्सोनिन (एंटीबॉडी और पूरक) की कमी और फागोसाइट्स के खराब चयापचय के कारण हो सकती है।
1. क्रोनिक ग्रैनुलोमेटस रोग के निदान में नाइट्रोब्लू टेट्राजोलियम रिकवरी टेस्ट लागू किया जाता है। विधि का सार इस प्रकार है: पीले डाई नाइट्रोसाइन टेट्राजोलियम को फागोसाइट्स में जोड़ा जाता है, आम तौर पर, जब इसे अवशोषित किया जाता है, तो फागोसाइट्स की चयापचय गतिविधि बढ़ जाती है, नाइट्रोसिन टेट्राजोलियम बहाल हो जाता है, इस प्रतिक्रिया के उत्पाद नीले रंग के होते हैं। फागोसाइट्स के चयापचय के उल्लंघन को नीले धुंधलापन की तीव्रता में कमी से आंका जाता है। यदि उल्लंघन का पता चला है, तो साइटोक्रोम बी 558 और अन्य फागोसाइट प्रोटीन का स्तर निर्धारित किया जाता है।
2. केमिलुमिनेसेंस भी फागोसाइट्स की कार्यात्मक गतिविधि का आकलन करना संभव बनाता है। आम तौर पर, फागोसाइटोसिस के दौरान, बड़ी संख्या में मुक्त ऑक्सीजन रेडिकल दिखाई देते हैं, सब्सट्रेट को ऑक्सीकरण करते हैं, उदाहरण के लिए, जीवाणु कोशिका दीवार के घटक। ऑक्सीकरण दृश्य या पराबैंगनी प्रकाश के उत्सर्जन के साथ होता है। फागोसाइट्स की कार्यात्मक गतिविधि का न्याय करने के लिए विकिरण की तीव्रता का उपयोग किया जा सकता है।
3. फागोसाइटिक गतिविधि का मूल्यांकन ऑप्सोनिन और फागोसाइट्स की कार्यात्मक स्थिति का अध्ययन करने का सबसे जानकारीपूर्ण तरीका है।
एक। तकनीक
1) रोगी के रक्त से पृथक ल्यूकोसाइट्स को सीरम से धोया जाता है, गिना जाता है और स्वस्थ या बीमार सीरम (ऑप्सोनिन का स्रोत) और जीवित बैक्टीरिया (आमतौर पर स्टैफिलोकोकस ऑरियस या एस्चेरिचिया कोलाई) युक्त माध्यम में रखा जाता है।
2) मिश्रण को 37 डिग्री सेल्सियस पर इनक्यूबेट किया जाता है, ऊष्मायन की शुरुआत के 0, 30, 60 और 120 मिनट के बाद नमूने लिए जाते हैं। व्यवहार्य जीवाणुओं की संख्या निर्धारित करने के लिए, प्रत्येक नमूने को तेजी से ठंडा किया जाता है और टीका लगाया जाता है।
3) ऊष्मायन की शुरुआत के 2 घंटे बाद, मिश्रण को सेंट्रीफ्यूज किया जाता है। ल्यूकोसाइट्स और फागोसाइटेड बैक्टीरिया नीचे की ओर बस जाते हैं, जबकि गैर-फागोसाइटेड बैक्टीरिया सतह पर तैरते रहते हैं। व्यवहार्य जीवाणुओं की संख्या तलछट और सतह पर तैरनेवाला में निर्धारित होती है।
बी। परिणामों का मूल्यांकन। आम तौर पर, लगभग 95% बैक्टीरिया 2 घंटे के भीतर फागोसाइट्स द्वारा अवशोषित और नष्ट हो जाते हैं। पुरानी ग्रैनुलोमेटस बीमारी में, नष्ट बैक्टीरिया की संख्या 10% से अधिक नहीं होती है, और ल्यूकोसाइट्स के अंदर व्यवहार्य बैक्टीरिया पाए जाते हैं। स्वस्थ सीरम के साथ ऊष्मायन के दौरान ल्यूकोसाइट्स में जीवित बैक्टीरिया की उपस्थिति बैक्टीरिया को पकड़ने की क्षमता में कमी के अभाव में बैक्टीरिया के पाचन के उल्लंघन का संकेत देती है। बढ़ी हुई सामग्रीसतह पर तैरनेवाला में व्यवहार्य बैक्टीरिया जब रोगी के सीरम के साथ ऊष्मायन किया जाता है तो यह ऑप्सनिन की कमी को इंगित करता है।
4. ल्यूकोसाइट्स के केमोटैक्सिस। केमोटैक्सिस का उल्लंघन फागोसाइट्स में दोष, केमोटैक्सिस के अवरोधकों की उपस्थिति, सीरम या ऊतक केमोटैक्सिस कारकों की कमी के कारण हो सकता है।
एक। त्वचा खिड़की विधि। एक स्केलपेल का उपयोग करके, 4 मिमी 2 के क्षेत्र के साथ एपिडर्मिस की सतह परत को हटा दिया जाता है (इस मामले में थोड़ी मात्रा में रक्त दिखाई देना चाहिए)। क्षतिग्रस्त क्षेत्र पर एक कवर ग्लास रखा गया है। दिन के दौरान, हर 0.5-2 घंटे में कवरस्लिप बदल दी जाती है। फिर स्लाइड्स को दाग दिया जाता है और उन पर मौजूद श्वेत रक्त कोशिकाओं की माइक्रोस्कोप के तहत जांच की जाती है। आम तौर पर, पहले 2 घंटों के दौरान, चोट वाली जगह पर न्यूट्रोफिल का प्रवाह होता है। अगले 12 घंटों में, न्यूट्रोफिल को मोनोसाइट्स द्वारा बदल दिया जाता है।
बी। इन विट्रो में केमोटैक्सिस का अध्ययन केमोटैक्सिस कारकों द्वारा रक्त से पृथक फागोसाइट्स की उत्तेजना पर आधारित है। निर्देशित प्रवास के लिए फागोसाइट्स की क्षमता का आकलन उन्हें बॉयडेन कक्ष या पेट्री डिश में agarose के साथ रखकर किया जा सकता है।
5. ल्यूकोसाइट्स का आसंजन। ल्यूकोसाइट्स के आसंजन का उल्लंघन अभिव्यक्ति में कमी या उनकी सतह पर आसंजन अणुओं की अनुपस्थिति के कारण होता है, उदाहरण के लिए, CD11/CD18। फ्लो साइटोमेट्री का उपयोग आसंजन अणुओं को निर्धारित करने के लिए किया जाता है। न्यूट्रोफिल और मोनोसाइट्स पर CD11/CD18 की अनुपस्थिति देर से गर्भनाल टुकड़ी, आवर्तक द्वारा प्रकट होती है जीवाण्विक संक्रमण, पीरियोडोंटाइटिस। ल्यूकोसाइट्स के आसंजन का आकलन एंडोथेलियल कोशिकाओं का पालन करने की उनकी क्षमता से भी किया जा सकता है। हालाँकि, यह अध्ययन केवल कुछ शोध प्रयोगशालाओं में किया जाता है।
6. एस्प्लेनिया का निदान। प्लीहा संक्रमण से बचाने में महत्वपूर्ण भूमिका निभाता है क्योंकि इसमें होता है बड़ी राशिमैक्रोफेज और प्लाज्मा कोशिकाएं। सेप्सिस अक्सर एस्प्लेनिया के रोगियों में देखा जाता है, और विकृत एरिथ्रोसाइट्स और गोवेल-जॉली निकायों को रक्त स्मीयरों में पाया जाता है। स्किंटिग्राफी और अन्य का उपयोग करके एस्प्लेनिया का पता लगाया जाता है वाद्य तरीकेअनुसंधान।
7. अन्य अध्ययन। मायलोपरोक्सीडेज, ग्लूटाथियोन पेरोक्सीडेज, लाइसोजाइम, जी-6-पीडी, पाइरूवेट किनेज और इलेक्ट्रॉन माइक्रोस्कोपी की गतिविधि का निर्धारण फागोसाइट्स की छोटी-मोटी खराबी का पता लगाने और वैज्ञानिक उद्देश्यों के लिए किया जाता है। न्यूट्रोपेनिया के साथ, रक्त में ल्यूकोसाइट्स की संख्या के बार-बार निर्धारण, कॉर्टिकोस्टेरॉइड्स, एड्रेनालाईन और एंडोटॉक्सिन के प्रशासन के बाद रक्त में ल्यूकोसाइट्स की संख्या का निर्धारण, ल्यूकोसाइट्स के लिए एंटीबॉडी का निर्धारण, अस्थि मज्जा परीक्षा का संकेत दिया जाता है।
8. अस्थि मज्जा परीक्षा लगातार ल्यूकोपेनिया या ल्यूकोसाइटोसिस के साथ की जाती है, ल्यूकोसाइट्स के आकारिकी में परिवर्तन, रक्त में विस्फोट के रूपों का पता लगाना।
डी पूरक अध्ययन। यदि इतिहास के डेटा (तालिका 18.9 देखें) और बुनियादी प्रयोगशाला परीक्षण पूरक कमी का संकेत देते हैं, तो इसके गहन अध्ययन का संकेत दिया जाता है। इसमें पूरक घटकों का परिमाणीकरण और कार्यात्मक मूल्यांकन, पूरक सक्रियण के वैकल्पिक मार्ग का अध्ययन, ऑप्सोनिन और सीरम केमोटैक्सिस कारकों का निर्धारण शामिल है। अध्ययन किए गए सीरम में ओपसोनिन की कमी सामान्य ल्यूकोसाइट्स द्वारा बैक्टीरिया और खमीर कवक के फागोसाइटोसिस को बढ़ाने में असमर्थता से प्रमाणित होती है।
D. प्रसव पूर्व निदान और आनुवंशिक परामर्श। आज तक, यह स्थापित किया गया है कि कई इम्युनोडेफिशिएंसी हैं वंशानुगत रोग: उनके वंशानुक्रम के प्रकार का पता चल जाता है, दोषपूर्ण जीन के स्थान का पता चलता है, इस जीन का उत्पाद निर्धारित होता है (तालिका 18.4 देखें)। वर्तमान में, दोषपूर्ण जीन के कैरिज की पहचान करना संभव हो गया है। तो, एक एंजाइम को कूटने वाले दोषपूर्ण जीन की विषमयुग्मजी गाड़ी का पता इस एंजाइम की गतिविधि में कमी से लगाया जा सकता है, उदाहरण के लिए, ऑटोसोमल रिसेसिव गंभीर संयुक्त इम्युनोडेफिशिएंसी में, एडेनोसिन डेमिनमिनस की गतिविधि कम हो जाती है, क्रोनिक ग्रैनुलोमेटस रोग में - श्वसन श्रृंखला एंजाइम , एक्स-लिंक्ड एग्माग्लोबुलिनमिया में - बी-लिम्फोसाइटों में टाइरोसिन किनसे। बिगड़ा हुआ एंजाइम संश्लेषण से जुड़े कई दोषों की भी पहचान की गई है, उदाहरण के लिए, एक्स-लिंक्ड गंभीर संयुक्त इम्युनोडेफिशिएंसी में - इंटरल्यूकिन -2 रिसेप्टर की गामा श्रृंखला का संश्लेषण बिगड़ा हुआ है, आईजीएम हाइपरप्रोडक्शन सिंड्रोम - ग्लाइकोप्रोटीन का संश्लेषण कोशिका झिल्ली gp39 - CD40 B-लिम्फोसाइट रिसेप्टर का लिगैंड। एक्स-लिंक्ड इम्युनोडेफिशिएंसी वाली लड़कियों में, लिम्फोसाइटों के बिगड़ा हुआ भेदभाव (एक्स-लिंक्ड एग्माग्लोबुलिनमिया, एक्स-लिंक्ड गंभीर संयुक्त इम्युनोडेफिशिएंसी, विस्कॉट-एल्ड्रिच सिंड्रोम) से प्रकट होता है, रक्त में विभेदित और अविभाजित लिम्फोसाइट्स दोनों का पता लगाया जाता है। यह इस तथ्य के कारण है कि दोषपूर्ण जीन को ले जाने वाला एक्स गुणसूत्र केवल कुछ कोशिकाओं में निष्क्रिय होता है। इन इम्युनोडेफिशिएंसी की नैदानिक अभिव्यक्तियों की अनुपस्थिति में अविभाजित लिम्फोसाइटों की उपस्थिति दोषपूर्ण जीन की गाड़ी को इंगित करती है। प्रतिबंध खंड लंबाई बहुरूपता विश्लेषण भी परिवार में दोषपूर्ण जीन के वाहक की पहचान करना संभव बनाता है। प्रयोगशाला के तरीकेप्रसवपूर्व निदान गर्भनाल रक्त कोशिकाओं और एमनियोटिक द्रव, साथ ही कोरियोनिक विली के अध्ययन पर आधारित होते हैं। तो, गंभीर संयुक्त इम्युनोडेफिशिएंसी के सभी रूपों में, टी-लिम्फोसाइट्स गर्भनाल रक्त में अनुपस्थित हैं; विस्कॉट-एल्ड्रिच सिंड्रोम में, माइक्रोविली से रहित थ्रोम्बोसाइटोपेनिया और टी-लिम्फोसाइट्स पाए जाते हैं। तालिका में। 18.4 कुछ प्राथमिक इम्युनोडेफिशिएंसी के निदान के लिए वंशानुक्रम के प्रकार और आनुवंशिक तरीकों का उपयोग करने की संभावना को इंगित करता है।
वी सामान्य सिद्धांतइम्युनोडेफिशिएंसी का उपचार। इम्युनोडेफिशिएंसी वाले मरीजों को विशेष ध्यान देने की आवश्यकता होती है और उन्हें न केवल निरंतर चिकित्सा देखभाल की आवश्यकता होती है, बल्कि मनोवैज्ञानिक और सामाजिक समर्थन की भी आवश्यकता होती है।
आहार। malabsorption syndrome की अनुपस्थिति में, किसी आहार की आवश्यकता नहीं होती है। गैस्ट्रोइंटेस्टाइनल विकारों की उपस्थिति में, पोषण विशेषज्ञ के साथ परामर्श आवश्यक है। सामान्य वृद्धि और विकास सुनिश्चित करने के लिए आहार को प्रोटीन, विटामिन और ट्रेस तत्वों की आवश्यकता को पूरा करना चाहिए और कैलोरी में उच्च होना चाहिए। इम्युनोडेफिशिएंसी में अल्पपोषण से प्रतिरक्षा का और भी अधिक दमन हो सकता है।
बी. संक्रमण प्रोफिलैक्सिस को सभी इम्युनोकॉम्प्रोमाइज्ड रोगियों के लिए संकेत दिया जाता है, विशेष रूप से गंभीर संयुक्त इम्युनोडेफिशिएंसी वाले।
1. गंभीर संयुक्त इम्यूनोडिफ़िशिएंसी वाले शिशुओं का पूर्ण अलगाव और उन्हें बाँझ बक्से में रखने से रोगाणुओं से संपर्क समाप्त हो जाता है, लेकिन इसके लिए विशेष उपकरण और उच्च सामग्री लागत की आवश्यकता होती है। अधूरा अलगाव कम प्रभावी होता है, क्योंकि इम्युनोडेफिशिएंसी में गंभीर संक्रमण सूक्ष्मजीवों के कारण भी होते हैं जो स्वस्थ लोगों के लिए रोगजनक नहीं होते हैं। घर पर संक्रमण के जोखिम को कम करने के लिए, यह आवश्यक है कि रोगी एक अलग बिस्तर पर सोए, उसका अपना कमरा हो, संक्रामक रोगियों के संपर्क से बचें, खासकर अगर संक्रमण दाद सिंप्लेक्स वायरस या वैरिकाला-जोस्टर के कारण होता है।
2. इम्युनोग्लोबुलिन के साथ रिप्लेसमेंट थेरेपी कई रोगियों को सामान्य जीवन जीने की अनुमति देती है, जिनमें ह्यूमर इम्युनिटी की कमी होती है। बीमार बच्चे के माता-पिता को समझाया जाता है कि उसे अत्यधिक देखभाल की आवश्यकता नहीं है, ताजी हवा में चलने से बचना चाहिए, अन्य बच्चों के साथ खेल सकते हैं और प्री-स्कूल संस्थानों और स्कूल में भाग ले सकते हैं।
बी संक्रमण का उपचार
1. क्रोनिक ओटिटिस मीडिया का इलाज रोगाणुरोधी एजेंटों के साथ किया जाता है। यदि आवश्यक हो, तो सर्जिकल उपचार किया जाता है। श्रवण हानि का शीघ्र पता लगाने और उपचार के लिए, नियमित रूप से एक श्रवण परीक्षण किया जाता है।
2. श्वसन पथ के पुराने संक्रमण। वर्ष में कम से कम एक बार (यदि बिगड़ती है - अधिक बार) समारोह की जांच करें बाह्य श्वसनऔर छाती का एक्स-रे लें। ब्रोन्किइक्टेसिस के साथ, पोस्टुरल ड्रेनेज और इनहेलेशन पर विशेष ध्यान दिया जाता है, जिसे घर पर किया जा सकता है (अध्याय 7 देखें, पैराग्राफ V.A.6-7)।
3. साइनसाइटिस। तेज होने के मामले में, रोगाणुरोधी और वैसोकॉन्स्ट्रिक्टर एजेंट निर्धारित हैं। यदि दवा उपचार अप्रभावी है, तो संक्रमण का प्रेरक एजेंट निर्धारित किया जाता है और परानासल साइनस को हटा दिया जाता है। परानासल साइनस पर अन्य ऑपरेशन दुर्लभ हैं, खासकर छोटे बच्चों में।
डी. गंभीर इम्युनोडेफिशिएंसी वाले रोगियों के लिए विशेष रूप से मनोसामाजिक समर्थन की आवश्यकता होती है, क्योंकि वे गंभीर मनोवैज्ञानिक और वित्तीय कठिनाइयों का अनुभव करते हैं। स्कूल के शिक्षकों को बच्चे की बीमारी के बारे में पता होना चाहिए और उसके साथ अतिरिक्त कक्षाओं का ध्यान रखना चाहिए। इम्यून डेफिसिएंसी फाउंडेशन और नेशनल ऑर्गनाइजेशन फॉर रेयर डिजीज इम्युनोडेफिशिएंसी वाले लोगों को शैक्षिक साहित्य और अन्य सहायता प्रदान करते हैं।
डी सावधानियां
1. यदि सेलुलर प्रतिरक्षा की कमी का संदेह है, तो पूरे रक्त संक्रमण से बचा जाना चाहिए क्योंकि दाता लिम्फोसाइट्स भ्रष्टाचार-बनाम-होस्ट रोग का कारण बन सकते हैं। यदि रक्त आधान आवश्यक है, तो इसे 30 Gy की खुराक पर विकिरणित किया जाता है। इसके अलावा, साइटोमेगालोवायरस और हेपेटाइटिस बी, सी और डी वायरस की उपस्थिति के लिए सभी रक्त घटकों की सावधानीपूर्वक जांच की जाती है।
2. जीवित वायरस के टीके, जैसे कि जीवित पोलियो वैक्सीन, खसरा, कण्ठमाला और रूबेला वैक्सीन, और बीसीजी, प्रतिरक्षाविहीन रोगियों में contraindicated हैं। अतीत में, जब चेचक के टीके का व्यापक रूप से उपयोग किया जाता था, तब यह रोगी के परिवार के सदस्यों को भी नहीं दिया जाता था। वर्तमान में, एक रोगी के परिवार के सदस्यों को एक जीवित पोलियो वैक्सीन के टीकाकरण से बचा जाता है, इसके बजाय निष्क्रिय पोलियो वैक्सीन का उपयोग किया जाता है (तालिका 21.5 देखें)। निष्क्रिय टीके आम तौर पर सुरक्षित होते हैं और इनका उपयोग नैदानिक उद्देश्यों के लिए भी किया जा सकता है। टीकों को अच्छी तरह से साफ किया जाना चाहिए। विस्कॉट-एल्ड्रिच सिंड्रोम वाले रोगियों में खराब शुद्ध निष्क्रिय निष्क्रिय टाइफाइड वैक्सीन के उपयोग के साथ एनाफिलेक्टिक सदमे के मामलों का वर्णन किया गया है। इस मामले में एनाफिलेक्टिक झटका, जाहिरा तौर पर, टीके में एंडोटॉक्सिन के मिश्रण और इसे अवरुद्ध करने वाले एंटीबॉडी की कमी के कारण होता है।
3. टॉन्सिल्लेक्टोमी और एडिनोटॉमी सख्त संकेतों के अनुसार किए जाते हैं। विस्कॉट-एल्ड्रिच सिंड्रोम के साथ अत्यंत दुर्लभ मामलों में स्प्लेनेक्टोमी की जाती है, जब रक्तस्राव को रोका नहीं जा सकता है। अन्य मामलों में, इसे contraindicated है क्योंकि इससे गंभीर संक्रमण का खतरा बढ़ जाता है।
4. कॉर्टिकोस्टेरॉइड्स और अन्य इम्यूनोसप्रेसेन्ट्स का उपयोग शायद ही कभी किया जाता है।
ई. रोगाणुरोधी
1. संक्रमण का उपचार। बुखार और संक्रमण की अन्य अभिव्यक्तियों के साथ, रोगाणुरोधी चिकित्सा तुरंत शुरू हो जाती है, बिना बीज बोने के परिणामों की प्रतीक्षा किए और रोगज़नक़ की संवेदनशीलता का निर्धारण। यदि उपचार अप्रभावी है, तो बुवाई के परिणामों और रोगज़नक़ की संवेदनशीलता का निर्धारण करने के लिए, एक और दवा निर्धारित की जाती है। उपचार के नियम सामान्य प्रतिरक्षा वाले रोगियों के समान हैं। यदि रोगाणुरोधी एजेंट अप्रभावी हैं, तो एक माइकोबैक्टीरियल, वायरल, प्रोटोजोअल या फंगल संक्रमण का संदेह होना चाहिए।
2. निवारक उपयोगरोगाणुरोधी एजेंट विस्कॉट-एल्ड्रिच सिंड्रोम जैसे गंभीर संक्रमणों के साथ इम्युनोडेफिशिएंसी में प्रभावी होते हैं। दीर्घकालिक रोगाणुरोधी प्रोफिलैक्सिस के लिए कई नियम हैं। उनमें से एक के अनुसार, कई रोगाणुरोधी एजेंटों को एक साथ 1-2 महीने के पाठ्यक्रमों के बीच अंतराल के साथ निर्धारित किया जाता है। यह योजना संक्रमण का दमन प्रदान करती है और सूक्ष्मजीवों के प्रतिरोधी उपभेदों के उद्भव को रोकती है। बच्चों को आमतौर पर एमोक्सिसिलिन/क्लैवुलनेट, एरिथ्रोमाइसिन और टीएमपी/एसएमएक्स या सेफलोस्पोरिन समूह की कोई भी दवा, वयस्क - एमोक्सिसिलिन/क्लैवुलनेट, टीएमपी/एसएमएक्स और टेट्रासाइक्लिन या सेफलोस्पोरिन समूह की कोई भी दवा दी जाती है।
VI. व्यक्तिगत इम्युनोडेफिशिएंसी का उपचार
ए हास्य प्रतिरक्षा की अपर्याप्तता
1. सामान्य इम्युनोग्लोबुलिन के साथ रिप्लेसमेंट थेरेपी गंभीर ह्यूमर इम्युनिटी की कमी के इलाज का मुख्य तरीका है। प्रतिस्थापन चिकित्सा का लक्ष्य समर्थन करना है सामान्य स्तरआईजीजी सामान्य इम्युनोग्लोबुलिन को सेप्सिस को रोकने और सीओपीडी की ओर ले जाने वाले श्वसन पथ के संक्रमण का इलाज करने के लिए पर्याप्त खुराक पर प्रशासित किया जाता है। इन दवाओं को एक्स-लिंक्ड एग्माग्लोबुलिनमिया, कॉमन वेरिएबल हाइपोगैमाग्लोबुलिनमिया, आईजीएम हाइपरप्रोडक्शन सिंड्रोम, गंभीर संयुक्त इम्युनोडेफिशिएंसी, विस्कॉट-एल्ड्रिच सिंड्रोम के लिए संकेत दिया गया है। ज्यादातर मामलों में बच्चों में क्षणिक हाइपोगैमाग्लोबुलिनमिया को सामान्य इम्युनोग्लोबुलिन के साथ उपचार की आवश्यकता नहीं होती है। सामान्य इम्युनोग्लोबुलिन पृथक IgA की कमी में contraindicated हैं (कारण भारी जोखिमएनाफिलेक्टिक झटका बहिर्जात IgA के खिलाफ IgE के उत्पादन के कारण)।
1) अंतःशिरा प्रशासन के लिए सामान्य इम्युनोग्लोबुलिन लिखिए। सामान्य इम्युनोग्लोबुलिन की तुलना में इसके निम्नलिखित फायदे हैं: 1) इम्युनोग्लोबुलिन का अंतःशिरा प्रशासन इंट्रामस्क्युलर इंजेक्शन की तुलना में कम दर्दनाक है; 2) में / आप दवा की एक उच्च खुराक दर्ज कर सकते हैं; 3) अंतःशिरा प्रशासन के साथ, सीरम में आईजीजी का उच्च स्तर हासिल किया जाता है। अंतःशिरा प्रशासन के लिए सामान्य इम्युनोग्लोबुलिन की कई तैयारी हैं (तालिका 18.10 देखें)। इनमें से अधिकांश दवाएं अच्छी तरह से सहन की जाती हैं और इम्युनोडेफिशिएंसी में प्रभावी होती हैं। प्रारंभिक खुराक आमतौर पर 300-400 मिलीग्राम / किग्रा / माह है। 4 सप्ताह के उपचार के बाद सीरम में आईजीजी का न्यूनतम स्तर मानक की निचली सीमा तक पहुंचना चाहिए और कम से कम 500 मिलीग्राम% होना चाहिए। कुछ अध्ययनों से पता चला है कि सामान्य अंतःशिरा इम्युनोग्लोबुलिन (600 मिलीग्राम / किग्रा / माह तक) की उच्च खुराक पुरानी श्वसन पथ के संक्रमण में प्रभावी होती है। उपचार की प्रभावशीलता और सीरम में आईजीजी के न्यूनतम स्तर को ध्यान में रखते हुए, दवा के प्रशासन की खुराक और आवृत्ति को व्यक्तिगत रूप से चुना जाता है।
2) सामान्य इम्युनोग्लोबुलिन। रखरखाव की खुराक आमतौर पर 100 मिलीग्राम / किग्रा / माह (0.6 मिली / किग्रा / माह) होती है, जो रखरखाव की खुराक से 2-3 गुना अधिक होती है। एक रखरखाव खुराक हर 3-4 सप्ताह में प्रशासित किया जाता है। एक बार वयस्क होने पर, आप एक महीने के लिए सामान्य इम्युनोग्लोबुलिन के 20 मिलीलीटर से अधिक नहीं दर्ज कर सकते हैं - 40 मिलीलीटर से अधिक। सामान्य इम्युनोग्लोबुलिन की एक बड़ी खुराक की शुरूआत काफी दर्दनाक होती है, इसलिए बड़े बच्चे और वयस्क एकल खुराक को विभाजित करते हैं और 5 मिलीलीटर को अलग-अलग क्षेत्रों में इंजेक्ट करते हैं, हर 1-2 सप्ताह में इंजेक्शन दोहराते हैं। दवा को नितंबों और जांघों के सामने इंजेक्ट करना सबसे अच्छा है। संक्रमण को रोकने और सीरम आईजीजी स्तर 200 मिलीग्राम% से ऊपर बनाए रखने के लिए, सामान्य इम्युनोग्लोबुलिन का लगातार प्रशासन अधिक प्रभावी होता है। सामान्य इम्युनोग्लोबुलिन की प्रभावशीलता का आकलन करने के लिए सीरम आईजीजी स्तरों का बार-बार माप अव्यावहारिक है, क्योंकि विभिन्न रोगियों में दवा के प्रशासन के बाद सीरम में आईजीजी का स्तर असमान रूप से बढ़ता है और अवशोषण की दर, इंजेक्शन स्थल पर प्रोटियोलिसिस और ऊतकों में वितरण पर निर्भर करता है। . पर मामूली संक्रमणइम्युनोग्लोबुलिन का चयापचय बढ़ जाता है, इस संबंध में, दवा की एक अतिरिक्त खुराक को प्रशासित करना अक्सर आवश्यक होता है।
बी। दुष्प्रभाव
1) सामान्य इम्युनोग्लोबुलिन का उपयोग करते समय स्थानीय प्रतिक्रियाएं विशेष रूप से स्पष्ट होती हैं। इनमें इंजेक्शन स्थल पर कोमलता, सड़न रोकनेवाला फोड़ा, फाइब्रोसिस, चोट शामिल हैं सशटीक नर्व(शायद ही कभी होता है)। रक्तस्रावी सिंड्रोम में, सामान्य इम्युनोग्लोबुलिन को contraindicated है।
2) प्रणालीगत प्रतिक्रियाएं। सामान्य इम्युनोग्लोबुलिन का उपयोग करते समय, बुखार, ठंड लगना, मतली, उल्टी और पीठ दर्द संभव है। प्रणालीगत प्रतिक्रियाओं का जोखिम दवा के प्रशासन की दर और सहवर्ती संक्रमण की उपस्थिति पर निर्भर करता है। अधिक गंभीर प्रतिक्रियाएं जैसे तीव्रगाहिता संबंधी सदमाऔर ब्रोंकोस्पज़म दुर्लभ हैं। वे इंट्रावास्कुलर आईजीजी एकत्रीकरण (विशेष रूप से सामान्य इम्युनोग्लोबुलिन के आकस्मिक इंट्रावास्कुलर प्रशासन के साथ) या सामान्य इम्युनोग्लोबुलिन में निहित आईजीए के खिलाफ निर्देशित आईजीई के संश्लेषण के कारण हो सकते हैं। एनाफिलेक्टिक प्रतिक्रियाओं का उपचार चैप में वर्णित है। 11, पी। वी। यदि सामान्य इम्युनोग्लोबुलिन के लिए गंभीर एनाफिलेक्टिक प्रतिक्रियाओं का इतिहास था, तो निम्नलिखित नियमों का पालन किया जाना चाहिए।
ए) नियुक्ति के लिए संकेतों की समीक्षा करें और सामान्य इम्युनोग्लोबुलिन के साथ उपचार की आवश्यकता को उचित ठहराएं।
बी) यदि उनकी आवश्यकता है, तो पहले एस / सी को विभिन्न कंपनियों से 0.02 मिलीलीटर की खुराक पर दवाओं के साथ इंजेक्ट किया जाता है और स्थानीय और प्रणालीगत प्रतिक्रियाओं का मूल्यांकन किया जाता है। कुछ प्रयोगशालाएँ IgE और IgG से IgA निर्धारित करती हैं। यदि प्रतिक्रिया इन एंटीबॉडी के कारण होती है, तो कम से कम आईजीए अशुद्धता वाली दवा की एक परीक्षण खुराक प्रशासित की जाती है। यह ध्यान में रखा जाना चाहिए कि एक ही कंपनी की दवा के विभिन्न बैच IgA की सामग्री में भिन्न हो सकते हैं। यदि परीक्षण की खुराक स्थानीय या प्रणालीगत प्रतिक्रिया का कारण नहीं बनती है, तो पूरी खुराक को सावधानीपूर्वक इंजेक्ट करें। एनाफिलेक्टिक प्रतिक्रियाओं के उच्च जोखिम के कारण, ऐसे रोगियों को सामान्य इम्युनोग्लोबुलिन केवल एक अस्पताल में प्रशासित किया जाता है।
ग) कुछ लेखक सामान्य इम्युनोग्लोबुलिन के प्रशासन से 1 घंटे पहले कॉर्टिकोस्टेरॉइड्स या डिपेनहाइड्रामाइन का प्रशासन करने की सलाह देते हैं। हालांकि, ये उपाय हमेशा एनाफिलेक्टिक प्रतिक्रिया को नहीं रोकते हैं और इसके अलावा, इसकी शुरुआती अभिव्यक्तियों को छुपा सकते हैं।
घ) जोखिम और गंभीरता को कम करने के लिए दुष्प्रभावसामान्य इम्युनोग्लोबुलिन को कभी-कभी 2-3 मिली / घंटा की दर से इंट्रामस्क्युलर रूप से इंजेक्ट किया जाता है, और अंतःशिरा प्रशासन के लिए सामान्य इम्युनोग्लोबुलिन को 24 घंटे के लिए एससी प्रशासित किया जाता है। प्रशासन के लिए, एक 23 जी तितली सुई और एक जलसेक पंप का उपयोग किया जाता है।
ई) यदि प्रणालीगत प्रतिक्रियाओं से बचा नहीं जा सकता है, तो सामान्य इम्युनोग्लोबुलिन के बजाय एक करीबी रिश्तेदार, आमतौर पर पिता से प्लाज्मा को ट्रांसफ्यूज किया जाता है।
2. विशिष्ट इम्युनोग्लोबुलिन स्वस्थ व्यक्तियों के रक्त से प्राप्त किए जाते हैं जो किसी भी संक्रमण से प्रतिरक्षित होते हैं। किसी भी रोगज़नक़ के प्रति एंटीबॉडी युक्त एक विशिष्ट इम्युनोग्लोबुलिन की शुरूआत इसके कारण होने वाले संक्रमण को रोक सकती है या इसकी गंभीरता को कम कर सकती है (अध्याय 21, पृष्ठ XV.B देखें)।
3. ताजा जमे हुए प्लाज्मा। इतिहास में सामान्य इम्युनोग्लोबुलिन के लिए गंभीर प्रणालीगत प्रतिक्रियाओं की उपस्थिति में, हास्य प्रतिरक्षा की कमी वाले रोगियों को कभी-कभी ताजा जमे हुए प्लाज्मा के साथ इंजेक्शन लगाया जाता है।
एक। सामान्य इम्युनोग्लोबुलिन की तुलना में ताजा जमे हुए प्लाज्मा के निम्नलिखित फायदे हैं।
1) इसमें केवल IgG ही नहीं, सभी वर्गों के इम्युनोग्लोबुलिन होते हैं।
2) दाता के टीकाकरण के बाद, एक विशिष्ट रोगज़नक़ के प्रति एंटीबॉडी की उच्च सामग्री वाला प्लाज्मा प्राप्त किया जा सकता है।
बी। ताजा जमे हुए प्लाज्मा का मुख्य नुकसान संक्रमण संचरण और आधान प्रतिक्रियाओं का जोखिम है। प्लाज्मा दाताओं की संख्या को सीमित करके और रोगी के परिवार के सदस्यों के बीच उनका मिलान करके संक्रमण के जोखिम को कम किया जा सकता है। दाता को एचआईवी संक्रमण, हेपेटाइटिस बी और सी से बाहर रखा जाना चाहिए। संक्रमण संचरण के जोखिम के साथ-साथ सामान्य इम्युनोग्लोबुलिन की उपलब्धता के कारण, इम्युनोडेफिशिएंसी के लिए ताजा जमे हुए प्लाज्मा का आधान वर्तमान में शायद ही कभी किया जाता है।
में। खुराक। रोगी की स्थिति के आधार पर, ताजा जमे हुए प्लाज्मा को हर 3-4 सप्ताह में 15-20 मिली / किग्रा IV की खुराक पर प्रशासित किया जाता है। संतृप्त खुराक रखरखाव खुराक से 2-3 गुना अधिक है। मात्रा अधिभार से बचने के लिए, कई दिनों में कई खुराक में एक लोडिंग खुराक प्रशासित की जाती है। मासिक रखरखाव खुराक को कई घंटों में प्रशासित किया जाता है। सेलुलर प्रतिरक्षा की अपर्याप्तता के मामले में, ग्राफ्ट-बनाम-होस्ट रोग से बचने के लिए, ताजा जमे हुए प्लाज्मा को 30 Gy की खुराक पर विकिरणित किया जाता है।
बी सेलुलर प्रतिरक्षा की अपर्याप्तता। चूंकि सेलुलर प्रतिरक्षा की अपर्याप्तता, विशेष रूप से गंभीर संयुक्त इम्युनोडेफिशिएंसी के कारण हो सकती है विभिन्न तंत्रइम्युनोडेफिशिएंसी के इस समूह के लिए कोई एकल उपचार आहार नहीं है। एक नियम के रूप में, सेलुलर प्रतिरक्षा की कमी वाले मरीजों का इलाज विशेष केंद्रों में किया जाता है।
1. अस्थि मज्जा प्रत्यारोपण। अस्थि मज्जा में प्लुरिपोटेंट स्टेम सेल (एरिथ्रोसाइट्स, लिम्फोसाइट्स, ग्रैन्यूलोसाइट्स, मैक्रोफेज, मेगाकारियोसाइट्स के पूर्ववर्ती) और परिपक्व टी- और बी-लिम्फोसाइट्स दोनों होते हैं। अस्थि मज्जा प्रत्यारोपण का उपयोग गंभीर संयुक्त इम्युनोडेफिशिएंसी, विस्कॉट-एल्ड्रिच सिंड्रोम और सेलुलर प्रतिरक्षा की कमी के साथ-साथ अप्लास्टिक एनीमिया, तीव्र मायलोइड ल्यूकेमिया और लिम्फोसाइटिक ल्यूकेमिया, क्रोनिक ग्रैनुलोमेटस रोग और जन्मजात न्यूट्रोपेनिया में सफलतापूर्वक किया जाता है। इन रोगियों को अस्थि मज्जा प्रत्यारोपण से पहले और बाद में गहन उपचार की आवश्यकता होती है। अस्थि मज्जा प्रत्यारोपण केवल विशेष केंद्रों में किया जाता है।
एक। एचएलए-मैचेड होल बोन मैरो ट्रांसप्लांट। प्रत्यारोपण की तकनीक इस प्रकार है। नीचे जेनरल अनेस्थेसियादाता के इलियाक शिखा से अस्थि मज्जा की छोटी मात्रा की कई आकांक्षाएं करें। प्रत्यारोपण के लिए आवश्यक अस्थि मज्जा की मात्रा प्राप्तकर्ता के वजन के 10 मिलीलीटर / किग्रा की दर से निर्धारित की जाती है, लिम्फोसाइटों और मोनोसाइट्स की संख्या - प्राप्तकर्ता के वजन के प्रति 1 किलोग्राम 300-500 मिलियन कोशिकाओं की दर से। अस्थि मज्जा को एक हेपरिन कंटेनर में एकत्र किया जाता है और हड्डी के छोटे टुकड़ों को हटाने के लिए एक महीन तार की जाली के माध्यम से फ़िल्टर किया जाता है। फ़िल्टर किए गए अस्थि मज्जा को अंतःशिर्ण रूप से प्राप्तकर्ता में अंतःक्षिप्त किया जाता है। सफल बोन मैरो ट्रांसप्लांटेशन और ग्राफ्ट-बनाम-होस्ट रोग की रोकथाम के लिए एचएलए एंटीजन के आधार पर सावधानीपूर्वक टाइपिंग और दाता का चयन आवश्यक है। अस्थि मज्जा दाताओं का आमतौर पर प्राप्तकर्ता के भाई-बहनों के बीच मिलान किया जाता है और एचएलए एंटीजन के लिए आनुवंशिक टाइपिंग विधियों का उपयोग करके प्राप्तकर्ता के साथ मिलान किया जाता है। हाल ही में, एक गैर-रिश्तेदार से लिए गए अस्थि मज्जा प्रत्यारोपण के लिए उपयोग करने का प्रयास किया गया है और सीरोलॉजिकल विधियों का उपयोग करके एचएलए के लिए टाइप किया गया है। हालांकि, इस तरह के प्रत्यारोपण के साथ, ग्राफ्ट-बनाम-होस्ट रोग का जोखिम काफी अधिक होता है (अध्याय 17 देखें)।
बी। एचएलए-मिलान, टी-लिम्फोसाइट-घटित अस्थि मज्जा का प्रत्यारोपण 1981 से गंभीर सेलुलर प्रतिरक्षा की कमी के इलाज के लिए किया गया है। इस मामले में अस्थि मज्जा दाता आमतौर पर प्राप्तकर्ता के माता-पिता होते हैं। इस तरह के प्रत्यारोपण के लिए दाता अस्थि मज्जा की एक बड़ी मात्रा (आमतौर पर 1 लीटर) की आवश्यकता होती है। अस्थि मज्जा से परिपक्व टी-लिम्फोसाइटों को हटाने के लिए, निम्नलिखित विधियों का उपयोग किया जाता है: 1) सोया लेक्टिन के साथ एग्लूटीनेशन; 2) राम एरिथ्रोसाइट्स के साथ रोसेट गठन; 3) एंटीबॉडी और पूरक द्वारा मध्यस्थता वाले टी-लिम्फोसाइटों का विनाश। परिपक्व टी-लिम्फोसाइटों को हटाने के बाद, स्टेम सेल और परिपक्व बी-लिम्फोसाइट्स अस्थि मज्जा में रहते हैं। गंभीर संयुक्त इम्युनोडेफिशिएंसी में, टी-लिम्फोसाइट-मुक्त अस्थि मज्जा का प्रत्यारोपण सेलुलर प्रतिरक्षा को पुनर्स्थापित करता है, लेकिन एंटीबॉडी उत्पादन बिगड़ा रहता है। अपर्याप्त सेलुलर प्रतिरक्षा वाले सभी रोगियों में ऐसा प्रत्यारोपण प्रभावी नहीं है। तो, एडेनोसाइन डेमिनमिनस और प्यूरीन न्यूक्लियोसाइड फॉस्फोराइलेज की कमी के साथ, यह सेलुलर प्रतिरक्षा की बहाली की ओर नहीं ले जाता है। टी-लिम्फोसाइटों से साफ किए गए अस्थि मज्जा के प्रत्यारोपण से बर्किट के लिंफोमा का खतरा बढ़ जाता है।
2. रिप्लेसमेंट थेरेपी। सेलुलर प्रतिरक्षा की कमी के मामले में प्रतिस्थापन चिकित्सा का लक्ष्य जैविक रूप से कमी की भरपाई करना है। सक्रिय पदार्थरोगी को इन पदार्थों के स्रोत - व्यवहार्य दाता कोशिकाओं को पेश किए बिना, टी-लिम्फोसाइटों के सामान्य कामकाज के लिए आवश्यक है।
एक। एंजाइमों के साथ प्रतिस्थापन चिकित्सा। जैसा कि ऊपर उल्लेख किया गया है, ऑटोसोमल रिसेसिव गंभीर संयुक्त इम्युनोडेफिशिएंसी एडेनोसिन डेमिनमिनस की कमी के कारण होता है। इस एंजाइम के स्रोत के रूप में विकिरणित एरिथ्रोसाइट द्रव्यमान का उपयोग किया जा सकता है। हालांकि यह व्यक्तिपरक सुधार की ओर नहीं ले जाता है, यह रक्त में एरिथ्रोसाइट्स की संख्या और इम्युनोग्लोबुलिन के स्तर को बढ़ाता है, और लिम्फोसाइटों की माइटोगेंस और एलोजेनिक कोशिकाओं के लिए प्रोलिफ़ेरेटिव प्रतिक्रिया को भी उत्तेजित करता है। हाल ही में, एडीनोसिन डेमिनेज रिप्लेसमेंट थेरेपी के लिए पॉलीइथाइलीन ग्लाइकोल-संयुग्मित गोजातीय एंजाइम का उपयोग किया गया है। एरिथ्रोसाइट द्रव्यमान की तुलना में, यह दवा प्लाज्मा एडेनोसिन डेमिनमिनस की गतिविधि को काफी बढ़ा देती है। गोजातीय एडेनोसाइन डेमिनमिनस की शुरूआत प्रतिरक्षाविज्ञानी मापदंडों को सामान्य नहीं करती है, लेकिन व्यक्तिपरक सुधार की ओर ले जाती है। एडीनोसिन डेमिनमिनस रिप्लेसमेंट थेरेपी का नुकसान यह है कि यह केवल अस्थायी सुधार का कारण बनता है।
बी। जनन विज्ञानं अभियांत्रिकी। यूएस नेशनल इंस्टीट्यूट ऑफ हेल्थ में ऑटोसोमल रिसेसिव गंभीर संयुक्त इम्यूनोडेफिशियेंसी के इलाज के लिए एक प्रयोगात्मक विधि लागू की गई थी। विधि का सार रोगियों के टी-लिम्फोसाइटों के जीनोम में जीन एन्कोडिंग एडेनोसिन डेमिनमिनस को स्थानांतरित करना है। इस उपचार पद्धति की प्रभावकारिता का अच्छी तरह से अध्ययन नहीं किया गया है। वर्तमान में, एडीनोसिन डेमिनमिनस जीन को स्टेम सेल जीनोम में शामिल करने का प्रयास किया जा रहा है। शायद भविष्य में, जेनेटिक इंजीनियरिंग विभिन्न प्राथमिक इम्युनोडेफिशिएंसी का सफलतापूर्वक इलाज करना संभव बना देगी।
में। स्थानांतरण कारक कम आणविक भार (आणविक भार 10,000 से अधिक नहीं) का मिश्रण है जो नष्ट हुए ल्यूकोसाइट्स से पृथक जैविक रूप से सक्रिय पदार्थ हैं। इम्युनोडेफिशिएंसी में उपयोग किए जाने वाले ट्रांसफर फैक्टर को ल्यूकोसाइट्स से स्वस्थ दाताओं से प्राप्त किया जाता है, जो सामान्य एंटीजन के साथ प्रतिरक्षित होते हैं, जैसे कि माइकोबैक्टीरिया और कवक के एंटीजन। स्थानांतरण कारक की क्रिया के तंत्र का अध्ययन नहीं किया गया है, लेकिन यह ज्ञात है कि यह सेलुलर प्रतिरक्षा के विशिष्ट और गैर-विशिष्ट सक्रियण दोनों का कारण बनता है। स्थानांतरण कारक की प्रभावशीलता पर कोई विश्वसनीय डेटा नहीं है, नियंत्रित अध्ययन नहीं किए गए हैं। हालांकि, यह दिखाया गया है कि यह त्वचा और श्लेष्मा झिल्ली के पुराने कैंडिडिआसिस वाले रोगियों की स्थिति में सुधार करता है। गंभीर संयुक्त इम्युनोडेफिशिएंसी में, स्थानांतरण कारक अप्रभावी होता है। स्थानांतरण कारक के साथ उपचार के दौरान हेमोब्लास्टोस के कई मामले दर्ज किए गए हैं। हालांकि उनके विकास और उपचार के बीच एक स्पष्ट संबंध स्थापित नहीं किया गया है, स्थानांतरण कारक को अत्यधिक सावधानी के साथ निर्धारित किया जाना चाहिए।
डी. थाइमस हार्मोन। थाइमस पेप्टाइड हार्मोन (थाइमोसिन, थाइमोपोइटिन, और अन्य) पर आधारित कई दवाएं हैं। थाइमोसिन एक 28 अमीनो एसिड पेप्टाइड है जो गोजातीय थाइमस से निकाला जाता है। जाहिर है, थाइमोसिन टी-लिम्फोसाइटों के सभी पूर्वजों पर कार्य नहीं करता है। गंभीर संयुक्त प्रतिरक्षाविहीनता वाले अधिकांश रोगियों में थाइमोसिन अप्रभावी है। हालांकि, सेलुलर प्रतिरक्षा अपर्याप्तता के साथ कम गंभीर इम्युनोडेफिशिएंसी में, विशेष रूप से विस्कॉट-एल्ड्रिच सिंड्रोम, एलिम्फोसाइटोसिस और डिजॉर्ज सिंड्रोम में, थाइमोसिन के साथ उपचार के पहले परिणाम उत्साहजनक थे। डिजॉर्ज सिंड्रोम और ऐलिम्फोसाइटोसिस में, थायमोपेंटिन की शुरूआत के साथ कुछ सुधार देखा गया है, थायमोपोइटिन टुकड़े के समान एक सिंथेटिक पेंटेपेप्टाइड (32वें से 36वें अमीनो एसिड अवशेष)। टिमोपेंटिन के गंभीर दुष्प्रभाव नहीं हैं, हालांकि, इसके प्रशासन के साथ लगभग 30% रोगियों में स्थानीय प्रतिक्रियाएं देखी जाती हैं।
ई. साइटोकिन्स विभिन्न कोशिकाओं द्वारा निर्मित मध्यस्थों का एक बड़ा समूह है और प्रतिरक्षा प्रणाली के कार्यों के नियमन में शामिल है (अध्याय 1, पैराग्राफ IV.B और तालिका 1.3 देखें)। बिगड़ा हुआ इंटरल्यूकिन -2 संश्लेषण के साथ गंभीर संयुक्त इम्युनोडेफिशिएंसी में, पुनः संयोजक इंटरल्यूकिन -2 का उपयोग किया जाता है। कुछ मामलों में, उपचार प्रभावी है। आईजीई हाइपरप्रोडक्शन और डिफ्यूज न्यूरोडर्माेटाइटिस के सिंड्रोम में, इंटरफेरॉन गामा का उपयोग किया जाता है। यह टी-हेल्पर्स द्वारा इंटरल्यूकिन्स -4 और -5 के संश्लेषण को रोकता है। इंटरफेरॉन अल्फा बर्किट के लिंफोमा में प्रभावी है। Filgrastim, molgramostim और interleukin-3 का उपयोग इम्यूनोसप्रेसिव थेरेपी के बाद अस्थि मज्जा में न्यूट्रोफिल और मोनोसाइट्स की परिपक्वता को प्रोत्साहित करने के लिए किया जाता है।
ई. ट्रेस तत्व। जठरांत्र संबंधी मार्ग में जन्मजात जस्ता malabsorption एंटरोपैथिक एक्रोडर्माटाइटिस के साथ संयोजन में हास्य और सेलुलर प्रतिरक्षा की गंभीर अपर्याप्तता की ओर जाता है। रोग त्वचा और जठरांत्र संबंधी मार्ग के गंभीर घावों से प्रकट होता है और इसके साथ कुअवशोषण सिंड्रोम, दस्त और मानसिक विकार, उपचार के बिना मौत की ओर जाता है। जिंक की तैयारी इस रोग की सभी अभिव्यक्तियों को समाप्त करती है।
3. प्रायोगिक उपचार
एक। थाइमस एपिथेलियल सेल कल्चर। उपचार के प्रायोगिक तरीकों में से एक थाइमस एपिथेलियल कोशिकाओं (आर। हांग, 1986) का प्रत्यारोपण है। जन्मजात हृदय दोषों के शल्य चिकित्सा उपचार के दौरान सामान्य प्रतिरक्षा (माता-पिता की लिखित सहमति के साथ) वाले बच्चों से थाइमस ऊतक प्राप्त किया जाता है। थाइमस एपिथेलियल कोशिकाओं का प्रत्यारोपण थाइमस में लिम्फोसाइटों की बिगड़ा हुआ परिपक्वता के कारण होने वाली इम्युनोडेफिशिएंसी में प्रभावी है। अस्थि मज्जा में लिम्फोसाइटों की परिपक्वता के उल्लंघन में, यह अप्रभावी है।
बी। भ्रूण थाइमस का प्रत्यारोपण। उपचार की इस पद्धति के सर्वोत्तम परिणाम डिजॉर्ज सिंड्रोम वाले रोगियों में प्राप्त होते हैं। ग्राफ्ट-बनाम-होस्ट रोग के जोखिम को कम करने के लिए, 14 सप्ताह की गर्भकालीन आयु से कम के भ्रूण से थाइमस ऊतक प्राप्त किया जाता है। थाइमस को ट्रांसप्लांट करने के कई तरीके हैं: 1) थाइमस टिश्यू का पूर्वकाल पेट की दीवार की पेशी में ट्रांसप्लांट करना; 2) थाइमस कोशिकाओं के निलंबन का इंट्रापेरिटोनियल या इंट्रापेरिटोनियल प्रशासन; 3) थाइमस के छोटे टुकड़ों का इंट्रापेरिटोनियल इंजेक्शन।
में। भ्रूण के यकृत प्रत्यारोपण का उपयोग गंभीर संयुक्त प्रतिरक्षाविहीनता के लिए किया जाता है। यह उपचार गंभीर ग्राफ्ट-बनाम-होस्ट रोग के उच्च जोखिम से जुड़ा है, विशेष रूप से 12 सप्ताह की गर्भकालीन आयु से अधिक भ्रूणों के यकृत प्रत्यारोपण में। पशु प्रयोगों और नैदानिक परीक्षणों ने यकृत कोशिकाओं के इंट्रापेरिटोनियल प्रशासन के साथ प्रतिरक्षा की बहाली का प्रदर्शन किया है। जिगर और भ्रूण के थाइमस के प्रत्यारोपण के दौरान दाता टी-लिम्फोसाइटों का जुड़ाव लगभग 25% रोगियों में गंभीर संयुक्त इम्युनोडेफिशिएंसी के साथ देखा जाता है। हालाँकि, आज इन अंगों के प्रत्यारोपण का लगभग कभी उपयोग नहीं किया जाता है। ज्यादातर मामलों में, सेलुलर प्रतिरक्षा की अपर्याप्तता के मामले में, अस्थि मज्जा प्रत्यारोपण एचएलए एंटीजन के प्राप्तकर्ता के साथ संगत एक करीबी रिश्तेदार से किया जाता है।
बी फागोसाइट्स की अपर्याप्तता। वर्तमान में फैगोसाइट की कमी के लिए प्रतिस्थापन चिकित्सा के कोई विश्वसनीय तरीके नहीं हैं, उदाहरण के लिए, पुरानी ग्रैनुलोमेटस बीमारी, मायलोपरोक्सीडेज की कमी, चेडियाक-हिगाशी सिंड्रोम के लिए। इंटरफेरॉन गामा को हाल ही में पुरानी ग्रैनुलोमेटस बीमारी में प्रभावी दिखाया गया है। इस बीमारी में, साथ ही जन्मजात न्यूट्रोपेनिया में, अस्थि मज्जा प्रत्यारोपण का आमतौर पर उपयोग किया जाता है। यह माना जाता है कि विभिन्न एंजाइमों की अपर्याप्तता के कारण पुरानी ग्रैनुलोमेटस बीमारी के कई रूप हैं। इन दोषों की पहचान भविष्य में प्रतिस्थापन चिकित्सा के विकास की अनुमति देगी। वर्तमान में, फागोसाइट की कमी का इलाज गामा इंटरफेरॉन, रोगाणुरोधी एजेंटों, एस्कॉर्बिक एसिड और ल्यूकोसाइट मास ट्रांसफ्यूजन के साथ किया जाता है।
1. क्रोनिक ग्रैनुलोमेटस रोग के लिए इंटरफेरॉन गामा की सिफारिश की जाती है। इस बीमारी के एक्स-लिंक्ड रूप में (साइटोक्रोम बी 558 की कमी के कारण), यह दवा न्यूट्रोफिल में साइटोक्रोम बी 558 की गतिविधि को बढ़ाती है, जो बैक्टीरिया के इंट्रासेल्युलर विनाश की सक्रियता के साथ होती है और संक्रमण के जोखिम को कम करती है। इंटरफेरॉन गामा को क्रोनिक ग्रैनुलोमेटस रोग के ऑटोसोमल रिसेसिव रूपों के लिए भी संकेत दिया गया है।
2. रोगाणुरोधी चिकित्सा
एक। संक्रमणों में, रोगाणुरोधी एजेंटों को जल्द से जल्द निर्धारित किया जाता है और, यदि संभव हो तो, अंतःशिरा रूप से प्रशासित किया जाता है, क्योंकि फागोसाइट की कमी फुलमिनेंट सेप्सिस के उच्च जोखिम से जुड़ी होती है। इसके बाद, रोगाणुरोधी एजेंटों को रोगज़नक़ की संवेदनशीलता को ध्यान में रखते हुए निर्धारित किया जाता है।
बी। संक्रमण को रोकने के लिए, सल्फोनामाइड्स या अन्य रोगाणुरोधी एजेंट जो स्टेफिलोकोसी के खिलाफ सक्रिय हैं, निर्धारित हैं। फैगोसाइट की कमी वाले अधिकांश रोगियों में रोगाणुरोधी प्रोफिलैक्सिस के दीर्घकालिक पाठ्यक्रम प्रभावी होते हैं।
3. गंभीर संक्रमण में, रोगाणुरोधी चिकित्सा के साथ संयोजन में WBC आधान प्रभावी होता है।
4. एस्कॉर्बिक एसिड, 500 मिलीग्राम / दिन मौखिक रूप से, चेडियाक-हिगाशी सिंड्रोम (ऐल्बिनिज़म, न्यूट्रोपेनिया, विशाल कणिकाओं और फागोसाइट्स की बिगड़ा हुआ जीवाणुनाशक गतिविधि, आवर्तक प्युलुलेंट संक्रमण) के रोगियों के लिए निर्धारित है। एस्कॉर्बिक एसिड फागोसाइट्स की कार्यात्मक गतिविधि को बढ़ाता है और संक्रमण के जोखिम को कम करता है।
डी. पूरक कमी
1. ताजा जमे हुए प्लाज्मा को उनकी पृथक कमी में पूरक घटकों के स्रोत के रूप में उपयोग किया जाता है। C5, C3 और C3b इनहिबिटर की कमी वाले रोगियों को इसके आधान से स्थिति में सुधार होता है और प्रयोगशाला मापदंडों का सामान्यीकरण होता है। यह वंशानुगत क्विन्के की एडिमा में भी प्रभावी है (अध्याय 10, खंड VIII.A देखें)। इस रोग के उपचार के लिए एक C1-एस्टरेज़ इनहिबिटर कॉन्संट्रेट वर्तमान में नैदानिक परीक्षणों में है।