Suhkurtõbi on krooniline haigus absoluutse või suhtelise insuliinipuuduse tõttu, mis põhjustab ainevahetushäireid, veresoonte kahjustusi (angiopaatiat), närvisüsteem(neuropaatia) ja patoloogilised muutused elundites ja kudedes.
Klassifikatsioon:
I tüüpi suhkurtõbi tekib siis, kui kõhunäärme Langerhansi saarekeste β-rakud hävivad. Seda iseloomustab absoluutne insuliinipuudus. Eristage autoimmuunset ja idiopaatiline suhkurtõbi.
2. tüüpi diabeet väljendub nii ülekaalus insuliiniresistentsuses kui ka insuliini sekretsiooni sekretoorses puudulikkuses.
Lisaks on ka teisi spetsiifilisi tüüpe diabeet põhjustatud rakkude geneetilistest defektidest, insuliini toime geneetilistest defektidest, eksokriinse pankrease haigustest, infektsioonidest, ravimitest jne.
I tüüpi suhkurtõbi tekib siis, kui kõhunäärme Langerhansi saarekeste β-rakud hävivad. Reeglina areneb haigus pärast viirusnakkust (Coxsackie, mumps, tsütomegaloviirus, retroviirus, punetised, leetrid). Viirused kahjustavad rakkude tsütoplasmamembraani, muudavad selle antigeenseid omadusi ja põhjustavad geneetilise eelsoodumusega inimestel raku apoptoosi ja põletikku.
Patoloogiline anatoomia.
Pankrease suurus on vähenenud, täheldatakse lipomatoosi ja skleroosi. Saared läbivad atroofiat ja hüalinoosi. Maks suureneb sageli, muutub lõtvuks, savikollaseks. Mikroskoopiliselt hepatotsüütides väheneb glükogeeni ja rasvavakuoolide hulk. Veresoontes esineb diabeetiline makro- ja mikroangiopaatia. Diabeetilist makroangiopaatiat iseloomustab elastse ja lihas-elastse tüüpi veresoonte ateroskleroosi areng. Mikroangiopaatiat iseloomustab basaalmembraani hävitamine, plasma immutamine ja hüalinoosi areng. Veelgi enam, sel juhul ladestub lipogjaliin veresoonte seintesse. Mikroangiopaatial on üldine iseloom. Neerudes tekib mikroagnipaatia glomerulite kahjustusena, millele järgneb glomeruloskleroosi areng. Glomerulites prolifereeruvad mesangiaalsed rakud, mis hiljem põhjustab mesangiaalset hüalinoosi. Kliiniliselt avaldub glomerulite kahjustus suhkurtõve korral Kimmelstiel-Wilsoni sündroomi kujul (proteinuuria, turse, arteriaalne hüpertensioon).
Diabeetilise mikroangiopaatia võimalikud eksudatiivsed ilmingud "fibriini korkide" kujul glomerulite kapillaarsilmustel. Lisaks tekib suhkurtõve tuubulite epiteelis parenhüümsete süsivesikute degeneratsioon, mis on tingitud asjaolust, et glükosuuria tekkega imbub glükoos tuubulite epiteeli ja moodustub glükogeen. Samal ajal muutub tuubulite epiteel kõrgeks, kerge poolläbipaistva tsütoplasmaga. Spetsiaalsete peitside (CHIC-reaktsioon, Best carmine) kasutamisel tuvastatakse glükogeeni terad ja tükid.
Kopsudes tekivad lipogranuloomid, mis koosnevad makrofaagidest, lipiididest ja võõrkehade hiidrakkudest.
Suhkurtõve tüsistused on seotud makro- ja mikroangiopaatia tekkega (müokardiinfarkt, pimedus, neerupuudulikkus). Sagedased infektsioonid, eriti mädased.
Sissejuhatus
Mõiste ja liigid
Etioloogia ja patogenees
dieediteraapia
Laboratoorsed uuringud
Riskitegurid ja prognoos
Diagnostika ja diferentsiaaldiagnostika
Tüsistused
Sümptomid ja märgid
Ärahoidmine
Diabeediga patsientide dispanservaatlus
Diabeedi patoloogiline anatoomia
Diabeetiline kooma ja ravi
Järeldus
Kirjandus
Sissejuhatus
Suhkurtõbi on haigus, mis on põhjustatud absoluutsest või suhtelisest insuliinipuudusest ja mida iseloomustab süsivesikute metabolismi tõsine rikkumine koos hüperglükeemia ja glükosuuriaga, samuti muud ainevahetushäired.
Etioloogias on olulised pärilik eelsoodumus, autoimmuunsed, vaskulaarsed häired, rasvumine, vaimsed ja füüsilised traumad ning viirusnakkused.
Absoluutse insuliinipuuduse korral väheneb insuliini tase veres selle sünteesi või Langerhansi saarte beetarakkude sekretsiooni rikkumise tõttu. Suhteline insuliinipuudus võib olla tingitud insuliini aktiivsuse vähenemisest, mis on tingitud selle suurenenud seondumisest valkudega, suurenenud hävitamisest maksaensüümide poolt, hormonaalsete ja mittehormonaalsete insuliiniantagonistide (glükagoon, neerupealiste hormoonid, kilpnääre, kasvuhormoon, esterdamata rasvhapped), muutused insuliinist sõltuvate kudede tundlikkuses insuliini suhtes.
Insuliinipuudus põhjustab süsivesikute, rasvade ja valkude metabolismi häireid. Rasv- ja lihaskoes väheneb rakumembraanide glükoosi läbilaskvus, suureneb glükogenolüüs ja glükoneogenees, tekivad hüperglükeemia, glükosuuria, millega kaasnevad polüuuria ja polüdipsia. Rasvade moodustumine väheneb ja rasvade lagunemine suureneb, mis toob kaasa ketoonkehade taseme tõusu veres (atsetoäädikhape, beeta-hüdroksüvõihape ja atsetoäädikhappe kondensatsiooniprodukt - atsetoon). See põhjustab happe-aluse seisundi nihkumist atsidoosi suunas, soodustab kaaliumi-, naatriumi- ja magneesiumiioonide suurenenud eritumist uriiniga ja häirib neerude tööd.
Polüuuriast tingitud märkimisväärne vedelikukaotus põhjustab dehüdratsiooni. Suurenenud kaaliumi, kloriidide, lämmastiku, fosfori, kaltsiumi eritumine organismist.
Mõiste ja liigid.
Diabeeton endokriinne haigus, mida iseloomustab krooniline veresuhkru taseme tõus kõhunäärmehormooni insuliini absoluutsest või suhtelisest puudusest. Haigus põhjustab igat tüüpi ainevahetuse rikkumist, veresoonte, närvisüsteemi, aga ka muude organite ja süsteemide kahjustusi. Klassifikatsioon
Eristama: .Insuliinsõltuv diabeet (I tüüpi diabeet) areneb peamiselt lastel ja noortel; .Insuliinsõltumatu diabeet (II tüüpi diabeet) areneb tavaliselt üle 40-aastastel ülekaalulistel inimestel. See on kõige levinum haigustüüp (esineb 80-85% juhtudest); .Sekundaarne (või sümptomaatiline) suhkurtõbi; .Raseduse diabeet. .Diabeet alatoitluse tõttu Kell 1. tüüpi diabeetpankrease rikkumise tõttu on absoluutne insuliinipuudus. Kell 2. tüüpi diabeetmärkis suhteline insuliinipuudus. Pankrease rakud toodavad samal ajal piisavalt insuliini (mõnikord isegi suurenenud koguses). Rakkude pinnal on aga blokeeritud või vähenenud nende struktuuride arv, mis tagavad selle kontakti rakuga ja aitavad verest glükoosil rakku siseneda. Glükoosipuudus rakkudes on signaal veelgi suuremaks insuliinitootmiseks, kuid sellel pole mingit mõju ning aja jooksul insuliini tootmine väheneb oluliselt. Etioloogia ja patogenees
Pärilik eelsoodumus, autoimmuunsed, vaskulaarsed häired, rasvumine, vaimsed ja füüsilised traumad ning viirusnakkused on olulised. Patogenees 1.kõhunäärme endokriinsete rakkude ebapiisav insuliini tootmine; 2. Insuliini interaktsiooni rikkumine kehakudede rakkudega (insuliiniresistentsus<#"justify">On pärilik eelsoodumus diabeedi tekkeks. Kui üks vanematest on haige, on I tüüpi diabeedi pärimise tõenäosus 10% ja II tüüpi diabeet 80%. dieediteraapia
Õige dieettoit diabeedigaon ülima tähtsusega. Valides õige dieedi kerge (ja sageli mõõduka) II tüüpi diabeedi vormi jaoks, saate minimeerida uimastiravi või isegi ilma selleta hakkama saada. SoovitatavDiabeetikute jaoks sööge järgmisi toite: · Leib - kuni 200 grammi päevas, enamasti must või eridiabeetik. · Supid, enamasti köögiviljad. Nõrgas liha- või kalapuljongis keedetud suppe võib tarbida mitte rohkem kui kaks korda nädalas. · Tailiha, linnuliha (kuni 100 grammi päevas) või kala (kuni 150 grammi päevas) keedetud või aspic kujul. · Teraviljast, kaunviljadest, pastast valmistatud roogasid ja lisandeid võib endale lubada aeg-ajalt, väikestes kogustes, vähendades tänapäeval leiva tarbimist. Teraviljadest on parem kasutada kaerahelbeid ja tatart, vastuvõetavad on ka hirss, oder, riisi teraviljad. Kuid manna on parem välja jätta. · Köögiviljad ja rohelised. Kartulit, peeti, porgandit soovitatakse tarbida mitte rohkem kui 200 grammi päevas. Kuid muid köögivilju (kapsas, salat, redis, kurk, suvikõrvits, tomat) ja rohelisi (v.a vürtsikas) võib peaaegu piiranguteta tarbida toorelt ja keedetud kujul, aeg-ajalt ka küpsetatuna. · Munad - mitte rohkem kui 2 tükki päevas: pehmeks keedetud, omleti kujul või muude roogade valmistamisel. · Hapude ja magushapude sortide puuviljad ja marjad (Antonovka õunad, apelsinid, sidrunid, jõhvikad, punased sõstrad ...) - kuni 200-300 grammi päevas. · Piim - arsti loal. Hapupiimatooted (keefir, kalgendatud piim, magustamata jogurt) - 1-2 klaasi päevas. Juust, hapukoor, koor - aeg-ajalt ja natuke. · Diabeedi kodujuustu soovitatakse tarbida iga päev, kuni 100-200 grammi päevas looduslikul kujul või kodujuustu, juustukookide, pudingite, vormiroogadena. Kodujuust, aga ka kaera- ja tatrapuder, kliid, kibuvitsamarjad parandavad rasvade ainevahetust ja normaliseerivad maksa tööd, hoiavad ära rasvamuutused maksas. · Joogid. Lubatud on roheline või must tee, see on võimalik piima, nõrga kohvi, tomatimahla, marjade ja hapude puuviljade mahladega. Söömine diabeedigasee on vajalik vähemalt 4 korda päevas ja parem - 5-6 korda, samal ajal. Toit peaks olema rikas vitamiinide, mikro- ja makroelementidega. Proovige oma dieeti võimalikult palju mitmekesistada, sest diabeedi jaoks lubatud toiduainete loetelu pole sugugi väike. Piirangud § Esiteks, ja see pole tõenäoliselt kellegi jaoks avastus, on diabeediga vaja piirata kergesti seeditavate süsivesikute tarbimist. Need on suhkur, mesi, moosid ja moosid, maiustused, muffinid ja muud maiustused, magusad puuviljad ja marjad: viinamarjad, banaanid, rosinad, datlid. Sageli on isegi soovitusi need toidud dieedist täielikult välja jätta, kuid see on tõesti vajalik ainult raske diabeedi korral. Kerge ja mõõduka astme korral, kui veresuhkru taset jälgitakse regulaarselt, on väikese koguse suhkru ja maiustuste kasutamine üsna vastuvõetav. § Mitte nii kaua aega tagasi leiti mitmete uuringute tulemusena, et suurenenud rasvasisaldus veres aitab oluliselt kaasa diabeedi progresseerumisele. Seetõttu piiratakse kasutamist rasvased toidud diabeedi puhul pole see vähem oluline kui maiustuste piiramine. Vabal kujul ja toiduvalmistamiseks tarbitava rasva (või ja taimeõli, seapekk, toidurasvad) kogus ei tohiks ületada 40 grammi päevas, samuti on vaja piirata teiste, seda sisaldavate toodete tarbimist. suur hulk rasv (rasvane liha, vorstid, vorstid, vorstid, juustud, hapukoor, majonees). § Samuti on vaja tõsiselt piirata ning parem on üldse mitte kasutada praetud, vürtsikaid, soolaseid, vürtsikaid ja suitsutatud toite, konserve, paprikat, sinepit, alkohoolseid jooke. § Ja toidud, mis sisaldavad palju rasvu ja süsivesikuid samal ajal, ei ole diabeedi all kannatajatele absoluutselt head: šokolaad, jäätis, koorekoogid ja koogid ... Parem on need dieedist täielikult välja jätta. Laboratoorsed uuringud
Tühja kõhu veresuhkru test<#"justify">Riskitegurid ja prognoos
I tüüpi diabeedi riskifaktoriteks on pärilikkus. Kui lapsel on geneetiline eelsoodumus diabeedi tekkeks, on soovimatute sündmuste kulgu peaaegu võimatu ära hoida. II tüüpi diabeedi riskifaktorid Erinevalt 1. tüüpi diabeedist on 2. tüüpi diabeet tingitud patsiendi elu- ja toitumisomadustest. Seega, kui teate II tüüpi diabeedi riskitegureid ja proovite paljusid neist vältida isegi pärilikkuse ägenemise korral, saate selle haiguse tekkeriski vähendada miinimumini. II tüüpi diabeedi riskifaktorid: · diabeeti haigestumise risk suureneb, kui lähisugulastel see haigus diagnoositakse; · vanus üle 45 aasta; Insuliiniresistentsuse sündroomi esinemine<#"justify">Diabeedi riskitegurid on järgmised: · geneetiline eelsoodumus, · vaimne ja füüsiline trauma, · ülekaalulisus, · pankrease kanali kivi · kõhunäärmevähk, · teiste endokriinsete näärmete haigused, · hüpotalamuse-hüpofüüsi hormoonide taseme tõus, · menopaus, · Rasedus, · mitmesugused viirusinfektsioonid · teatud ravimite kasutamine, · alkoholi kuritarvitamine, · toitumise tasakaalustamatus. Prognoos Praegu on kõigi suhkurtõve tüüpide prognoos tinglikult soodne, piisava ravi ja dieedi järgimise korral töövõime säilib. Tüsistuste progresseerumine aeglustub oluliselt või peatub täielikult. Siiski tuleb märkida, et enamikul juhtudel ei ole ravi tulemusena haiguse põhjust kõrvaldatud ja ravi on ainult sümptomaatiline. Diagnoos ja diferentsiaaldiagnostika
1. ja 2. tüüpi diabeedi diagnoosimist hõlbustab peamiste sümptomite olemasolu: polüuuria<#"justify">· suhkru (glükoosi) kontsentratsioon kapillaarveres tühja kõhuga ületab 6,1 mmol / l (millimooli liitri kohta) ja 2 tundi pärast sööki (söögijärgne glükeemia) ületab 11,1 mmol / l; Glükoositaluvuse testi tulemusena<#"justify">Diabeedi diferentsiaaldiagnoos (DIF). Diabeedi probleem on viimasel ajal meditsiinimaailmas laialt levinud. See moodustab ligikaudu 40% kõigist haigusjuhtudest. endokriinsüsteem. See haigus põhjustab sageli kõrget suremust ja varajase puude. Diabeedihaigete diferentsiaaldiagnoosimiseks on vaja kindlaks teha patsiendi seisund, suunates selle ühte klassi: neuropaatiline, angiopaatiline, diabeedi kulgu kombineeritud variant. Sarnase fikseeritud tunnuste arvuga patsiente peetakse samasse klassi kuuluvateks. Selles töös erineb. diagnoosimine esitatakse klassifitseerimisülesandena. Klassifitseerimismeetodina kasutatakse klasteranalüüsi ja Kemeny mediaanmeetodit, mis on matemaatilised valemid. Suhkurtõve diferentsiaaldiagnostikas ei tohiks mingil juhul juhinduda HA tasemest. Kahtluse korral tehke esialgne diagnoos ja täpsustage seda kindlasti. Diabeedi selgel või ilmsel kujul on selgelt määratletud kliiniline pilt: polüuuria, polüdipsia, kehakaalu langus. Vere laboratoorses uuringus täheldatakse glükoosisisalduse suurenemist. Uriini uurimisel - glükosuuria ja atsetouria. Kui hüperkliimia sümptomeid pole, kuid veresuhkru uuringu ajal tuvastatakse glükoosisisalduse suurenemine. Sel juhul tehakse diagnoosi välistamiseks või kinnitamiseks laboris spetsiaalne glükoosile reageerimise test. Tähelepanu tuleb pöörata uriini erikaalule (suhtelisele tihedusele), mis tuvastatakse teiste haiguste ravis või arstlikul läbivaatusel tehtavates analüüsides. Diff. Diabeedi vormide diagnoosimisel, ravi ja terapeutilise ravimi valimisel on äärmiselt vajalik määrata insuliini kontsentratsiooni tase veres. Insuliini määramine on võimalik patsientidel, kes ei ole insuliinipreparaate võtnud. Kõrgenenud insuliini tase madala glükoosikontsentratsiooniga on patoloogilise hüperinsulineemia näitaja. Kõrge insuliinitase veres tühja kõhuga koos kõrgenenud ja normaalse glükoosikontsentratsiooniga on glükoositalumatuse ja vastavalt suhkurtõve näitaja. Vajalik on haiguse terviklik diagnoos, mille eesmärk on keha tõsine uurimine. Diferentsiaaldiagnoos hoiab ära suhkurtõve tekke ja võimaldab õigeaegselt määrata vajaliku ravi. Ravi suhkurtõve insuliin Diabeedi ravi, loomulikult määrab arst. Diabeedi ravi hõlmab: .eridieet: on vaja välja jätta suhkur, alkohoolsed joogid, siirupid, koogid, küpsised, magusad puuviljad. Toitu tuleks võtta väikeste portsjonitena, eelistatavalt 4-5 korda päevas. Soovitatavad on erinevaid magusaineid (aspartaam, sahhariin, ksülitool, sorbitool, fruktoos jne) sisaldavad tooted. .insuliini igapäevane kasutamine (insuliinravi) on vajalik I tüüpi suhkurtõvega patsientidel ja II tüüpi diabeedi progresseerumisel. Ravim on saadaval spetsiaalsetes süstalpliiatsites, millega on lihtne süstida. Insuliiniga ravimisel on vaja iseseisvalt kontrollida glükoosi taset veres ja uriinis (kasutades spetsiaalseid ribasid). .tablettide kasutamine, mis aitavad alandada veresuhkru taset. Reeglina alustavad sellised ravimid II tüüpi diabeedi ravi. Haiguse progresseerumisel on vajalik insuliini määramine. Arsti peamised ülesanded diabeedi ravis on: · Süsivesikute ainevahetuse kompenseerimine. · Tüsistuste ennetamine ja ravi. · Kehakaalu normaliseerimine. Patsiendi koolitamine<#"justify">Kasulik diabeediga inimestele füüsilised harjutused. Rasvunud patsientide kehakaalu langusel on ka terapeutiline roll. Diabeedi ravi on eluaegne. Enesekontroll ja arsti soovituste täpne täitmine võib vältida või oluliselt aeglustada haiguse tüsistuste teket. Tüsistused
Suhkurtõbi tuleb pidevalt jälgida!!! Halva kontrolli ja sobimatu elustiili korral võivad tekkida sagedased ja järsud vere glükoositaseme kõikumised. Mis omakorda põhjustab tüsistusi. Kõigepealt ägedad, nagu hüpo- ja hüperglükeemia, ja seejärel kroonilised tüsistused. Kõige hullem on see, et need tekivad 10-15 aastat pärast haiguse algust, arenevad märkamatult ega mõjuta esialgu enesetunnet. sest kõrge sisaldus veresuhkrud tõusevad järk-järgult ja arenevad väga kiiresti, diabeedispetsiifilised tüsistused silmadest, neerudest, jalgadest, samuti mittespetsiifilised tüsistused südame-veresoonkonna süsteemist. Kuid kahjuks võib juba ilmnenud tüsistustega toime tulla väga raske. o hüpoglükeemia - veresuhkru langus, võib põhjustada hüpoglükeemilist koomat; o hüperglükeemia – veresuhkru taseme tõus, mille tagajärjeks võib olla hüperglükeemiline kooma. Sümptomid ja märgid
Mõlemal diabeeditüübil on sarnased sümptomid. Diabeedi esimesed sümptomid ilmnevad tavaliselt kõrge veresuhkru taseme tõttu. Kui glükoosi kontsentratsioon veres jõuab 160-180 mg / dl (üle 6 mmol / l), hakkab see tungima uriini. Aja jooksul, kui patsiendi seisund halveneb, muutub glükoosi tase uriinis väga kõrgeks. Selle tulemusena eritavad neerud lahjendamiseks rohkem vett suur summa glükoos eritub uriiniga. Seega on diabeedi esmaseks sümptomiks polüuuria (üle 1,5-2 liitri uriini eritumine päevas). Järgmine sümptom, mis on sagedase urineerimise tagajärg, on polüdipsia (pidev janutunne) ja rohke vedelikutarbimine. Tänu sellele, et uriiniga kaob suur hulk kaloreid, kaotavad inimesed kaalu. Selle tulemusena kogevad inimesed näljatunnet (suurenenud söögiisu). Seega iseloomustab diabeeti klassikaline sümptomite kolmik: · Polüuuria (rohkem kui 2 liitrit uriini päevas). · Polüdipsia (janu tunne). · Polüfaagia (suurenenud söögiisu). Samuti on igal diabeeditüübil oma eripärad. I tüüpi diabeediga inimestel tekivad reeglina esimesed sümptomid ootamatult, väga lühikese aja jooksul. Ja riik nagu diabeetiline ketoatsidoos võib areneda väga kiiresti. II tüüpi suhkurtõvega patsiendid on pikka aega asümptomaatilised. Isegi kui teatud kaebused on olemas, on nende intensiivsus ebaoluline. Mõnikord edasi varajased staadiumid II tüüpi suhkurtõve tekkimisel võib vere glükoosisisaldus langeda. Seda seisundit nimetatakse hüpoglükeemiaks. Kuna inimorganismis on teatud kogus insuliini, ei teki 2. tüüpi diabeediga patsientidel tavaliselt ketoatsidoosi varajases staadiumis. Muud, vähem spetsiifilised diabeedi tunnused võivad hõlmata: · Nõrkus, väsimus · Sagedased külmetushaigused · Mädased nahahaigused, furunkuloos, raskesti paranevate haavandite ilmnemine · Tugev sügelus suguelundite piirkonnas II tüüpi diabeediga patsiendid saavad oma haigusest sageli teada juhuslikult, mitu aastat pärast selle algust. Diabeedi diagnoos pannakse sellistel juhtudel kas aluseks edasijõudnute tase veresuhkru taset või diabeedi tüsistuste olemasolu alusel. Ärahoidmine
Diabeet on eelkõige pärilik haigus. Tuvastatud riskirühmad võimaldavad inimestel tänapäeval orienteeruda, hoiatada hoolimatu ja mõtlematu suhtumise eest oma tervisesse. Diabeet võib olla nii pärilik kui omandatud. Mitme riskiteguri koosmõju suurendab diabeedi tekke tõenäosust: rasvunud inimesel, kes põeb sageli viirusnakkused- gripp jne, see tõenäosus on ligikaudu sama, mis ägenenud pärilikkusega inimestel. Seega peaksid kõik riskirühma kuuluvad inimesed olema valvsad. Eriti tähelepanelik peaksite oma seisundi suhtes olema novembrist märtsini, sest enamik diabeedi juhtumeid esineb just sel perioodil. Olukorra muudab keeruliseks asjaolu, et sel perioodil võib teie seisundit segi ajada viirusinfektsiooniga. Esmases ennetuses on meetmed suunatud suhkurtõve ennetamisele: elustiili muutmine ja diabeedi riskifaktorite kõrvaldamine, ennetavad tegevused ainult inimestel või rühmadel, kellel on suur risk tulevikus diabeeti haigestuda. Liigse kehakaalu vähendamine. Ateroskleroosi ennetamine. Stressi ennetamine. Suhkrut (loodusliku magusaine kasutamine) ja loomset rasva sisaldavate toodete liigse tarbimise vähendamine. Imiku mõõdukas toitmine diabeedi vältimiseks lapsel. Diabeedi sekundaarne ennetamine Sekundaarne ennetus näeb ette meetmed, mille eesmärk on ennetada suhkurtõve tüsistusi - haiguse varajane kontroll, ennetades selle progresseerumist. Diabeediga patsientide dispanservaatlus
Diabeediga patsientide arstlik läbivaatus on süsteem ennetava ja meditsiinilised meetmed suunatud haiguse varajasele avastamisele, selle progresseerumise ennetamisele, kõikide haigete süsteemsele ravile, hea füüsilise ja hingelise seisundi säilitamisele, töövõime säilitamisele ning tüsistuste ja kaasuvate haiguste ennetamisele. Patsientide hästi korraldatud ambulatoorne jälgimine peaks tagama nende kõrvaldamise kliinilised sümptomid diabeet - janu, polüuuria, üldine nõrkus ja muud, töövõime taastumine ja säilitamine, tüsistuste ennetamine: ketoatsidoos, hüpoglükeemia, diabeetilised mikroangiopaatiad ja neuropaatia jt, saavutades diabeedi stabiilse kompenseerimise ja kehakaalu normaliseerimise. Dispanseri rühm - D-3. IDDM-iga noorukeid ei eemaldata ambulatoorsetest dokumentidest. Arstliku läbivaatuse süsteem peaks põhinema suhkurtõve immunopatoloogilise olemuse andmetel. IDDM-iga noorukid on vaja registreerida immunopatoloogiliste isikutena. Sensibiliseerivad sekkumised on vastunäidustatud. See on aluseks vaktsineerimisest meditsiinilisele loobumisele, antigeensete preparaatide kasutuselevõtu piiramisele. Pidev ravi insuliiniga on raske ülesanne ja nõuab teismelise ja arsti kannatlikkust. Suhkurtõbi hirmutab piirangute hulgaga, muudab teismelise eluviisi. On vaja õpetada teismelist insuliinihirmust üle saama. Peaaegu 95% IDDM-i põdevatest noorukitest ei ole õiget ettekujutust toitumisest, nad ei tea, kuidas muuta insuliini annuseid toitumise muutmisel, kehalise aktiivsuse ajal, mis vähendab glükeemiat. Kõige optimaalsemad on klassid "diabeedihaigete koolides" või "diabeedihaigete tervishoiuülikoolides". Vähemalt kord aastas on vajalik statsionaarne läbivaatus koos insuliiniannuste korrigeerimisega. Polikliiniku endokrinoloogi vaatlus - vähemalt 1 kord kuus. Alalised konsultandid peaksid olema silmaarst, sisearst, neuropatoloog, vajadusel uroloog, günekoloog, nefroloog. Tehakse antropomeetria, mõõdetakse vererõhku. Regulaarselt uuritakse glükeemia, glükosuuria ja atsetonuuria taset, perioodiliselt - vere lipiide ja neerufunktsiooni. Kõik diabeediga noorukid vajavad tuberkuloosiuuringut. Vähendatud glükoositaluvusega - 1 kord 3 kuu jooksul, dünaamiline vaatlus, silmaarsti läbivaatus 1 kord 3 kuu jooksul, EKG - 1 kord kuue kuu jooksul ja normaalse glükeemiaga 3 aasta jooksul - registrist kustutamine. Diabeedi patoloogiline anatoomia
Makroskoopiliselt võib pankrease mahtu vähendada, kortsuda. Muutused selle eritussektsioonis on ebastabiilsed (atroofia, lipomatoos, tsüstiline degeneratsioon, hemorraagia jne) ja esinevad tavaliselt vanemas eas. Histoloogiliselt leitakse insuliinsõltuva suhkurtõve korral pankrease saarekeste lümfotsüütiline infiltratsioon (insuliit). Viimaseid leidub valdavalt nendel saarekestel, mis sisaldavad p-rakke. Haiguse kestuse pikenedes leitakse β-rakkude progresseeruv hävimine, nende fibroos ja atroofia, pseudoatroofsed saarekesed ilma β-rakkudeta. Märgitakse pankrease saarekeste difuusset fibroosi (sagedamini insuliinsõltuva suhkurtõve ja teiste autoimmuunhaigused). Sageli täheldatakse saarekeste hüalinoosi ja hüaliinsete masside kogunemist rakkude vahel ja ümber veresooned. Märgitakse P-rakkude regenereerimise koldeid (haiguse varases staadiumis), mis haiguse kestuse pikenemisega kaovad täielikult. Insuliinsõltumatu suhkurtõve korral täheldatakse β-rakkude arvu mõningast vähenemist. Mõnel juhul on saarekeste aparatuuri muutused seotud põhihaiguse olemusega (hemokromatoos, äge pankreatiit jne). Diabeetilisesse koomasse surnud patoanatoomilisel uuringul tuvastatakse lipomatoos, põletikulised või nekrootilised muutused kõhunäärmes, maksa rasvkoe degeneratsioon, glomeruloskleroos, osteomalaatsia, verejooks seedetrakti, neerude suurenemine ja hüperemia ning mõnel juhul - müokardiinfarkt, mesenteriaalsete veresoonte tromboos, kopsuemboolia, kopsupõletik. Märgitakse ajuturset, sageli ilma morfoloogiliste muutusteta selle koes. Diabeetiline kooma ja ravi
Mõnedel patsientidel on suhkurtõbi raskekujuline ja see nõuab hoolikat ja täpset ravi insuliiniga, mida sellistel juhtudel manustatakse suurtes kogustes. Nii raske kui ka mõõduka raskusega suhkurtõbi võib põhjustada kooma vormis tüsistusi.<#"justify">Järeldus
Diabeetiline kooma tekib suhkurtõvega patsientidel, kellel on dieedi jäme rikkumine, insuliini kasutamise vigu ja selle kasutamise lõpetamine, kaasnevate haiguste (kopsupõletik, müokardiinfarkt jne), vigastuste ja kirurgilised sekkumised, füüsiline ja neuropsüühiline ülekoormus. Hüpoglükeemiline kooma areneb kõige sagedamini insuliini või teiste hüpoglükeemiliste ravimite üleannustamise tagajärjel. Hüpoglükeemia põhjuseks võib olla ebapiisav süsivesikute tarbimine tavalise insuliiniannuse sisseviimisega või pikad söömispausid, aga ka suur füüsiline töö mahu ja pingutuse osas, alkoholimürgistus, p-adrenergiliste retseptorite blokaatorite, salitsülaatide, antikoagulantide, mitmete tuberkuloosivastaste ravimite kasutamine. Lisaks tekib hüpoglükeemia (kooma) süsivesikute ebapiisava tarbimise korral organismis (nälgimine, enteriit) või nende drastilisel tarbimisel (füüsiline ülekoormus), samuti maksapuudulikkus. Arstiabi tuleb osutada viivitamatult. Diabeetilise ja hüpoglükeemilise kooma kooma soodne tulemus sõltub perioodist, mis on möödunud hetkest, mil patsient langes teadvuseta seisundisse kuni abi osutamiseni. Mida varem võetakse meetmeid kooma kõrvaldamiseks, seda soodsam on tulemus. Renderdamine arstiabi diabeetilise ja hüpoglükeemilise kooma korral tuleb läbi viia laboratoorsete analüüside järelevalve all. Seda saab teha haiglatingimustes. Katsed sellist patsienti kodus ravida võivad ebaõnnestuda. Kirjandus
Endokriinsüsteemi haiguste diagnoosimise ja ravi algoritmid, toim. I. I. Dedova. - M., 2005 - 256 lk. Balabolkin M. I. Endokrinoloogia. - M.: Meditsiin, 2004 - 416 lk. Davlitsarova K.E. Patsiendihoolduse põhialused. Esmaabi: Õpik.- M.: Foorum: Infa - M, 2004-386s. Kliiniline endokrinoloogia: juhend arstidele / Toim. T. Starkova. - M.: Meditsiin, 1998 - 512 lk. M.I. Balabolkin, E.M. Klebanova, V.M. Kreminskaja. Angiopaatia patogenees suhkurtõve korral. 1997. aastal Dreval AV DIABEETS JA MUUD KANNREASE ENDOKRINOPAATIAD (loengud). Moskva Regionaaluuringute Kliiniline Instituut. Andreeva L.P. jt Valgu diagnostiline väärtus suhkurtõve korral. // Nõukogude meditsiin. 1987. nr 2. S. 22-25. Balabolkin M. I. Suhkurtõbi. M.: Meditsiin, 1994. S. 30-33. Belovalova I.M., Knyazeva A.P. jt Pankrease hormoonide sekretsiooni uuring äsja diagnoositud suhkurtõvega patsientidel. // Endokrinoloogia probleemid. 1988. nr 6. S. 3-6.
7.1. DIABEEDI KLASSIFIKATSIOON
Diabeet(DM) - metaboolsete haiguste rühm, mida iseloomustab insuliini sekretsiooni ja/või insuliini toime efektiivsuse halvenemise tõttu tekkiv hüperglükeemia. Diabeedi korral tekkiva kroonilise hüperglükeemiaga kaasnevad tüsistused paljudest elunditest ja süsteemidest, eelkõige südamest, veresoontest, silmadest, neerudest ja närvidest. DM kokku mõjutab 5-6% elanikkonnast. Maailma majanduslikult arenenud riikides suureneb diabeedihaigete arv iga 10-15 aasta järel 2 korda. Oodatav eluiga DM-i korral väheneb 10-15%.
DM põhjused on väga erinevad. Enamikul juhtudest areneb diabeet kas absoluutse insuliinipuuduse tagajärjel. (I tüüpi diabeet) CD-1) või perifeersete kudede insuliinitundlikkuse vähenemise tõttu koos pankrease β-rakkude sekretoorse düsfunktsiooniga. ( II tüüpi suhkurtõbi -. SD-2). Mõnel juhul on patsiendile DM-1 või DM-2 määramine keeruline, kuid praktikas on DM-i hüvitamine olulisem kui selle tüübi täpne määramine. Etioloogiline klassifikatsioon eristab nelja peamist diabeedi kliinilist klassi (tabel 7.1).
Enimlevinud DM-1 (jaotis 7.5), DM-2 (jaotis 7.6) ja gestatsiooniline DM (jaotis 7.9) on käsitletud eraldi peatükkides. peal muud spetsiifilised liigid moodustab ainult umbes 1% DM juhtudest. Seda tüüpi DM-i etioloogiat ja patogeneesi näib olevat rohkem uuritud kui DM-1 ja eriti DM-2. Mitmed DM-i variandid on tingitud monogeensest pärilikkusest funktsiooni geneetilised defektidβ -rakud. See hõlmab autosomaalse domineerivalt päritud MODY sündroomi erinevaid variante (ingl. alanud noorte diabeet- täiskasvanute tüüpi diabeet noortel), mida iseloomustab rikkumine, kuid mitte insuliini sekretsiooni puudumine perifeersete kudede normaalse tundlikkusega selle suhtes.
Tab. 7.1. Diabeedi klassifikatsioon
Muide haruldane insuliini toime geneetilised defektid, seotud insuliiniretseptori mutatsiooniga (leprechaunism, Rabson-Mandehalli sündroom). DM areneb loomulikult koos eksokriinse kõhunäärme haigused, mis põhjustab β-rakkude hävimist (pankreatiit, pankreatektoomia, tsüstiline fibroos, hemokromatoos), samuti mitmetes endokriinsed haigused, mille puhul esineb ülemäärane kontrainsulaarhormoonide tootmine (akromegaalia, Cushingi sündroom). Ravimid ja kemikaalid(vakor, pentamidiin, nikotiinhape, diasoksiid jne) põhjustavad harva DM-i, kuid võivad insuliiniresistentsusega inimestel kaasa aidata haiguse avaldumisele ja dekompensatsioonile. Rida nakkushaigused(punetised, tsütomegaalia, koksaki- ja adenoviiruse infektsioon) võib kaasneda β-rakkude hävimine, samas kui enamikul patsientidest määratakse CD-1 immunogeneetilised markerid. To immuunvahendatud diabeedi haruldased vormid Nende hulka kuuluvad diabeet, mis areneb patsientidel, kellel on "jäik-rnan" sündroom (autoimmuunne neuroloogiline haigus), samuti diabeet, mis on tingitud kokkupuutest insuliiniretseptorite autoantikehadega. Erinevad valikud DM esineb suurenenud sagedusega aastal
palju geneetilised sündroomid, eriti Downi sündroomi, Klinefelteri, Turneri, Wolframi, Prader-Willi ja paljude teistega.
7.2. SÜSIVESIKUTE AINEVAHETUSE FÜSIOLOOGIA KLIINILISED ASPEKTID
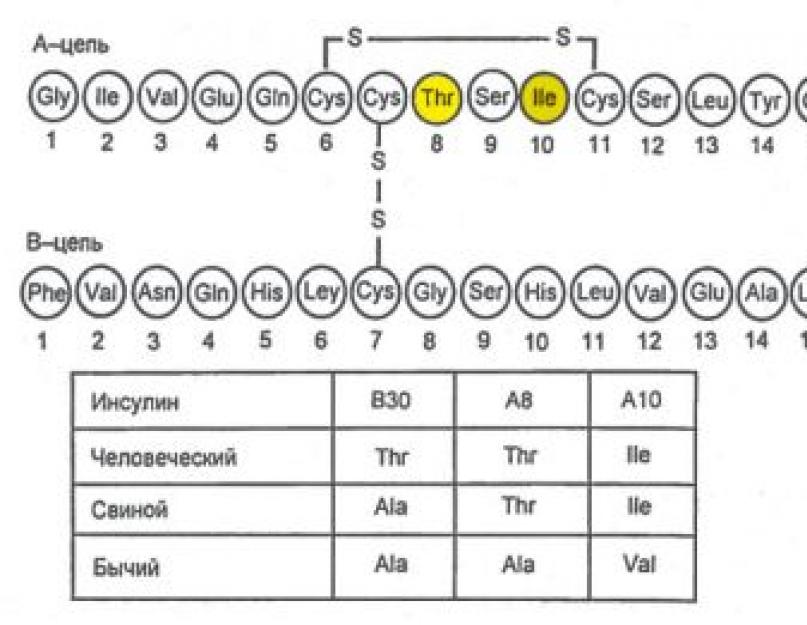
Insuliin sünteesitakse ja sekreteeritakse pankrease Langerhansi saarekeste (PZhZh) β-rakkude poolt. Lisaks eritavad Langerhansi saarekesed glükagooni (α-rakud), somatostatiini (δ-rakud) ja pankrease polüpeptiidi (PP-rakud). Saarerakkude hormoonid interakteeruvad üksteisega: glükagoon stimuleerib tavaliselt insuliini sekretsiooni ja somatostatiin pärsib insuliini ja glükagooni sekretsiooni. Insuliini molekul koosneb kahest polüpeptiidahelast (A-ahel - 21 aminohapet; B-ahel - 30 aminohapet) (joon. 7.1). Insuliini süntees algab preproinsuliini moodustumisega, mida proteaas lõhustab, moodustades proinsuliin. Golgi aparaadi sekretoorsetes graanulites lagundatakse proinsuliin insuliiniks ja C-peptiid, mis eksotsütoosi käigus verre erituvad (joon. 7.2).
Insuliini sekretsiooni peamine stimulaator on glükoos. Insuliin vabaneb vastusena vere glükoosisisalduse suurenemisele kahefaasiline(joonis 7.3). Esimene ehk äge faas kestab paar minutit ja see on seotud kogunenud vabanemisega
 Riis. 7.1. Insuliini molekuli primaarstruktuuri skeem
Riis. 7.1. Insuliini molekuli primaarstruktuuri skeem
 Riis. 7.2. Insuliini biosünteesi skeem
Riis. 7.2. Insuliini biosünteesi skeem
β-rakuline insuliin söögikordade vahelisel perioodil. Teine faas jätkub, kuni glükeemia tase saavutab normaalse tühja kõhuga (3,3-5,5 mmol / l). Sulfonüüluurea ravimid mõjutavad sarnaselt β-rakku.
Portaalisüsteemi kaudu jõuab insuliin maks- selle peamine sihtorgan. Maksa retseptorid seovad poole sekreteeritavast hormoonist. Teine pool, sattudes süsteemsesse vereringesse, jõuab lihastesse ja rasvkoesse. Suurem osa insuliinist (80%) läbib proteolüütilise lagunemise maksas, ülejäänud - neerudes ja ainult väike kogus metaboliseeritakse otse lihas- ja rasvarakkude poolt. Tavaline PZhZh
 Riis. 7.3. Insuliini kahefaasiline vabanemine glükoosi mõjul
Riis. 7.3. Insuliini kahefaasiline vabanemine glükoosi mõjul
täiskasvanu eritab 35-50 ühikut insuliini ööpäevas, mis on 0,6-1,2 ühikut 1 kg kehakaalu kohta. See sekretsioon jaguneb toiduks ja põhiliseks. toidu sekretsioon insuliin vastab söögijärgsele glükoositaseme tõusule, st. tänu sellele on tagatud toidu hüperglükeemilise toime neutraliseerimine. Toiduinsuliini kogus vastab ligikaudu sissevõetud süsivesikute kogusele - umbes 1-2,5 ühikut
10-12 g süsivesikute kohta (1 leivaühik - XE). Basaalinsuliini sekretsioon tagab optimaalse glükeemia ja anabolismi taseme söögikordade vahel ja une ajal. Basaalinsuliini eritub kiirusega umbes 1 U / h, pikaajalise füüsilise koormuse või pikaajalise tühja kõhuga väheneb see oluliselt. Toiduinsuliin moodustab vähemalt 50-70% päevasest insuliinitoodangust (joonis 7.4).
Insuliini sekretsioon ei sõltu mitte ainult toitumisest, vaid ka iga päev-
 Riis. 7 .4.
Päevase insuliinitootmise diagramm on normaalne
Riis. 7 .4.
Päevase insuliinitootmise diagramm on normaalne
kõikumised: insuliinivajadus tõuseb varajastel hommikutundidel ja siis päeva jooksul järk-järgult väheneb. Nii eritub hommikusöögiks 1 XE jaoks 2,0–2,5 U insuliini, lõunasöögiks 1,0–1,5 U ja õhtusöögiks 1,0 U. Selle insuliinitundlikkuse muutuse üheks põhjuseks on mitmete kontrainsulaarsete hormoonide (peamiselt kortisooli) kõrge tase hommikul, mis langeb öö hakul järk-järgult miinimumini.
Peamine insuliini füsioloogiline toime on glükoosi ülekande stimuleerimine insuliinist sõltuvate kudede rakumembraanide kaudu. Insuliini peamised sihtorganid on maks, rasvkude ja lihased. Insuliinist sõltumatud koed, mille varustamine glükoosiga ei sõltu insuliini toimest, hõlmavad eelkõige kesk- ja perifeerset närvisüsteemi, veresoonte endoteeli, vererakke jne. Insuliin stimuleerib glükogeeni sünteesi maksas ja lihastes, rasvade süntees maksas ja rasvkoes, valkude süntees maksas, lihastes ja teistes elundites. Kõik need muutused on suunatud glükoosi ärakasutamisele, mis viib selle taseme languseni veres. Insuliini füsioloogiline antagonist on glükagoon, mis stimuleerib glükogeeni ja rasvade mobiliseerimist depoost; Tavaliselt muutub glükagooni tase insuliini tootmisega vastastikku.
Insuliini bioloogilisi toimeid vahendab tema retseptorid asub sihtrakkudel. Insuliiniretseptor on glükoproteiin, mis koosneb neljast subühikust. Kõrge insuliinitasemega veres väheneb selle retseptorite arv vastavalt allareguleerimise põhimõttele, millega kaasneb raku tundlikkuse vähenemine insuliini suhtes. Pärast insuliini seondumist raku retseptoriga siseneb tekkinud kompleks rakku. Edasi lihas- ja rasvarakkudes põhjustab insuliin rakusiseste vesiikulite mobilisatsiooni, mis sisaldavad glükoosi transportija GLUT-4. Selle tulemusena liiguvad vesiikulid raku pinnale, kus GLUT-4 toimib glükoosi sisselaskeavana. Sarnane tegevus GLUT-4 mõjutab treening.
7.3. DIABEEDI LABORATOORNE DIAGNOSTIKA JA HÜVITAMISKRITEERIUMID
Diabeedi laboratoorne diagnoos põhineb vere glükoosisisalduse määramisel, samas kui diagnostilised kriteeriumid on kõigile ühesugused.
SD tüübid ja variandid (tabel 7.2). Muude laboratoorsete uuringute (glükosuuria tase, glükeeritud hemoglobiini taseme määramine) andmeid ei tohi kasutada diabeedi diagnoosi kinnitamiseks. DM-i diagnoosi saab määrata kahe avastamise põhjal, millest üks kolm kriteeriumi:
1. Diabeedi ilmsete sümptomitega (polüuuria, polüdipsia) ja glükoosisisaldus täiskapillaarveres üle 11,1 mmol / l, olenemata kellaajast ja eelmisest söögikorrast.
2. Kui glükoosi tase täiskapillaarveres on tühja kõhuga üle 6,1 mmol / l.
3. Kui glükoosisisaldus kapillaari täisveres on 2 tundi pärast 75 grammi glükoosi allaneelamist (suukaudne glükoositaluvuse test) üle 11,1 mmol / l.
Tab. 7.2. Diabeedi diagnoosimise kriteeriumid
 Kõige olulisem ja olulisem test diabeedi diagnoosimisel on tühja kõhu glükeemia taseme määramine (minimaalselt 8 tundi tühja kõhuga). Vene Föderatsioonis hinnatakse glükeemia taset reeglina täisveres. Glükoosi testimist kasutatakse laialdaselt paljudes riikides
Kõige olulisem ja olulisem test diabeedi diagnoosimisel on tühja kõhu glükeemia taseme määramine (minimaalselt 8 tundi tühja kõhuga). Vene Föderatsioonis hinnatakse glükeemia taset reeglina täisveres. Glükoosi testimist kasutatakse laialdaselt paljudes riikides
vereplasmas. Suukaudne glükoositaluvuse test(OGTT; glükoositaseme määramine 2 tundi pärast 75 grammi vees lahustatud glükoosi allaneelamist) omistatakse sellega seoses vähem tähtsust. OGTT põhjal aga diagnoositakse halvenenud glükoositaluvus(NTG). NTG diagnoositakse, kui tühja kõhu kapillaaride täisvere glükeemia tase ei ületa 6,1 mmol/l ja 2 tundi pärast glükoosikoormust on üle 7,8 mmol/l, kuid alla 11,1 mmol/l. Teine süsivesikute ainevahetuse häire variant on häiritud tühja kõhu glükeemia(NGNT). Viimane määratakse juhul, kui täiskapillaarvere glükeemia tase tühja kõhuga jääb vahemikku 5,6-6,0 mmol/l ja 2 tundi pärast glükoosikoormust on alla 7,8 mmol/l). NTG ja NGNT on praegu terminiga ühendatud prediabeet, kuna mõlemal patsiendikategoorial on kõrge risk diabeedi avaldumiseks ja diabeetilise makroangiopaatia tekkeks.
Diabeedi diagnoosimiseks tuleb glükeemia tase määrata standardsete laboratoorsete meetoditega. Glükeemiliste väärtuste tõlgendamisel tuleb meeles pidada, et tühja kõhu korral vastab täisveenivere glükoosisisaldus selle tasemele kapillaarveres. Pärast sööki ehk OGTT-d on selle tase veeniveres umbes 1,1 mmol/l madalam kui kapillaarveres. Plasma glükoosisisaldus on ligikaudu 0,84 mmol/l kõrgem kui täisveres. Hüvitise ja diabeediravi adekvaatsuse hindamiseks hinnatakse glükeemia taset kapillaarveres kaasaskantava seadme abil. glükomeetrid patsiendid ise, nende sugulased või meditsiinitöötajad.
Mis tahes tüüpi DM, aga ka märkimisväärse glükoosikoormuse korral, glükosuuria, mis on primaarsest uriinist glükoosi reabsorptsiooni läve ületamise tagajärg. Glükoosi reabsorptsiooni lävi on individuaalselt oluliselt erinev (≈ 9-10 mmol/l). Ühe näitajana ei tohiks glükosuuriat kasutada DM diagnoosimiseks. Tavaliselt glükosuuriat ei esine, välja arvatud olulise rafineeritud süsivesikute toidukoormuse korral.
Tooted ketoonkehad(atsetoon, atsetoatsetaat, β-hüdroksübutüraat) intensiivistub oluliselt absoluutse insuliinipuuduse korral. SD-1 dekompensatsiooniga on väljendunud ketonuuria(uurimisel kasutatakse testribasid, mis langevad uriini). Kerge (jälg)ketonuuria saab määrata tervetel inimestel nälgimise ja süsivesikutevaba dieedi ajal.
Tase C-peptiid. C-peptiidi tase veres võib kaudselt hinnata kõhunäärme β-rakkude insuliini sekretsioonivõimet. Viimased toodavad proinsuliini, millest enne sekretsiooni eraldatakse C-peptiid, mis siseneb verre insuliiniga võrdsetes kogustes. Insuliin on 50% ulatuses seotud maksas ja selle poolväärtusaeg perifeerses veres on umbes 4 minutit. Maks ei eemalda C-peptiidi vereringest ja selle poolväärtusaeg veres on umbes 30 minutit. Lisaks ei seondu see perifeeria raku retseptoritega. Seetõttu on C-peptiidi taseme määramine usaldusväärsem test saareaparaadi funktsioonide hindamiseks. C-peptiidi taset on kõige informatiivsem uurida stimulatsioonitestide taustal (pärast sööki või glükagooni manustamist). Test ei ole informatiivne, kui see viiakse läbi diabeedi raske dekompensatsiooni taustal, kuna raske hüperglükeemia on. toksiline toimeβ-rakkudele (glükoosi toksilisus). Insuliinravi eelnevatel päevadel ei mõjuta kuidagi testi tulemusi.
Põhiline ravi eesmärk Mis tahes tüüpi DM on selle hiliste tüsistuste ennetamine, mida on võimalik saavutada mitmete parameetrite stabiilse kompenseerimise taustal (tabel 7.3). Süsivesikute ainevahetuse kompenseerimise kvaliteedi peamine kriteerium DM-s on tase glükeeritud (glükosüülitud) hemoglobiin (HbA1c). Viimane on glükoosiga mittekovalentselt seotud hemoglobiin. Glükoos siseneb erütrotsüütidesse insuliinist sõltumatult ja hemoglobiini glükosüülimine on pöördumatu protsess ja selle aste on otseselt võrdeline glükoosi kontsentratsiooniga, millega see on 120 päeva jooksul kokkupuutes olnud. Väike osa hemoglobiinist on glükosüülitud ja normaalne; DM-iga saab seda oluliselt suurendada. HbA1c tase, erinevalt pidevalt muutuvast glükoositasemest, peegeldab lahutamatult glükeemiat viimase 3-4 kuu jooksul. Just selle intervalliga on soovitatav määrata HbA1c tase, et hinnata diabeedi kompensatsiooni.
Krooniline hüperglükeemia ei ole kaugeltki ainus riskitegur DM hiliste tüsistuste tekkeks ja progresseerumiseks. Mis puudutab DM hüvitise hindamine kompleksi põhjal
laboratoorium ja instrumentaalsed meetodid uuringud (tabel 7.3). Lisaks süsivesikute ainevahetuse seisundit iseloomustavatele näitajatele, tase vererõhk ja vere lipiidide profiil.
Tab. 7.3. Suhkurtõve hüvitamise kriteeriumid
 Lisaks ülaltoodud kompensatsioonikriteeriumidele on diabeedi ravi eesmärkide kavandamisel vajalik individuaalne lähenemine. DM-i hiliste komplikatsioonide (eriti mikroangiopaatia) tekke ja progresseerumise tõenäosus suureneb koos haiguse kestusega. Seega, kui lastel ja noortel patsientidel, kelle diabeedikogemus võib tulevikus ulatuda mitmekümne aastani, on vaja saavutada optimaalsed glükeemilised indeksid, siis patsientidel, kellel DM avaldus vanemaealistel ja seniilses eas, jäik euglükeemiline kompensatsioon, mis oluliselt suurendab. hüpoglükeemia oht, mis ei ole alati asjakohane.
Lisaks ülaltoodud kompensatsioonikriteeriumidele on diabeedi ravi eesmärkide kavandamisel vajalik individuaalne lähenemine. DM-i hiliste komplikatsioonide (eriti mikroangiopaatia) tekke ja progresseerumise tõenäosus suureneb koos haiguse kestusega. Seega, kui lastel ja noortel patsientidel, kelle diabeedikogemus võib tulevikus ulatuda mitmekümne aastani, on vaja saavutada optimaalsed glükeemilised indeksid, siis patsientidel, kellel DM avaldus vanemaealistel ja seniilses eas, jäik euglükeemiline kompensatsioon, mis oluliselt suurendab. hüpoglükeemia oht, mis ei ole alati asjakohane.
7.4. INSULIIN JA INSULIINRAAVI
Insuliinipreparaadid on 1. tüüpi diabeediga patsientidele üliolulised; lisaks saavad neid kuni 40% II tüüpi diabeediga patsientidest. Üldise juurde näidustused insuliinravi määramiseks diabeedi korral, millest paljud tegelikult kattuvad, hõlmavad järgmist:
1. 1. tüüpi diabeet
2. Pankreatektoomia
3. Ketoatsidootiline ja hüperosmolaarne kooma
4. II tüüpi diabeedi korral:
Insuliinipuuduse ilmsed nähud, nagu progresseeruv kaalulangus ja ketoos, raske hüperglükeemia;
Suured kirurgilised sekkumised;
Ägedad makrovaskulaarsed tüsistused (insult, müokardiinfarkt, gangreen jne) ja rasked nakkushaigused, millega kaasneb süsivesikute metabolismi dekompensatsioon;
Tühja kõhu glükeemia tase on üle 15-18 mmol / l;
Stabiilse hüvitise puudumine, hoolimata erinevate tablettide hüpoglükeemiliste ravimite maksimaalsete ööpäevaste annuste määramisest;
Diabeedi hiliste komplikatsioonide hilised staadiumid (raske polüneuropaatia ja retinopaatia, krooniline neerupuudulikkus).
5. Suutmatus saavutada dieetravi abil rasedusdiabeedi kompensatsiooni.
Päritolu Insuliinipreparaadid võib jagada kolme rühma:
loomsed insuliinid (sealiha);
Inimese insuliinid (poolsünteetilised, geneetiliselt muundatud);
Insuliini analoogid (lispro, aspart, glargiin, detemiir).
Iniminsuliini tootmise tehnoloogia areng on viinud selleni, et kasutatakse sea insuliin(erineb inimese omast ühe aminohappe võrra) on viimasel ajal oluliselt vähenenud. Sealiha insuliini saab kasutada iniminsuliini valmistamiseks poolsünteetiline meetod, mis hõlmab ühe erineva aminohappe asendamist selle molekulis. Kõrgeima kvaliteediga on geenitehnoloogia iniminsuliinid. Nende saamiseks seostatakse genoomiga inimese genoomi piirkond, mis vastutab insuliini sünteesi eest E. coli või pärmikultuuri, mille tulemusena hakkavad viimased tootma humaaninsuliini. Loomine insuliini analoogid erinevate aminohapete permutatsioonide abil oli eesmärgiks saada etteantud ja soodsaima farmakokineetikaga ravimeid. Niisiis, insuliin lispro (Humalog) on analoog
ülilühiajalise toimega insuliin, mille hüpoglükeemiline toime avaldub juba 15 minutit pärast süstimist. Seevastu insuliini analoogi glargiini (Lantus) iseloomustab pikaajaline toime, mis kestab kogu päeva, samas kui ravimi kineetikat iseloomustab plasmakontsentratsiooni väljendunud piikide puudumine. Enamik praegu kasutatavaid insuliinipreparaate ja selle analooge on toodetud aastal kontsentratsioon 100 U/ml. Kõrval toime kestus insuliinid jagunevad 4 põhirühma (tabel 7.4):
Tab. 7.4. Ravimite ja insuliini analoogide farmakokineetika
 1.
Ultralühiajaline toime (lispro, aspart).
1.
Ultralühiajaline toime (lispro, aspart).
2. Lühitoimeline (lihtne iniminsuliin).
3. Keskmine toimeaeg (insuliinid neutraalsel protamiinil Hagedorn).
4. Pikatoimeline (glargiin, detemiir).
5. Erineva toimeajaga insuliinide segud (Novomix-30, Humulin-MZ, Humalog-Mix-25).
Ettevalmistused ülilühike tegevus[lispro (Humalog), aspart (Novorapid)] on insuliini analoogid. Nende eelised on kiire areng hüpoglükeemiline toime pärast süstimist (pärast 15 minutit), mis võimaldab süstimist vahetult enne sööki või isegi vahetult pärast sööki, samuti lühike toimeaeg (alla 3 tunni), mis vähendab hüpoglükeemia riski. Ettevalmistused lühike tegevus(lihtinsuliin, tavaline insuliin) on lahus, mis sisaldab insuliini kontsentratsioonis 100 U / ml. Lihtne insuliinisüst tehakse 30 minutit enne sööki; toime kestus on umbes 4-6 tundi. Ultralühi- ja lühitoimelisi preparaate võib manustada subkutaanselt, intramuskulaarselt ja intravenoosselt.
Narkootikumide hulgas keskmine toime kestus neutraalse protamiini Hagedorn (NPH) kõige sagedamini kasutatavad preparaadid. NPH on valk, mis adsorbeerib insuliini mittekovalentselt, aeglustades selle imendumist nahaalusest depoost. NPH-insuliinide efektiivne toimeaeg on tavaliselt umbes 12 tundi; neid manustatakse ainult subkutaanselt. NPH-insuliin on suspensioon ja seetõttu on see erinevalt tavainsuliinist viaalis hägune ja pikaajalisel seismisel moodustub suspensioon, mida tuleb enne süstimist põhjalikult segada. Erinevalt teistest pikatoimelistest ravimitest võib NPH-insuliine segada mis tahes vahekorras lühitoimelise insuliiniga (lihtinsuliiniga), samas kui segu komponentide farmakokineetika ei muutu, kuna NPH ei seo täiendavaid koguseid lihtinsuliini ( joon. 7.5). Lisaks kasutatakse protamiini insuliini analoogide (Novomix-30, Humalog-Mix-25) standardsete segude valmistamiseks.
Narkootikumide hulgas pikatoimeline Praegu kasutatakse laialdaselt insuliini analooge glargiin(Lantus) ja detemir(Levemir). Nende ravimite farmakokineetika eeliseks on see, et erinevalt NPH-insuliinidest tagavad nad ühtlasema ja pikemaajalisema ravimi sissevõtmise nahaalusest depoost. Sellega seoses võib glargiini manustada ainult üks kord päevas ja peaaegu sõltumata kellaajast.
 Riis. 7.5. Farmakokineetika erinevad ravimid insuliin:
Riis. 7.5. Farmakokineetika erinevad ravimid insuliin:
a) ühekomponentne; b) insuliinide standardsed segud
Lisaks monokomponentsetele insuliinipreparaatidele in kliiniline praktika laialdaselt kasutatud standardsed segud. Tavaliselt, me räägime lühikese või ülilühikese insuliini segude kohta keskmise toimeajaga insuliiniga. Näiteks ravim "Humulin-MZ" sisaldab ühes viaalis 30% lihtsat insuliini ja 70% NPH insuliini; Novomix-30 sisaldab 30% aspartinsuliini ja 70% aspartinsuliini kristalset protamiini suspensiooni; Humalog-Mix-25 sisaldab 25% insuliin lispro ja 75% insuliin lispro protamiini suspensiooni. eelis
standardsed insuliinisegud on kahe süsti asendamine ühega ja segu komponentide annuste mõnevõrra suurem täpsus; puuduseks on segu üksikute komponentide individuaalse doseerimise võimatus. See määrab eelistuse standardsete insuliinisegude kasutamiseks DM-2 raviks või koos nn traditsiooniline insuliinravi(insuliini fikseeritud annuste määramine), samas kui intensiivne insuliinravi(paindlik annuse valik sõltuvalt glükeemilistest näitajatest ja süsivesikute kogusest toidus), eelistatav on ühekomponentsete preparaatide kasutamine.
Eduka insuliinravi võti on selle range järgimine süstimistehnikad. Insuliini manustamiseks on mitu võimalust. Lihtsaim ja samal ajal usaldusväärsem meetod on insuliini süstimine süstal. Mugavam viis insuliini manustamiseks on süstid. süstla pliiatsid, mis on kombineeritud seade, mis sisaldab insuliini reservuaari (padrunit), doseerimissüsteemi ja nõela koos injektoriga.
Säilitusraviks (kui me ei räägi diabeedi raskest dekompensatsioonist või kriitilistest seisunditest) manustatakse insuliini subkutaanselt. Lühitoimelist insuliini soovitatakse süstida kõhupiirkonna nahaalusesse rasvkoesse, pikatoimelist insuliini - reie- või õlakudedesse (joonis 7.6 a). Süstid tehakse sügavale nahaalusesse koesse läbi laialt kokkusurutud naha 45° nurga all (joonis 7.6 b). Patsienti tuleb soovitada vahetada igapäevaseid insuliini süstekohti samas piirkonnas, et vältida lipodüstroofia teket.
To tegurid, mis mõjutavad insuliini imendumise kiirust subkutaansest depoost tuleb omistada insuliini annus (annuse suurendamine pikendab imendumise kestust), süstekoht (kõhukoest imendub kiiremini), ümbritseva õhu temperatuur (soojendamine ja süstekoha masseerimine kiirendab imendumist).
Keerulisem manustamisviis, mis aga võimaldab paljudel patsientidel saavutada häid ravitulemusi, on kasutamine insuliini dosaator, või süsteemid insuliini pidevaks subkutaanseks manustamiseks. Dosaator on kaasaskantav seade, mis koosneb arvutist, mis määrab insuliini manustamisrežiimi, samuti insuliini manustamissüsteemist kateetri ja miniatuurse hüpodermilise nõela kaudu.
 Riis. 7.6. Insuliini süstid: a) tüüpilised süstekohad; b) insuliinisüstla nõela asukoht süstimise ajal
Riis. 7.6. Insuliini süstid: a) tüüpilised süstekohad; b) insuliinisüstla nõela asukoht süstimise ajal
rasvkude. Dosaatori abil viiakse läbi lühitoimelise või ülilühitoimelise insuliini pidev põhimanustamine (kiirus suurusjärgus 0,5-1 U / tund) ja enne söömist, sõltuvalt süsivesikute sisaldusest selles. ja glükeemia taset, süstib patsient sama lühitoimelise insuliini vajaliku boolusannuse. Dosaatoriga insuliinravi eeliseks on ainult lühitoimelise (või isegi ülilühikese) insuliini kasutuselevõtt, mis iseenesest on mõnevõrra füsioloogilisem, kuna pikaajaliste insuliinipreparaatide imendumine on suurte kõikumiste all; sellega seoses on lühitoimelise insuliini pidev manustamine paremini juhitav. Dosaatorit kasutava insuliinravi puuduseks on vajadus seadme pidevaks kandmiseks, samuti süstenõela pikaajaline viibimine nahaaluses koes, mis nõuab perioodilist insuliinivarustusprotsessi jälgimist. Dosaatorit kasutav insuliinravi on eelkõige näidustatud I tüüpi diabeediga patsientidele, kes on valmis selle manustamistehnikat valdama. Eelkõige tuleks sellega seoses tähelepanu pöörata patsientidele, kellel on väljendunud koidiku nähtus, samuti rasedatele ja rasedust planeerivatele DM-1-ga patsientidele ning patsientidele.
Korraliku eluviisiga entid (paindlikuma toitumise võimalus).
7.5. 1. TÜÜPI DIABEET
CD-1 - elundispetsiifiline autoimmuunne haigus, mis põhjustab kõhunäärme saarekeste insuliini tootvate β-rakkude hävimist, mis väljendub insuliini absoluutses puuduses. Mõnel juhul ei ole ilmse DM-1-ga patsientidel β-rakkude autoimmuunse kahjustuse markereid. (idiopaatiline CD-1).
Etioloogia
CD-1 on haigus, millel on pärilik eelsoodumus, kuid selle panus haiguse arengusse on väike (määrab selle arengu umbes 1/3 võrra). CD-1 identsete kaksikute vastavus on ainult 36%. Tõenäosus haigestuda DM-1 lapsel, kellel on haige ema, on 1-2%, isa - 3-6%, vend või õde - 6%. Üks või mitu autoimmuunse β-rakkude kahjustuse humoraalset markerit, mis hõlmavad pankrease saarekeste antikehi, glutamaadi dekarboksülaasi (GAD65) ja türosiinfosfataasi (IA-2 ja ΙΑ-2β) vastaseid antikehi, on leitud 85–90% juhtudest. patsiendid. Sellegipoolest on rakulise immuunsuse tegurid β-rakkude hävitamisel esmatähtsad. CD-1 on seotud selliste HLA haplotüüpidega nagu DQA ja DQB, samas kui mõned alleelid HLA-DR/DQ võivad soodustada haiguse arengut, samas kui teised on kaitsvad. Suurenenud sagedusega kombineeritakse CD-1 teiste autoimmuunsete endokriinsete ( autoimmuunne türeoidiit, Addisoni tõbi) ja mitte-endokriinsed haigused, nagu alopeetsia, vitiliigo, Crohni tõbi, reumaatilised haigused (tabel 7.5).
Patogenees
CD-1 avaldub siis, kui autoimmuunprotsessi käigus hävib 80-90% β-rakkudest. Selle protsessi kiirus ja intensiivsus võivad oluliselt erineda. Kõige sagedamini siis, kui tüüpiline vool laste ja noorte haiguste puhul kulgeb see protsess üsna kiiresti, millele järgneb haiguse kiire ilming, mille puhul esimeste kliiniliste sümptomite ilmnemisest ketoatsidoosi tekkeni (kuni ketoatsidootilise koomani) võib mööduda vaid mõni nädal.
Tab. 7.5. 1. tüüpi diabeet
 Tabeli jätk. 7.5
Tabeli jätk. 7.5
 Muudel, palju harvematel juhtudel, tavaliselt üle 40-aastastel täiskasvanutel, võib haigus olla varjatud. (latentne autoimmuunne diabeet täiskasvanutel – LADA), samal ajal diagnoositakse sellistel patsientidel haiguse alguses sageli DM-2 ja mitme aasta jooksul saab DM-i kompenseerida sulfonüüluurea ravimite määramisega. Kuid tulevikus, tavaliselt 3 aasta pärast, ilmnevad absoluutse insuliinipuuduse tunnused (kaalulangus, ketonuuria, raske hüperglükeemia, hoolimata hüpoglükeemiliste tablettide võtmisest).
Muudel, palju harvematel juhtudel, tavaliselt üle 40-aastastel täiskasvanutel, võib haigus olla varjatud. (latentne autoimmuunne diabeet täiskasvanutel – LADA), samal ajal diagnoositakse sellistel patsientidel haiguse alguses sageli DM-2 ja mitme aasta jooksul saab DM-i kompenseerida sulfonüüluurea ravimite määramisega. Kuid tulevikus, tavaliselt 3 aasta pärast, ilmnevad absoluutse insuliinipuuduse tunnused (kaalulangus, ketonuuria, raske hüperglükeemia, hoolimata hüpoglükeemiliste tablettide võtmisest).
Nagu mainitud, on DM-1 patogeneesi keskmes absoluutne insuliinipuudus. Glükoosi sisenemise võimatus insuliinist sõltuvatesse kudedesse (rasv ja lihased) põhjustab energiapuudust, mille tagajärjel intensiivistuvad lipolüüs ja proteolüüs, mis on seotud kehakaalu langusega. Glükeemia taseme tõus põhjustab hüperosmolaarsust, millega kaasneb osmootne diurees ja tõsine dehüdratsioon. Insuliinipuuduse ja energiapuuduse tingimustes pärsitakse kontrainsulaarsete hormoonide (glükagoon, kortisool, kasvuhormoon) tootmine, mis hoolimata suurenevast glükeemiast põhjustab glükoneogeneesi stimuleerimist. Suurenenud lipolüüs rasvkoes toob kaasa vabade rasvhapete kontsentratsiooni olulise tõusu. Insuliinipuuduse korral on maksa liposünteesivõime pärsitud ja vaba
nye rasvhapped hakkavad sisalduma ketogeneesis. Ketoonkehade kuhjumine põhjustab diabeetilise ketoosi ja hiljem ketoatsidoosi arengut. Dehüdratsiooni ja atsidoosi progresseeruva suurenemisega tekib kooma (vt lõik 7.7.1), mis insuliinravi ja rehüdratsiooni puudumisel lõpeb paratamatult surmaga.
Epidemioloogia
DM-1 moodustab ligikaudu 1,5-2% kõigist diabeedijuhtudest ja see suhteline arv väheneb jätkuvalt DM-2 esinemissageduse kiire kasvu tõttu. Eluaegne risk haigestuda CD-1 valge rassi puhul on umbes 0,4%. DM-1 esinemissagedus kasvab 3% aastas: 1,5% uute juhtude tõttu ja veel 1,5% patsientide eluea pikenemise tõttu. CD-1 levimus varieerub sõltuvalt elanikkonna etnilisest koosseisust. 2000. aasta seisuga oli see Aafrikas 0,02%, Lõuna-Aasias ning Lõuna- ja Kesk-Ameerikas 0,1% ning Euroopas ja Põhja-Ameerikas 0,2%. Kõige kõrgem on DM-1 esinemissagedus Soomes ja Rootsis (30-35 juhtu 100 tuhande elaniku kohta aastas), madalaim Jaapanis, Hiinas ja Koreas (vastavalt 0,5-2,0 juhtu). CD-1 manifestatsiooni vanuse tippaeg on ligikaudu 10-13 aastat. Enamikul juhtudest avaldub CD-1 enne 40. eluaastat.
Kliinilised ilmingud
AT tüüpilised juhtumid eriti lastel ja noortel debüteerib CD-1 erksa kliinilise pildiga, mis areneb mitme kuu või isegi nädala jooksul. CD-1 manifestatsiooni võivad provotseerida nakkus- ja muud kaasuvad haigused. Iseloomulik kõikidele diabeeditüüpidele omased sümptomid, seotud hüperglükeemiaga: polüdipsia, polüuuria, sügelus, kuid SD-1 puhul on need väga väljendunud. Seega saavad patsiendid kogu päeva jooksul juua ja eritada kuni 5-10 liitrit vedelikku. spetsiifiline DM-1 puhul on absoluutsest insuliinipuudusest põhjustatud sümptomiks kaalulangus, mis jõuab 1-2 kuu jooksul 10-15 kg-ni. Iseloomulik on väljendunud üldine ja lihasnõrkus, töövõime langus, unisus. Haiguse alguses võib mõnel patsiendil tekkida söögiisu suurenemine, mis ketoatsidoosi tekkimisel asendub anoreksiaga. Viimast iseloomustab atsetoonilõhna (või puuviljalõhna) ilmumine suust,
märkus, oksendamine, sageli kõhuvalu (pseudoperitoniit), tugev dehüdratsioon ja lõpeb kooma tekkega (vt punkt 7.7.1). Mõnel juhul on CD-1 esimene ilming lastel progresseeruv teadvuse kahjustus kuni koomani kaasuvate haiguste, tavaliselt nakkusliku või ägeda kirurgilise patoloogia taustal.
Suhteliselt harvadel juhtudel on CD-1 arenemine üle 35-40-aastastel inimestel (varjatud autoimmuunne diabeet täiskasvanutel) haigus ei pruugi avalduda nii selgelt (mõõdukas polüdipsia ja polüuuria, kaalulangus puudub) ja seda avastada isegi juhuslikult glükeemia taseme rutiinsel määramisel. Nendel juhtudel diagnoositakse patsiendil sageli alguses DM-2 ja ta määrab suukaudsed hüpoglükeemilised ravimid (TSP), mis mõneks ajaks pakuvad DM-i vastuvõetavat kompensatsiooni. Sellest hoolimata tekivad patsiendil mitme aasta jooksul (sageli aasta jooksul) suurenevast absoluutsest insuliinipuudusest tingitud sümptomid: kaalulangus, võimetus säilitada normaalset glükeemiat HFT taustal, ketoos, ketoatsidoos.
Diagnostika
Arvestades, et DM-1-l on elav kliiniline pilt ja see on ka suhteliselt haruldane haigus, ei ole DM-1 diagnoosimiseks glükeemia taseme skriiningmääramine näidustatud. Haiguse tekkimise tõenäosus patsientide lähimates sugulastes on madal, mis koos tõhusate DM-1 esmase ennetamise meetodite puudumisega määrab haiguse immunogeneetiliste markerite uurimise sobimatuse neis. DM-1 diagnoos põhineb enamikul juhtudest olulise hüperglükeemia tuvastamisel patsientidel, kellel on absoluutse insuliinipuuduse rasked kliinilised ilmingud. OGTT-d DM-1 diagnoosimiseks tuleb teha väga harva.
Diferentsiaaldiagnoos
Kahtlastel juhtudel (keskmise raskusega hüperglükeemia tuvastamine ilmsete kliiniliste ilmingute puudumisel, manifestatsioon suhteliselt keskeas), samuti diferentsiaaldiagnoosimiseks teiste DM-i tüüpidega, taseme määramine. C-peptiid(basaal ja 2 tundi pärast sööki). Kaudsel diagnostilisel väärtusel võib kahtlastel juhtudel olla määratlus immunoloogilised markerid CD-1 - saarekeste antikehad
PZhZh, glutamaadi dekarboksülaasi (GAD65) ja türosiinfosfataasi (IA-2 ja IA-2β) jaoks. CD-1 ja CD-2 diferentsiaaldiagnoos on esitatud tabelis. 7.6.
Tab. 7.6. Diferentsiaaldiagnoos ja erinevused CD-1 ja CD-2 vahel
 Ravi
Ravi
Mis tahes tüüpi DM-i ravi põhineb kolmel põhiprintsiibil: hüpoglükeemiline ravi (DM-1 korral - insuliinravi), dieet ja patsiendi koolitus. insuliinravi SD-1 kuludega asendamine ja selle eesmärk on maksimaalselt imiteerida hormooni füsioloogilist tootmist, et saavutada aktsepteeritud kompensatsioonikriteeriumid (tabel 7.3). Füsioloogilisele insuliini sekretsioonile kõige lähemal intensiivne insuliinravi. Insuliinivajadus, mis vastab selle basaalsekretsioon, varustatud kahe keskmise toimeajaga insuliini süstiga (hommikul ja õhtul) või ühe pikatoimelise insuliini (glargiini) süstiga. Basaalinsuliini koguannus
rida ei tohiks ületada poolt ravimi ööpäevasest koguvajadusest. Insuliini sekretsioon söögi ajal või boolusena asendatakse lühikese või ülikiire insuliini süstimisega enne iga sööki, samas kui selle annus arvutatakse eelseisva söögikorra ajal eeldatavalt tarbitavate süsivesikute koguse ja patsiendi poolt glükomeetri abil kindlaks määratud veresuhkru taseme alusel. enne iga insuliinisüsti (joonis 7.7).
Hinnanguline intensiivne insuliinirežiim, mis muutub peaaegu iga päev, võib kujutada järgmiselt. Lähtudes sellest, igapäevane vajadus insuliinis on umbes 0,5-0,7 U 1 kg kehakaalu kohta (70 kg kaaluval patsiendil umbes 35-50 U). Umbes 1/s–1/2 sellest annusest moodustab pikatoimeline insuliin (20–25 U), 1/2–2/s lühitoimeline või ülilühitoimeline insuliin. NPH-insuliini annus jagatakse 2 süstiks: hommikul 2 / s selle annusest (12 U), õhtul - 1 / s (8-10 U).
eesmärk esimene aste Insuliinravi valik on tühja kõhuga glükoositaseme normaliseerimine. NPH-insuliini õhtune annus manustatakse tavaliselt kell 20-23, millele järgneb hommikune lühitoimelise insuliini annus enne hommikusööki. NPH insuliini õhtuse annuse valimisel tuleb silmas pidada võimalust, et tekib mitmeid
 Riis. 7.7. Intensiivse insuliinravi skeem
Riis. 7.7. Intensiivse insuliinravi skeem
üsna tüüpilised nähtused. Hommikuse hüperglükeemia põhjuseks võib olla pikatoimelise insuliini ebapiisav annus, kuna hommikuks suureneb insuliinivajadus märkimisväärselt ("koidu" fenomen). Lisaks annuse ebapiisavale annusele võib selle liig põhjustada hommikust hüperglükeemiat - Somoji fenomen(Somogyi), posthüpoglükeemiline hüperglükeemia. Seda nähtust seletatakse asjaoluga, et kudede maksimaalne tundlikkus insuliini suhtes toimub kella 2–4 vahel öösel. Just sel ajal on peamiste kontrainsulaarsete hormoonide (kortisool, kasvuhormoon jne) tase tavaliselt madalaim. Kui pikatoimelise insuliini õhtune annus on ülemäärane, siis sel ajal areneb hüpoglükeemia. Kliiniliselt võib see ilmneda halva unena koos õudusunenägude, teadvuseta unetegevuse, hommikuste peavalude ja väsimusega. Hüpoglükeemia tekkimine põhjustab sel ajal glükagooni ja teiste kontrainsulaarsete hormoonide märkimisväärset kompenseerivat vabanemist, millele järgneb hüperglükeemia hommikul. Kui sellises olukorras õhtul manustatava pikatoimelise insuliini annust ei vähendata, vaid suurendatakse, süveneb öine hüpoglükeemia ja hommikune hüperglükeemia, mis võib lõpuks viia kroonilise insuliini üleannustamise sündroomi (Somogyi sündroom), mis on rasvumise kombinatsioon. diabeedi kroonilise dekompensatsiooni, sagedase hüpoglükeemia ja progresseeruvate hiliste komplikatsioonidega. Somogyi fenomeni diagnoosimiseks on vaja uurida glükeemia taset umbes kell 3 öösel, mis on insuliinravi valiku lahutamatu osa. Kui õhtuse NPH annuse vähenemisega ohutu öise hüpoglükeemiani kaasneb hommikune hüperglükeemia (koidikunähtus), tuleb patsiendil soovitada ärkamist varem (6-7 hommikul), samal ajal kui öösel manustatud insuliin jätkab säilitada normaalset glükeemilist taset.
Teine NPH-insuliini süst tehakse tavaliselt enne hommikusööki koos lühitoimelise (ülilühiajalise) insuliinisüstiga hommikul. Sel juhul valitakse annus peamiselt glükeemia taseme näitajate põhjal enne peamisi igapäevaseid söögikordi (lõunasöök, õhtusöök); lisaks võib seda piirata hüpoglükeemia tekkimine söögikordade vahel, näiteks keskpäeval, hommiku- ja lõunasöögi vahel.
kogu insuliiniannus pikaajaline tegevus(glargiini) manustatakse üks kord päevas, pole vahet, mis kell. Kineetika
glargiin- ja detemirinsuliinid on hüpoglükeemia, sealhulgas öise hüpoglükeemia tekkeriski seisukohalt soodsamad.
Lühi- või ülilühitoimelise insuliini annus sõltub isegi patsiendi insuliini manustamise esimesel päeval tarbitud süsivesikute (leivaühikute) kogusest ja glükeemia tasemest enne süstimist. Tavaliselt võetakse õhtusöögiks umbes 1/4 annusest lühitoimelist insuliini (6-8 RÜ), lähtudes insuliini sekretsiooni päevasest rütmist normis, ülejäänud annus jagatakse ligikaudu võrdselt hommiku- ja lõunasöögiks (10-12). RÜ). Mida kõrgem baasjoon glükeemiat, seda vähem see manustatud insuliiniühiku kohta väheneb. Lühitoimelist insuliini manustatakse 30 minutit enne sööki, ülilühitoimelist insuliini vahetult enne sööki või isegi vahetult pärast sööki. Lühitoimelise insuliini annuse piisavust hinnatakse glükeemianäitajate järgi 2 tundi pärast sööki ja enne järgmist söögikorda.
Insuliini annuse arvutamiseks intensiivse insuliinravi ajal piisab XE arvu arvutamisest ainult süsivesikute komponendi põhjal. Samas ei lähe arvesse mitte kõik süsivesikuid sisaldavad tooted, vaid ainult nn loendatavad. Viimaste hulka kuuluvad kartul, teraviljatooted, puuviljad, vedelad piimatooted ja suhkrurikkad toidud. Arvesse ei võeta tooteid, mis sisaldavad mitteseeditavaid süsivesikuid (enamik köögivilju). Välja on töötatud spetsiaalsed vahetustabelid, mille abil süsivesikute kogust XE-s väljendades on võimalik välja arvutada vajalik insuliiniannus. Üks XE vastab 10-12 g süsivesikutele (tabel 10.7).
Pärast 1 XE-d sisaldavat sööki tõuseb glükeemia tase 1,6-2,2 mmol / l, s.o. umbes sama palju kui glükoosi tase väheneb 1 ühiku insuliini sisestamisel. Teisisõnu, iga toidus sisalduva XU kohta, mida kavatsetakse süüa, on vaja eelnevalt manustada (olenevalt kellaajast) umbes 1 ühik insuliini. Lisaks tuleb arvesse võtta glükeemia taseme enesekontrolli tulemusi, mis tehakse enne iga süsti, ja kellaaega (umbes 2 RÜ insuliini 1 XE kohta hommikul ja lõuna ajal, 1 RÜ 1 XE kohta õhtusöögiks). Seega, kui tuvastatakse hüperglükeemia, tuleb insuliini annust, mis arvutatakse vastavalt eelseisvale söögikorrale (vastavalt XE arvule), suurendada ja vastupidi, kui tuvastatakse hüpoglükeemia, manustatakse vähem insuliini.
Tab. 7.7. 1 XE moodustavate toodete samaväärne asendamine
 Näiteks kui patsiendil on 30 minutit enne planeeritud 5 XE-d sisaldavat õhtusööki glükeemiline tase 7 mmol/l, peab ta süstima 1 ühiku insuliini, et glükeemia langeks. normaalne tase: 7 mmol/l kuni umbes 5 mmol/l. Lisaks tuleb 5 XE katmiseks manustada 5 ühikut insuliini. Seega süstib patsient sel juhul 6 ühikut lühitoimelist või ülikiiret insuliini.
Näiteks kui patsiendil on 30 minutit enne planeeritud 5 XE-d sisaldavat õhtusööki glükeemiline tase 7 mmol/l, peab ta süstima 1 ühiku insuliini, et glükeemia langeks. normaalne tase: 7 mmol/l kuni umbes 5 mmol/l. Lisaks tuleb 5 XE katmiseks manustada 5 ühikut insuliini. Seega süstib patsient sel juhul 6 ühikut lühitoimelist või ülikiiret insuliini.
Pärast CD-1 avaldumist ja insuliinravi alustamist piisavalt pikka aega võib insuliinivajadus olla väike ja olla väiksem kui 0,3-0,4 U / kg. Seda perioodi nimetatakse remissioonifaasiks või "Mesinädalad". Pärast hüperglükeemia ja ketoatsidoosi perioodi, mis pärsivad insuliini sekretsiooni 10-15% ülejäänud β-rakkudest, taastab hormonaalsete ja ainevahetushäirete kompenseerimine insuliini manustamisega nende rakkude funktsiooni, mis seejärel võtavad üle keha insuliiniga minimaalsel tasemel. See periood võib kesta mitu nädalat kuni mitu aastat, kuid lõpuks saab "mesinädalad" allesjäänud β-rakkude autoimmuunse hävimise tõttu läbi.
Dieet DM-1-ga treenitud patsientidel, kellel on enesekontrolli ja insuliiniannuse valiku oskused, saab seda liberaliseerida, s.t. läheneb vabaks. Kui patsient ei ole ülekaaluline või alakaaluline, peaks dieet olema
isokaloriline. DM-1 toidu põhikomponent on süsivesikud, mis peaksid moodustama umbes 65% päevasest kalorist. Eelistada tuleks toiduaineid, mis sisaldavad kompleksseid, aeglaselt imenduvaid süsivesikuid, aga ka kiudainerikkaid toite. Vältida tuleks kergesti seeditavaid süsivesikuid sisaldavaid toite (jahu, magus). Valkude osakaalu tuleks vähendada 10-35%-ni, mis aitab vähendada mikroangiopaatia tekkeriski ja rasvade osakaalu 25-35%-ni, samas kui rasvade piiramine peaks moodustama kuni 7% kaloritest, mis vähendab ateroskleroosi tekke oht. Lisaks on vaja vältida alkohoolsete jookide, eriti kangete jookide joomist.
DM-1-ga patsiendiga töötamise lahutamatu osa ja selle tõhusa hüvitamise võti on patsiendi koolitus. Patsient peab kogu elu jooksul iseseisvalt muutma insuliini annust iga päev, sõltuvalt paljudest teguritest. Ilmselgelt eeldab see teatud oskuste omamist, mida patsiendile tuleb õpetada. "SD-1 patsiendi kool" korraldatakse endokrinoloogiahaiglates või ambulatoorsetes haiglates ja koosneb 5-7 struktureeritud sessioonist, mille käigus arst või eriväljaõppe saanud õde õpetab interaktiivses režiimis, kasutades erinevaid visuaalseid abivahendeid, patsientidele põhimõtteid enesekontroll.
Prognoos
Insuliinravi puudumisel sureb DM-1-ga patsient paratamatult ketoatsidootilise kooma tõttu. Ebapiisava insuliinravi korral, mille korral ei ole täidetud diabeedi kompenseerimise kriteeriumid ja patsient on kroonilises hüperglükeemias (tabel 7.3), hakkavad arenema ja progresseeruma hilised tüsistused (punkt 7.8). DM-1 korral diabeetilise mikroangiopaatia (nefropaatia ja retinopaatia) ja neuropaatia (sündroom) ilmingud diabeetiline jalg). Makroangiopaatia DM-1 puhul tuleb esile suhteliselt harva.
7.6. 2. TÜÜP DIABEET
2. tüüpi diabeet- krooniline haigus, mis väljendub süsivesikute metabolismi rikkumises koos hüperglükeemia tekkega insuliiniresistentsuse ja β-rakkude sekretoorse düsfunktsiooni tõttu;
samuti lipiidide metabolismi ateroskleroosi tekkega. Kuna patsientide surma ja puude peamine põhjus on süsteemse ateroskleroosi tüsistused, nimetatakse CD-2 mõnikord ka südame-veresoonkonna haiguseks.
Tab. 7.8. 2. tüüpi diabeet
 Etioloogia
Etioloogia
CD-2 on päriliku eelsoodumusega multifaktoriaalne haigus. Identsete kaksikute CD-2 vastavus ulatub 80% -ni või rohkem. Enamik CD-2-ga patsiente viitab CD-2 esinemisele lähisugulaste seas; CD-2 olemasolul ühel vanemal on selle arengu tõenäosus järglastel kogu elu jooksul 40%. Ühtegi geeni, mille polümorfism määrab CD-2 eelsoodumuse, pole leitud. CD-2 päriliku eelsoodumuse rakendamisel mängivad suurt tähtsust keskkonnategurid, peamiselt elustiili tunnused. CD-2 arengu riskitegurid on:
Rasvumine, eriti vistseraalne (vt lõik 11.2);
etnilisus (eriti traditsioonilise eluviisi muutmisel läänelikule);
Istuv eluviis;
Dieedi omadused (suur rafineeritud süsivesikute tarbimine ja madal kiudainesisaldus);
Arteriaalne hüpertensioon.
Patogenees
Patogeneetiliselt on CD-2 heterogeenne metaboolsete häirete rühm ja just see määrab selle olulise kliinilise heterogeensuse. Selle patogenees põhineb insuliiniresistentsusel (insuliini vahendatud glükoosi kasutamise vähenemine kudedes), mis realiseerub β-rakkude sekretoorse düsfunktsiooni taustal. Seega on insuliinitundlikkuse ja insuliini sekretsiooni vahel tasakaalustamatus. Sekretsiooni düsfunktsioonβ -rakud See seisneb insuliini "varajase" sekretoorse vabanemise aeglustamises vastusena vere glükoositaseme tõusule. Samal ajal praktiliselt puudub sekretsiooni 1. (kiire) faas, mis seisneb vesiikulite tühjendamises kogunenud insuliiniga; Sekretsiooni 2. (aeglane) faas viiakse läbi vastusena stabiliseerivale hüperglükeemiale pidevalt, toniseerivas režiimis ja hoolimata insuliini liigsest sekretsioonist ei normaliseeru glükeemia tase insuliiniresistentsuse taustal (joonis 7.8).
Hüperinsulinemia tagajärjeks on insuliiniretseptorite tundlikkuse ja arvu vähenemine, samuti supressioon.
retseptorijärgsed mehhanismid, mis vahendavad insuliini toimet (insuliiniresistentsus). Peamise glükoosi transporteri sisaldus lihas- ja rasvarakkudes (GLUT-4) väheneb vistseraalse rasvumisega inimestel 40% ja DM-2-ga inimestel 80%. Hepatotsüütide insuliiniresistentsuse ja portaalhüperinsulineemia tõttu glükoosi hüperproduktsioon maksas, ja tekib tühja kõhuga hüperglükeemia, mis tuvastatakse enamikul DM-2-ga patsientidel, sealhulgas haiguse varases staadiumis.
Hüperglükeemia iseenesest mõjutab negatiivselt β-rakkude sekretoorse aktiivsuse olemust ja taset (glükoosi toksilisus). Pikaajaline, paljude aastate ja aastakümnete jooksul, olemasolev hüperglükeemia viib lõpuks insuliinitootmise vähenemiseni β-rakkude poolt ja patsiendil võivad tekkida mõned sümptomid. insuliinipuudus- kehakaalu langus, ketoos koos kaasnevate nakkushaigustega. Insuliini jääkproduktsioon, mis on piisav ketoatsidoosi vältimiseks, säilib aga DM-2-s peaaegu alati.
Epidemioloogia
CD-2 määrab diabeedi epidemioloogia üldiselt, kuna see moodustab umbes 98% selle haiguse juhtudest. CD-2 levimus on erinevates riikides ja etnilistes rühmades erinev. Euroopa keeles
 Riis. 7.8.β-rakkude sekretoorne düsfunktsioon II tüüpi suhkurtõve korral (insuliini sekretsiooni esimese kiire faasi kaotus)
Riis. 7.8.β-rakkude sekretoorne düsfunktsioon II tüüpi suhkurtõve korral (insuliini sekretsiooni esimese kiire faasi kaotus)
riikides, USA-s ja Vene Föderatsioonis, on see umbes 5-6% elanikkonnast. Vanusega suureneb DM-2 esinemissagedus: täiskasvanute seas on DM-2 levimus 10%, üle 65-aastaste seas ulatub see 20% -ni. CD-2 esinemissagedus on Ameerika ja Hawaii saarte põliselanike seas 2,5 korda kõrgem; Pima hõimu (Arizonas) indiaanlaste seas ulatub see 50% -ni. India, Hiina, Tšiili ja Aafrika riikide traditsioonilise eluviisiga maaelanike seas on CD-2 levimus väga madal (alla 1%). Teisest küljest ulatub see lääne tööstusriikidesse sisserändajate hulgas märkimisväärsele tasemele. Nii et Indiast ja Hiinast pärit immigrantide seas, kes elavad USA-s ja Suurbritannias, ulatub CD-2 levimus 12-15% -ni.
WHO prognoosib, et järgmise 20 aasta jooksul suureneb diabeetikute arv maailmas 122% (135 miljonilt 300 miljonile). Selle põhjuseks on nii rahvastiku progresseeruv vananemine kui ka linnastunud elustiili levik ja süvenemine. Viimastel aastatel on toimunud märkimisväärne CD-2 "noorendamine" ja selle esinemissageduse tõus laste seas.
Kliinilised ilmingud
Enamikel juhtudel, puuduvad väljendunud kliinilised ilmingud, ja diagnoos tehakse rutiinse glükeemilise testiga. Haigus avaldub tavaliselt üle 40 aasta vanuselt, samas kui valdaval enamusel patsientidest on ülekaalulisus ja muud metaboolse sündroomi komponendid (vt lõik 11.2). Patsiendid ei kaeba töövõime languse üle, kui selleks pole muid põhjusi. Janu ja polüuuria kaebused saavutavad harva märkimisväärse raskusastme. Üsna sageli tunnevad patsiendid muret naha ja tupe sügeluse pärast ning seetõttu pöörduvad nad dermatoloogide ja günekoloogide poole. Kuna CD-2 tegelikust avaldumisest diagnoosimiseni möödub sageli aastaid (keskmiselt umbes 7 aastat), domineerib paljudel patsientidel haiguse avastamise ajal kliinilises pildis diabeedi hiliste tüsistuste sümptomid ja ilmingud. Pealegi toimub CD-2-ga patsiendi esimene visiit arstiabi saamiseks väga sageli hiliste tüsistuste tõttu. Seega saab jalahaavanditega patsiente hospitaliseerida kirurgilistesse haiglatesse. (diabeetilise jala sündroom) pöörduge silmaarsti poole seoses nägemise järkjärgulise halvenemisega (diabeetiline retinopaatia), haiglasse sattuda südameatakkide, insultidega
jalgade veresoonte hävitava kahjustusega asutustes, kus neil avastatakse esmakordselt hüperglükeemia.
Diagnostika
Kõigi diabeeditüüpide jaoks ühised diagnostilised kriteeriumid on esitatud punktis 7.3. DM-2 diagnoos põhineb enamikul juhtudest hüperglükeemia tuvastamisel inimestel, kellel on tüüpiline kliinilised tunnused CD-2 (rasvumine, vanus üle 40-45 aasta, positiivne CD-2 anamnees, muud metaboolse sündroomi komponendid), absoluutse insuliinipuuduse kliiniliste ja laboratoorsete tunnuste puudumisel (väljendav kaalulangus, ketoos). Kombinatsioon DM-2 kõrgest levimusest, selle loomupärasest pikast asümptomaatilisest kulgemisest ja võimalusest vältida selle raskeid tüsistusi, tingimusel et varajane diagnoosimine määrab vajaduse sõelumine, need. küsitluse läbiviimine CD-2 välistamiseks inimeste seas, kellel puuduvad haiguse sümptomid. Peamine test, nagu mainitud, on otsustavus tühja kõhu glükeemiline tase. Seda näidatakse järgmistes olukordades:
1. Kõigil üle 45-aastastel inimestel, eriti ülekaalulistel inimestel (KMI üle 25 kg / m 2), intervalliga üks kord 3 aasta jooksul.
2. Nooremas eas liigse kehakaalu (KMI üle 25 kg / m 2) ja täiendavate riskitegurite, sealhulgas:
Istuv eluviis;
CD-2 lähisugulastel;
Rahvus kõrge riskiga SD-2 arendamine (afroameeriklased, hispaanlased, põlisameeriklased jne);
Naised, kes on sünnitanud lapse kaaluga üle 4 kg ja/või kellel on anamneesis rasedusdiabeet;
Arteriaalne hüpertensioon (≥ 140/90 mm Hg);
HDL > 0,9 mmol/l ja/või triglütseriidid > 2,8 mmol/l;
polütsüstiliste munasarjade sündroom;
NTG ja NGNT;
Südame-veresoonkonna haigused.
DM-2 esinemissageduse märkimisväärne suurenemine laste seas tingib vajaduse glükeemia taseme määramiseks skriininguga. laste ja teismeliste seas(alates 10-aastaselt 2-aastase intervalliga või algusega
puberteet, kui see esines rohkem kui varajane iga) kuuluvad rühmadesse suurenenud risk mille hulka kuuluvad lapsed ülekaaluline(KMI ja/või kaal > 85 protsentiil vanuse järgi või kaal üle 120% ideaalkaalust) ja mis tahes kaks järgmist täiendavat riskitegurit:
CD-2 esimese või teise sugulusliini sugulaste seas;
Kuulumine kõrge riskiga rahvusesse;
Insuliiniresistentsusega seotud kliinilised ilmingud (acanthosis nigricans, arteriaalne hüpertensioon, düslipideemia);
Diabeet, sealhulgas rasedusaegne, emal.
Diferentsiaaldiagnoos
Suurim kliiniline tähtsus on CD-2 ja CD-1 diferentsiaaldiagnostikal, mille põhimõtteid on kirjeldatud punktis 7.5 (tabel 7.6). Nagu mainitud, põhineb see enamikul juhtudel andmetel kliiniline pilt. Juhtudel, kui diabeedi tüüpi on raske kindlaks teha või kahtlustatakse mõnda harvaesinevat diabeedivarianti, sh pärilike sündroomide korral, on kõige olulisem praktiline vastus, kas patsient vajab insuliinravi.
Ravi
DM-2 ravi põhikomponendid on: dieetteraapia, kehalise aktiivsuse suurendamine, hüpoglükeemiline ravi, DM-i hiliste tüsistuste ennetamine ja ravi. Kuna enamik DM-2-ga patsiente on rasvunud, peaks dieet olema suunatud kehakaalu langetamisele (hüpokaloorne) ja hiliste tüsistuste, eelkõige makroangiopaatia (ateroskleroosi) ennetamisele. hüpokaloriline dieet vajalik kõigile liigse kehakaaluga (KMI 25-29 kg/m2) või rasvunud (KMI> 30 kg/m2) patsientidele. Enamasti tuleks soovitada vähendada päevast toidu kaloraaži naistel 1000-1200 kcal-ni ja meestel 1200-1600 kcal-ni. Toidu põhikomponentide soovitatav suhe DM-2-s on sarnane DM-1 omaga (süsivesikud - 65%, valgud 10-35%, rasvad kuni 25-35%). Kasuta alkohol tuleks piirata, kuna see on oluline lisakalorite allikas, lisaks alkoholi tarbimine ravi taustal
PII koos sulfonüüluurea ravimite ja insuliiniga võib esile kutsuda hüpoglükeemia tekke (vt lõik 7.7.3).
Soovitused jaoks suurenenud füüsiline aktiivsus peab olema individualiseeritud. Alguses on soovitatav mõõduka intensiivsusega aeroobne treening (kõndimine, ujumine) 30-45 minutit 3-5 korda päevas (umbes 150 minutit nädalas). Tulevikus järkjärguline tõus kehaline aktiivsus, mis aitab oluliselt kaasa kehakaalu vähenemisele ja normaliseerumisele. Lisaks aitab füüsiline aktiivsus vähendada insuliiniresistentsust ja omab hüpoglükeemilist toimet. Dieetteraapia ja suurenenud kehalise aktiivsuse kombinatsioon ilma hüpoglükeemilisi ravimeid välja kirjutamata võimaldab säilitada DM-i kompensatsiooni vastavalt seatud eesmärkidele (tabel 7.3) ligikaudu 5% DM-2-ga patsientidest.
Ettevalmistused selleks hüpoglükeemiline ravi CD-2-ga võib jagada nelja põhirühma.
I. Ravimid, mis aitavad vähendada insuliiniresistentsust (sensibilisaatorid). Sellesse rühma kuuluvad metformiin ja tiasolidiindioonid. Metformiin on ainus praegu kasutatav ravim selles rühmas biguaniidid. Selle toimemehhanismi peamised komponendid on järgmised:
1. Maksa glükoneogeneesi pärssimine (maksa glükoosi tootmise vähenemine), mis viib tühja kõhu glükeemia vähenemiseni.
2. Insuliiniresistentsuse vähenemine (perifeersete kudede, peamiselt lihaste suurenenud glükoosi kasutamine).
3. Anaeroobse glükolüüsi aktiveerimine ja glükoosi imendumise vähendamine peensooles.
Metformiin on hüpoglükeemilise ravi esmavaliku ravim II tüüpi diabeedi, rasvumise ja tühja kõhuga hüperglükeemiaga patsientidel. Algannus on 500 mg öösel või õhtusöögi ajal. Edaspidi suureneb annus järk-järgult 2-3 grammi 2-3 annuseks. Kõrvaltoimetest on suhteliselt sagedased düspeptilised sümptomid (kõhulahtisus), mis on tavaliselt mööduvad ja kaovad iseenesest 1-2 nädala pärast ravimi võtmist. Kuna metformiinil ei ole insuliini tootmist stimuleerivat toimet, ei esine selle ravimi monoteraapia ajal hüpoglükeemiat.
areneda (selle toimet nimetatakse antihüperglükeemiliseks, mitte hüpoglükeemiliseks). Metformiini määramise vastunäidustused on rasedus, raske südame-, maksa-, neeru- ja muude elundite puudulikkus, samuti muu päritoluga hüpoksilised seisundid. Üliharvaesinev tüsistus, mis tekib metformiini väljakirjutamisel ilma ülaltoodud vastunäidustusi arvesse võtmata, on laktatsidoos, mis on anaeroobse glükolüüsi hüperaktivatsiooni tagajärg.
Tiasolidiindioonid(pioglitasoon, rosiglitasoon) on peroksisoomi proliferaatoriga aktiveeritud retseptori agonistid (PPAR-γ). Tiasolidiindioonid aktiveerivad glükoosi ja lipiidide metabolismi lihas- ja rasvkoes, mis toob kaasa endogeense insuliini aktiivsuse tõusu, s.o. Insuliiniresistentsuse kõrvaldamiseks (insuliini sensibilisaatorid). Pioglitasooni päevane annus on 15-30 mg / päevas, rosiglitasooni - 4-8 mg (1-2 annuse jaoks). Tiasolidiindioonide kombinatsioon metformiiniga on väga tõhus. Tiasolidiindioonide määramise vastunäidustuseks on maksa transaminaaside taseme tõus (2,5 korda või rohkem). Lisaks hepatotoksilisusele on tiasolidiindioonide kõrvaltoimeteks vedelikupeetus ja tursed, mis on sagedasemad, kui neid kombineerida insuliiniga.
II. Ravimid, mis toimivadβ rakke ja suurendab insuliini sekretsiooni. Sellesse rühma kuuluvad sulfonüüluurea ravimid ja gliniidid (prandiaalsed glükeemilised regulaatorid), mida kasutatakse peamiselt glükeemilise taseme normaliseerimiseks pärast sööki. peamine sihtmärk sulfonüüluurea ravimid(PSM) on pankrease saarekeste β-rakud. PSM-id seonduvad β-rakumembraani spetsiifiliste retseptoritega. See viib ATP-st sõltuvate kaaliumikanalite sulgumiseni ja rakumembraani depolariseerumiseni, mis omakorda soodustab kaltsiumikanalite avanemist. Kaltsiumi sisenemine β-rakkudesse põhjustab nende degranulatsiooni ja insuliini vabanemist verre. Kliinilises praktikas kasutatakse palju PSM-i, mis erinevad hüpoglükeemilise toime kestuse ja raskusastme poolest (tabel 7.9).
Tab. 7.9. Sulfonüüluuread
 Peamine ja üsna levinud kõrvalmõju PSM on hüpoglükeemia (vt lõik 7.7.3). See võib tekkida ravimi üleannustamise, selle kumulatsiooni (neerupuudulikkuse) korral,
Peamine ja üsna levinud kõrvalmõju PSM on hüpoglükeemia (vt lõik 7.7.3). See võib tekkida ravimi üleannustamise, selle kumulatsiooni (neerupuudulikkuse) korral,
dieedi (söögikordade vahelejätmine, alkoholi joomine) või režiimi (oluline füüsiline aktiivsus, enne mida ei vähendata PSM-i annust ega tarbita süsivesikuid) mittejärgimine.
Grupi juurde gliniidid(prandiaalsed glükeemilised regulaatorid) on repagliniid(bensoehappe derivaat; päevane annus 0,5-16 mg/päevas) ja nategliniid(D-fenüülalaniini derivaat; päevane annus 180-540 mg/päevas). Pärast manustamist interakteeruvad ravimid kiiresti ja pöörduvalt β-rakkude sulfonüüluurea retseptoriga, mille tulemuseks on insuliini taseme lühiajaline tõus, mis jäljendab normaalselt selle sekretsiooni esimest faasi. Ravimeid võetakse 10-20 minutit enne põhitoidukordi, tavaliselt 3 korda päevas.
III. Ravimid, mis vähendavad glükoosi imendumist soolestikus.
Sellesse rühma kuuluvad akarboos ja guarkummi. Akarboosi toimemehhanism on α-glükosidaaside pöörduv blokaad peensoolde, mille tulemusena aeglustuvad süsivesikute järjestikuse fermentatsiooni ja imendumise protsessid, väheneb glükoosi resorptsiooni ja maksa sisenemise kiirus ning söögijärgse glükeemia tase. Akarboosi algannus on 50 mg 3 korda päevas, edaspidi võib annust suurendada 100 mg-ni 3 korda päevas; ravimit võetakse vahetult enne sööki või söögi ajal. Akarboosi peamine kõrvalmõju on soole düspepsia (kõhulahtisus, kõhupuhitus), mis on seotud imendumata süsivesikute sattumisega jämesoolde. Akarboosi hüpoglükeemiline toime on väga mõõdukas (tabel 7.10).
Kliinilises praktikas kombineeritakse hüpoglükeemilisi tablette tõhusalt üksteisega ja insuliinipreparaatidega, kuna enamikul patsientidest on samaaegselt nii tühja kõhuga kui ka söögijärgne hüperglükeemia. Neid on arvukalt fikseeritud kombinatsioonid ravimid ühes tabletis. Kõige sagedamini kombineeritakse metformiini ühes tabletis erinevate PSM-idega, samuti metformiini tiasolidiindioonidega.
Tab. 7.10. Tablettide kujul kasutatavate diabeedivastaste ravimite toimemehhanism ja potentsiaalne efektiivsus
 IV. Insuliinid ja insuliini analoogid
IV. Insuliinid ja insuliini analoogid
Teatud etapis hakkab insuliinipreparaate saama kuni 30–40% II tüüpi diabeediga patsientidest. DM-2 insuliinravi näidustused on toodud lõigu 7.4 alguses. Kõige tavalisem variant II tüüpi diabeediga patsientidele insuliinravile üleminekuks on pika toimeajaga insuliini (NPH-insuliin, glargiin või detemiir) väljakirjutamine koos manustatavate hüpoglükeemiliste tablettidega. Olukorras, kus tühja kõhu glükeemia taset ei ole võimalik metformiini määramisega kontrollida või viimane on vastunäidustatud, määratakse patsiendile õhtune (öine) insuliinisüst. Kui tabletipreparaatide abil ei ole võimalik nii tühja kõhuga kui ka söögijärgset glükeemiat kontrollida, viiakse patsient üle monoinsuliinravile. Tavaliselt toimub DM-2-ga insuliinravi nn "traditsiooniline" skeem mis hõlmab pika- ja lühitoimelise insuliini fikseeritud annuste määramist. Selles plaanis
mugavad standardsed insuliinisegud, mis sisaldavad ühes viaalis lühitoimelist (ülilühikest) ja pikatoimelist insuliini. Traditsioonilise insuliinravi valiku määrab asjaolu, et DM-2-ga määratakse see sageli eakatele patsientidele, kelle treenimine insuliini annust iseseisvalt muutma on keeruline. Lisaks suurendab hüpoglükeemia riski intensiivne insuliinravi, mille eesmärk on säilitada süsivesikute ainevahetuse kompenseerimine tasemel, mis läheneb normoglükeemilisele tasemele. Kui kerge hüpoglükeemia ei kujuta endast tõsist ohtu noortel patsientidel, siis vanematel patsientidel, kellel on vähenenud hüpoglükeemia lävi, võib see avaldada südame-veresoonkonna süsteemile väga kahjulikku mõju. Noortele II tüüpi diabeediga patsientidele, aga ka tõhusa õppimise võimaluse osas paljutõotavatele patsientidele võib määrata insuliinravi intensiivse versiooni.
Prognoos
DM-2-ga patsientide puude ja surma peamine põhjus on hilised tüsistused (vt lõik 7.8), kõige sagedamini diabeetiline makroangiopaatia. Individuaalsete hiliste tüsistuste tekkimise riski määrab tegurite kompleks, mida käsitletakse vastavates peatükkides. Nende arengu universaalne riskitegur on krooniline hüperglükeemia. Seega põhjustab 2. tüüpi diabeediga patsientide HbA1c taseme 1% langus üldise suremuse vähenemist vastavalt umbes 20%, 2% ja 3% - umbes 40%.
7.7. DIABEEDI Ägedad komplikatsioonid
7.7.1. diabeetiline ketoatsidoos
Diabeetiline ketoatsidoos (DKA)- DM-1 dekompensatsioon, mis on põhjustatud insuliini absoluutsest puudusest õigeaegse ravi puudumisel, mis lõpeb ketoatsidootilise koomaga (CK) ja surmaga.
Etioloogia
DKA põhjus on absoluutne insuliinipuudus. See või teine DKA raskusaste määratakse enamikul patsientidest DM-1 avaldumise ajal (10–20% kõigist DKA juhtudest).
I tüüpi diabeedi diagnoosiga patsiendil võib DKA tekkida siis, kui insuliini manustamine lõpetatakse, sageli patsiendi enda poolt (13% DKA juhtudest), kaasuvate haiguste, peamiselt nakkushaiguste taustal, ilma ravita. insuliini annuse suurendamine
Tab. 7.11. diabeetiline ketoatsidoos
 Kuni 20% DKA juhtudest noortel I tüüpi diabeediga patsientidel on seotud psühholoogiliste probleemide ja/või söömishäiretega (hirm kaalutõusu ees, hirm hüpoglükeemia ees, noorukite probleemid). Paljudes riikides on DKA üsna levinud põhjus
Kuni 20% DKA juhtudest noortel I tüüpi diabeediga patsientidel on seotud psühholoogiliste probleemide ja/või söömishäiretega (hirm kaalutõusu ees, hirm hüpoglükeemia ees, noorukite probleemid). Paljudes riikides on DKA üsna levinud põhjus
insuliini ärajätmine patsiendi enda poolt ravimite kõrge hinna tõttu mõne elanikkonnarühma jaoks (tabel 7.11).
Patogenees
DKA patogenees põhineb absoluutsel insuliinipuudusel koos kontrainsulaarsete hormoonide, näiteks glükagooni, katehhoolamiinide ja kortisooli tootmise suurenemisega. Selle tulemusena suureneb märkimisväärselt maksa glükoosi tootmine ja perifeersete kudede selle kasutamise rikkumine, hüperglükeemia suurenemine ja rakuvälise ruumi osmolaarsuse rikkumine. Insuliinipuudus kombinatsioonis kontrainsulaarsete hormoonide suhtelise liiaga DKA-s põhjustab vabade rasvhapete vabanemist vereringesse (lipolüüs) ja nende ohjeldamatut oksüdeerumist maksas ketoonkehadeks (β-hüdroksübutüraat, atsetoatsetaat, atsetoon), mille tulemuseks on hüperketoneemia. ja edasine metaboolne atsidoos. Raske glükosuuria tagajärjel areneb osmootne diurees, dehüdratsioon, naatriumi, kaaliumi ja teiste elektrolüütide kadu (joon. 7.9).
Epidemioloogia
Uute DKA juhtude sagedus on 5–8 1000 DM-1-ga patsiendi kohta aastas ja see sõltub otseselt DM-ga patsientide arstiabi korralduse tasemest. USA-s toimub igal aastal ligikaudu 100 000 DKA tõttu haiglaravi ning kuna ühe patsiendi ühe haiglaravi maksumus on 13 000 dollarit, kulutatakse statsionaarsele DKA-ravile aastas üle 1 miljardi dollari. Vene Föderatsioonis registreeriti 2005. aastal DKA 4,31% lastest, 4,75% noorukitest ja 0,33% täiskasvanud DM-1-ga patsientidest.
Kliinilised ilmingud
DKA areng võib olenevalt selle põhjustanud põhjusest kesta mitu nädalat kuni päevani. Enamikul juhtudel eelnevad DKA-le dekompenseeritud diabeedi sümptomid, kuid mõnikord ei pruugi neil olla aega areneda. DKA kliinilisteks sümptomiteks on polüuuria, polüdipsia, kaalulangus, üldine kõhuvalu ("diabeetiline pseudoperitoniit"), dehüdratsioon, tugev nõrkus, atsetoonilõhn (või puuviljalõhn) ja teadvuse järkjärguline hägustumine. Tõeline kooma DKA-s on varajase diagnoosimise tõttu viimasel ajal suhteliselt harva arenenud. Füüsilisel läbivaatusel ilmnevad dehüdratsiooni tunnused: vähenenud
 Riis. 7.9. Ketoatsidootilise kooma patogenees
Riis. 7.9. Ketoatsidootilise kooma patogenees
naha turgor ja silmamuna tihedus, tahhükardia, hüpotensioon. Kaugelearenenud juhtudel areneb Kussmauli hingamine. Rohkem kui 25%-l DKA-ga patsientidest tekib oksendamine, mis võib oma värvilt meenutada kohvipaksu.
Diagnostika
Kliinilise pildi andmete, DM-1 esinemise näidustuste ja andmete põhjal patsiendil laboriuuringud. DKA-le on iseloomulik hüperglükeemia (mõnel juhul ebaoluline), ketonuuria, metaboolne atsidoos, hüperosmolaarsus (tabel 7.12).
Tab. 7.12. Diabeedi ägedate tüsistuste laboridiagnoos
 Diabeedi ägeda dekompensatsiooniga patsientide uurimisel on vaja määrata glükeemia, kreatiniini ja uurea, elektrolüütide tase, mille põhjal arvutatakse efektiivne osmolaarsus. Lisaks on vajalik happe-aluse oleku hindamine. Efektiivne osmolaarsus(EO) arvutatakse järgmise valemi abil: 2 *. Tavaline EO on 285–295 mOsm / l.
Diabeedi ägeda dekompensatsiooniga patsientide uurimisel on vaja määrata glükeemia, kreatiniini ja uurea, elektrolüütide tase, mille põhjal arvutatakse efektiivne osmolaarsus. Lisaks on vajalik happe-aluse oleku hindamine. Efektiivne osmolaarsus(EO) arvutatakse järgmise valemi abil: 2 *. Tavaline EO on 285–295 mOsm / l.
Enamikul DKA-ga patsientidel on leukotsütoos, mille raskusaste on võrdeline ketoonkehade tasemega veres. Tase naatrium, reeglina väheneb see vedeliku osmootse väljavoolu tõttu intratsellulaarsetest ruumidest rakuvälisesse vastusena hüperglükeemiale. Harva võib naatriumisisaldus olla valepositiivne raske hüpertüreoidismi tagajärjel.
triglütserideemia. Tase kaalium Seerum võib algselt olla kõrgendatud, kuna see liigub rakuvälistest ruumidest.
Diferentsiaaldiagnoos
Muud diabeediga patsientide teadvusekaotuse põhjused. Hüperosmolaarse koomaga diferentsiaaldiagnostika ei tekita reeglina raskusi (see areneb eakatel II tüüpi diabeediga patsientidel) ega oma suurt kliinilist tähtsust, sest Mõlema haigusseisundi ravi põhimõtted on sarnased. Kui diabeediga patsiendi teadvuse kaotuse põhjust ei ole võimalik kiiresti välja selgitada, näidatakse talle glükoosi sisseviimist, kuna. hüpoglükeemilised seisundid on palju tavalisemad ja kiire positiivne dünaamika glükoosi manustamise taustal võimaldab iseenesest välja selgitada teadvuse kaotuse põhjuse.
Ravi
DKA ravi hõlmab rehüdratatsiooni, hüperglükeemia korrigeerimist, elektrolüütide häireid ja diabeedi dekompensatsiooni põhjustanud haiguste ravi. Ravi viiakse kõige optimaalsemalt läbi eriarsti intensiivravi osakonnas raviasutus. Raske kaasuva südamepatoloogiata täiskasvanud patsientidel juba haiglaeelses staadiumis esmase meetmena rehüdratsioon isotoonilist lahust (0,9% NaCl) soovitatakse manustada ligikaudu liiter tunnis (umbes 15-20 ml kehakaalu kilogrammi kohta tunnis). Vedelikupuuduse täielik asendamine, mis DKA puhul on 100-200 ml 1 kg kehakaalu kohta, tuleb saavutada esimesel ravipäeval. Samaaegse südame- või neerupuudulikkuse korral tuleks seda perioodi pikendada. Lastele on rehüdratsioonravi isotoonilise lahuse soovitatav kogus 10-20 ml 1 kg kehakaalu kohta tunnis, kusjuures esimese 4 tunni jooksul ei tohiks see ületada 50 ml 1 kg kehakaalu kohta. Täielik rehüdratsioon on soovitatav saavutada umbes 48 tunni jooksul. Pärast seda, kui glükeemia tase langeb paralleelse insuliinravi taustal ligikaudu 14 mmol / l-ni, lülituvad nad üle 10% glükoosilahuse transfusioonile, mis jätkab rehüdratsiooni.
Nüüd on vastu võetud mõiste "väikesed annused". insuliini DKA ravis. Kasutatakse ainult lühitoimelist insuliini. Intravenoosse insuliini kõige optimaalsem kasutamine
rida. Intramuskulaarne manustamine Insuliin, mis on vähem efektiivne, on võimalik ainult DKA mõõduka raskusastme, stabiilse hemodünaamika ja intravenoosse ravi võimatuse korral. Viimasel juhul tehakse süstid kõhu sirglihasesse, samal ajal kui insuliinisüstlale asetatakse nõel. intramuskulaarsed süstid(usaldusväärseks intramuskulaarseks süstimiseks) ja selle nõela kaudu tõmmatakse viaalist süstlasse insuliin.
Insuliini intravenoosseks manustamiseks on mitu võimalust. Esiteks saab insuliini süstida infusioonisüsteemi "igemesse", samal ajal kui vajalik kogus insuliini tõmmatakse insuliinisüstlasse, mille järel tõmmatakse sellesse 1 ml isotoonilist lahust. Kuni glükeemia tase jõuab 14 mmol / l-ni, süstitakse patsiendile iga tunni järel 6-10 ühikut lühitoimelist insuliini; edasi (paralleelselt rehüdratatsioonilahuse muutmisega isotooniliselt 10% glükoosile) sõltuvalt tunnis määratud glükeemia näitajatest vähendatakse insuliini annust 4-8 ühikuni tunnis. Soovitatav glükeemilise taseme languse kiirus ei tohi ületada 5 mmol/l tunnis. Veel üks intravenoosse insuliinravi võimalus hõlmab perfuusori kasutamist. Perfuusori lahuse valmistamiseks võetakse järgmine suhe: 50 ühikule lühitoimelisele insuliinile lisatakse 2 ml 20% inimese albumiini lahust, misjärel lisatakse 50 mg 0,9% isotoonilist lahust. Kui valitakse insuliini intramuskulaarne manustamisviis, manustatakse esialgu 20 ühikut lühitoimelist insuliini, seejärel 6 ühikut iga tund ja pärast glükeemia taseme 14 mmol/l saavutamist vähendatakse annust 4 ühikuni tunnis. Pärast hemodünaamika täielikku stabiliseerumist ja happe-aluse häirete kompenseerimist viiakse patsient üle subkutaansetele insuliinisüstidele.
Nagu märgitud, hoolimata märkimisväärsest kaaliumipuudus kehas ( täielik kaotus 3-6 mmol / kg), DKA korral võib selle tase enne insuliinravi algust veidi tõusta. Siiski on soovitatav alustada kaaliumkloriidi lahuse transfusiooni samaaegselt insuliinravi alustamisega, kui plasma kaaliumisisaldus on alla 5,5 mmol/L. Kaaliumipuuduse edukas korrigeerimine toimub ainult pH normaliseerumise taustal. Madala pH korral väheneb oluliselt kaaliumi sissevõtt rakku, sellega seoses on võimalusel soovitav ülekantud kaaliumkloriidi doos kohandada konkreetse pH indikaatoriga (tabel 7.13).
Tab. 7.13. Kaaliumipuuduse korrigeerimise skeem
 * Arvutamiseks kasutatakse järgmisi andmeid:
* Arvutamiseks kasutatakse järgmisi andmeid:
1 g KCl = 13,4 mmol; 1 mmol KCl = 0,075 g KC1 4% lahuses: 100 ml-s - 4 g KC1, 25 ml-s - 1 g KC1, 10 ml-s 0,4 g KC1.
Diabeedi dekompensatsiooni põhjuseks on sageli nakkushaigused(püelonefriit, nakatunud haavand diabeetilise jala sündroomi korral, kopsupõletik, sinusiit jne). Kehtib reegel, mille kohaselt DKA-s on antibiootikumravi ette nähtud peaaegu kõigile madala palavikuga või palavikuga patsientidele, isegi kui infektsioonikolde pole nähtav, kuna kehatemperatuuri tõus ei ole DKA-le endale tüüpiline. .
Prognoos
Suremus DKA-sse on 0,5–5%, kusjuures enamik juhtudest on tingitud hilisest ja oskusteta arstiabist. Suremus on kõrgeim (kuni 50%) eakate patsientide seas.
7.7.2. Hüperosmolaarne kooma
Hüperosmolaarne kooma(GOK) - haruldane äge tüsistus SD-2-ga, mis areneb tõsise dehüdratsiooni ja hüperglükeemia tagajärjel absoluutse insuliinipuuduse puudumise taustal, kaasneb kõrge suremus (tabel 7.14).
Etioloogia
GOK areneb reeglina II tüüpi diabeediga eakatel patsientidel. Sellised patsiendid on enamasti üksildased, elavad ilma hoolitsuseta, eiravad oma seisundit ja enesekontrolli ning ei võta piisavalt vedelikku. Infektsioonid põhjustavad sageli dekompensatsiooni (diabeetilise jala sündroom, kopsupõletik, äge püelonefriit), ajuhäireid.
vereringe- ja muud seisundid, mille tõttu patsiendid liiguvad halvasti, ei võta hüpoglükeemilisi ravimeid ja vedelikke.
Tab. 7.14. Hüperosmolaarne kooma (GOC)
 Patogenees
Patogenees
Suurenev hüperglükeemia ja osmootne diurees põhjustavad tõsist dehüdratsiooni, mida ülaltoodud põhjustel väljastpoolt ei täiendata. Hüperglükeemia ja dehüdratsiooni tagajärjeks on plasma hüperosmolaarsus. GOC patogeneesi lahutamatuks komponendiks on suhteline insuliini defitsiit ja kontra-insuliini hormoonide liig, kuid DM-2-sse jääv insuliini jääksekretsioon on piisav lipolüüsi ja ketogeneesi pärssimiseks, mille tulemusena areneb areng. ketoatsidoosi ei esine.
Mõnel juhul võib kudede hüpoperfusiooni taustal määrata hüperlaktateemia tagajärjel mõõduka atsidoosi. Raske hüperglükeemia korral suureneb tserebrospinaalvedeliku osmootse tasakaalu säilitamiseks rakkudest tuleva naatriumi sisaldus. aju kus vahetatakse kaaliumi. Närvirakkude transmembraanne potentsiaal on häiritud. Teadvuse progresseeruv hägustumine areneb koos konvulsiivse sündroomiga (joonis 7.10).
Epidemioloogia
GOC moodustab 10–30% ägedatest hüperglükeemilistest seisunditest II tüüpi diabeediga täiskasvanud ja eakatel patsientidel. Ligikaudu 2/3 GOK juhtudest areneb inimestel, kellel on varem diagnoosimata diabeet.
Kliinilised ilmingud
Hüperosmolaarse kooma kliinilise pildi tunnused on järgmised:
Dehüdratsiooni ja hüpoperfusiooni nähtude ja tüsistuste kompleks: janu, limaskestade kuivus, tahhükardia, arteriaalne hüpotensioon, iiveldus, nõrkus, šokk;
fokaalsed ja generaliseerunud krambid;
Palavik, iiveldus ja oksendamine (40-65% juhtudest);
Sagedased kaasuvad haigused ja tüsistused on süvaveenide tromboos, kopsupõletik, aju vereringe, gastroparees.
Diagnostika
See põhineb kliinilise pildi, patsiendi vanuse ja CD-2 anamneesi andmetel, raske hüperglükeemia ketonuuria puudumisel ja ketoatsidoos. GOK tüüpilised laboratoorsed tunnused on esitatud tabelis. 7.12.
 Riis. 7 .10.
Hüperosmolaarse kooma patogenees
Riis. 7 .10.
Hüperosmolaarse kooma patogenees
Diferentsiaaldiagnoos
Muud ägedad seisundid, mis tekivad DM-ga patsientidel, kõige sagedamini kaasuva patoloogiaga, mis viisid DM-i raske dekompensatsioonini.
Ravi
GOC ravi ja jälgimine, välja arvatud mõned tunnused, ei erine ketoatsidootilise diabeetilise kooma puhul kirjeldatust (jaotis 7.7.1):
Suurem esialgse rehüdratsiooni maht 1,5-2 liitrit 1 tunni kohta; 1 l - 2. ja 3. tunniks, seejärel 500 ml / h isotoonilist naatriumkloriidi lahust;
Kaaliumi sisaldavate lahuste sisseviimise vajadus on reeglina suurem kui ketoatsidootilise kooma korral;
Insuliinravi on sarnane QC-ga, kuid insuliinivajadus on väiksem ja glükeemia taset tuleb vähendada mitte kiiremini kui 5 mmol / l tunnis, et vältida ajuturse teket;
Hüpotoonilise lahuse (NaCl 0,45%) sisseviimist on kõige parem vältida (ainult raske hüpernatreemia korral: > 155 mmol/l ja/või efektiivne osmolaarsus > 320 mOsm/l);
Bikarbonaati ei ole vaja manustada (ainult pH-ga atsidoosi eriintensiivravi osakonnas< 7,1).
Prognoos
Korea valitsuse suremus on kõrge ja ulatub 15–60% -ni. Halvim prognoos on eakatel patsientidel, kellel on raske kaasuv haigus, mis on sageli DM dekompensatsiooni ja GOC tekke põhjuseks.
7.7.3. hüpoglükeemia
hüpoglükeemia- Vere glükoosisisalduse langus<2,2- 2,8 ммоль/л), сопровождающее клинический синдром, характеризующийся признаками активации симпатической нервной системы и/или дисфункцией центральной нервной системы. Гипогликемия как лабораторный феномен не тождественен понятию «гипогликемическая симптоматика», поскольку лабораторные данные и клиническая картина не всегда совпадают.
Etioloogia
Insuliinipreparaatide ja selle analoogide, samuti sulfonüüluurea preparaatide üleannustamine;
ebapiisav toidutarbimine muutumatu hüpoglükeemilise ravi taustal;
Alkohoolsete jookide vastuvõtt;
Füüsiline aktiivsus muutumatu hüpoglükeemilise ravi taustal ja / või ilma täiendava süsivesikute tarbimiseta;
Diabeedi hiliste tüsistuste (autonoomne neuropaatia koos gastropareesiga, neerupuudulikkus) ja paljude teiste haiguste (neerupealiste puudulikkus, hüpotüreoidism, maksapuudulikkus, pahaloomulised kasvajad) tekkimine muutumatul hüpoglükeemilisel ravil (TSP jätkamine ja kuhjumine neerupuudulikkuse taustal , säilitades insuliini sama annuse);
Insuliini manustamise tehnika rikkumine (subkutaanse asemel intramuskulaarne süstimine);
Kunstlik hüpoglükeemia (patsiendi teadlik hüpoglükeemiliste ravimite üleannustamine);
Orgaaniline hüperinsulinism – insulinoom (vt lõik 10.3).
Patogenees
Hüpoglükeemia patogenees seisneb tasakaalustamatuses glükoosi verre sisenemise, selle kasutamise, insuliini taseme ja kontrainsulaarsete hormoonide vahel. Tavaliselt on glükeemia tasemel vahemikus 4,2-4,7 mmol/l insuliini tootmine ja vabanemine β-rakkudest pärsitud. Glükeemia taseme langusega alla 3,9 mmol / l kaasneb kontrainsulaarsete hormoonide (glükagoon, kortisool, kasvuhormoon, adrenaliin) tootmise stimuleerimine. Neuroglükopeenilised sümptomid arenevad glükeemia taseme langusega alla 2,5-2,8 mmol / l. Üleannustamine insuliini ja/või ravimid sulfonüüluurea hüpoglükeemia areneb eksogeense või endogeense hormooni otsese hüpoglükeemilise toime tõttu. Sulfonüüluurea ravimite üleannustamise korral võivad hüpoglükeemilised sümptomid pärast rünnaku leevendamist korduda mitu korda, kuna mitmete ravimite toimeaeg võib ulatuda päevani või kauemaks. TSP-d, millel ei ole insuliini tootmist stimuleerivat toimet (metformiin, tiasolidiindioonid), ei saa iseenesest põhjustada hüpoglükeemiat, kuid nende lisamisel sulfonüüluureatele või insuliinile võib viimaste sama annuse võtmine põhjustada hüpoglükeemiat hüpoglükeemilise toime kumuleerumise tõttu. kombineeritud ravi (tabel .7.15).
Tab. 7.15. hüpoglükeemia
 Tabeli lõpp. 7.15
Tabeli lõpp. 7.15
 Kui saate alkohol maksas on glükoneogeneesi pärssimine, mis on kõige olulisem hüpoglükeemiat takistav tegur. Füüsiline treening aitavad kaasa insuliinist sõltumatule glükoosi kasutamisele, mille tõttu võivad nad muutumatu hüpoglükeemilise ravi taustal ja / või täiendava süsivesikute tarbimise puudumisel põhjustada hüpoglükeemiat.
Kui saate alkohol maksas on glükoneogeneesi pärssimine, mis on kõige olulisem hüpoglükeemiat takistav tegur. Füüsiline treening aitavad kaasa insuliinist sõltumatule glükoosi kasutamisele, mille tõttu võivad nad muutumatu hüpoglükeemilise ravi taustal ja / või täiendava süsivesikute tarbimise puudumisel põhjustada hüpoglükeemiat.
Epidemioloogia
Kerge, kiiresti pöörduv hüpoglükeemia I tüüpi diabeediga patsientidel, kes saavad intensiivset insuliinravi, võib tekkida mitu korda nädalas ja on suhteliselt kahjutu. Ühel intensiivset insuliinravi saavatel patsientidel esineb 1 raske hüpoglükeemia juhtum aastas. Enamikul juhtudel tekib hüpoglükeemia öösel. T2DM-i korral tekib 20% insuliini saavatest patsientidest ja 6% sulfonüüluurea ravimeid saavatest patsientidest 10 aasta jooksul vähemalt üks raske hüpoglükeemia episood.
Kliinilised ilmingud
On kaks peamist sümptomite rühma: adrenergilised, mis on seotud sümpaatilise närvisüsteemi aktiveerumisega ja adrenaliini vabanemisega neerupealiste poolt, ja neuroglükopeensed, mis on seotud kesknärvisüsteemi talitlushäiretega selle peamise närvisüsteemi puudulikkuse taustal. energia substraat. To adrenergiline sümptomite hulka kuuluvad: tahhükardia, müdriaas; ärevus, agressiivsus; värisemine, külm higi, paresteesia; iiveldus, tugev nälg, hüpersalivatsioon; kõhulahtisus, liigne urineerimine. To neuroglükopeenne sümptomite hulka kuuluvad asteenia,
vähenenud keskendumisvõime, peavalu, hirm, segasus, desorientatsioon, hallutsinatsioonid; kõne-, nägemis-, käitumishäired, amneesia, teadvusehäired, krambid, mööduv halvatus, kellele. Hüpoglükeemia süvenedes ei pruugi sümptomite raskuse ja järjestuse vahel olla selget seost. Esineda võivad ainult adrenergilised või ainult neuroglükopeenilised sümptomid. Mõnel juhul võivad patsiendid, vaatamata normoglükeemia taastumisele ja käimasolevale ravile, jääda stuporisse või isegi koomasse mitmeks tunniks või isegi päevaks. Pikaajaline hüpoglükeemia või selle sagedased episoodid võivad põhjustada kesknärvisüsteemis (eelkõige ajukoores) pöördumatuid muutusi, mille ilmingud varieeruvad märkimisväärselt deliristlikust ja hallutsinatoorsetest-paranoilistest episoodidest kuni tüüpiliste epilepsiahoogudeni, mille vältimatuks tagajärjeks on püsiv dementsus. .
Patsiendid taluvad subjektiivselt hüperglükeemiat kergemini kui isegi kerge hüpoglükeemia episoode. Seetõttu peavad paljud patsiendid hüpoglükeemia hirmu tõttu vajalikuks säilitada glükeemia suhteliselt kõrgel tasemel, mis tegelikult vastab haiguse dekompensatsioonile. Sellest stereotüübist üle saamine nõuab mõnikord arstide ja õppejõudude märkimisväärseid pingutusi.
Diagnostika
Hüpoglükeemia kliiniline pilt diabeediga patsiendil koos madala veresuhkru taseme laboratoorse (tavaliselt glükomeetri abil) tuvastamisega.
Diferentsiaaldiagnoos
Muud põhjused, mis põhjustavad teadvusekaotust. Kui diabeediga patsiendi teadvuse kaotuse põhjus pole teada ja glükeemia taseme kiiret analüüsi pole võimalik teha, näidatakse talle glükoosi sisseviimist. Sageli on vaja välja selgitada diabeediga patsientide sagedase hüpoglükeemia tekke põhjus. Enamasti on need tingitud ebapiisavast hüpoglükeemilisest ravist ja patsiendi vähesest teadmistest oma haiguse kohta. Tuleb meeles pidada, et mitmed haigused (neerupealiste puudulikkus, hüpotüreoidism, neeru- ja maksapuudulikkus), sealhulgas pahaloomulised kasvajad, võivad põhjustada hüpoglükeemilise ravi vajaduse vähenemist kuni selle täieliku tühistamiseni ("kadunud diabeet").
Ravi
Kerge hüpoglükeemia raviks, mille puhul patsient on teadvusel ja saab ennast aidata, piisab tavaliselt süsivesikuid sisaldava toidu või vedeliku võtmisest 1-2 leivaühikut (10-20 g glükoosi). See kogus sisaldub näiteks 200 ml magusas puuviljamahlas. Joogid on hüpoglükeemia peatamisel tõhusamad, kuna vedelal kujul imendub glükoos palju kiiremini. Kui sümptomid süvenevad vaatamata jätkuvale süsivesikute tarbimisele, on vaja intravenoosset glükoosi või intramuskulaarset glükagooni. Rasket hüpoglükeemiat koos teadvusekaotusega ravitakse sarnaselt. Sellisel juhul süstitakse patsiendile umbes 50 ml 40% glükoosilahus intravenoosselt. Glükoosi manustamist tuleb jätkata, kuni rünnak on leevendunud ja glükeemia normaliseerub, kuigi reeglina pole vaja suuremat annust - kuni 100 ml või rohkem. glükagoon manustada (tavaliselt tehases valmistatud täidetud süstlaga) intramuskulaarselt või subkutaanselt. Mõne minuti pärast normaliseerub glükagooni poolt glükogenolüüsi indutseerimisest tingitud glükeemia tase. Kuid see ei juhtu alati: kõrge insuliinisisaldusega veres on glükagoon ebaefektiivne. Glükagooni poolväärtusaeg on lühem kui insuliinil. Alkoholismi ja maksahaiguste korral on glükogeeni süntees häiritud ja glükagooni manustamine võib olla ebaefektiivne. Glükagooni manustamise kõrvalmõjuks võib olla oksendamine, mis tekitab aspiratsiooniohu. Soovitav on, et patsiendi sugulased valdaksid glükagooni süstimise tehnikat.
Prognoos
Kerge hüpoglükeemia hea haigushüvitisega koolitatud patsientidel on ohutu. Sage hüpoglükeemia on märk halvast DM-i kompensatsioonist; enamikul juhtudel on sellistel patsientidel rohkem või vähem väljendunud hüperglükeemia ja ülejäänud päeva jooksul kõrge glükeeritud hemoglobiini tase. Diabeedi hiliste tüsistustega eakatel patsientidel võib hüpoglükeemia esile kutsuda selliseid vaskulaarseid tüsistusi nagu müokardiinfarkt, insult, võrkkesta hemorraagia. Kuni 30 minutit kestev hüpoglükeemiline kooma piisava ravi ja kiire teadvuse naasmisega ei põhjusta reeglina tüsistusi ega tagajärgi.
7.8. DIABEEDI HILLISED TÜSISTUSED
Mõlemal DM-i tüübil tekivad hilised tüsistused. Kliiniliselt eristatakse viit peamist DM-i hilist tüsistust: makroangiopaatia, nefropaatia, retinopaatia, neuropaatia ja diabeetilise jala sündroom. Teatud tüüpi DM-i hiliste komplikatsioonide mittespetsiifilisuse määrab asjaolu, et nende peamine patogeneetiline seos on krooniline hüperglükeemia. Sellega seoses ei esine DM-1 ilmnemise ajal patsientidel peaaegu kunagi hilinenud tüsistusi, mis arenevad aastate ja aastakümnete jooksul, sõltuvalt ravi efektiivsusest. DM-1 puhul omandab reeglina suurim kliiniline tähtsus diabeetiline mikroangiopaatia(nefropaatia, retinopaatia) ja neuropaatia (diabeetilise jala sündroom). Vastupidi, DM-2 puhul avastatakse sageli hilised tüsistused juba diagnoosimise ajal. Esiteks on see tingitud asjaolust, et CD-2 avaldub juba ammu enne diagnoosi panemist. Teiseks on ateroskleroosil, mis kliiniliselt väljendub makroangiopaatias, palju DM-ga ühiseid patogeneesi seoseid. DM-2 puhul on suurim kliiniline tähtsus reeglina diabeetiline makroangiopaatia, mis diagnoosimise hetkel avastatakse valdaval enamusel patsientidest. Igal juhul varieerub üksikute hiliste komplikatsioonide kogum ja raskusaste nende paradoksaalsest täielikust puudumisest, hoolimata haiguse märkimisväärsest kestusest, kuni kõigi võimalike võimaluste kombinatsioonini raskes vormis.
Hilised komplikatsioonid on peamine surmapõhjus diabeeti põdevatel patsientidel ja võttes arvesse selle levimust - kõige olulisem meditsiiniline ja sotsiaalne terviseprobleem enamikus riikides. Mis puudutab ravi peamine eesmärk ja diabeediga patsientide jälgimine on selle hiliste tüsistuste ennetamine (esmane, sekundaarne, tertsiaarne).
7.8.1. Diabeetiline makroangiopaatia
Diabeetiline makroangiopaatia- kollektiivne kontseptsioon, mis ühendab suurte arterite aterosklerootilisi kahjustusi diabeedi korral,
kliiniliselt avaldub südame isheemiatõbi (CHD), ajuveresoonte hävitav ateroskleroos, alajäsemed, siseorganid ja arteriaalne hüpertensioon (tabel 7.16).
Tab. 7.16. Diabeetiline makroangiopaatia
 Etioloogia ja patogenees
Etioloogia ja patogenees
Tõenäoliselt sarnane ateroskleroosi etioloogia ja patogeneesiga inimestel, kellel ei ole DM-i. Aterosklerootilised naastud ei erine mikroskoopilise struktuuri poolest inimestel, kellel on ja ilma DM. DM-i puhul võivad aga esile kerkida täiendavad riskifaktorid või DM süvendab teadaolevaid mittespetsiifilisi tegureid. Need, kellel on SD, peaksid sisaldama:
1. Hüperglükeemia. See on ateroskleroosi arengu riskitegur. HbA1c taseme tõus 1% võrra DM-2-ga patsientidel suureneb
Müokardiinfarkti tekkerisk on 15%. Hüperglükeemia aterogeense toime mehhanism ei ole täiesti selge, see võib olla seotud LDL-i metabolismi lõpp-produktide ja veresoonte seina kollageeni glükosüülimisega.
2. arteriaalne hüpertensioon(AG). Patogeneesis omistatakse suurt tähtsust neerukomponendile (diabeetiline nefropaatia). DM-2 hüpertensioon ei ole vähem oluline südameataki ja insuldi riskitegur kui hüperglükeemia.
3. Düslipideemia. Hüperinsulineemia, mis on T2DM-i insuliiniresistentsuse lahutamatu komponent, põhjustab HDL taseme langust, triglütseriidide tõusu ja tiheduse vähenemist, s.o. LDL suurenenud aterogeensus.
4. ülekaalulisus, mis mõjutab enamikku CD-2-ga patsiente, on sõltumatu ateroskleroosi, müokardiinfarkti ja insuldi riskifaktor (vt lõik 11.2).
5. insuliiniresistentsus. Hüperinsulineemia ja insuliini-proinsuliinitaoliste molekulide kõrge tase suurendavad ateroskleroosi riski, mis võib olla seotud endoteeli düsfunktsiooniga.
6. Vere hüübimise rikkumine. Diabeedi korral määratakse fibrinogeeni, trombotsüütide inhibiitori aktivaatori ja von Willebrandi faktori taseme tõus, mille tulemusena moodustub vere hüübimissüsteemi protrombootiline seisund.
7. endoteeli düsfunktsioon, mida iseloomustab plasminogeeni inhibiitori aktivaatori ja rakuadhesioonimolekulide suurenenud ekspressioon.
8. oksüdatiivne stress, mis põhjustab oksüdeeritud LDL-i ja F2-isoprostaani kontsentratsiooni suurenemist.
9. süsteemne põletik, mille puhul suureneb fibrinogeeni ja C-reaktiivse valgu ekspressioon.
Kõige olulisemad riskitegurid koronaararterite haiguse tekkeks DM-2 puhul on kõrgenenud LDL, madal HDL, arteriaalne hüpertensioon, hüperglükeemia ja suitsetamine. Üks erinevusi DM-i aterosklerootilise protsessi vahel on levinum ja oklusiivse kahjustuse distaalne olemus, need. Sageli on protsessi kaasatud suhteliselt väiksemad arterid, mis raskendab kirurgilist ravi ja halvendab prognoosi.
Epidemioloogia
Risk haigestuda koronaartõve II tüüpi diabeediga inimestel on 6 korda suurem kui diabeedita inimestel, samas kui meestel ja naistel on see sama. Arteriaalne hüpertensioon tuvastatakse 20% DM-1 ja 75% DM-2 patsientidest. Üldiselt esineb seda DM-ga patsientidel kaks korda sagedamini kui neil, kellel seda ei esine. Perifeersete veresoonte oblitereeriv ateroskleroos areneb 10% DM-ga patsientidest. Ajuveresoonte trombemboolia areneb 8% diabeediga patsientidest (2-4 korda sagedamini kui diabeedita inimestel).
Kliinilised ilmingud
Põhimõtteliselt ei erine DM-ita isikute omadest. DM-2 kliinilises pildis tulevad sageli esile makrovaskulaarsed tüsistused (müokardiinfarkt, insult, jalgade veresoonte oklusiivne kahjustus) ja just nende arengu ajal avastatakse patsiendil sageli hüperglükeemia. Võib-olla kaasuva autonoomse neuropaatia tõttu esineb kuni 30% diabeediga inimeste müokardiinfarktidest ilma tüüpilise stenokardiahoota (valutu infarkt).
Diagnostika
Ateroskleroosi tüsistuste (CHD, tserebrovaskulaarne õnnetus, jalaarterite oklusiivsed kahjustused) diagnoosimise põhimõtted ei erine DM-ita isikute omadest. Mõõtmine vererõhk(BP) tuleks läbi viia igal diabeediga patsiendi arstivisiidil ja näitajate määramisel. lipiidide spekter vereanalüüs (üldkolesterool, triglütseriidid, LDL, HDL) diabeedi korral tuleks läbi viia vähemalt kord aastas.
Diferentsiaaldiagnoos
Muud südame-veresoonkonna haigused, sümptomaatiline arteriaalne hüpertensioon, sekundaarne düslipideemia.
Ravi
♦ Vererõhu kontroll. Süstoolse vererõhu õige tase diabeedi korral on alla 130 mmHg ja diastoolne 80 mmHg (tabel 7.3). Enamik patsiente vajab selle eesmärgi saavutamiseks mitut antihüpertensiivset ravimit. Diabeedi antihüpertensiivse ravi valikravimid on AKE inhibiitorid ja angiotensiini retseptori blokaatorid, millele vajadusel lisatakse tiasiiddiureetikume. Müokardiinfarkti põdenud diabeedihaigete valikravimid on β-blokaatorid.
♦ Düslipideemia korrigeerimine. Lipiidide spektri indikaatorite sihttasemed on esitatud tabelis. 7.3. Lipiidide taset langetava ravi valikravimid on 3-hüdroksü-3-metüülglutarüül-CoA reduktaasi (statiinid) inhibiitorid.
♦ trombotsüütidevastane ravi. Ravi aspiriiniga (75-100 mg/päevas) on näidustatud üle 40-aastastele diabeediga patsientidele, kellel on suurenenud risk haigestuda südame-veresoonkonna haigustesse (tüsistunud perekonna ajalugu, arteriaalne hüpertensioon, suitsetamine, düslipideemia, mikroalbuminuuria), samuti kõigile patsientidele. ateroskleroosi kliiniliste ilmingutega sekundaarse ennetusena.
♦ Koronaararterite haiguse skriinimine ja ravi. Koronaararterite haiguse välistamiseks mõeldud stressitestid on näidustatud südame-veresoonkonna haiguste sümptomitega patsientidele, samuti patoloogia avastamiseks EKG-s.
Prognoos
75% DM-2 ja 35% DM-1 patsientidest sureb südame-veresoonkonna haigustesse. Ligikaudu 50% II tüüpi diabeediga patsientidest sureb koronaararterite haiguse tüsistuste tõttu, 15% aju trombemboolia tõttu. Diabeedihaigete suremus müokardiinfarkti ületab 50%.
7.8.2. diabeetiline retinopaatia
diabeetiline retinopaatia(DR) - võrkkesta veresoonte mikroangiopaatia, mida iseloomustab mikroaneurüsmide, hemorraagiate, eksudatiivsete muutuste ja äsja moodustunud veresoonte vohamine, mis põhjustab osalist või täielikku nägemise kaotust (tabel 7.17).
Etioloogia
DR-i arengu peamine etioloogiline tegur on krooniline hüperglükeemia. Muud tegurid (arteriaalne hüpertensioon, düslipideemia, suitsetamine, rasedus jne) on vähem olulised.
Patogenees
DR-i patogeneesi peamised lingid on:
Võrkkesta veresoonte mikroangiopaatia, mis põhjustab veresoonte luumenuse ahenemist hüpoperfusiooni tekkega;
Laevade degeneratsioon koos mikroaneurüsmide moodustumisega;
Progresseeruv hüpoksia, mis stimuleerib veresoonte proliferatsiooni ja põhjustab rasvade degeneratsiooni ja kaltsiumisoolade ladestumist võrkkestas;
Tab. 7.17. diabeetiline retinopaatia
 eksudatsiooniga mikroinfarktid, mis põhjustavad pehmete "puuvillalaikude" moodustumist;
eksudatsiooniga mikroinfarktid, mis põhjustavad pehmete "puuvillalaikude" moodustumist;
Lipiidide ladestumine koos tihedate eksudaatide moodustumisega;
Paljunevate veresoonte kasv võrkkestas koos šuntide ja aneurüsmide moodustumisega, mis põhjustab veenide laienemist ja võrkkesta hüpoperfusiooni süvenemist;
Varastamise nähtus koos isheemia edasise progresseerumisega, mis on infiltraatide ja armide moodustumise põhjus;
Võrkkesta eraldumine selle isheemilise lagunemise ja klaaskesta tõmbe moodustumise tagajärjel;
Klaaskeha hemorraagia hemorraagilise infarkti, ulatusliku veresoonte invasiooni ja aneurüsmi rebendi tagajärjel;
Iirise veresoonte proliferatsioon (diabeetiline rubeoos), mis viib sekundaarse glaukoomi tekkeni;
Makulopaatia võrkkesta tursega.
Epidemioloogia
DR on arenenud riikide tööealise elanikkonna seas kõige levinum pimedaks jäämise põhjus ning DM-ga patsientidel on pimedaks jäämise risk 10-20 korda suurem kui üldpopulatsioonil. DM-1 diagnoosimise ajal ei leitud DR-i peaaegu ühelgi patsiendil, 5 aasta pärast avastatakse haigus 8% patsientidest ja 30-aastase diabeediga patsientidest - 98% patsientidest. CD-2 diagnoosimise ajal tuvastatakse DR 20–40% patsientidest ja 15-aastase CD-2 kogemusega patsientide hulgas 85%. SD-1 puhul on suhteliselt sagedasem proliferatiivne retinopaatia ja SD-2 puhul makulopaatia (75% makulopaatia juhtudest).
Kliinilised ilmingud
Üldtunnustatud klassifikatsiooni kohaselt on DR-i 3 etappi
(Tabel 7.18).
Diagnostika
Täielik oftalmoloogiline uuring, sealhulgas otsene oftalmoskoopia koos võrkkesta pildistamisega, on näidustatud DM-1-ga patsientidele 3-5 aastat pärast haiguse algust ja DM-2-ga patsientidele kohe pärast selle avastamist. Edaspidi tuleks selliseid uuringuid korrata igal aastal.
Tab. 7.18. Diabeetilise retinopaatia klassifikatsioon
 Diferentsiaaldiagnoos
Diferentsiaaldiagnoos
Muud silmahaigused diabeediga patsientidel.
Ravi
Diabeetilise retinopaatia, aga ka teiste hiliste tüsistuste ravi põhiprintsiip on DM optimaalne kompensatsioon. Kõige tõhusam diabeetilise retinopaatia ravi ja pimeduse ennetamine on laser fotokoagulatsioon. eesmärk
 Riis. 7.11. Diabeetiline retinopaatia:
Riis. 7.11. Diabeetiline retinopaatia:
a) leviku tõkestamine; b) preproliferatiivne; c) proliferatiivne
laserfotokoagulatsioon on äsja moodustunud veresoonte toimimise lõpetamine, mis kujutavad endast peamist ohtu selliste tõsiste tüsistuste tekkele nagu hemoftalmia, võrkkesta tõmbe irdumine, iirise rubeoos ja sekundaarne glaukoom.
Prognoos
Pimedus registreeritakse 2% DM-ga patsientidest (3-4% DM-1-ga patsientidest ja 1,5-2% DM-2-ga patsientidest). DR-iga seotud uute pimedaksjäämise juhtude ligikaudne määr on 3,3 juhtu 100 000 elaniku kohta aastas. DM-1 korral põhjustab HbA1c langus 7,0% -ni DR-i väljakujunemise riski vähenemise 75% ja DR-i progresseerumise riski vähenemise 60% võrra. DM-2 korral vähendab HbA1c 1% võrra DR-i tekke riski 20%.
7.8.3. diabeetiline nefropaatia
diabeetiline nefropaatia(DNF) on defineeritud kui albuminuuria (rohkem kui 300 mg albumiini päevas või proteinuuria üle 0,5 g valgu päevas) ja/või neerude filtreerimisfunktsiooni langus diabeediga inimestel kuseteede infektsioonide puudumisel. , südamepuudulikkus või muud neeruhaigused. Mikroalbuminuuria on defineeritud kui albumiini eritumine 30–300 mg/päevas või 20–200 mcg/min.
Etioloogia ja patogenees
DNF-i peamised riskitegurid on diabeedi kestus, krooniline hüperglükeemia, arteriaalne hüpertensioon, düslipideemia ja neeruhaigus vanematel. DNF-is mõjutab see peamiselt glomerulaaraparaat neerud.
1. Üks võimalikest mehhanismidest, mille abil hüperglükeemia aitab kaasa glomerulaarsete kahjustuste tekkele, on sorbitooli akumuleerumine glükoosi metabolismi polüooliraja aktiveerimise tõttu, samuti mitmed arenenud glükoosi lõpp-produktid.
2. Hemodünaamilised häired, nimelt intraglomerulaarne arteriaalne hüpertensioon(kõrgenenud vererõhk neeru glomerulites) on patogeneesi oluline komponent
Intraglomerulaarse hüpertensiooni põhjuseks on arterioolide tooni rikkumine: aferendi laienemine ja efferendi kitsenemine.
Tab. 7.19. diabeetiline nefropaatia
 See omakorda toimub mitmete humoraalsete tegurite, nagu angiotensiin-2 ja endoteliin, mõjul, samuti glomerulaarmembraani elektrolüütide omaduste rikkumise tõttu. Lisaks soodustab süsteemne hüpertensioon intraglomerulaarset hüpertensiooni, mis esineb enamikul DNF-ga patsientidel. Intraglomerulaarse hüpertensiooni tõttu kahjustuvad basaalmembraanid ja filtratsioonipoorid,
See omakorda toimub mitmete humoraalsete tegurite, nagu angiotensiin-2 ja endoteliin, mõjul, samuti glomerulaarmembraani elektrolüütide omaduste rikkumise tõttu. Lisaks soodustab süsteemne hüpertensioon intraglomerulaarset hüpertensiooni, mis esineb enamikul DNF-ga patsientidel. Intraglomerulaarse hüpertensiooni tõttu kahjustuvad basaalmembraanid ja filtratsioonipoorid,
mille kaudu hakkavad tungima jäljed (mikroalbuminuuria), millele järgneb märkimisväärne kogus albumiini (proteinuuria). Basaalmembraanide paksenemine põhjustab nende elektrolüütide omaduste muutumise, mis iseenesest viib selleni, et ultrafiltraati satub rohkem albumiini ka siis, kui filtratsioonipooride suurus ei muutu.
3. Geneetiline eelsoodumus. DNF-iga patsientide sugulastel esineb arteriaalne hüpertensioon sagedamini. On tõendeid seose kohta DNP ja ACE geeni polümorfismi vahel. Mikroskoopiliselt näitab DNF glomerulite basaalmembraanide paksenemist, mesangiumi laienemist, samuti fibrootilisi muutusi aferentsetes ja eferentsetes arterioolides. Viimases etapis, mis kliiniliselt vastab kroonilisele neerupuudulikkusele (CRF), määratakse fokaalne (Kimmelstiel-Wilson) ja seejärel difuusne glomeruloskleroos.
Epidemioloogia
Mikroalbuminuuria määratakse 6-60% DM-1-ga patsientidest 5-15 aastat pärast selle avaldumist. DNF määratakse 35%-l DM-1-ga patsientidest, sagedamini meestel ja isikutel, kellel tekkis DM-1 alla 15-aastaselt. DM-2-ga areneb DNF 25% Euroopa rassi ja 50% Aasia rassi esindajatest. Üldine DNF-i levimus T2DM-is on 4-30%.
Kliinilised ilmingud
Suhteliselt varajane kliiniline ilming, mis on kaudselt seotud DNF-iga, on arteriaalne hüpertensioon. Muud kliiniliselt ilmsed ilmingud on hilised. Nende hulka kuuluvad nefrootilise sündroomi ja kroonilise neerupuudulikkuse ilmingud.
Diagnostika
DNF-i sõelumine DM-iga inimestel hõlmab iga-aastast testimist mikroalbuminuuria DM-1-ga 5 aastat pärast haiguse ilmnemist ja DM-2-ga - kohe pärast selle avastamist. Lisaks on arvutamiseks vaja vähemalt kord aastas määrata kreatiniini taset glomerulaarfiltratsiooni kiirus (GFR). GFR-i saab arvutada erinevate valemitega, näiteks Cockcroft-Gault valemiga:
Meestel: a = 1,23 (GFR norm 100 - 150 ml/min) Naistel: a = 1,05 (GFR norm 85 - 130 ml/min)
DNF-i algstaadiumis võib tuvastada GFR-i tõusu, mis CRF-i edenedes järk-järgult langeb. Mikroalbuminuuriat hakatakse määrama 5-15 aastat pärast CD-1 avaldumist; DM-2 puhul tuvastatakse see 8-10% juhtudest kohe pärast avastamist, tõenäoliselt haiguse pika asümptomaatilise kulgemise tõttu enne diagnoosimist. T1DM-i ilmne proteinuuria või albuminuuria haripunkt saabub 15–20 aastat pärast tekkimist. Proteinuuria viitab pöördumatus DNF, mis varem või hiljem viib CRF-i. Ureemia tekib keskmiselt 7-10 aastat pärast ilmse proteinuuria tekkimist. Tuleb märkida, et GFR ei korreleeru proteinuuriaga.
Diferentsiaaldiagnoos
Muud proteinuuria ja neerupuudulikkuse põhjused diabeediga inimestel. Enamasti seostatakse DNF-i arteriaalse hüpertensiooni, diabeetilise retinopaatia või neuropaatiaga, mille puudumisel peaks diferentsiaaldiagnostika olema eriti ettevaatlik. 10% juhtudest DM-1 ja 30% juhtudest DM-2 puhul ei ole proteinuuria seotud DNP-ga.
Ravi
♦ Põhitingimused esmaseks ja sekundaarseks ärahoidmine
DNF on diabeedi kompenseerimine ja normaalse süsteemse arteriaalse rõhu säilitamine. Lisaks tähendab DNF-i esmane ennetamine valgu tarbimise vähendamist - vähem kui 35% päevastest kaloritest.
♦ Etapil mikroalbuminuuria ja proteinuuria patsientidele näidatakse AKE inhibiitorite või angiotensiini retseptori blokaatorite määramist. Samaaegse arteriaalse hüpertensiooniga määratakse need antihüpertensiivsetes annustes, vajadusel kombinatsioonis teiste antihüpertensiivsete ravimitega. Normaalse vererõhu korral määratakse need ravimid annustes, mis ei põhjusta hüpotensiooni teket. Nii AKE inhibiitorid (DM-1 ja DM-2 puhul) kui ka angiotensiini retseptori blokaatorid (DM-2 puhul) aitavad vältida mikroalbuminuuria üleminekut proteinuuriaks. Mõnel juhul elimineeritakse mikroalbuminuuria selle ravi taustal koos diabeedi kompenseerimisega vastavalt muudele parameetritele. Lisaks on vajalik alates mikroalbuminuuria staadiumist
valgu tarbimise vähendamine alla 10% päevasest kalorikogusest (või alla 0,8 grammi kehakaalu kilogrammi kohta) ja soola tarbimise vähendamine alla 3 grammi päevas.
♦ Laval CKD, reeglina on vajalik hüpoglükeemilise ravi korrigeerimine. Enamik II tüüpi diabeediga patsiente tuleb üle viia insuliinravile, kuna TSP kuhjumisega kaasneb raske hüpoglükeemia tekke oht. Enamikul I tüüpi diabeediga patsientidel väheneb insuliinivajadus, kuna neerud on selle metabolismi üks peamisi kohti. Kui seerumi kreatiniinisisaldus tõuseb 500 µmol/l või rohkem, on vaja tõstatada küsimus patsiendi ettevalmistamisest kehaväliseks (hemodialüüs, peritoneaaldialüüs) või kirurgiliseks (neeru siirdamine) ravimeetodiks. Neerusiirdamine on näidustatud kreatiniinisisalduse korral kuni 600-700 µmol/l ja glomerulaarfiltratsiooni kiiruse vähenemise korral alla 25 ml/min, hemodialüüsi - vastavalt 1000-1200 µmol/l ja alla 10 ml/min.
Prognoos
50% 1. tüüpi diabeediga patsientidest ja 10% 2. tüüpi diabeediga patsientidest, kellel on proteinuuria, areneb krooniline neeruhaigus järgmise 10 aasta jooksul. 15% kõigist alla 50-aastaste I tüüpi diabeediga patsientide surmajuhtumitest on seotud DNP-st tingitud CRF-ga.
7.8.4. Diabeetiline neuropaatia
Diabeetiline neuropaatia(DNE) on närvisüsteemi kahjustuse sündroomide kombinatsioon, mida saab klassifitseerida sõltuvalt selle erinevate osakondade (sensoor-motoorne, autonoomne) valdavast osalusest protsessis, samuti kahjustuse levimusest ja raskusastmest ( Tabel 7.20).
I. Sensomotoorne neuropaatia:
sümmeetriline;
Fokaalne (mononeuropaatia) või polüfokaalne (kraniaalne, proksimaalne motoorne, jäsemete ja kehatüve mononeuropaatia).
II. Autonoomne (vegetatiivne) neuropaatia:
Kardiovaskulaarne (ortostaatiline hüpotensioon, südame denervatsiooni sündroom);
Seedetrakt (mao atoonia, sapiteede düskineesia, diabeetiline enteropaatia);
Urogenitaalne (koos põie- ja seksuaalfunktsiooni häiretega);
Patsiendi hüpoglükeemia äratundmise võime halvenemine;
Pupillide funktsiooni kahjustus;
Higinäärmete funktsioonide rikkumine (distaalne anhidroos, liighigistamine söömisel).
Tab. 7.20. Diabeetiline neuropaatia
 Etioloogia ja patogenees
Etioloogia ja patogenees
DNE peamine põhjus on hüperglükeemia. Selle patogeneesiks on välja pakutud mitmeid mehhanisme:
Glükoosi metabolismi polüooliraja aktiveerimine, mille tulemuseks on sorbitooli ja fruktoosi akumuleerumine närvirakkudes ning müoinositooli ja glutatiooni sisalduse vähenemine. See omakorda toob kaasa vabade radikaalide protsesside aktiveerumise ja lämmastikoksiidi taseme languse;
Närvirakkude membraani ja tsütoplasmaatiliste valkude mitteensümaatiline glükosüülimine;
Mikroangiopaatia vasa nervorum, mis põhjustab kapillaaride verevoolu aeglustumist ja närvide hüpoksiat.
Epidemioloogia
DNE levimus mõlemas DM-i tüübis on umbes 30%. DM-1 korral hakatakse seda 5 aasta pärast haiguse algusest tuvastama 10% patsientidest. Uute DNE juhtude sagedus DM-2 puhul on umbes 6% patsientidest aastas. Kõige tavalisem variant on distaalne sümmeetriline sensomotoorne NNE.
Kliinilised ilmingud
Sensorimootor DNE avaldub motoorsete ja sensoorsete häirete kompleksina. DNE distaalse vormi tavaline sümptom on paresteesia, mis väljenduvad "roomamistundes", tuimuses. Patsiendid kurdavad sageli jalgade külmetust, kuigi need jäävad katsudes soojaks, mis on märk, mis eristab polüneuropaatiat isheemilistest muutustest, kui jalad on puudutamisel külmad. Vibratsioonitundlikkus on sensoorse neuropaatia varajane ilming. Iseloomulik on "rahutute jalgade" sündroom, mis on öise paresteesia ja ülitundlikkuse kombinatsioon. Valu jalgades sagedamini häiritakse öösel, samas kui mõnikord ei talu patsient teki puudutust. Tüüpilisel juhul võib valu, erinevalt arterite hävitavatest haigustest, leevendada kõndimisega. Aastaid hiljem võib valu spontaanselt lakata valutundlikkuse eest vastutavate väikeste närvikiudude surma tõttu. Hüpoesteesia mis väljendub "sukade" ja "kinnaste" tüüpide tundlikkuse kaotuses. Sügava propriotseptiivse tundlikkuse rikkumine põhjustab koordinatsiooni halvenemist ja liikumisraskusi (sensoorne ataksia). Patsient kaebab "kellegi teise jalgade" pärast, "vati peal seismise" tunnet. Troofilise innervatsiooni rikkumine põhjustab degeneratiivseid muutusi nahas, luudes ja kõõlustes. Valutundlikkuse rikkumine põhjustab jalgade sagedasi, patsiendile märkamatuid mikrotraumasid, mis on kergesti nakatunud. Koordinatsiooni ja kõndimise rikkumine põhjustab jala liigeste koormuse mittefüsioloogilist ümberjaotamist. Selle tulemusena on jala luu-lihassüsteemi anatoomilised suhted häiritud.
Jalavõlvi deformeerub, tursed, luumurrud, tekivad kroonilised mädased protsessid (vt punkt 7.8.5).
On mitmeid autonoomse DNE vorme. Põhjus kardiovaskulaarne vorm- südame-kopsukompleksi ja suurte veresoonte innervatsiooni rikkumine. Vagusnärv on pikim närv ja seetõttu mõjutab see varem kui teised. Sümpaatiliste mõjutuste ülekaalu tulemusena areneb rahuoleku tahhükardia. Ebapiisav reaktsioon ortostaasile avaldub ortostaatiline hüpotensioon ja minestus. Kopsu-südame kompleksi autonoomne denervatsioon viib südame löögisageduse varieeruvuse puudumiseni. Valutu müokardiinfarkti suurenenud esinemissagedus diabeediga patsientide seas on seotud autonoomse neuropaatiaga.
Sümptomid seedetrakti vorm DNE-d on gastroparees koos hilinenud või vastupidi kiire mao tühjenemisega, mis võib tekitada raskusi insuliinravi valikul, kuna süsivesikute imendumise aeg ja maht varieeruvad määramatult; söögitoru atoonia, refluksösofagiit, düsfaagia; vesine kõhulahtisus. Sest urogenitaalne vorm DNE-d iseloomustab kusejuhade ja põie atoonia, mis põhjustab kalduvust kuseteede infektsioonidele; erektsioonihäired (umbes 50% diabeediga patsientidest); retrograadne ejakulatsioon.
Teised autonoomse DNE võimalikud ilmingud on halvenenud võime ära tunda hüpoglükeemiat, pupillide funktsiooni kahjustus, higinäärmete funktsiooni kahjustus (anhidroos) ja diabeetiline amüotroofia.
Diagnostika
DM-ga patsientide neuroloogiline läbivaatus tuleb läbi viia igal aastal. See hõlmab vähemalt testimist distaalse sensomotoorse neuropaatia tuvastamiseks. Selleks hinnatakse vibratsioonitundlikkust gradueeritud häälekahvli abil, puutetundlikkust monofilamendi abil, samuti temperatuuri- ja valutundlikkust. Vastavalt näidustustele uuritakse autonoomse närvisüsteemi seisundit: südame parasümpaatilise innervatsiooni puudulikkuse diagnoosimiseks kasutatakse mitmeid funktsionaalseid teste, näiteks südame löögisageduse mõõtmist sügaval hingamisel koos varieeruvuse hindamisega.
pulsisagedus ja Valsalva test; ortostaatilist testi kasutatakse südame sümpaatilise innervatsiooni puudulikkuse diagnoosimiseks.
Diferentsiaaldiagnoos
Muu päritolu neuropaatia (alkohoolne, ureemiline, B 12 vaegusaneemiaga jne). Autonoomse neuropaatia tagajärjel tekkinud ühe või teise organi düsfunktsiooni diagnoos pannakse paika alles pärast elundipatoloogia välistamist.
Ravi
1. Hüpoglükeemilise ravi optimeerimine.
2. Jalgade hooldus (vt punkt 7.8.5).
3. Neurotroopsete ravimite (α-lipoehape) efektiivsust ei kinnitata kõigis uuringutes.
4. Sümptomaatiline ravi (valu vaigistamine, sildenafiil erektsioonihäirete korral, fludrokortisoon ortostaatilise hüpotensiooni korral jne).
Prognoos
Algstaadiumis võib DNE olla pöörduv DM stabiilse kompenseerimise taustal. DNE määratakse 80% haavanditega patsientidest ja see on jala amputatsiooni peamine riskitegur.
7.8.5. diabeetilise jala sündroom
diabeetilise jala sündroom(SDS) - jala patoloogiline seisund DM-s, mis tekib perifeersete närvide, naha ja pehmete kudede, luude ja liigeste kahjustuse taustal ning avaldub ägedate ja krooniliste haavandite, osteoartikulaarsete kahjustuste ja mädaste nekrootiliste protsessidena (tabel 7.21). .
Etioloogia ja patogenees
DFS-i patogenees on mitmekomponentne ja seda esindab neuropaatiliste ja perfusioonihäirete kombinatsioon, millel on väljendunud kalduvus infektsioonidele. Lähtudes ühe või teise loetletud teguri ülekaalust patogeneesis, eristatakse 3 peamist vormi
Tab. 7.21. diabeetilise jala sündroom
 I. Neuropaatiline vorm(60-70 %):
I. Neuropaatiline vorm(60-70 %):
Ilma osteoartropaatiata;
diabeetilise osteoartropaatiaga.
II. Neuroisheemia (segatud) vorm(15-20 %).
III. Isheemiline vorm(3-7 %).
SDS neuropaatiline vorm. Diabeetilise neuropaatia korral on kahjustatud peamiselt pikimate närvide distaalsed osad. Troofiliste impulsside pikaajaline defitsiit põhjustab naha, luude, sidemete, kõõluste ja lihaste hüpotroofiat. Sidestruktuuride hüpotroofia tagajärjeks on jala deformeerumine koos tugikoormuse mittefüsioloogilise ümberjaotusega ja selle ülemäärane suurenemine teatud piirkondades. Nendes kohtades, näiteks metatarsaalsete luude peade projektsioonis, täheldatakse naha paksenemist ja hüperkeratoosi teket. Pidev surve nendele piirkondadele viib aluseks olevate pehmete kudede põletikulise autolüüsini, mis loob eeldused haavandi tekkeks. Atroofia ja nõrgenenud higistamise tagajärjel muutub nahk kuivaks ja kergesti lõhenevaks. Valutundlikkuse vähenemise tõttu ei pööra patsient sageli toimuvatele muutustele tähelepanu. Ta ei suuda õigeaegselt tuvastada kingade ebamugavust, mis põhjustab kriimustuste ja kalluste moodustumist, ei märka võõrkehade sissetoomist, väikseid haavu pragunemise kohtadesse. Olukorda süvendab sügava tundlikkuse rikkumine, mis väljendub kõnnaku rikkumises, jala vales paigaldamises. Kõige sagedamini on peptiline haavand nakatunud stafülokokkide, streptokokkide, soolestiku rühma bakteritega; anaeroobne taimestik liitub sageli. Neuropaatiline osteoartropaatia on jala osteoartikulaarse aparatuuri väljendunud düstroofsete muutuste (osteoporoos, osteolüüs, hüperostoos) tagajärg.
SDS-i isheemiline vorm on alajäsemete arterite ateroskleroosi tagajärg, mis viib peamise verevoolu rikkumiseni, st. on üks diabeetilise makroangiopaatia variante.
Epidemioloogia
SDS-i täheldatakse 10-25% -l ja teatud andmetel ühel või teisel kujul 30-80% diabeediga patsientidest. Ameerika Ühendriikides on DFS-iga diabeedihaigete ravi aastased kulud 1 miljard dollarit.
Kliinilised ilmingud
Kell neuropaatiline vorm SDS eristab kahte kõige levinumat tüüpi kahjustusi: neuropaatiline haavand ja osteoartropaatia (koos arenguga
 Riis. 7.12. Neuropaatiline haavand diabeetilise jala sündroomi korral
Riis. 7.12. Neuropaatiline haavand diabeetilise jala sündroomi korral
 Riis. 7.13. Charcoti liiges diabeetilise jala sündroomi korral
Riis. 7.13. Charcoti liiges diabeetilise jala sündroomi korral
Charcot liigend). neuropaatilised haavandid, reeglina paiknevad need talla- ja sõrmedevaheliste ruumide piirkonnas, st. jalalaba piirkondadele, mis kogevad suurimat survet (joonis 7.12).
Destruktiivsed muutused jala luus ja sidemetes võivad areneda mitme kuu jooksul ja põhjustada luude tõsist deformatsiooni - diabeetiline osteoartropaatia ja moodustamine puuliige, samal ajal võrreldakse jalga piltlikult "kondikotiga"
Kell SDS isheemiline vorm
jalgade nahk on külm, kahvatu või tsüanootiline; harva on roosakas-punane toon, mis on tingitud pindmiste kapillaaride laienemisest vastusena isheemiale. Haavandilised defektid tekivad akraalse nekroosina – sõrmeotstel, kandade äärepinnal (joon. 7.14).
Jala-, popliteaal- ja reiearterite arterite pulss on nõrgenenud või ei ole palpeeritav.
Tüüpilistel juhtudel kurdavad patsiendid "vahelduvat lonkamist". Jäseme isheemilise kahjustuse raskusastme määravad kolm peamist tegurit: stenoosi raskusaste, kollateraalse verevoolu areng, vere hüübimissüsteemi seisund.
Diagnostika
Diabeedihaige jalgu tuleks kontrollida iga kord arstivisiidi ajal, vähemalt kord poole aasta jooksul. SDS-i diagnoos hõlmab:
 Riis. 7.14. Akranekroos diabeetilise jala sündroomi isheemilises vormis
Riis. 7.14. Akranekroos diabeetilise jala sündroomi isheemilises vormis
Jalgade uurimine;
Neuroloogilise seisundi hindamine - erinevat tüüpi tundlikkus, kõõluste refleksid, elektromüograafia;
Arteriaalse verevoolu seisundi hindamine - angiograafia, dopplerograafia, dopplerograafia;
jalgade ja pahkluude röntgenuuring;
Haavavooluse bakterioloogiline uuring.
Diferentsiaaldiagnoos
See viiakse läbi erineva päritoluga jalgade haavaprotsesside, samuti muude alajäsemete veresoonte oklusiivsete haiguste ja jala liigeste patoloogiaga. Lisaks on vaja eristada SDS-i kliinilisi vorme (tabel 7.22).
Ravi
Ravi neuropaatiliselt nakatunud VTS-vormid sisaldavad järgmisi tegevusi:
DM-i kompenseerimise optimeerimine, reeglina insuliini annuse suurendamine ja DM-2 korral - sellele ülekandmine;
süsteemne antibiootikumravi;
jala täielik mahalaadimine (see võib viia aastaid eksisteerinud haavandite paranemiseni mõne nädala jooksul);
Haava lokaalne ravi hüperkeratoosi piirkondade eemaldamisega;
Jalgade hooldus, õige valik ja spetsiaalsete jalanõude kandmine. Õigeaegne konservatiivne ravi võimaldab
vältida operatsiooni 95% juhtudest.
Tab. 7.22. SDS-i kliiniliste vormide diferentsiaaldiagnostika
 Ravi isheemiline VTS-vormid hõlmavad järgmist:
Ravi isheemiline VTS-vormid hõlmavad järgmist:
DM-i kompenseerimise optimeerimine, reeglina insuliini annuse suurendamine ja DM-2 korral - sellele ülekandmine;
Haavandiliste-nekrootiliste kahjustuste puudumisel tegevusteraapia (1-2-tunnine jalutuskäik päevas, mis aitab kaasa kollateraalse verevoolu arengule);
kahjustatud veresoonted;
Konservatiivne ravi: antikoagulandid, aspiriin (kuni 100 mg / päevas), vajadusel - fibrinolüütikumid, prostaglandiin E1 ja prostatsükliini preparaadid.
Ulatusliku mäda-nekrootilise kahjustuse tekkega kõigis SDS-i variantides tõstatatakse amputatsiooni küsimus.
Prognoos
50–70% teostatud jala amputatsioonide koguarvust on DM patsientidel. Jalgade amputatsioonid on diabeetikutel 20–40 korda sagedasemad kui mittediabeetilistel patsientidel.
7.9. DIABEED JA RASEDUS
Rasedusdiabeet(GDM) on glükoositalumatus, mis tuvastati esmakordselt raseduse ajal (tabel 7.23). See määratlus ei välista võimalust, et süsivesikute ainevahetuse patoloogia võib eelneda rasedusele. GDM-i tuleks eristada olukordadest, kus varem diagnoositud diabeediga naine (vanuse tõttu sagedamini 1. tüüpi diabeet) rasestub.
Etioloogia ja patogenees
GDM-iga on need sarnased SD-2-ga. Munasarjade ja platsenta steroidide kõrge tase, samuti kortisooli moodustumise suurenemine neerupealiste koores põhjustavad raseduse ajal füsioloogilise insuliiniresistentsuse kujunemist. GDM-i teket seostatakse asjaoluga, et raseduse ajal loomulikult tekkiv insuliiniresistentsus ja sellest tulenevalt eelsoodumusega isikute suurenenud insuliinivajadus ületab pankrease β-rakkude funktsionaalset võimekust. Pärast sünnitust, hormonaalsete ja metaboolsete suhete taastumisega algtasemele, see tavaliselt kaob.
Tab. 7.23. Rasedusdiabeet
 GDM areneb tavaliselt 2. trimestri keskel, raseduse 4. ja 8. kuu vahel. Enamikul patsientidest on liigne kehakaal ja CD-2 anamnees on koormatud. GDM-i väljakujunemise riskitegurid, samuti naiste rühmad, kellel on madal risk GDM-i tekkeks, on toodud tabelis. 7.24.
GDM areneb tavaliselt 2. trimestri keskel, raseduse 4. ja 8. kuu vahel. Enamikul patsientidest on liigne kehakaal ja CD-2 anamnees on koormatud. GDM-i väljakujunemise riskitegurid, samuti naiste rühmad, kellel on madal risk GDM-i tekkeks, on toodud tabelis. 7.24.
Tab. 7.24. Rasedusdiabeedi riskifaktorid
 Ema hüperglükeemia põhjustab lapse vereringesüsteemi hüperglükeemiat. Glükoos läbib kergesti platsentat ja läheb pidevalt ema verest lootele. Samuti toimub aktiivne aminohapete transport ja ketokehade ülekandumine lootele. Seevastu insuliin, glükagoon ja emalt saadud vabad rasvhapped ei satu loote verre. Esimesel 9-12 rasedusnädalal ei tooda loote kõhunääre veel oma insuliini. See aeg vastab loote organogeneesi faasile, mil pideva hüperglükeemia korral võivad emal tekkida mitmesugused väärarengud (süda, selg, seljaaju, seedetrakt). Alates 12. rasedusnädalast hakkab loote kõhunääre sünteesima insuliini ning vastusena hüperglükeemiale areneb loote pankrease β-rakkude reaktiivne hüpertroofia ja hüperplaasia. Hüperinsulineemia tõttu areneb loote makrosoomia, aga ka letsitiini sünteesi pärssimine, mis seletab vastsündinute respiratoorse distressi sündroomi suurt esinemissagedust. β-rakkude hüperplaasia ja hüperinsulinemia tagajärjel on kalduvus raskele ja pikaajalisele hüpoglükeemiale.
Ema hüperglükeemia põhjustab lapse vereringesüsteemi hüperglükeemiat. Glükoos läbib kergesti platsentat ja läheb pidevalt ema verest lootele. Samuti toimub aktiivne aminohapete transport ja ketokehade ülekandumine lootele. Seevastu insuliin, glükagoon ja emalt saadud vabad rasvhapped ei satu loote verre. Esimesel 9-12 rasedusnädalal ei tooda loote kõhunääre veel oma insuliini. See aeg vastab loote organogeneesi faasile, mil pideva hüperglükeemia korral võivad emal tekkida mitmesugused väärarengud (süda, selg, seljaaju, seedetrakt). Alates 12. rasedusnädalast hakkab loote kõhunääre sünteesima insuliini ning vastusena hüperglükeemiale areneb loote pankrease β-rakkude reaktiivne hüpertroofia ja hüperplaasia. Hüperinsulineemia tõttu areneb loote makrosoomia, aga ka letsitiini sünteesi pärssimine, mis seletab vastsündinute respiratoorse distressi sündroomi suurt esinemissagedust. β-rakkude hüperplaasia ja hüperinsulinemia tagajärjel on kalduvus raskele ja pikaajalisele hüpoglükeemiale.
Epidemioloogia
DM mõjutab 0,3% kõigist reproduktiivses eas naistest, 0,2-0,3% rasedatest on juba alguses ja 1-14% rasedustest areneb GDM või ilmneb tõeline DM. GDM-i levimus on erinevates populatsioonides erinev, näiteks USA-s avastatakse seda ligikaudu 4% rasedatel (135 tuhat juhtu aastas).
Kliinilised ilmingud
GSD-s puudub. Võib esineda dekompenseeritud diabeedi mittespetsiifilisi sümptomeid.
Diagnostika
Tühja kõhu veresuhkru tase on biokeemilise vereanalüüsi osana näidustatud kõigile rasedatele naistele. Riskirühma kuuluvatel naistel (tabel 7.24) on näidatud suukaudne glükoositaluvuse test(OGTT). Kirjeldatakse paljusid selle rakendamise variante rasedatel naistel. Lihtsaim neist eeldab järgmisi reegleid:
3 päeva enne uuringut on naine tavapärasel dieedil ja järgib oma tavapärast füüsilist koormust;
Katse tehakse hommikul tühja kõhuga pärast vähemalt 8-tunnist üleöö paastumist;
Pärast tühja kõhuga vereproovi võtmist joob naine 5 minutit lahust, mis koosneb 75 grammist kuivast glükoosist, mis on lahustatud 250–300 ml vees; 2 tunni pärast tehakse korduv glükeemia taseme määramine.
GDM-i diagnoos põhineb järgmisel kriteeriumid:
Täisvere (venoosne, kapillaar) glükoos tühja kõhuga > 6,1 mmol/l või
Venoosse plasma glükoosisisaldus ≥ 7 mmol/l või
Glükoos kapillaari täisveres või venoosses plasmas 2 tundi pärast 75 g glükoosi ≥ 7,8 mmol/l manustamist.
Kui riskirühma kuuluval naisel on uuringu tulemused normaalsed, korratakse testi 24-28 rasedusnädalal.
Diferentsiaaldiagnoos
GSD ja tõeline SD; glükosuuria raseduse ajal.
Ravi
Risk emale ja lootele, samuti lähenemisviisid diabeedi ravile ja selle kontrolli tunnused GDM-i ja tõelise diabeedi korral on samad. Diabeedi hilised tüsistused raseduse ajal võivad märkimisväärselt edeneda, kuid kvaliteetse diabeedi kompenseerimise korral puuduvad raseduse katkemise näidustused. Diabeediga (tavaliselt DM-1) naine peaks rasedust planeerima noores eas, kui tüsistuste risk on kõige väiksem. Kui rasedus on planeeritud, on soovitatav rasedus katkestada.
vastuvõtt paar kuud pärast optimaalse hüvitise saavutamist. Raseduse planeerimise vastunäidustused on raskekujuline nefropaatia koos progresseeruva neerupuudulikkusega, raske südame isheemiatõbi, raskekujuline proliferatiivne retinopaatia, mida ei saa korrigeerida, ketoatsidoos raseduse alguses (ketoonkehad on teratogeensed tegurid).
Ravi eesmärk GDM ja tõeline diabeet raseduse ajal on järgmiste laboriparameetrite saavutamine:
tühja kõhuga glükoos< 5-5,8 ммоль/л;
Glükeemia 1 tund pärast söömist< 7,8 ммоль/л;
Glükeemia 2 tundi pärast söömist< 6,7 ммоль/л;
Keskmine päevane glükeemiline profiil< 5,5 ммоль/л;
HbA1c tase kuukontrollis, nagu tervetel inimestel (4-6%).
DM-1-ga, nagu ka väljaspool rasedust, peaks naine saama intensiivset insuliinravi, kuid raseduse ajal soovitatakse glükeemia taset hinnata 7-8 korda päevas. Kui tavapäraste süstide taustal ei ole võimalik normoglükeemilist kompensatsiooni saavutada, tuleb kaaluda patsiendi üleviimist insuliinravile, kasutades insuliini dosaatorit.
Esimesel etapil GDM-i ravi on ette nähtud dieetteraapia, mis seisneb päevase kalorite tarbimise piiramises umbes 25 kcal / kg tegelikust kaalust, seda eelkõige kergesti seeditavate loomset päritolu süsivesikute ja rasvade tõttu, samuti kehalise aktiivsuse suurendamise tõttu. Kui dieetravi ei suuda ravi eesmärke saavutada, tuleb patsiendile määrata intensiivne insuliinravi. Kõik tabletid diabeedivastased ravimid (TSP) raseduse ajal vastunäidustatud. Umbes 15% naistest tuleb üle viia insuliinravile.
Prognoos
GDM ja DM ebarahuldava kompenseerimise korral raseduse ajal on lootel erinevate patoloogiate tekke tõenäosus 30% (risk on 12 korda suurem kui üldpopulatsioonis). Rohkem kui 50% naistest, kellel tekib raseduse ajal GDM, tekib CD-2 järgmise 15 aasta jooksul.
Diabeet- absoluutsest või suhtelisest insuliinipuudusest põhjustatud krooniline haigus, mis põhjustab igat tüüpi ainevahetuse, eeskätt süsivesikute ainevahetuse häireid, veresoonte kahjustusi (angiopaatiat) ning patoloogilisi muutusi erinevates organites ja kudedes.
Vastavalt WHO klassifikatsioonile (1999) on:
1) I tüüpi suhkurtõbi, mis väljendub absoluutse insuliinipuudusega (autoimmuunne ja idiopaatiline) pankrease saarekeste β-rakkude hävimises;
2) II tüüpi suhkurtõbi, mis põhineb muutustel β-rakkudes, mis põhjustab suhtelist insuliinipuudust ja insuliiniresistentsust;
3) muud spetsiifilised diabeeditüübid: P-rakkude funktsiooni geneetilised defektid; insuliini toime geneetilised defektid; immuunvahendatud diabeedi ebatavalised vormid;
4) rasedusdiabeet (rasedusdiabeet).
Elundite ja kudede muutused suhkurtõve korral
Pikaajaline hüperglükeemia aitab kaasa insuliiniresistentsuse tekkele ja kahjustab rakke (glükoosi toksilisuse nähtus), viib glükoosi transportervalkude ja β-rakkude sekretoorse aktiivsuse vähenemiseni. Kõik see vähendab süsivesikute kasutamist kudedes ja põhjustab muud tüüpi ainevahetuse rikkumist. Selle tulemusena tekib suhkurtõve korral erinevate elundite ja kudede progresseeruv kahjustus. Patsientidel tekivad tõsised muutused mitte ainult kõhunäärmes, vaid ka maksas, veresoontes, võrkkestas, neerudes, närvisüsteemis (diabeetiline angiopaatia, retinopaatia, nefropaatia, neuropaatia).
Diabeedi tõttu surnud patsientide kõhunääre on vähenenud, I tüüpi suhkurtõve korral - fibroosist tingitud tihe konsistents koos väljendunud atroofiliste muutustega lobulites. Kell mikroskoopiline uurimine nähtavad on haruldased väikesed Langerhansi saarekesed, millel on vähenenud degranuleerunud P-rakkude arv. II tüüpi diabeedi korral võib kõhunääre lipomatoosi tõttu suureneda, kuid lõikel on väikesed sagarad. Mõlemat tüüpi suhkurtõve kulgu määrab diabeetiline angiopaatia, seetõttu nimetatakse suhkurtõbe ka metaboolseks-veresoonkonna haiguseks. Just veresoonte kahjustuste tõttu on diabeet pimeduse põhjuste hulgas esikohal, neil patsientidel on 17 korda suurem tõenäosus neerukahjustuste tekkeks, 2-3 korda sagedamini - müokardiinfarkt ja insult, 5 korda sagedamini - alajäsemete gangreen. kui samaealistel.ja soost normoglükeemiliste näitajatega.
Diabeetilisele makroangiopaatiale on iseloomulik keskmise ja suure kaliibriga arterite kahjustus ning see esineb reeglina küpsetel ja vanadel inimestel ning seetõttu on see kõige enam väljendunud II tüüpi suhkurtõve korral. Selle ilminguteks on ateroskleroos, mis on tavaliselt rohkem väljendunud ja levinud kui mittediabeetikutel (suhkurtõbi on ateroskleroosi riskitegur) ning palju harvem Menckebergi mediaalne lupjumine ja difuusne intimafibroos. Suurte arterite kahjustuse tagajärjel areneb arvukalt alajäsemete nekroosi ja gangreeni. Diabeetiline mikroangiopaatia on üldistatud ja areneb igas vanuses patsientidel ning on märgitud selle otsest sõltuvust suhkurtõve kestusest. Mõjutatud on erinevate elundite ja kudede arterioolid ja kapillaarid, eriti sageli neerud, võrkkesta, nahk ja skeletilihased. Koos mittespetsiifiliste muutustega (plasma immutamine, veresoone seina hüalinoos, düstroofia, rakkude proliferatsioon ja atroofia) esineb ka suhkurtõvele iseloomulikku endoteeli voodri basaalmembraanide paksenemist PAS-positiivsete ainete kuhjumise tõttu ( peamiselt IV tüüpi kollageen).
Diabeetiline retinopaatia mõjutab peaaegu 100% enam kui 15 aastat diabeeti põdevatest inimestest. Lisaks selle silmapatoloogia aluseks olevatele diabeetilisele mikroangiopaatiale iseloomulikele morfoloogilistele muutustele tekivad võrkkesta kapillaarides ja veenulites mikroaneurüsmid ning perivaskulaarne turse, hemorraagia, nägemisnärvi düstroofsed ja atroofilised muutused. On olemas mitteproliferatiivne ehk lihtne diabeetiline retinopaatia ja proliferatiivne retinopaatia.
diabeetiline nefropaatia
Diabeediga patsientidel areneb neerudes diabeetiline intrakapillaarne glomeruloskleroos, mis põhjustab rasket nefrootilist sündroomi, mis sai nime autorite järgi, kes kirjeldasid seda esmakordselt Kimmelstiel-Wilsoni sündroomina. Samal ajal on neerud sümmeetriliselt vähendatud, peeneteralise pinnaga, tiheda konsistentsiga, mis on tingitud sidekoe kasvust (diabeetilised kõverad neerud).Mikroskoopiline uuring eristab järgmist tüüpi haigusele iseloomulikke glomerulaarmuutusi:
- nodulaarset (nodulaarset) glomeruloskleroosi täheldatakse 5–35% patsientidest ja see on spetsiifiline suhkurtõve suhtes. Seda iseloomustab mesangiaalsete rakkude paljunemine ja membraanitaolise aine tootmine koos homogeensete eosinofiilsete ja PAS-positiivsete ümarate moodustiste moodustumisega;
- difuusne glomeruloskleroos, mis kõige sagedamini areneb patsientidel ja väljendub kapillaaride basaalmembraanide hajusa paksenemisena, kaasneb glomerulaarse mesangiumi kasv;
- segatüüpi diabeetiline glomeruloskleroos.
Neerude glomerulite elektronmikroskoopiline uuring näitab mesangiumi suurenemist ja mesangiaalrakkude proliferatsiooni (interkapillaarne glomeruloskleroos), millega kaasneb kapillaaride basaalmembraanide hajus paksenemine.
Lisaks täheldatakse patsientidel hüalinoosi mitte ainult toomist, vaid erinevalt sellest hüpertensioon ja eferentsed glomerulaarsed arterioolid koos hüalinoosi ja suuremate arteriaalsete veresoonte skleroosiga. Tubulites täheldatakse epiteeli valgu (kuni vakuolaarset) ja rasva (nefrootilise sündroomi esinemise korral) degeneratsiooni. Proksimaalsetes tuubulites tuvastatakse primaarsest uriinist reabsorbeeritud glükoosi polümerisatsiooni tõttu epiteeli glükogeeni infiltratsioon.
Diabeetiline neuropaatia
Selle esinemissagedus on korrelatsioonis suhkurtõve kestuse ja raskusastmega. Patsientidel areneb aksiaalsete silindrite segmentaalne demüelinisatsioon, turse ja düstroofia, mis põhjustab impulsi juhtivuse kiiruse vähenemist piki närvikiude.Diabeediga patsientidel tekib sageli vitiliigo, ksantomatoos ja naha lipoidnekroos. Oluliselt suurenenud risk sapikivitõbi ainevahetushäirete ja sapipõie atoonia tõttu. Sekundaarse immuunpuudulikkuse tõttu liituvad sageli mädased tüsistused (püoderma, furunkuloos, bronhopneumoonia, sepsis), võivad areneda püelonefriit ja tuberkuloos. Kaasaegne ravi põhjustas suhkurtõvega patsientide eeldatava eluea olulise pikenemise. Sellega seoses on suhkurtõve surm seotud haiguse tüsistustega (müokardiinfarkt, tserebrovaskulaarne õnnetus, alajäsemete gangreen, neerupuudulikkus, sekundaarne infektsioon).
Makroskoopiliselt võib pankrease mahtu vähendada, kortsuda. Muutused selle eritussektsioonis on ebastabiilsed (atroofia, lipomatoos, tsüstiline degeneratsioon, hemorraagia jne) ja esinevad tavaliselt vanemas eas. Histoloogiliselt leitakse insuliinsõltuva suhkurtõve korral pankrease saarekeste lümfotsüütiline infiltratsioon (insuliit). Viimaseid leidub valdavalt nendel saarekestel, mis sisaldavad p-rakke. Haiguse kestuse pikenedes leitakse β-rakkude progresseeruv hävimine, nende fibroos ja atroofia, pseudoatroofsed saarekesed ilma β-rakkudeta. Täheldatakse pankrease saarekeste difuusset fibroosi (sagedamini koos insuliinsõltuva suhkurtõve ja teiste autoimmuunhaiguste kombinatsiooniga). Sageli täheldatakse saarekeste hüalinoosi ja hüaliini masside kogunemist rakkude vahele ja veresoonte ümber. Märgitakse P-rakkude regenereerimise koldeid (haiguse varases staadiumis), mis haiguse kestuse pikenemisega kaovad täielikult. Insuliinsõltumatu suhkurtõve korral täheldatakse β-rakkude arvu mõningast vähenemist. Mõnel juhul on saarekeste aparatuuri muutused seotud põhihaiguse olemusega (hemokromatoos, äge pankreatiit jne).
Morfoloogilised muutused teistes endokriinsetes näärmetes on muutlikud. Hüpofüüsi, kõrvalkilpnäärmete suurust saab vähendada. Mõnikord tekivad hüpofüüsis degeneratiivsed muutused koos eosinofiilsete ja mõnel juhul basofiilsete rakkude arvu vähenemisega. Munandites on võimalik spermatogeneesi vähenemine ja munasarjades - follikulaarse aparaadi atroofia. Sageli täheldatakse mikro- ja makroangiopaatiat. Mõnikord määratakse kopsudes tuberkuloosi muutused. Reeglina täheldatakse neeru parenhüümi glükogeeni infiltratsiooni. Mõnel juhul tuvastatakse nodulaarne glomeruloskleroos (kapillaarne glomeruloskleroos, Kimmelstiel-Wilsoni sündroom) ja diabeedile spetsiifiline tubulaarnefroosi. Neerudes võivad esineda muutused, mis on iseloomulikud difuussele ja eksudatiivsele glomeruloskleroosile, arterioskleroosile, püelonefriidile, nekrootilisele papilliidile, mida kombineeritakse suhkurtõvega sagedamini kui teiste haigustega. Nodulaarne glomeruloskleroos esineb ligikaudu 25% -l suhkurtõvega patsientidest (sagedamini insuliinsõltuva suhkurtõve korral) ja on korrelatsioonis selle kestusega. Nodulaarset glomeruloskleroosi iseloomustavad mikroaneurüsmid, mis on organiseeritud hüaliinseteks sõlmedeks (Kimmelstiel-Wilsoni sõlmed), mis paiknevad glomeruluse perifeerias või keskel ja kapillaaride alusmembraani paksenemine. Sõlmed (milles on märkimisväärne hulk mesangiaalraku tuumasid ja hüaliinmaatriksit) kitsendavad või ummistavad täielikult kapillaaride luumenit. Hajusa glomeruloskleroosiga (intrakapillaarne) täheldatakse glomerulite kõigi osakondade kapillaaride alusmembraani paksenemist, kapillaaride valendiku vähenemist ja nende oklusiooni. Tavaliselt leitakse kombinatsioon muutustest neerudes, mis on iseloomulik nii difuussele kui ka nodulaarsele glomeruloskleroosile. Arvatakse, et nodulaarsele glomeruloskleroosile võib eelneda difuusne glomeruloskleroos. Tubulaarse nefroosiga täheldatakse glükogeeni sisaldavate vakuoolide kogunemist epiteelirakkudesse, sagedamini proksimaalsetesse tuubulitesse ja PAS-positiivsete ainete (glükoproteiinid, neutraalsed mukopolüsahhariidid) ladestumist nende tsütoplasmaatilistesse membraanidesse. Tubulaarse nefroosi raskusaste korreleerub hüperglükeemiaga ja ei vasta tubulaarse düsfunktsiooni olemusele. Maks on sageli laienenud, läikiv, punakaskollane (rasvaga imbumise tõttu), sageli madala glükogeenisisaldusega. Mõnikord esineb maksatsirroos. Kesknärvisüsteemi ja teistesse organitesse on glükogeeni infiltratsioon.
Diabeetilise kooma tõttu surnute patoanatoomilisel uurimisel tuvastatakse lipomatoos, kõhunäärme põletikulised või nekrootilised muutused, maksa rasvkoe degeneratsioon, glomeruloskleroos, osteomalaatsia, seedetrakti verejooks, neerude suurenemine ja hüpereemia, mõnel juhul ka müokardiinfarkt, mesenteriaalsete veresoonte tromboos, kopsuemboolia, kopsupõletik. Märgitakse ajuturset, sageli ilma morfoloogiliste muutusteta selle koes.