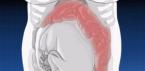
फार्मास्युटिकल तुल्यता
औषधीय उत्पाद औषधीय रूप से समकक्ष होते हैं यदि उनमें समान सक्रिय पदार्थ समान मात्रा में और समान खुराक के रूप में होते हैं, समान या समान मानकों की आवश्यकताओं को पूरा करते हैं, और सक्रिय पदार्थों की शक्ति या एकाग्रता में समान होते हैं। अक्सर, सक्रिय पदार्थ की समान सामग्री के बावजूद, जेनेरिक दवा मूल रूप से excipients की संरचना में भिन्न होती है।
समाधान के 5 मिलीलीटर के संदर्भ में मूल दवा विगैमॉक्स और जेनेरिक मोक्सीसिन की संरचना
- विगैमॉक्स (28)
- मोक्सीसिन (29)
सक्रिय संघटक ऑक्सीफ्लोक्सासिन हाइड्रोक्लोराइड 0.02725 ग्राम मोक्सीफ्लोक्सासिन हाइड्रोक्लोराइड 0.02725 ग्राम
परिरक्षक बेंजालकोनियम क्लोराइड
अन्य अंश सोडियम क्लोराइड सोडियम क्लोराइड
बोरिक एसिड
हाइड्रोक्लोरिक एसिड और/या सोडियम हाइड्रोक्साइड (पीएच समायोजन के लिए)
इंजेक्शन के लिए पानी
जेनेरिक मोक्सीफ्लोक्सासिन हाइड्रोक्लोराइड में एक संरक्षक होता है, मूल दवा विगैमॉक्स में एक संरक्षक नहीं होता है।
जैव समानता
दो औषधीय उत्पादों को जैव-समतुल्य माना जाता है यदि वे औषधीय रूप से समकक्ष हैं, समान जैवउपलब्धता है और, जब एक ही खुराक पर प्रशासित किया जाता है, तो वे पर्याप्त प्रभावकारिता और सुरक्षा प्रदान करने के समान होते हैं। जैवउपलब्धता से तात्पर्य दवा के सक्रिय संघटक या सक्रिय घटक के अवशोषण की दर और अनुपात से है, जो आवेदन के बिंदु पर कार्य करना शुरू कर देता है।
संक्षेप में, जैव समानता शरीर के तरल पदार्थ और ऊतकों में एकाग्रता के संदर्भ में मूल और सामान्य के अवशोषण की दर और डिग्री की समानता है। तुलनात्मक जैव समानता अध्ययन के परिणामों की विश्वसनीयता काफी हद तक अनुपालन (जीएमपी - अच्छा नैदानिक अभ्यास) पर निर्भर करती है और इसे स्वतंत्र, बहुकेंद्र, यादृच्छिक, नियंत्रित, दीर्घकालिक होना चाहिए।
यदि एक जेनेरिक को अन्य देशों में उपयोग के लिए अनुमोदित किया जाता है, तो यह रूसी संघ में एक सरलीकृत योजना (जैव समानता का निर्धारण किए बिना) के अनुसार पंजीकृत है। इस प्रकार, रूसी संघ में विदेशी जेनरिक का पंजीकरण करते समय, हम बड़े पैमाने पर दवा कंपनियों द्वारा प्रस्तुत किए गए डोजियर पर भरोसा करते हैं। कुछ मामलों में ऐसा "भोलापन" रोगियों के लिए महंगा है, क्योंकि। जेनरिक अपने फार्माकोकाइनेटिक गुणों के मामले में मूल दवा से मेल नहीं खा सकते हैं। मूल क्लैरिथ्रोमाइसिन के लिए जेनरिक की जैव समानता की नियंत्रण जांच के उदाहरण पर, सी.एन. नाइटिंगेल एट अल ने यूएसपी मानकों का उपयोग करते हुए जैव समानता के लिए मूल 40-कॉपी क्लैरिथ्रोमाइसिन उत्पाद की तुलना की। अध्ययन से पता चला है कि 70% जेनेरिक मूल दवा की तुलना में बहुत अधिक धीरे-धीरे घुलते हैं, जो उनके अवशोषण के लिए महत्वपूर्ण है। उत्पाद की एक इकाई में सक्रिय सिद्धांत की मात्रा के संदर्भ में 80% जेनरिक मूल से भिन्न होते हैं। अधिकांश नमूनों में सक्रिय सिद्धांत से संबंधित अशुद्धियों की मात्रा मूल से अधिक है। "सर्वश्रेष्ठ" जेनेरिक में वे 2% थे, "सबसे खराब" में - 32%। अशुद्धियों की उपस्थिति ने प्रतिकूल प्रतिक्रियाओं की गंभीरता को निर्धारित किया।
नेत्र रोग विशेषज्ञ एक समान स्थिति का सामना करते हैं। कांगडन एन.जी. एट अल (2001), एक यादृच्छिक डबल-ब्लाइंड अध्ययन के परिणामों के आधार पर, ब्रांडेड दवा प्राप्त करने वाले रोगियों की तुलना में जेनेरिक एनएसएआईडी - डाइक्लोफेनाक के स्थानीय उपयोग के संबंध में कंजाक्तिवा और कॉर्निया की जलन के मामलों की प्रबलता को स्थापित किया। .
1. चिकित्सा उपयोग के लिए औषधीय उत्पादों की विनिमेयता सरकार द्वारा स्थापित तरीके से निर्धारित की जाती है रूसी संघ, निम्नलिखित मापदंडों के आधार पर:
1) फार्मास्युटिकल पदार्थों की गुणात्मक और मात्रात्मक विशेषताओं की तुल्यता (बायोसिमिलर (बायोसिमिलर) औषधीय उत्पादों (बायोसिमिलर) - तुलनीयता) (विभिन्न लवण, एस्टर, कॉम्प्लेक्स, आइसोमर्स, क्रिस्टलीय रूपों और एक ही सक्रिय पदार्थ के अन्य डेरिवेटिव का उपयोग नहीं है) विनिमेयता औषधीय उत्पादों के लिए एक बाधा, यदि औषधीय उत्पाद की जैव-समतुल्यता के अध्ययन के दौरान या यदि औषधीय उत्पाद की चिकित्सीय तुल्यता के अध्ययन के दौरान इस अध्ययन का संचालन करना असंभव है, तो फार्माकोकाइनेटिक्स में नैदानिक रूप से महत्वपूर्ण अंतर की अनुपस्थिति और ( या) चिकित्सा उपयोग के लिए औषधीय उत्पाद की सुरक्षा और प्रभावकारिता साबित हुई है);
2) तुल्यता खुराक की अवस्था(समकक्ष खुराक रूपों का अर्थ विभिन्न खुराक रूपों के रूप में समझा जाता है जिनमें प्रशासन का एक ही मार्ग और प्रशासन की विधि होती है, तुलनीय फार्माकोकाइनेटिक विशेषताएं होती हैं और औषधीय क्रियाऔर वांछित नैदानिक प्रभाव की उपलब्धि भी सुनिश्चित करना। खुराक के रूपों में अंतर उनके विनिमेयता के लिए एक बाधा नहीं है, अगर औषधीय उत्पाद की जैव-समतुल्यता के अध्ययन के दौरान या यदि औषधीय उत्पाद की चिकित्सीय तुल्यता के अध्ययन के दौरान इस अध्ययन का संचालन करना असंभव है, तो नैदानिक रूप से महत्वपूर्ण अंतरों की अनुपस्थिति फार्माकोकाइनेटिक्स में और (या) चिकित्सा उपयोग के लिए औषधीय उत्पाद की सुरक्षा और प्रभावकारिता);
3) चिकित्सा उपयोग के लिए औषधीय उत्पाद के अंशों की संरचना की समानता या तुलना (चिकित्सा उपयोग के लिए औषधीय उत्पाद के excipients की संरचना में अंतर उनके विनिमेयता के लिए एक बाधा नहीं है, अगर औषधीय उत्पाद के जैव-समतुल्यता अध्ययन के दौरान) चिकित्सा उपयोग के लिए या यदि अध्ययन के दौरान चिकित्सा उपयोग के लिए औषधीय उत्पाद की चिकित्सीय तुल्यता के दौरान इस अध्ययन का संचालन करना असंभव है, तो फार्माकोकाइनेटिक्स में नैदानिक रूप से महत्वपूर्ण अंतर की अनुपस्थिति और (या) चिकित्सा उपयोग के लिए औषधीय उत्पाद की सुरक्षा और प्रभावकारिता की गई है। सिद्ध किया हुआ। विपरित प्रतिक्रियाएंरोगियों के कुछ समूहों में या उनकी घटना की आवृत्ति में वृद्धि);
4) प्रशासन और उपयोग की विधि की पहचान;
5) औषधीय उत्पाद की जैव-तुल्यता के अध्ययन के दौरान नैदानिक रूप से महत्वपूर्ण अंतर की अनुपस्थिति या, यदि यह अध्ययन करना असंभव है, तो चिकित्सीय तुल्यता के अध्ययन के दौरान औषधीय उत्पाद की सुरक्षा और प्रभावकारिता में नैदानिक रूप से महत्वपूर्ण अंतर का अभाव। . यह पैरामीटर इस संघीय कानून के अनुच्छेद 18 के भाग 10 में निर्दिष्ट जेनेरिक दवाओं पर लागू नहीं होता है। बायोसिमिलर (बायोसिमिलर) औषधीय उत्पादों (बायोसिमिलर) के संबंध में, परिणामों के आधार पर औषधीय उत्पाद की सुरक्षा, प्रभावकारिता और प्रतिरक्षण क्षमता में नैदानिक रूप से महत्वपूर्ण अंतर की अनुपस्थिति पर डेटा नैदानिक अनुसंधानइस भाग द्वारा निर्धारित तरीके से प्रदान की जाती हैं;
6) औषधीय उत्पाद के निर्माता का अच्छे विनिर्माण अभ्यास की आवश्यकताओं का अनुपालन।
2. चिकित्सा उपयोग के लिए पंजीकृत औषधीय उत्पादों के मापदंडों की तुलना एक विशेषज्ञ संस्थान के विशेषज्ञों के एक आयोग द्वारा उनके राज्य पंजीकरण की प्रक्रिया में ऐसे औषधीय उत्पादों की जांच के दौरान की जाती है। इस तुलना के परिणामस्वरूप किए गए चिकित्सा उपयोग के लिए औषधीय उत्पादों की विनिमेयता या गैर-विनिमेयता पर विशेषज्ञों के निष्कर्ष अधिकृत संघीय कार्यकारी निकाय द्वारा अनुमोदित रूप में विशेषज्ञ की राय के अनुलग्नक के रूप में तैयार किए गए हैं।
3. इस लेख के प्रावधान संदर्भ औषधीय उत्पादों, हर्बल औषधीय उत्पादों, होम्योपैथिक औषधीय उत्पादों और औषधीय उत्पादों पर लागू नहीं होते हैं जिन्हें बीस वर्षों से अधिक समय से रूसी संघ में चिकित्सा उपयोग के लिए अनुमोदित किया गया है और जिसके लिए एक का संचालन करना असंभव है जैव समानता अध्ययन।
विनिमेयता की समस्या दवाई (एलएस) वर्तमान में हमारे देश और विदेश दोनों में विभिन्न स्तरों पर काफी सक्रिय रूप से चर्चा की जा रही है। इसकी विशुद्ध रूप से चिकित्सीय और बल्कि प्रासंगिक आर्थिक पृष्ठभूमि दोनों है। यह ध्यान दिया जाना चाहिए कि हमारे देश में अभी भी विनिमेय दवाओं की कोई स्पष्ट परिभाषा नहीं है। इस अवधारणा की व्याख्या बहुत हद तक विभिन्न विशेषज्ञों की राय और दवाओं के उपयोग में उनके अनुभव पर निर्भर करती है। विशुद्ध रूप से चिकित्सीय समस्याओं और सरकारी अनुबंधों के तहत दवाओं की खरीद से संबंधित समस्याओं को हल करते समय इस शब्द के प्रति पूरी तरह से अलग रवैया उत्पन्न हो सकता है।
हालांकि, हम विनिमेयता समस्या के कुछ विशिष्ट पहलुओं पर ध्यान देंगे। चिकित्सीय दृष्टिकोण से, यह स्पष्ट है कि एक ही औषधीय समूह की दो अलग-अलग दवाएं (अर्थात, दो अलग-अलग सक्रिय पदार्थ युक्त) एक-दूसरे को प्रतिस्थापित कर सकती हैं, बशर्ते कि उनके पास, उदाहरण के लिए, क्रिया का एक ही तंत्र (जैसे, समान रिसेप्टर्स की नाकाबंदी) और यदि आवश्यक हो, तो खुराक और प्रशासन की आवृत्ति के लिए उपयुक्त समायोजन किया जाएगा। और इस अर्थ में, डॉक्टर के लिए ये दो दवाएं विनिमेय होंगी: अब एक बिक्री पर नहीं है, और वह दूसरे को लिख देगा। यह तथाकथित चिकित्सीय प्रतिस्थापन है, लेकिन यह विनिमेयता की अवधारणा के समान नहीं है। वर्तमान में, यह शब्द मूल दवा को एक जेनेरिक दवा से बदलने या एक जेनेरिक दवा को दूसरे के साथ उसी सक्रिय पदार्थ के साथ बदलने के लिए संदर्भित करता है। इसमें, कम से कम, पहले से ही एक निश्चित समझौता है। लेकिन किन मूल दवाओं और जेनरिक को विनिमेय माना जाना चाहिए और इस मुद्दे को हल करने के रास्ते में क्या समस्याएं आती हैं, हम इस लेख में चर्चा करेंगे।
पुनरुत्पादित दवाओं (जेनेरिक) की तुल्यता की समस्या काफी तीव्र है क्योंकि एक बड़ी संख्या मेंबाजार पर विभिन्न निर्माताओं से दवाएं। यह मुद्दा पूरे विश्व में प्रासंगिक है, लेकिन हमारे देश में पिछले दो दशकों में इसने विशेष महत्व हासिल कर लिया है, क्योंकि हम ड्रग्स के विशाल प्रवाह के लिए तैयार नहीं थे। हमारी नियामक प्रणाली, वैज्ञानिक आधार और सभी अवधारणाओं को दवाओं की कमी से पीड़ित बाजार के लिए अनुकूलित किया गया है। अब स्थिति नाटकीय रूप से बदल गई है। रूसी दवा बाजार बड़ी संख्या में दवाओं से संतृप्त है। कुछ सक्रिय पदार्थों (पैरासिटामोल, एसिटाइलसैलिसिलिक एसिड, सोडियम डाइक्लोफेनाक, मेटामिज़ोल सोडियम, एनालाप्रिल मैलेट, सिप्रोफ्लोक्सासिन हाइड्रोक्लोराइड, आदि) के लिए, विभिन्न निर्माताओं से कई सौ दवाओं को 10 साल पहले पंजीकृत किया गया था (विभिन्न खुराक रूपों और खुराक को ध्यान में रखते हुए)। अब संबंधित दवाओं की संख्या थोड़ी कम हो गई है, लेकिन यह किसी भी तरह से जेनरिक की समस्या को दूर नहीं करता है।
प्रश्न क्या है? आखिरकार, सामानों की अधिकता को प्रतिस्पर्धा में योगदान देना चाहिए, उत्पादों की गुणवत्ता में सुधार करके और उनकी लागत को कम करके ग्राहक के लिए संघर्ष। और यह इस जगह से है कि भविष्य में इस लेख में हम "उत्पाद" शब्द से बचने की कोशिश करेंगे, क्योंकि हम दवाओं के बारे में बात करेंगे, अर्थात। अद्वितीय गुणों वाले उत्पादों के बारे में, जिनके लिए प्राथमिक मानदंड गुणवत्ता, दक्षता और सुरक्षा हैं। बाकी सब कुछ एक परिणाम है - दवाओं की कीमत, और स्वास्थ्य जिसे हम आधुनिक आवश्यकताओं को पूरा नहीं करने वाली दवाओं का उपयोग करते समय खोने का जोखिम उठाते हैं।
दवाओं के लिए आवश्यकताएँ
दवाओं की अदला-बदली का आकलन करने के लिए दृष्टिकोणों की चर्चा शुरू करते हुए, यह इंटरनेशनल फेडरेशन ऑफ फार्मास्युटिकल फेडरेशन (एफआईपी, www.fip.org) और इंटरनेशनल फेडरेशन ऑफ फार्मास्युटिकल मैन्युफैक्चरर्स एंड एसोसिएशन (आईएफपीएमए) के संयुक्त बयान के एक अंश का हवाला देने लायक है। www.ifpma.org), जिसे 1999 में अपनाया गया था, जिसमें विशेष रूप से कहा गया है कि मूल दवा को जेनेरिक दवा से बदलने पर "केवल तभी किया जाना चाहिए जब जैव-समतुल्यता सहित स्वीकृत अंतर्राष्ट्रीय मानकों का अनुपालन किया जाए। बाजार में उपलब्ध सभी दवाओं की गुणवत्ता की गारंटी"।
वही दस्तावेज़ कहता है: “सभी सरकारों को स्वीकृत अंतरराष्ट्रीय मानकों के अनुसार अपने-अपने देशों में उपलब्ध सभी दवाओं की गुणवत्ता, सुरक्षा और प्रभावकारिता सुनिश्चित करने के लिए कदम उठाने चाहिए। यह मूल और जेनेरिक दवाओं, निजी और सार्वजनिक क्षेत्रों और आयातित और स्थानीय रूप से उत्पादित उत्पादों दोनों पर लागू होता है।
इस प्रकार, किसी भी दवा के लिए तीन आवश्यकताएं होती हैं: दक्षता, सुरक्षा और गुणवत्ता। दवाओं के मूल्यांकन के लिए यह दृष्टिकोण वर्तमान में पूरी दुनिया में स्वीकार किया जाता है, सहित। और हमारे देश में।
"प्रभावकारिता" और "सुरक्षा" श्रेणियां बायोमेडिकल मुद्दों को संदर्भित करती हैं, जबकि "गुणवत्ता" एक विशुद्ध रूप से फार्मास्युटिकल समस्या है और प्रामाणिकता (यानी, पैकेज की सामग्री की पहचान) के संदर्भ में नियामक दस्तावेजों की आवश्यकताओं के साथ दवाओं के अनुपालन को दर्शाती है। ), शुद्धता (अशुद्धियों की सामग्री द्वारा) और सक्रिय पदार्थ की मात्रात्मक सामग्री (या संयुक्त तैयारी के मामले में पदार्थ)। गुड मैन्युफैक्चरिंग प्रैक्टिस (जीएमपी) के नियम गुणवत्ता आश्वासन और दवाओं के नियंत्रण से अटूट रूप से जुड़े हुए हैं।
मूल और पुनरुत्पादित दवाएं। मूल शर्तें
दवाओं के विनिमेयता के मुद्दों पर चर्चा करते समय, मुख्य शर्तों को परिभाषित करना आवश्यक है। संघीय कानून संख्या 61-एफजेड "दवाओं के संचलन पर" निम्नलिखित परिभाषा प्रदान करता है: एक मूल दवा एक दवा है जिसमें पहली बार प्राप्त एक दवा पदार्थ होता है या फार्मास्युटिकल पदार्थों का एक नया संयोजन होता है, जिसकी प्रभावशीलता और सुरक्षा होती है दवाओं के प्रीक्लिनिकल अध्ययन और दवाओं के नैदानिक परीक्षणों के परिणामों की पुष्टि की। विदेशी साहित्य में, आप संबंधित शब्द "इनोवेटर उत्पाद", "ब्रांडेड उत्पाद" पा सकते हैं। डब्ल्यूएचओ के दस्तावेजों में, "इनोवेटर फार्मास्युटिकल उत्पाद" एक ऐसा उत्पाद है जिसे पहली बार इसकी गुणवत्ता, सुरक्षा और प्रभावकारिता के दस्तावेज़ीकरण के आधार पर उपयोग के लिए अनुमोदित किया गया है।
मूल दवा विकसित करने वाले संगठन को इसके लिए लंबी अवधि (20 वर्ष या उससे अधिक तक) के लिए पेटेंट संरक्षण प्राप्त होता है, जो क्षतिपूर्ति की अनुमति देता है ऊंची कीमतेंउपकरण के विकास और बाजार पर इसके प्रचार के साथ-साथ अतिरिक्त आय प्राप्त करने के लिए। पेटेंट संरक्षण के दौरान मूल दवाओं की उच्च लागत होती है और समाप्त होने के बाद जेनरिक की तुलना में अधिक लागत होती है।
यह परिस्थिति लगातार आलोचना का कारण बनती है। यह तर्क दिया जाता है कि एक नई दवा (यानी, एक नया अणु) के विकास के लिए अग्रणी निर्माताओं द्वारा घोषित लागत स्पष्ट रूप से अधिक है, साथ ही पेटेंट की समाप्ति के बाद मूल उत्पादों की लागत भी है।
लेकिन यह मत भूलो कि, सबसे पहले, आधुनिक दवाओं में दवाओं की तुलना में कार्रवाई के अधिक सूक्ष्म, लक्षित, चयनात्मक तंत्र होते हैं, उदाहरण के लिए, उसी से औषधीय समूहलेकिन कई दशक पहले विकसित हुआ। इसलिए, सक्रिय पदार्थों की आधुनिक स्क्रीनिंग के साथ भी, जो कुछ मामलों में एक नए सक्रिय अणु के लिए खोज समय को काफी कम कर सकता है, खोज अवधि, उपयोग की जाने वाली आधुनिक उच्च प्रौद्योगिकियों की लागत से गुणा, महत्वपूर्ण वित्तीय लागतों में बदल जाती है।
दूसरे, हम यह दोहराते नहीं थकेंगे कि फार्मास्युटिकल उद्योग के विकास के पीछे मुख्य प्रेरक शक्ति नवीन दवाओं के निर्माता हैं। यह याद रखना चाहिए कि मूल दवाओं की बिक्री से प्राप्त लाभ अंततः नवीन दवाओं के विकास के लिए निर्देशित होता है।
जेनेरिक दवा - एक दवा जिसमें एक ही दवा पदार्थ या मूल दवा के समान खुराक के रूप में एक ही फार्मास्युटिकल पदार्थों का संयोजन होता है, और मूल दवा के प्रचलन में आने के बाद प्रचलन में आ जाता है। पुनरुत्पादित दवाओं के संबंध में, "जेनेरिक" या "जेनेरिक" (जेनेरिक उत्पाद) शब्द का भी प्रयोग किया जाता है।
यह ध्यान दिया जाना चाहिए कि विभिन्न देशों में "जेनेरिक" शब्द की अलग-अलग व्याख्या के कारण डब्ल्यूएचओ दस्तावेजों (www.who.int) में, "मल्टीसोर्स फ़ार्मास्युटिकल उत्पादों" शब्द का उपयोग करने की अनुशंसा की जाती है। डब्ल्यूएचओ उन्हें फ़ार्मास्यूटिकल रूप से समकक्ष या फ़ार्मास्युटिकल रूप से वैकल्पिक दवाओं के रूप में परिभाषित करता है जो चिकित्सीय रूप से समकक्ष हो भी सकते हैं और नहीं भी। शब्द "मल्टीसोर्स", हालांकि घरेलू शब्दावली में बहुत ही शानदार और सह-अस्तित्व में नहीं है, लेकिन इस समझ को ठोस बनाता है कि पुनरुत्पादित दवाएं फार्मास्यूटिकल पदार्थों और बहुत अलग मूल के excipients से उत्पन्न होती हैं। यही है, उन्हें एक डिजाइनर के रूप में इकट्ठा किया जाता है - विभिन्न निर्माताओं के भागों से। चूंकि, सैद्धांतिक रूप से, आपूर्तिकर्ता आसानी से बदल सकते हैं, यह पहले से ही मूल दवाओं के निर्माताओं की आलोचना का एक कारण है। वास्तव में, इस तरह का दृष्टिकोण आम तौर पर समान गुणवत्ता सुनिश्चित करने के साथ-साथ दक्षता और सुरक्षा आवश्यकताओं के अनुपालन को सुनिश्चित करना मुश्किल बनाता है।
इस संबंध में, जेनेरिक की परिभाषा दिलचस्प है, जो यूरोपीय संसद के निर्देश 2001/83 / ईसी में दी गई है, जो दवाओं की आवश्यकताओं को निर्धारित करती है: जेनेरिक औषधीय उत्पाद(जेनेरिक औषधीय उत्पाद) का अर्थ एक ऐसा औषधीय उत्पाद है जिसमें सक्रिय पदार्थ के संबंध में समान गुणात्मक और मात्रात्मक संरचना होती है और संदर्भ दवा के समान खुराक का रूप होता है, और जिसकी जैवउपलब्धता को संदर्भ दवा के संबंध में जैवउपलब्धता अध्ययनों से सिद्ध किया गया है। यही है, यूरोपीय संघ के देश सैद्धांतिक रूप से जैव-समतुल्यता समस्याओं के साथ जेनरिक के बाजार में उपस्थिति की अनुमति नहीं देते हैं, हालांकि, निश्चित रूप से, यह संबंधित समस्या को बिल्कुल भी बाहर नहीं करता है।
डब्ल्यूएचओ की परिभाषा के अनुसार, औषधीय उत्पाद औषधीय रूप से समकक्ष होते हैं यदि उनमें एक ही खुराक के रूप में एक ही सक्रिय पदार्थ (पदार्थ) की समान मात्रा होती है, तुलनीय गुणवत्ता मानकों को पूरा करते हैं और प्रशासन के एक ही मार्ग के लिए अभिप्रेत हैं। यूएस एफडीए (www.fda.gov) द्वारा एक समान, लेकिन अधिक विशिष्ट और व्यावहारिक परिभाषा दी गई है: दवाओं को फार्मास्युटिकल रूप से समकक्ष माना जाता है यदि उनमें (1) समान सक्रिय तत्व (2) समान खुराक या एकाग्रता के साथ हों (3) एक ही दवा के रूप में, (4) प्रशासन के एक ही मार्ग के लिए अभिप्रेत है, और (5) मात्रात्मक सामग्री, शुद्धता और पहचान के लिए फार्माकोपियल या अन्य लागू मानकों को पूरा करता है।
डब्ल्यूएचओ इंगित करता है कि औषधीय उत्पाद फार्मास्यूटिकल विकल्प होते हैं यदि उनमें समान सक्रिय सिद्धांत की समान मात्रा होती है, लेकिन खुराक के रूप में भिन्न होती है (उदाहरण के लिए, टैबलेट और कैप्सूल) और/या रासायनिक रूप में (विभिन्न लवण, एस्टर)। फार्मास्युटिकल विकल्प प्रशासन के एकल मार्ग के लिए डिज़ाइन किए गए हैं। फार्मास्युटिकल वैकल्पिक दवाओं की परिभाषा में, FDA का दृष्टिकोण लगभग समान है।
यह ध्यान दिया जाना चाहिए कि साहित्य में वर्तमान समय तक, इंटरनेट पर, मौखिक भाषण में, कोई भी "दवा पर्यायवाची", "दवा एनालॉग्स", "दवा के विकल्प" आदि शब्दों का ढीला उपयोग पा सकता है। हम उपरोक्त दृष्टिकोणों के अनुरूप संदर्भ के स्पष्ट संकेत के बिना इस शब्दावली का उपयोग करने के खिलाफ विशेषज्ञों को चेतावनी देना चाहते हैं।
उदाहरण के लिए, जेनेरिक के संबंध में "दवा पर्यायवाची" शब्द का गलत उपयोग जारी है। यह कम से कम कुछ हद तक उचित होगा यदि चिकित्सीय तुल्यता, विनिमेयता की कोई समस्या नहीं थी। इसलिए, दवाओं के विभिन्न व्यापारिक नाम पर्यायवाची नहीं हो सकते। लेकिन पदार्थों के लिए यह हो सकता है, उदाहरण के लिए: एक अंतरराष्ट्रीय के रूप में मेटामिज़ोल सोडियम वर्ग नाम(आईएनएन) और घरेलू फार्माकोपियल नाम के रूप में एनलगिन, आईएनएन के रूप में पेरासिटामोल और यूएस नाम (यूएसएएन) के रूप में एसिटामिनोफेन।
जेनरिक की जैव समानता
एक ही सक्रिय संघटक, खुराक, खुराक का रूप और प्रशासन का मार्ग विभिन्न निर्माताओं से दवाओं को एक साथ लाता है, लेकिन इसका मतलब यह नहीं है कि जेनरिक की प्रभावशीलता भी समान होगी, क्योंकि सक्रिय पदार्थ (उदाहरण के लिए, बहुरूपता) के गुणवत्ता मापदंडों में अंतर, excipients की संरचना में और / या निर्माण प्रक्रिया में इन दवाओं की प्रभावशीलता में अंतर हो सकता है। यह तथ्य लंबे समय से ज्ञात है और पिछली शताब्दी के मध्य से चर्चा की गई है।
एक छोटे से विषयांतर के रूप में, हम ध्यान दें कि जेनरिक की प्रभावशीलता और सुरक्षा पर अशुद्धियों के प्रभाव के मुद्दे पर अक्सर चर्चा की जाती है। इस अवसर पर, यह कहा जा सकता है कि यदि दवाओं के लिए एकीकृत राज्य फार्माकोपियल गुणवत्ता मानक में निर्धारित शुद्धता मानकों का पालन किया जाता है, तो आम तौर पर अशुद्धियों के प्रभाव का मुद्दा दूर हो जाता है। एक और बात यह है कि जब ऐसा गुणवत्ता मानक (यानी, स्टेट फार्माकोपिया) वास्तव में अपने पूर्ण रूप में मौजूद नहीं है, और निर्माताओं (एफएसपी और एनडी) के मौजूदा नियामक दस्तावेज बहुत विविध हैं। इस मामले में, अशुद्धियों के साथ-साथ अन्य गुणवत्ता मानकों का सवाल खुला रहता है, जिसका दवाओं की प्रभावकारिता और सुरक्षा पर अप्रत्यक्ष प्रभाव पड़ता है।
तो, जेनरिक की विविधता के संबंध में, जैविक तुल्यता की अवधारणा उत्पन्न हुई। डब्ल्यूएचओ के दस्तावेजों के अनुसार, दो औषधीय उत्पाद जैव-समतुल्य हैं यदि वे औषधीय रूप से समकक्ष या औषधीय रूप से वैकल्पिक हैं, और अधिकतम प्लाज्मा सांद्रता (सीएमएक्स) के संदर्भ में उनकी जैव उपलब्धता, इस एकाग्रता (टीएमएक्स) तक पहुंचने का समय और फार्माकोकाइनेटिक वक्र (एयूसी) के बाद का क्षेत्र। समान परिस्थितियों में एक ही दाढ़ की खुराक पर आवेदन इस हद तक समान होते हैं कि उनके प्रभाव अनिवार्य रूप से समान होते हैं। यूरोपीय मेडिसिन एजेंसी (ईएमए, www.ema.europa.eu) और एफडीए द्वारा लगभग यही दृष्टिकोण अपनाया जाता है।
डब्ल्यूएचओ और एफडीए अनुशंसा करते हैं कि विवो और इन विट्रो परीक्षणों में निम्नलिखित का उपयोग करके जैव समानता निर्धारित की जाए:
- मनुष्यों में तुलनात्मक फार्माकोकाइनेटिक परीक्षण (जैविक तरल पदार्थों में दवा या इसके चयापचयों की एकाग्रता प्रोफ़ाइल का अध्ययन);
- मनुष्यों में तुलनात्मक फार्माकोडायनामिक परीक्षण (दवाओं के कारण होने वाले प्रभावों का अध्ययन);
- तुलनात्मक नैदानिक परीक्षण;
- इन विट्रो में तुलनात्मक अध्ययन (उदाहरण के लिए, "विघटन" परीक्षण)।
"तुलनात्मक" शब्द का अर्थ है कि उपरोक्त सभी अध्ययन परीक्षण उत्पाद और तुलनित्र दवा में प्रासंगिक मापदंडों की तुलना करके किए जाते हैं।
डब्ल्यूएचओ आवश्यक दवाओं के लिए एक तुलनित्र चुनने के लिए दिशानिर्देश प्रकाशित करता है। इन सिफारिशों में, विशेष रूप से, प्रत्येक आईएनएन के लिए प्रवर्तक दवा का ब्रांड नाम शामिल है, जिसे जेनरिक की विनिमेयता स्थापित करते समय एक तुलनित्र के रूप में उपयोग करने की सिफारिश की जाती है। यह उचित खुराक के रूप और खुराक भी प्रदान करता है।
संयुक्त राज्य अमेरिका में, एक तुलनित्र दवा का चुनाव तथाकथित ऑरेंज बुक में प्रस्तुत आंकड़ों पर आधारित है, जिसके बारे में हम नीचे चर्चा करेंगे। यह एक विशिष्ट खुराक के रूप में एक विशिष्ट दवा, एक विशिष्ट खुराक और एक विशिष्ट निर्माता का संकेत भी देता है। जिन दवाओं का उपयोग जेनेरिक दवाओं से उनकी तुलना करने के लिए किया जा सकता है, उन्हें उपयुक्त कॉलम में चिह्नित किया गया है। घरेलू दस्तावेज भी हैं, जो फार्माकोकाइनेटिक अध्ययन करने और दवाओं की जैव समानता का आकलन करने के लिए "विघटन" परीक्षण करने के निर्देश प्रदान करता है।
चिकित्सीय तुल्यता और विनिमेयता
अंत में, सबसे महत्वपूर्ण अवधारणा चिकित्सीय तुल्यता है। महत्वपूर्ण है, क्योंकि यह समझने के सबसे करीब है कि किन दवाओं को आपस में बदला जा सकता है। वास्तव में, डब्ल्यूएचओ की परिभाषा के अनुसार, एक विनिमेय दवा एक ऐसी दवा है जो तुलनात्मक दवा की तुलना में चिकित्सीय रूप से समकक्ष होती है और जिसके लिए तुलनित्र दवा को प्रतिस्थापित किया जा सकता है क्लिनिकल अभ्यास. एफडीए दस्तावेजों में भी यही स्थिति परिलक्षित होती है।
हम एक ऐसा दृष्टिकोण भी अपनाएंगे जहां चिकित्सीय रूप से समकक्ष दवाएं अदला-बदली की जा सकती हैं। यह केवल इस प्रश्न को हल करने के लिए बनी हुई है: किन दवाओं को चिकित्सीय रूप से समकक्ष माना जाता है?
चिकित्सीय तुल्यता के लिए मानदंड
आइए डब्ल्यूएचओ की परिभाषा के साथ शुरू करें: "दो औषधीय उत्पाद चिकित्सीय रूप से समकक्ष हैं यदि वे औषधीय रूप से समकक्ष या औषधीय रूप से वैकल्पिक हैं और, एक ही दाढ़ की खुराक में उनके उपयोग के बाद, उनकी प्रभावकारिता और सुरक्षा अनिवार्य रूप से समान होती है जब उनका उपयोग उसी तरह से किया जाता है। निर्देशों में वर्णित शर्तें"।
अब यहां एफडीए द्वारा दी गई चिकित्सीय तुल्यता की परिभाषा दी गई है: "दवाओं को चिकित्सीय रूप से समकक्ष माना जाता है, यदि वे औषधीय रूप से समकक्ष हैं और समान नैदानिक प्रभाव और सुरक्षा प्रोफ़ाइल हैं, और जब उनका उपयोग निर्देशों में वर्णित शर्तों के तहत किया जाता है"। अर्थात्, WHO के विपरीत, FDA केवल औषधीय रूप से समकक्ष दवाओं को चिकित्सीय समकक्ष के रूप में मानता है। इस प्रकार, एफडीए के दृष्टिकोण से, कैप्सूल और टैबलेट, उदाहरण के लिए, एक ही खुराक में भी, चिकित्सीय रूप से समकक्ष नहीं होंगे। इसके अलावा, एफडीए, एक सामान्य परिभाषा के बाद, चिकित्सीय तुल्यता के लिए सभी शर्तों का विशेष रूप से वर्णन करता है।
1. दवाओं को प्रभावी और सुरक्षित उपयोग के लिए अनुमोदित किया जाना चाहिए।
2. तैयारी औषधीय रूप से समकक्ष होनी चाहिए।
3. तैयारी जैव-समतुल्य होनी चाहिए, अर्थात। शर्तों को पूरा करना होगा:
- उनके पास कोई ज्ञात या संभावित जैव-समतुल्यता समस्या नहीं है और इन विट्रो में परीक्षण किए जाने पर प्रासंगिक मानक की आवश्यकताओं को पूरा करते हैं, या
- वे जानते हैं कि उनके पास संभावित जैव-समतुल्यता समस्याएं हैं या हो सकती हैं, लेकिन एक उपयुक्त जैव-समतुल्यता मानक की आवश्यकताओं को पूरा करने के लिए दिखाया गया है।
4. तैयारी में उचित निर्देश होने चाहिए।
5. उत्पादों का निर्माण गुड मैन्युफैक्चरिंग प्रैक्टिस (यानी जीएमपी) की आवश्यकताओं के अनुसार किया जाना चाहिए।
एफडीए आधिकारिक तौर पर "चिकित्सीय समकक्ष मूल्यांकन के साथ स्वीकृत दवा उत्पाद" शीर्षक से एक महत्वपूर्ण दस्तावेज जारी करता है, जिसका मोटे तौर पर "चिकित्सीय समकक्ष मूल्यांकन के साथ स्वीकृत दवा उत्पाद" के रूप में अनुवाद किया जा सकता है। संक्षेप में, इस दस्तावेज़ को ऑरेंज बुक कहा जाता है।
वास्तव में, विशिष्ट निर्माताओं से दवाओं की चिकित्सीय तुल्यता का आकलन करने के लिए उपरोक्त दृष्टिकोण इस प्रकाशन में एफडीए द्वारा परिलक्षित होते हैं। FDA विशेषज्ञों का कहना है कि उपयुक्त चिकित्सीय तुल्यता कोड का उपयोग एक दवा को दूसरे के साथ बदलने और विशेष रूप से उपचार की लागत को कम करने में मदद करते समय एक मार्गदर्शक के रूप में काम कर सकता है। यह भी याद रखना चाहिए कि एफडीए ऑरेंज बुक का मुख्य मूल्य यह है कि इसका एक इलेक्ट्रॉनिक संस्करण है और इसे दैनिक रूप से अपडेट किया जाता है।
यह ध्यान दिया जाना चाहिए कि वर्तमान में, घरेलू शब्दावली में, एक ऐसी स्थिति विकसित हो गई है जब जैव-समतुल्यता परीक्षण का अर्थ केवल एकाग्रता प्रोफ़ाइल का अध्ययन है। औषधीय पदार्थ, अर्थात। फार्माकोकाइनेटिक अध्ययन। और घरेलू विशेषज्ञों का मानना है कि जैव-समतुल्यता और चिकित्सीय तुल्यता की बराबरी नहीं की जा सकती है, क्योंकि बाद की पुष्टि केवल प्रोटोकॉल के अनुसार पूर्ण नैदानिक परीक्षण करके की जा सकती है। विदेशी दस्तावेज़ीकरण इन अवधारणाओं की पहचान को दर्शाता है या सीधे इंगित करता है। इसलिए, एफडीए ऑरेंज बुक में, चिकित्सीय तुल्यता चिह्न के आधार पर रखा जा सकता है सकारात्मक परिणामफार्माकोकाइनेटिक दृष्टिकोण द्वारा जैव समानता का अध्ययन करते समय। ज्यादातर मामलों में इस तरह के अध्ययनों की आत्मनिर्भरता इस तथ्य के कारण है कि रक्त प्लाज्मा में दवा पदार्थ की एकाग्रता प्रोफ़ाइल कार्रवाई की साइट से मेल खाती है।
एफडीए के कुछ चिकित्सीय तुल्यता मानदंडों की भी नीचे चर्चा की गई है। लेकिन सामान्य तौर पर, हम मानते हैं कि ड्रग इंटरचेंजबिलिटी की समस्या को हल करने के लिए FDA का दृष्टिकोण काफी उचित और सबसे विकसित है। लेकिन उपरोक्त सभी शर्तों को अनिवार्य रूप से पूरा करने के साथ। हम इस बात पर जोर देते हैं कि यदि "गुणवत्ता" की दिशा में समस्या हल हो जाती है, तो चिकित्सीय तुल्यता के कोड "प्रभावकारिता" और "सुरक्षा" की दिशा में एक मार्गदर्शक के रूप में काम कर सकते हैं।
चिकित्सीय तुल्यता और जीएमपी
दवाओं की चिकित्सीय तुल्यता (अर्थात, विनिमेयता) के लिए मानदंड स्थापित करके, FDA जीएमपी आवश्यकताओं का अनुपालन करने के लिए उनके उत्पादन की आवश्यकता को इंगित करता है। यह निश्चित रूप से बहुत महत्वपूर्ण है। वास्तव में, यदि दवाओं का उत्पादन जीएमपी मानकों के अनुसार नहीं किया जाता है, तो वे एक बैच से दूसरे बैच में सजातीय नहीं हो सकते हैं। और यह दवा के सभी मापदंडों को प्रभावित करता है: गुणवत्ता, प्रभावकारिता और सुरक्षा। इसलिए, ऐसे उत्पादों की एक श्रृंखला के लिए सिद्ध चिकित्सीय तुल्यता का मतलब यह बिल्कुल भी नहीं है कि भविष्य में सभी उत्पाद आवश्यक जैव-समतुल्यता मानकों को पूरा करेंगे।
साथ ही, यह समझना चाहिए कि राज्य नियंत्रणगुणवत्ता समग्र रूप से समस्या का समाधान नहीं करती है, भले ही यह सभी निर्मित और आयातित दवाओं के लिए किया जा सकता है। इसलिए, वर्तमान में, पूरी दुनिया में और हमारे देश में हम बात कर रहे हेदवा गुणवत्ता नियंत्रण से गुणवत्ता आश्वासन पर ध्यान केंद्रित करने पर। इससे पहले, हमने बार-बार बताया है कि निर्माता के पास उत्पादन में उच्च गुणवत्ता वाली दवाएं होती हैं, जब उन्हें उत्पादन प्रक्रिया में प्राप्त किया जाता है, न कि इसलिए कि कम गुणवत्ता वाली दवाएं अच्छी तरह से खारिज कर दी जाती हैं। इस सिद्धांत के बाद जीएमपी आवश्यकताओं (और इससे भी अधिक) के साथ उद्यम का पूर्ण अनुपालन, अधिकृत व्यक्तियों की संस्था की शुरूआत, विशेष रूप से योग्य कर्मियों की भागीदारी, विशेषज्ञों (प्रौद्योगिकीविदों, विश्लेषकों, आदि) की तीव्र कमी को कम करना शामिल है। , और भी बहुत कुछ।
यहां हम यह भी जोड़ते हैं कि दवा की गुणवत्ता सुनिश्चित करने में निर्माता के स्वयं के अनुसंधान और विकास संसाधन महत्वपूर्ण भूमिका निभाते हैं। और जितना अधिक ये संसाधन विकसित होते हैं और उत्पादन, नियंत्रण और गुणवत्ता आश्वासन विभागों के साथ अधिक निकटता से बातचीत करते हैं, उतना ही आप संबंधित उत्पादों की गुणवत्ता के बारे में सुनिश्चित हो सकते हैं।
अनुसंधान के बिना तुल्यता स्थापित करना
प्रारंभिक स्थिति यह है कि यदि दवा का इरादा है प्रणालीगत उपयोग(दवा पदार्थ प्रणालीगत परिसंचरण में निर्धारित होता है), फिर फार्माकोकाइनेटिक जैव-समानता अध्ययन आवश्यक हैं। यदि दवा का प्रभाव दिखने के कारण नहीं है सक्रिय पदार्थप्रणालीगत परिसंचरण में या उपलब्ध विश्लेषणात्मक तरीकों से इसे निर्धारित करना मुश्किल है, फिर फार्माकोडायनामिक या यहां तक कि पूर्ण नैदानिक अध्ययन की आवश्यकता है।
लेकिन सवाल तुलना करने का उठता है, उदाहरण के लिए, इंजेक्शन योग्य। यदि ये तैयार समाधान हैं जो औषधीय रूप से समकक्ष दवाएं हैं और अंतःशिरा प्रशासन के लिए अभिप्रेत हैं, तो उनकी चिकित्सीय तुल्यता कैसे स्थापित की जाए और क्या यह बिल्कुल किया जाना चाहिए?
डब्ल्यूएचओ के अनुसार, निम्नलिखित मामलों में अतिरिक्त अध्ययन के बिना जेनेरिक दवाओं को चिकित्सीय रूप से समकक्ष माना जा सकता है।
1. औषधीय उत्पाद पैरेंट्रल (अंतःशिरा, चमड़े के नीचे या इंट्रामस्क्युलर) प्रशासन के लिए अभिप्रेत हैं और एक ही दाढ़ एकाग्रता में एक ही सक्रिय पदार्थ के जलीय घोल हैं, और लगभग समान सांद्रता में समान या समान अंश भी होते हैं। कुछ एक्सीसिएंट्स (जैसे बफरिंग एजेंट, प्रिजर्वेटिव और एंटीऑक्सिडेंट) निम्न स्थिति में भिन्न हो सकते हैं: यदि यह दिखाया जा सकता है कि यह औषधीय उत्पाद की सुरक्षा और / या प्रभावकारिता को प्रभावित नहीं करता है।
2. दवाएं समाधान हैं मौखिक प्रशासन(जैसे सिरप, अमृत, टिंचर) जिसमें समान दाढ़ सांद्रता में समान सक्रिय पदार्थ होते हैं और अनिवार्य रूप से तुलनीय सांद्रता में समान अंश होते हैं। इस मामले में, उन excipients के विचार पर पूरा ध्यान दिया जाना चाहिए जो जठरांत्र संबंधी मार्ग में सक्रिय पदार्थ के अवशोषण और स्थिरता को प्रभावित करते हैं।
3. औषधीय उत्पाद समाधान तैयार करने के लिए पाउडर हैं, और परिणामी समाधान अंक 1 या 2 में निर्दिष्ट मानदंडों को पूरा करना चाहिए।
4. दवाएं गैसें हैं।
5. कान और आंख की दवाएं जो हैं जलीय समाधानऔर समान दाढ़ सांद्रता में समान सक्रिय पदार्थ और तुलनीय सांद्रता में अनिवार्य रूप से समान अंश होते हैं। कुछ अंश (जैसे संरक्षक, बफरिंग एजेंट, आसमाटिक और चिपचिपापन सुधारक) भिन्न हो सकते हैं, बशर्ते कि उनके उपयोग से उत्पाद की सुरक्षा और/या प्रभावकारिता प्रभावित न हो।
6. दवाओं के लिए स्थानीय आवेदन, जो जलीय घोल होते हैं और समान दाढ़ सांद्रता में समान सक्रिय पदार्थ (पदार्थ) होते हैं और अनिवार्य रूप से तुलनीय सांद्रता में समान अंश होते हैं।
7. औषधीय उत्पाद जो एक नेबुलाइज़र में इनहेलेशन के रूप में या नाक स्प्रे के रूप में उपयोग के लिए जलीय घोल हैं, जो अनिवार्य रूप से समान उपकरणों का उपयोग करने के लिए अभिप्रेत हैं और समान सांद्रता में समान सक्रिय पदार्थ (पदार्थ) होते हैं और अनिवार्य रूप से तुलनीय सांद्रता में समान अंश होते हैं। . औषधीय तैयारी में विभिन्न अंश हो सकते हैं, बशर्ते कि उनके उपयोग से तैयारी की सुरक्षा और/या प्रभावकारिता प्रभावित न हो।
इस प्रकार, उपरोक्त स्थितियां उपयुक्त शोध की आवश्यकता को दूर करती हैं। और इन मामलों में रचना में भिन्न अंशों के प्रभाव की अनुपस्थिति, आवेदक को, स्पष्ट रूप से, अतिरिक्त जानकारी प्रदान करके प्रदर्शित करना चाहिए। सामान्य तौर पर, किसी को यह समझना चाहिए कि वर्णित मामलों में औषधीय उत्पाद की चिकित्सीय तुल्यता की गारंटी नियामक दस्तावेज की आवश्यकताओं के साथ इसकी गुणवत्ता का अनुपालन होगी।
व्यक्तिगत मुद्दों पर ध्यान देने की आवश्यकता है
दवाओं का उपयोग करते समय, सरकारी अनुबंधों के तहत उन्हें खरीदते समय, मैं एक स्पष्ट मार्गदर्शिका रखना चाहता हूं जो यह बताए कि कौन सी दवाएं विनिमेय हैं। ऐसा गाइड ऑरेंज बुक का एक एनालॉग हो सकता है। लेकिन इसके गठन और प्रासंगिक नियमों की स्थापना में, ऊपर वर्णित के अलावा, कई विशिष्ट बिंदुओं को ध्यान में रखना आवश्यक है। सामान्य नियम. आइए कुछ विशेष समस्याओं पर ध्यान दें।
सराय। ज्ञात हो कि आईएनएन के अनुसार दवाओं की आपूर्ति का आदेश देकर किया जाना चाहिए। अपवाद इंसुलिन और साइक्लोस्पोरिन हैं, जिसके लिए यह व्यापारिक नामों से किया जा सकता है। लेकिन यह ध्यान दिया जाना चाहिए कि आईएनएन (या आईएनएन गायब होने पर दूसरा नाम) एकमात्र दिशानिर्देश के रूप में काम नहीं कर सकता है।
सबसे पहले, एक सक्रिय पदार्थ (आईएनएन) वाली दवाएं अन्य विशेषताओं (खुराक, खुराक के रूप, प्रशासन की विधि) में भिन्न हो सकती हैं, जो आम तौर पर उनकी विनिमयशीलता को बाहर करती हैं।
दूसरे, एक औपचारिक दृष्टिकोण के साथ, गलती करने की संभावना है, क्योंकि डब्ल्यूएचओ आमतौर पर एसिड और बेस (यदि कोई हो) के लिए आईएनएन (और इसे रूसी संघ के दवाओं के राज्य रजिस्टर में ध्यान में रखा जाता है) प्रदान करता है। बुनियादी संरचना के लवण, एस्टर और अन्य डेरिवेटिव के लिए, आईएनएन को केवल तभी असाइन किया जा सकता है जब ऐसे डेरिवेटिव एकमात्र संभावित विकल्प हों। उदाहरण के लिए, नमक के लिए INN को सौंपा गया था - मेटामिज़ोल सोडियम। और यह इस कारण से किया गया था कि अस्थिरता के कारण मेटामिज़ोल एसिड के रूप में मौजूद नहीं है, लेकिन यह एक दुर्लभ मामला है। निर्णय लेते समय, त्रुटि इस तथ्य में निहित हो सकती है कि एक आईएनएन के लिए वास्तव में अलग-अलग सक्रिय पदार्थ हो सकते हैं, उदाहरण के लिए: सिप्रोफ्लोक्सासिन (आधार के रूप में) और सिप्रोफ्लोक्सासिन हाइड्रोक्लोराइड (नमक), हाइड्रोकार्टिसोन (मुख्य संरचना) और हाइड्रोकार्टिसोन एसीटेट (एस्टर - आधार संरचनाओं से प्राप्त)। जैसा कि हमने ऊपर उल्लेख किया है, विभिन्न लवण और एस्टर युक्त तैयारी फार्मास्युटिकल विकल्प हैं। एफडीए विशेषज्ञ ऐसी दवाओं को चिकित्सीय रूप से समकक्ष नहीं मानते हैं, और इस पर सहमति होनी चाहिए, क्योंकि सामान्य स्थिति में, सक्रिय पदार्थों के रासायनिक संशोधनों का उद्देश्य घुलनशीलता, स्थिरता, क्रिस्टलीयता, कण आकार, जैवउपलब्धता आदि को बदलना है, जो अंततः सुरक्षा को प्रभावित करता है। और दवा प्रभावकारिता।
खुराक के रूप को बदलना। खुराक के रूप में आमूल-चूल परिवर्तन सामान्य रूप से नकारात्मक प्रभाव डाल सकता है। उदाहरण के लिए, पैरेंट्रल और मौखिक प्रशासन के लिए दवाएं समान नहीं हैं और विनिमेय नहीं हैं। इसके अलावा, रोगी बेहोश हो सकता है और इंजेक्शन की आवश्यकता हो सकती है। के लिए दवा की आवश्यकता हो सकती है मलाशय प्रशासनक्योंकि रोगी निगल नहीं सकता। स्थानीय और प्रणालीगत उपयोग की तैयारी, भले ही उनका उपयोग एक ही विकृति के इलाज के लिए किया जाता है, पूरी तरह से अलग प्रभावशीलता है (प्रणालीगत अधिक प्रभावी हैं)।
यह ज्ञात है कि प्रशासन के विभिन्न मार्गों वाली दवाओं का उपयोग आमतौर पर के अनुसार किया जा सकता है विभिन्न संकेत. एक पाठ्यपुस्तक उदाहरण फेनोटेरोल है। दवा बेरोटेक, साँस लेना के लिए एक समाधान या एरोसोल, एक ब्रोन्कोडायलेटर है (उदाहरण के लिए, ब्रोन्कियल अस्थमा के हमलों को दूर करने के लिए), और पार्टुसिस्टन, गोलियां या जलसेक के लिए ध्यान केंद्रित, एक टोलिटिक (प्रीटरम श्रम की रोकथाम) है।
यहां यह भी ध्यान दिया जाना चाहिए कि पैकेज में खुराक के रूप की इकाइयों की संख्या भी महत्वपूर्ण हो सकती है। उदाहरण के लिए, गर्भनिरोधक गोलियाँ. एक पैक में 21 गोलियां होती हैं। दूसरे में 28 गोलियां हैं, जिनमें से 7 प्लेसबॉस हैं। FDA इन दवाओं को चिकित्सीय समकक्ष नहीं मानता है।
फार्मास्युटिकल विकल्प घोलने के लिए इंजेक्शन योग्य पाउडर, पतला होने के लिए केंद्रित इंजेक्शन योग्य समाधान, और उपयोग के लिए तैयार इंजेक्शन योग्य समाधान हैं जिन्हें इस तरह के प्रारंभिक जोड़तोड़ की आवश्यकता नहीं होती है। एफडीए के मुताबिक ऐसी दवाएं चिकित्सकीय रूप से समकक्ष नहीं हैं।
संयुक्त दवाएं। समस्या संयुक्त दवा के प्रतिस्थापन के साथ मोनोप्रेपरेशन के साथ होती है जिसमें समान सक्रिय तत्व होते हैं और संयोजन में समान खुराक में होते हैं। उदाहरण के लिए, "एक ग्राहक के कार्यों (निष्क्रियता) के बारे में शिकायतों पर विचार करने के अभ्यास का अवलोकन, एक अधिकृत निकाय, एक विशेष संगठन, एक नीलामी आयोग जो स्वास्थ्य सेवा क्षेत्र में बोली लगाने के दौरान संघीय कानून संख्या 1 के प्रावधानों के अनुसार है। 94-एफजेड 21 जुलाई, 2005" (रूस की संघीय एंटीमोनोपॉली सर्विस, जुलाई 2011 के राज्य के आदेश को रखते हुए नियंत्रण विभाग द्वारा तैयार) में कहा गया है कि "एंटीवायरल दवाओं की खरीद के लिए ग्राहक द्वारा लॉट के गठन की प्रक्रिया में" : मानव इम्युनोडेफिशिएंसी वायरस से संक्रमित व्यक्तियों के उपचार के लिए संयुक्त और एकल दवाएं, यह ध्यान में रखा जाना चाहिए कि 2 या 3 गोलियों के रूप में एक ही संयोजन में संयुक्त और एकल दवाएं विनिमेय हैं। यदि हम स्वीकार करते हैं कि यह स्वीकार्य है, तो इस समस्या का समाधान विशिष्ट होना चाहिए, अर्थात। चिकित्सीय तुल्यता के लिए उपरोक्त मानदंडों को ध्यान में रखते हुए, वैज्ञानिक साक्ष्य के आधार पर प्रत्येक दवा के लिए स्वीकार किया जाना चाहिए।
ड्यूरा लेक्स…
नशीली दवाओं से संबंधित गतिविधियों को कानून द्वारा नियंत्रित किया जाता है। यह सहित लागू होता है। और सरकारी अनुबंधों के तहत दवाओं की खरीद। उदाहरण के लिए, संघीय कानून संख्या 94-एफजेड (भाग 3.1, अनुच्छेद 34) के अनुसार, "नीलामी दस्तावेज में सेवा चिह्न, व्यापार नाम, पेटेंट, उपयोगिता मॉडल, औद्योगिक डिजाइन, मूल या निर्माता के नाम का संकेत नहीं हो सकता है, और माल, सूचना, कार्य, सेवाओं के लिए भी आवश्यकताएं, यदि ऐसी आवश्यकताएं ऑर्डर देने में प्रतिभागियों की संख्या को सीमित करती हैं।
लेकिन, जैसा कि गारंट कंपनी के विशेषज्ञों ने उल्लेख किया है, "यह याद रखना चाहिए कि ऑर्डर देने का उद्देश्य ग्राहक की जरूरतों को पूरा करना है (कानून संख्या 94-एफजेड का अनुच्छेद 3)। जैसा कि इस संबंध में उल्लेख किया गया है, अदालतें, उनकी आवश्यकताओं के आधार पर, ग्राहक को उत्पाद की गुणवत्ता, कार्यात्मक विशेषताओं (उपभोक्ता गुण), आयाम, पैकेजिंग, अर्थात के लिए विशिष्ट आवश्यकताओं को स्थापित करना चाहिए। ग्राहक की जरूरतें प्रासंगिक आवश्यकताओं को स्थापित करने में निर्धारण कारक हैं (केस नंबर A03-2442/2010 के मामले में 07.09.2010 के पश्चिम साइबेरियाई जिले की संघीय एंटीमोनोपॉली सेवा का फरमान)"। और एक औषधीय उत्पाद के लिए विशिष्ट आवश्यकताओं को निर्दिष्ट करने की वैधता का प्रश्न, हमारी राय में, इसे ध्यान में रखते हुए तय किया जाना चाहिए चिकित्सा पहलूजिनकी चर्चा ऊपर की गई है।
ज्ञात है, उदाहरण के लिए, वह स्थिति है जो 2010 में ज़ोलेड्रोनिक एसिड की तैयारी खरीदते समय विकसित हुई थी। एक आदेश देते समय, रूसी संघ के रक्षा मंत्रालय ने दवा के खुराक के रूप और एकाग्रता को इस तरह से निर्दिष्ट किया कि यह वास्तव में एक विशिष्ट निर्माता की दवा को इंगित करता है - 5 मिलीग्राम / 100 मिलीलीटर जलसेक समाधान केवल के तहत निर्मित होता है अक्लास्टा नाम और नोवार्टिस द्वारा निर्मित है। इस मामले में, फेडरल एंटीमोनोपॉली सर्विस ने उल्लंघन के बारे में निर्णय लिया, जो ऑर्डर देने में प्रतिभागियों की संख्या को सीमित करता है, और ग्राहक को एक संबंधित आदेश जारी किया गया था। एफएएस के फैसले के खिलाफ रक्षा मंत्रालय ने अपील की थी मध्यस्थता अदालतदो उदाहरण, लेकिन बरकरार रखा। इस मामले में, दवा निर्माता, यानी से कोई आपत्ति प्राप्त नहीं हुई थी। उन्होंने सहमति व्यक्त की कि जलसेक के लिए समाधान के लिए एक लियोफिलिसेट या ध्यान केंद्रित, जो बाजार पर भी उपलब्ध है, इस मामले में तैयार समाधान के लिए एक समान प्रतिस्थापन होगा, हालांकि, एफडीए की आवश्यकताओं के अनुसार, यह मामला नहीं है।
और यहाँ एक और है, ऐसा प्रतीत होता है, एक समान स्थिति, जिस पर अंततः एक अलग निर्णय लिया गया था। 2010 में कुरगन क्षेत्रीय नैदानिक अस्पतालडोकैटेक्सेल युक्त दवा की खरीद के लिए एक आदेश दिया। उसी समय, अतिरिक्त आवश्यकताओं को नीलामी दस्तावेज़ीकरण में शामिल किया गया था: 1) 20 मिलीग्राम जलसेक के समाधान के लिए ध्यान केंद्रित करें, शीशी मात्रा 24.4 मिलीग्राम / 0.61 मिलीलीटर, शीशी नंबर 1 में विलायक 1.98 मिलीलीटर के साथ पूर्ण; 2) जलसेक के लिए समाधान के लिए ध्यान केंद्रित करें 80 मिलीग्राम, बोतल भरने की मात्रा 94.4 मिलीग्राम / 2.36 मिलीलीटर, बोतल नंबर 1 में विलायक 7.33 मिलीलीटर के साथ पूरा करें। इस तरह के विवरण, वास्तव में, फिर से एक विशिष्ट दवा - टैक्सोटेयर की ओर इशारा करते हैं। इसके अलावा, ग्राहक ने इसे छिपाया नहीं: कानून संख्या 94-एफजेड के अनुसार, नीलामी दस्तावेज में उन्होंने न केवल आईएनएन, बल्कि अनिवार्य शब्दों "या समकक्ष" के साथ व्यापार नाम का भी संकेत दिया। फिर भी, एफएएस ने उल्लंघन पाया, क्योंकि वास्तव में बाजार पर इस तरह के रिलीज के साथ कोई समकक्ष नहीं है, लेकिन ऐसी अन्य दवाएं हैं जो एक विकल्प हो सकती हैं। हालांकि, मध्यस्थता अदालत में मामले पर विचार करते समय, एफएएस के फैसले को अमान्य घोषित कर दिया गया था।
एक पूरी तरह से अप्रत्याशित मोड़, जो एक विशेषज्ञ को भी पहली नज़र में अजीब लगता है। लेकिन जिस वैज्ञानिक औचित्य पर अदालत का मार्गदर्शन किया गया वह इस प्रकार था। उद्धरण: "... कुर्गन क्षेत्र के लिए संघीय एंटीमोनोपॉली सेवा का विवादित निर्णय निम्नलिखित के कारण अवैध है: इच्छुक पार्टी ने इस बात पर ध्यान नहीं दिया कि शीशी भरने की मात्रा के लिए नीलामी दस्तावेज में निर्दिष्ट आवश्यकता 24.4 है। मिलीग्राम / 0.61 मिली और 94.4 मिलीग्राम / 2 ,36 मिली ग्राहक द्वारा आवश्यक दवा के प्रभावी उपयोग को सुनिश्चित करने के लिए एकमात्र संभव फिलिंग है, जो मानता है कि यह यह फिलिंग है जो आसंजन को ध्यान में रखते हुए उचित खुराक सुनिश्चित करती है। पोत की दीवारें) और पूर्व-मिश्रित समाधान की तैयारी के दौरान द्रव के नुकसान की भरपाई की अनुमति देता है, का मानना है कि शीशी में दवा की अधिकता, इसकी सामग्री को कम करने के बाद, 20 मिलीग्राम की सही खुराक का संकेत दिया गया है शीशी के लेबल पर। आसंजन के परिणामस्वरूप शीशी को अलग-अलग भरने से वास्तविक खुराक प्राप्त होगी जो आवश्यकता से कम होगी, परिणामस्वरूप, दवा का उपयोग करते समय कोई चिकित्सीय प्रभाव नहीं होगा।
80 मिलीग्राम के जलसेक की तैयारी के लिए ध्यान केंद्रित करने पर भी यही बात लागू होती है। जोर देकर कहा कि आवेदक द्वारा आपूर्ति की गई शीशी की केवल भरने की मात्रा और नीलामी दस्तावेज (24.4 मिलीग्राम / 0.61 मिलीलीटर और 94.4 मिलीग्राम / 2.36 मिलीलीटर) में संकेतित अतिरिक्त माप के बिना एक सटीक खुराक की अनुमति देता है, जबकि एक अलग आकार की एक बोतल एक बनाता है गलत खुराक का महत्वपूर्ण जोखिम। इस प्रकार, शीशी भरने की मात्रा के नीलामी दस्तावेज में संकेत वास्तव में दवा की आपूर्ति उस रूप में सुनिश्चित करने के लिए किया गया था जिसमें इसे प्रदान करना संभव है। प्रभावी आवेदनरोगियों के उपचार में कैंसर, इस परिस्थिति को कुरगन क्षेत्र के लिए संघीय एंटीमोनोपॉली सर्विस द्वारा विवादित निर्णय जारी करते समय ध्यान में नहीं रखा गया था।"।
एक बार फिर दिए गए उदाहरणों से संकेत मिलता है कि भले ही कुछ सामान्य दिशानिर्देश हों, प्रत्येक विशिष्ट मामले पर अलग से विचार करने की आवश्यकता होती है। ऑरेंज बुक का एक निश्चित एनालॉग इस समस्या के समाधान के लिए संपर्क कर सकता है, जिसमें यह संकेत दिया जा सकता है कि एक दवा में विनिमेय दवाएं नहीं हैं, जबकि दूसरी में है। लेकिन साथ ही आपको यह भी समझना चाहिए कि यह बहुत बड़ा काम है। वास्तव में, यह साक्ष्य पर आधारित एक वैज्ञानिक कार्य है।
निष्कर्ष
ड्रग इंटरचेंजबिलिटी के मुद्दों पर विचार करते समय, किसी को इस तथ्य से आगे बढ़ना चाहिए कि एक ही सक्रिय ड्रग पदार्थ युक्त पुनरुत्पादित दवाएं चिकित्सीय रूप से समकक्ष नहीं हैं, और इसलिए विनिमेय नहीं हैं। प्रत्येक निर्माता से प्रत्येक दवा के लिए उनकी चिकित्सीय तुल्यता सिद्ध होनी चाहिए। यह साक्ष्य साक्ष्य-आधारित साक्ष्य पर आधारित होना चाहिए और दवा बदलने का विशिष्ट निर्णय चिकित्सकीय रूप से विशिष्ट होना चाहिए और उपयुक्त दिशानिर्देश में प्रदान की गई जानकारी पर आधारित हो सकता है।
एक बार फिर, हम इस तथ्य की ओर ध्यान आकर्षित करते हैं कि निर्मित दवाओं की गुणवत्ता के संबंध में एक अनसुलझे मुद्दे के साथ। राज्य फार्माकोपिया के संबंध में, दवाओं की अदला-बदली से संबंधित निर्णय लेना मुश्किल बना हुआ है।
साहित्य
1. दवाओं की जैव उपलब्धता: सिद्धांत और समस्याएं। प्रतिवेदन वैज्ञानिक डब्ल्यूएचओ समूह संख्या 536। - जिनेवा: डब्ल्यूएचओ, 1975।
2. गारंटी विशेषज्ञ: गारंटी-अधिकतम (इलेक्ट्रॉनिक संसाधन)।
3. दवाओं की जैव समानता का आकलन। पद्धति संबंधी निर्देश। - एम .: एफजीयू एनटी ईएसएमपी, 2008।
4. रूस के आर्थिक विकास मंत्रालय, रूस के स्वास्थ्य और सामाजिक विकास मंत्रालय और रूसी संघ की संघीय एंटीमोनोपॉली सेवा का पत्र दिनांक 31 अक्टूबर 2007 नंबर 16811-एपी/डी04, 8035-वीएस और/आईए/ 20555
5. टेंटसोवा ए.आई., अज़गीखिन आई.एस. खुराक के रूप और दवाओं की चिकित्सीय प्रभावकारिता। - एम .: मेडिसिन, 1974. - 336 पी।
6. 12 अप्रैल, 2010 के संघीय कानून संख्या 61-एफजेड "द सर्कुलेशन ऑफ मेडिसिन" पर।
7. 21 जुलाई, 2005 के संघीय कानून संख्या 94-एफजेड "माल की आपूर्ति, कार्य के प्रदर्शन, राज्य और नगरपालिका की जरूरतों के लिए सेवाओं के प्रावधान के लिए आदेश देने पर।"
8. खोलोदोव एल.ई., याकोवलेव वी.पी. क्लिनिकल फार्माकोकाइनेटिक्स। - एम .: मेडिसिन, 1985. - 464 पी।
9. चिकित्सीय तुल्यता मूल्यांकन के साथ स्वीकृत दवा उत्पाद, 31वां संस्करण, FDA, 2011।
10. सीपीएमपी/ईडब्ल्यूपी/क्यूडब्ल्यूपी/1401/98 रेव. 1/ संशोधन: जैव समानता की जांच पर दिशानिर्देश, ईएमए, 2010।
11. मानव उपयोग के लिए औषधीय उत्पादों से संबंधित सामुदायिक संहिता पर यूरोपीय संसद और 6 नवंबर 2001 की परिषद का निर्देश 2001/83/ईसी।
12 मिर्गी में सामान्य प्रिस्क्राइबिंग। क्या ये सुरक्षित है? पी। क्रॉफर्ड, डब्ल्यू। हॉल, बी। चैपल एट अल।, जब्ती 1996; 5:1-5.
13. आईसीएच हार्मोनाइज्ड त्रिपक्षीय दिशानिर्देश: मानव उपयोग के लिए फार्मास्यूटिकल्स के पंजीकरण के लिए सामान्य तकनीकी दस्तावेज: गुणवत्ता एम 4 क्यू (आर 1)। - जिनेवा: आईसीएच, 2002।
14. आईसीएच हार्मोनाइज्ड त्रिपक्षीय दिशानिर्देश: मानव उपयोग के लिए फार्मास्यूटिकल्स के पंजीकरण के लिए सामान्य तकनीकी दस्तावेज: सुरक्षा। M4S (R2)। - जिनेवा: आईसीएच, 2002।
15. आईसीएच हार्मोनाइज्ड त्रिपक्षीय दिशानिर्देश: मानव उपयोग के लिए फार्मास्यूटिकल्स के पंजीकरण के लिए सामान्य तकनीकी दस्तावेज: प्रभावकारिता। M4E (R1)। - जिनेवा: आईसीएच, 2002।
16. इंटरनेशनल फार्मास्युटिकल फेडरेशन (एफआईपी) और इंटरनेशनल फेडरेशन ऑफ फार्मास्युटिकल मैन्युफैक्चरर्स एसोसिएशन (आईएफपीएमए) के बीच संयुक्त वक्तव्य: रोगी की सुरक्षा के लिए औषधीय उत्पादों की गुणवत्ता और सुरक्षा सुनिश्चित करना। - बार्सिलोना: एफआईपी, आईएफपीएमए, 1999।
17. डब्ल्यूएचओ तकनीकी रिपोर्ट श्रृंखला, नहीं। 902, 2002. अनुलग्नक 11: विनिमेय मल्टीसोर्स (जेनेरिक) उत्पादों के तुल्यता मूल्यांकन के लिए तुलनित्र फार्मास्युटिकल उत्पादों के चयन पर मार्गदर्शन।
18. डब्ल्यूएचओ तकनीकी रिपोर्ट श्रृंखला, नहीं। 937, 2006। अनुबंध 7: मल्टीसोर्स (जेनेरिक) फार्मास्युटिकल उत्पाद: विनिमेयता स्थापित करने के लिए पंजीकरण आवश्यकताओं पर दिशानिर्देश।
दुनिया के किसी भी देश में दवा नीति का अंतिम लक्ष्य आबादी को सुरक्षित, प्रभावी, उच्च गुणवत्ता और वहनीय प्रदान करना है दवाओं. इस नीति में प्रमुख बिंदुओं में से एक जेनेरिक दवाओं का व्यापक उपयोग है।
यू.एस. रुडिक, इंस्टीट्यूट ऑफ थेरेपी का नाम एल.टी. यूक्रेन के माइनर एकेडमी ऑफ मेडिकल साइंसेज, खार्कोव
 सबसे अधिक बार, जेनरिक का उपयोग सामाजिक रूप से महत्वपूर्ण बीमारियों के लिए किया जाता है जिनमें उच्च प्रसार होता है ( धमनी का उच्च रक्तचाप, पुरानी दिल की विफलता, तपेदिक, मधुमेहऔर आदि।)। इस संबंध में, यह स्पष्ट है कि सामाजिक रूप से महत्वपूर्ण बीमारियों के पाठ्यक्रम और परिणाम पर अनुकूल प्रभाव केवल अपेक्षाकृत सस्ती और उच्च गुणवत्ता वाली जेनरिक का उपयोग करके प्राप्त किया जा सकता है।
सबसे अधिक बार, जेनरिक का उपयोग सामाजिक रूप से महत्वपूर्ण बीमारियों के लिए किया जाता है जिनमें उच्च प्रसार होता है ( धमनी का उच्च रक्तचाप, पुरानी दिल की विफलता, तपेदिक, मधुमेहऔर आदि।)। इस संबंध में, यह स्पष्ट है कि सामाजिक रूप से महत्वपूर्ण बीमारियों के पाठ्यक्रम और परिणाम पर अनुकूल प्रभाव केवल अपेक्षाकृत सस्ती और उच्च गुणवत्ता वाली जेनरिक का उपयोग करके प्राप्त किया जा सकता है।
डब्ल्यूएचओ की परिभाषा के अनुसार, "जेनेरिक" शब्द का अर्थ चिकित्सा पद्धति में इस्तेमाल की जाने वाली दवा से है, जो एक अभिनव (मूल) दवा के साथ परस्पर क्रिया करती है, जो एक नियम के रूप में, निर्माता कंपनी से लाइसेंस के बिना उत्पादित होती है और एक की समाप्ति के बाद बेची जाती है। पेटेंट या अन्य अनन्य अधिकार।
एक सामान्य उत्पाद को निम्नलिखित मानदंडों को पूरा करना चाहिए:
- मूल दवा के समान सक्रिय संघटक होते हैं;
- समान जैवउपलब्धता है;
- एक ही खुराक के रूप में जारी किया गया;
- गुणवत्ता, दक्षता और सुरक्षा बनाए रखना;
- पेटेंट संरक्षण नहीं है;
- मूल दवा की तुलना में कम लागत है;
- फार्माकोपियल आवश्यकताओं का अनुपालन, जीएमपी (अच्छे विनिर्माण अभ्यास) शर्तों के तहत उत्पादित किया जाना;
- उपयोग और सावधानियों के लिए समान संकेत हैं।
जैसा कि नैदानिक अभ्यास से पता चलता है, एक ही दवा के रूपों और खुराक में समान सक्रिय अवयवों वाली दवाएं, लेकिन विभिन्न उद्यमों में उत्पादित, चिकित्सीय प्रभावकारिता और उनके चिकित्सा उपयोग के निर्देशों में प्रदान की गई प्रतिकूल प्रतिक्रियाओं की घटनाओं में काफी भिन्न हो सकती हैं।
ईयू निर्देश 2001/83 भी मूल को परिभाषित करता है इसी तरह की दवाएं. एक औषधीय उत्पाद अनिवार्य रूप से प्रवर्तक उत्पाद के समान होता है यदि यह समान मात्रात्मक और के मानदंडों को पूरा करता है गुणवत्ता रचनासक्रिय पदार्थों के संबंध में, एक ही खुराक के रूप में और जैव-समतुल्य है, जब तक कि यह वैज्ञानिक रूप से स्पष्ट नहीं है कि यह सुरक्षा और प्रभावकारिता के मामले में मूल दवा से अलग है।
डॉक्टर और मरीज दोनों के लिए मुख्य मुद्दों में से एक जेनेरिक और मूल दवाओं की अदला-बदली की समस्या है।
अंतर्राष्ट्रीय समुदाय, राष्ट्रीय स्वास्थ्य सेवाएं विभिन्न कंपनियों द्वारा उत्पादित जेनेरिक दवाओं की प्रभावशीलता और सुरक्षा के मूल्यांकन के लिए साक्ष्य-आधारित मानदंड विकसित करने और व्यवहार में लाने में रुचि रखती हैं।
आधुनिक अवधारणाओं के अनुसार, एक जेनेरिक और एक दवा-ब्रांड की अनुरूपता तीन महत्वपूर्ण घटकों पर आधारित होती है, जिन्हें फार्मास्युटिकल, फार्माकोकाइनेटिक और चिकित्सीय तुल्यता कहा जाता है।
यूरोप में, दवाओं को माना जाता है औषधीय रूप से समकक्ष, यदि उनमें समान मात्रा में और समान खुराक के रूप में समान सक्रिय पदार्थ होते हैं, तो समान या समान मानकों की आवश्यकताओं को पूरा करते हैं।
अमेरिकी परिभाषा के अनुसार, औषधीय रूप से समकक्ष दवाओं में एक ही खुराक के रूप में समान सक्रिय तत्व होते हैं, प्रशासन के एक ही मार्ग के लिए अभिप्रेत हैं और सक्रिय पदार्थों की शक्ति या एकाग्रता में समान हैं।
लेकिन फ़ार्मास्यूटिकल रूप से समकक्ष एजेंट आवश्यक रूप से चिकित्सीय रूप से समकक्ष नहीं होंगे, अर्थात। ऐसे, जिसके उपयोग के बाद एक ही दाढ़ की खुराक में, प्रभावकारिता और सुरक्षा के संदर्भ में प्रभाव वास्तव में समान होता है। इस प्रकार, रूसी संघ में पंजीकृत एरिथ्रोमाइसिन, जब उच्च आवृत्ति के साथ अंतःशिरा में प्रशासित किया जाता है, तो थ्रोम्बोटिक जटिलताओं का कारण बनता है, जबकि यूरोप में, एबॉट एरिथ्रोमाइसिन का व्यापक रूप से अंतःशिरा प्रशासन के लिए उपयोग किया जाता है, जबकि अंतःशिरा जलसेक के लिए सबसे सुरक्षित मैक्रोलाइड एंटीबायोटिक माना जाता है।
दवा के उपयोग की सुरक्षा में सहायक पदार्थ एक महत्वपूर्ण भूमिका निभाते हैं। जेनेरिक दवाएं बनाते समय, एक्सीसिएंट्स की मूल संरचना को संरक्षित करने की आवश्यकता होती है, हालांकि, हमेशा ज्ञात नहीं होती है। डब्ल्यूएचओ की सिफारिशों के आधार पर जेनेरिक दवाओं में सहायक सामग्री के उपयोग को नियंत्रित किया जाता है।
मूल्यांकन करते समय फार्माकोकाइनेटिक तुल्यता (या जैव समानता)मानव शरीर में दवाओं के अवशोषण और वितरण की विशेषताओं की तुलना की जाती है। डब्ल्यूएचओ की परिभाषा के अनुसार, "दो औषधीय उत्पादों को जैव-समतुल्य माना जाता है यदि वे औषधीय रूप से समकक्ष हैं, समान जैवउपलब्धता है और, जब एक ही खुराक पर प्रशासित किया जाता है, तो पर्याप्त प्रभावकारिता और सुरक्षा प्रदान करते हैं।"
यूरोपीय संघ (ईयू) और संयुक्त राज्य अमेरिका के देशों में अपनाई गई परिभाषाएँ कुछ भिन्न हैं।
यूरोपीय सूत्रीकरण के अनुसार, दो औषधीय उत्पाद जैव-समतुल्य हैं यदि वे औषधीय रूप से समकक्ष या वैकल्पिक हैं और यदि उनकी जैवउपलब्धता (दर और अवशोषण की सीमा) एक ही दाढ़ की खुराक पर प्रशासन के बाद इस हद तक समान है कि उनकी प्रभावकारिता और सुरक्षा अनिवार्य रूप से समान है। .
अमेरिकी परिभाषा के अनुसार, जैव-समतुल्य दवाएं औषधीय रूप से समकक्ष या औषधीय रूप से वैकल्पिक दवाएं हैं जिनकी समान प्रयोगात्मक परिस्थितियों में परीक्षण किए जाने पर तुलनीय जैवउपलब्धता होती है।
एक जैव-तुल्यता अध्ययन अनिवार्य रूप से (मौखिक उत्पादों के लिए) एक तुलनात्मक जैवउपलब्धता परीक्षण है। प्रत्येक अध्ययन दवा के लिए, अवशोषण की पूर्णता की विशेषता वाले मुख्य फार्माकोकाइनेटिक पैरामीटर निर्धारित किए जाने चाहिए: एकाग्रता-समय वक्र (एयूसी) के तहत क्षेत्र, अवशोषण की दर (सी अधिकतम, टी अधिकतम) और सक्रिय पदार्थ के विसर्जन की दर (के एल, टी 1/2)। यह निष्कर्ष निकालने के लिए कि इन मापदंडों में कोई अंतर नहीं है, विचरण का विश्लेषण लागू किया जाता है और 90% विश्वास अंतराल की गणना की जाती है। तुल्यता की पुष्टि करने के लिए, यह आवश्यक है कि अध्ययन दवा के जैवउपलब्धता मापदंडों के अनुपात का 90% विश्वास अंतराल -80 और +125% संदर्भ दवा के मूल्यों से आगे न जाए।
साथ ही, यह ध्यान रखना महत्वपूर्ण है कि दवाओं की जैव समानता के बारे में बात करना असंभव है यदि यह निश्चित रूप से ज्ञात नहीं है कि दवा का उत्पादन कहां और कैसे किया गया था। यदि इस बात की कोई निश्चितता नहीं है कि जिस उत्पादन स्थल पर यह दवा बनाई गई है, वह जीएमपी आवश्यकताओं का अनुपालन करती है, तो जैव-समतुल्यता अध्ययनों के साथ-साथ अन्य नैदानिक परीक्षणों में संलग्न होना व्यर्थ है, क्योंकि दवाओं की गुणवत्ता बैच से बैच तक बनाए नहीं रखी जाती है। वैश्विक अर्थ में, जीएमपी एक दवा में गुणवत्ता का चरण-दर-चरण, व्यवस्थित और चरण-दर-चरण "एम्बेडिंग" है। इस संबंध में, जैव-तुल्यता परीक्षण दवाओं की गुणवत्ता सुनिश्चित करने के लिए समग्र प्रणाली का एक हिस्सा है।
सभी जेनरिकों में जैव-समतुल्यता सिद्ध होनी चाहिए, क्योंकि सिद्धांत रूप में केवल जैव-समतुल्य दवाओं में समान नैदानिक प्रभावकारिता और सुरक्षा प्रोफ़ाइल हो सकती है।
1984 में, संयुक्त राज्य अमेरिका के राष्ट्रपति ने FDA की आवश्यकता वाले कानून पर हस्ताक्षर किए खाद्य उत्पाददवाएं) अनुमोदित नुस्खे और ओवर-द-काउंटर दवाओं की सूची सार्वजनिक रूप से उपलब्ध कराने के लिए। इस कानून ने पहली बार एक नई धारणा पेश की कि जैव-समतुल्य दवाएं चिकित्सीय रूप से समकक्ष हैं और इसलिए विनिमेय हैं। संस्करण चिकित्सीय तुल्यता मूल्यांकन के साथ स्वीकृत दवा उत्पाद- एक सूची कहा जाता है "ऑरेंज बुक" (ऑरेंज बुक), - उनकी सुरक्षा और प्रभावकारिता के आधार पर FDA द्वारा अनुमोदित दवाओं की पहचान करता है। ऑरेंज बुक की स्थिति के बारे में बोलते हुए, यह ध्यान दिया जाना चाहिए कि सूची का उपयोग करके दवाओं के चिकित्सीय तुल्यता के अपने मूल्यांकन के बारे में सूचित करके, एफडीए एक दवा के चुनाव पर जनता, विशेषज्ञों और अधिकृत निकायों को अपनी सिफारिशें प्रदान करता है। इस तरह के मूल्यांकन को किसी विशेष दवा के उपयोग पर प्रतिबंध के रूप में या इस बात के प्रमाण के रूप में नहीं लिया जाना चाहिए कि उनमें से एक दूसरे के लिए बेहतर है। ऑरेंज बुक ज्यादातर मल्टीसोर्स दवाओं को एक-दूसरे से अलग करने का काम नहीं करती है, लेकिन यह बताती है कि उपलब्ध टूल ने संदर्भ उत्पाद के लिए उनकी चिकित्सीय तुल्यता साबित करने की समस्या को हल किया है या नहीं। चिकित्सीय तुल्यता एक वैज्ञानिक निर्णय है, जबकि सामान्य प्रतिस्थापन की लागत-बचत प्रथा भी सामाजिक और आर्थिक विचारों पर आधारित है।
ऑरेंज बुक के बारे में आया क्योंकि, स्वास्थ्य सेवा प्रणाली में पैसे बचाने के लिए, संयुक्त राज्य में लगभग हर राज्य ने सामान्य प्रतिस्थापन को प्रोत्साहित करने के लिए कानून और / या नियम बनाए हैं। इन कानूनों के कार्यान्वयन के लिए दवाओं की एक सकारात्मक या नकारात्मक सूची बनाने की आवश्यकता थी (वे जो मूल दवा को या तो बदल सकती हैं या नहीं)। FDA विशेषज्ञों ने एक एकल औषधि सूत्र तैयार किया है, जिसमें औषधियों की चिकित्सीय तुल्यता का मूल्यांकन पत्र कोड के रूप में प्रस्तुत किया गया था। चिकित्सीय तुल्यता का वर्णन करने वाले अक्षर कोडों की प्रणाली आपको शीघ्रता से यह निर्धारित करने की अनुमति देती है कि क्या एक निश्चित दवा को संदर्भ एक (पहला अक्षर) के जैव-समतुल्य होने के लिए स्थापित किया गया है और एफडीए मूल्यांकन (दूसरा पत्र) के बारे में अतिरिक्त जानकारी प्राप्त करने के लिए। जिन दो मुख्य श्रेणियों में जेनेरिक दवाओं को वर्गीकृत किया जा सकता है, उन्हें ए और बी लेबल किया जाता है।श्रेणी ए में वे दवाएं शामिल हैं जो चिकित्सीय रूप से अन्य फ़ार्मास्यूटिकल रूप से समकक्ष उत्पादों के बराबर हैं जिनके लिए:
- कोई ज्ञात या संदिग्ध जैव-समतुल्यता समस्या नहीं; उन्हें खुराक के रूप के आधार पर एए, एएन, एओ, एपी या एटी अक्षरों द्वारा नामित किया गया है;
- जैव-समतुल्यता के साथ वास्तविक या संभावित समस्याओं को जैव-समतुल्यता के पर्याप्त प्रमाण द्वारा हल किया जा सकता है; ऐसे मामलों में, पदनाम AB का उपयोग किया जाता है।
कोड बी उन दवाओं को दर्शाता है जिन्हें एफडीए वर्तमान में अन्य औषधीय रूप से समकक्ष उत्पादों के लिए चिकित्सीय रूप से गैर-समतुल्य मानता है, अर्थात वास्तविक या संभावित जैव-समतुल्यता समस्याओं को पर्याप्त जैव-समतुल्यता निर्धारण द्वारा हल नहीं किया जा सकता है। अक्सर समस्या विशिष्ट खुराक के रूप में होती है, न कि सक्रिय पदार्थ. ऐसे मामलों में, पदनाम बीसी, बीडी, बीई, बीएन, बीपी, बीआर, बीएस, बीटी, बीएक्स या बी लागू होते हैं।
एक समय में, FDA ने फार्मास्युटिकल कंपनियों की गतिविधियों के साथ-साथ चिकित्सा उत्पादों के वितरकों (तथाकथित प्रायोजकों) के स्वामित्व या प्रभावित उद्यमों पर एक मसौदा गाइड प्रकाशित किया था। सार्वजनिक सुनवाई और मसौदे की चर्चा की आवश्यकता इस तथ्य के कारण थी कि व्यक्तियों और लोगों के समूहों ने राज्य विधानसभाओं, फार्मास्युटिकल संगठनों और दवा नियंत्रण समितियों से संपर्क किया, कुछ दवाओं की अदला-बदली की समस्या के बारे में चिंता व्यक्त की, विशेष रूप से सीमित चिकित्सीय दवाओं के साथ। अनुक्रमणिका। वे विशेष रूप से इस बात में रुचि रखते थे कि क्या इस तरह की दवाओं की सुरक्षा और प्रभावकारिता बदल जाएगी, अगर एक प्रसिद्ध निर्माता की दवा के बजाय, एफडीए द्वारा चिकित्सीय रूप से समकक्ष के रूप में मान्यता प्राप्त दवा, लेकिन एक पंजीकृत ट्रेडमार्क द्वारा संरक्षित नहीं थी, को बदल दिया गया था। 1998 में, इस मुद्दे को स्पष्ट करने के लिए FDA स्वास्थ्य आयुक्त स्टुअर्ट एल. नाइटिंगेल का एक पत्र प्रकाशित किया गया था। नीचे उसका सारांश है: "दवाओं के लिए चिकित्सीय तुल्यता के निर्धारण के आधार पर, FDA ने एक बयान जारी किया है:
- एक प्रसिद्ध ब्रांड को एक अपंजीकृत ब्रांड के साथ बदलते समय अतिरिक्त नैदानिक परीक्षणों की आवश्यकता नहीं होती है;
- दवा के सूत्र या निर्माण प्रक्रिया को बदलते समय कोई विशेष सावधानी बरतने की आवश्यकता नहीं है, बशर्ते कि ये परिवर्तन FDA द्वारा FDA के कानूनों और विनियमों के अनुसार अनुमोदित हों;
- जैसा कि ऑरेंज बुक में कहा गया है, एफडीए के अनुसार, चिकित्सीय रूप से समकक्ष पाए जाने वाली दवाओं से समान नैदानिक प्रभाव होने की उम्मीद की जा सकती है, भले ही दवा ज्ञात हो या नई;
- किसी भी दवा वर्ग को किसी अन्य वर्ग से अलग व्यवहार करने की कोई आवश्यकता नहीं है यदि एफडीए ने प्रश्न में दवाओं के लिए चिकित्सीय समकक्षता निर्धारित की है।"
एफडीए के मुताबिक, चिकित्सीय समकक्षदवाओं को निम्नलिखित सामान्य आवश्यकताओं को पूरा करने के लिए माना जाता है:
ए) उनकी प्रभावशीलता और सुरक्षा सिद्ध हो गई है;
बी) वे औषधीय रूप से समकक्ष हैं, अर्थात्:
- एक ही खुराक के रूप में समान सक्रिय अवयवों की समान मात्रा होती है और प्रशासन के एक ही मार्ग के लिए अभिप्रेत है;
- शक्ति, गुणवत्ता, शुद्धता और पहचान के लिए आवश्यकताओं को पूरा करना;
ग) जैव समतुल्य हैं, अर्थात्:
- कोई ज्ञात या संभावित जैव-समतुल्यता मुद्दे नहीं हैं और वे इन विट्रो मानक को पूरा करते हैं, या
- यदि मौजूदा ज्ञात या संभावित समस्याओं को जैव-समतुल्यता अध्ययन आयोजित करके समाप्त किया जा सकता है;
घ) निर्देशों में पर्याप्त निर्देश;
ई) जीएमपी आवश्यकताओं के अनुसार निर्मित।
डब्ल्यूएचओ की परिभाषा के अनुसार, दो दवाओं को चिकित्सीय रूप से समकक्ष माना जाता है यदि वे औषधीय रूप से समकक्ष हैं, दवा पदार्थ की समान जैव उपलब्धता है और जब एक ही दाढ़ की खुराक पर प्रशासित किया जाता है, तो उनकी कार्रवाई उचित प्रभावकारिता और सुरक्षा प्रदान करती है।
इस प्रकार, चिकित्सीय तुल्यता ड्रग इंटरचेंजबिलिटी के लिए एक बुनियादी आवश्यकता है।
यूरोपीय संघ के देशों, संयुक्त राज्य अमेरिका, रूसी संघ, आदि के लिए अपनाई गई जेनेरिक दवाओं के चिकित्सा और जैविक गुणवत्ता नियंत्रण के लिए दवाओं की जैव समानता का निर्धारण मुख्य मानदंड है।
यह माना जाता है कि यदि दवाओं की जैव-समतुल्यता सिद्ध हो जाती है, तो जेनेरिक दवाओं के अतिरिक्त नैदानिक परीक्षण करने की कोई आवश्यकता नहीं है, क्योंकि जैव-समतुल्यता की उपस्थिति इंगित करती है कि अध्ययन दवा की सभी प्रभावकारिता और सुरक्षा संकेतक तुलनीय हैं।बायोइक्विवेलेंस परीक्षण स्वस्थ स्वयंसेवकों या रोगियों में नैदानिक अध्ययन हैं जिन्हें एक जांच औषधीय उत्पाद के प्रशासन के लिए संकेत दिया गया है।
जेनेरिक दवाओं की जैव-समतुल्यता का मूल्यांकन प्रासंगिक अंतरराष्ट्रीय और राष्ट्रीय मानकों द्वारा कड़ाई से नियंत्रित किया जाता है। वर्तमान में, यूक्रेन में, दवा बाजार के गहन विस्तार के कारण, विभिन्न उत्पादन की दवाओं के एनालॉग्स के बीच प्रतिस्पर्धा बढ़ रही है। उनमें से कई (विशेषकर घरेलू दवाओं के लिए) की जैव-समतुल्यता सिद्ध नहीं हुई है। इन दवाओं के सीमित कार्यक्रम पर आयोजित नैदानिक परीक्षण हमेशा उनकी प्रभावशीलता और सुरक्षा के बारे में पर्याप्त वस्तुनिष्ठ जानकारी प्रदान नहीं कर सकते हैं।
विभिन्न स्रोतों (तथाकथित मल्टीसोर्स ड्रग्स) से उपलब्ध समान दवाओं की विनिमेयता निर्धारित करने के लिए डब्ल्यूएचओ दिशानिर्देश ध्यान दें कि चिकित्सीय तुल्यता की पुष्टि करने के लिए अक्सर जैव-समतुल्यता का उपयोग किया जाता है. हालाँकि, यह भी संभव है अन्य दृष्टिकोण, अर्थात्:
- फार्माकोडायनामिक विशेषताओं का तुलनात्मक निर्धारण (उदाहरण के लिए, पुतली का फैलाव, परिवर्तन) हृदय दरया रक्त चाप), जब फार्माकोडायनामिक प्रतिक्रिया को मापना आसान हो या फार्माकोकाइनेटिक मापदंडों की तुलना में अधिक विश्वसनीय हो, या दवाओं के लिए स्थानीय कार्रवाई;
- एक सीमित दायरे में तुलनात्मक नैदानिक परीक्षण, जब न तो फार्माकोकाइनेटिक और न ही फार्माकोडायनामिक अध्ययन निर्णायक सबूत प्रदान करते हैं;
- इन विट्रो परीक्षणों में, उदाहरण के लिए, एक खुराक के रूप (विघटन परीक्षण) की घुलनशीलता का निर्धारण, जिसमें कई बिंदुओं पर स्थापित घुलनशीलता प्रोफ़ाइल के रूप में शामिल है।
अंत में, कुछ मामलों में, चिकित्सीय समकक्षता के विशिष्ट प्रमाण की आवश्यकता नहीं होती है, उदाहरण के लिए, बशर्ते कि सभी रासायनिक (जैसे, अशुद्धता प्रोफ़ाइल), दवा (जैसे, स्थिरता) और विनिर्माण (जीएमपी) संकेतक चुने हुए संदर्भ के अनुरूप हों। दूसरे शब्दों में, यह माना जाता है कि इन मामलों में तकनीकी मापदंडों की अनुरूपता अपने आप में चिकित्सीय तुल्यता की गारंटी देती है। सभी मामलों में, हम दवाओं के साथ तुलनात्मक परीक्षणों के बारे में बात कर रहे हैं, जिनकी चिकित्सीय प्रभावकारिता सिद्ध मानी जाती है।
पूर्वगामी के आधार पर, यह स्पष्ट है कि चिकित्सीय तुल्यता में फार्मास्युटिकल तुल्यता और मानदंडों में से एक शामिल है:
- मनुष्यों में जैव समानता का अध्ययन;
- मनुष्यों में फार्माकोडायनामिक अध्ययन;
- क्लिनिकल परीक्षण;
- इन विट्रो विघटन परीक्षण (कुछ मामलों में)।
सामान्य उत्पादन और गुणवत्ता नियंत्रण भी excipients पर निर्भर करते हैं। उनके लिए आवश्यकताएं सक्रिय पदार्थ के समान होनी चाहिए। Excipients या ड्रग शेल की संरचना में कोई भी परिवर्तन दवा की गुणवत्ता, इसकी जैव उपलब्धता, विषाक्त या एलर्जी की घटनाओं को महत्वपूर्ण रूप से बदल सकता है।
चिकित्सीय तुल्यता की अवधारणा केवल उन्हीं सक्रिय अवयवों वाली दवाओं पर लागू होती है और एक ही नैदानिक स्थितियों (उदाहरण के लिए, सिरदर्द के लिए निर्धारित पेरासिटामोल और एसिटाइलसैलिसिलिक एसिड) में उपयोग किए जाने वाले विभिन्न चिकित्सीय उत्पादों पर लागू नहीं होती है।
एक औषधीय उत्पाद जो चिकित्सीय तुल्यता के लिए उपरोक्त मानदंडों को पूरा करता है, उसे ऐसा माना जाता है, भले ही वह कुछ विशेषताओं में भिन्न हो, जैसे कि फॉर्म, टैबलेट मार्किंग, पैकेजिंग, एक्सीसिएंट्स (डाई, प्रिजर्वेटिव सहित), समाप्ति तिथि और निर्देशों में न्यूनतम अंतर। (उदाहरण के लिए, फार्माकोकाइनेटिक्स पर एक विशिष्ट जानकारी की उपस्थिति), साथ ही भंडारण की स्थिति।यदि किसी विशेष रोगी के उपचार में इस तरह के अंतर महत्वपूर्ण हैं, तो डॉक्टर की आवश्यकता हो सकती है कि एक विशेष ब्रांड उसे फार्मेसी से निकाल दिया जाए। इस सीमा के अलावा, FDA का मानना है कि चिकित्सीय रूप से समकक्ष के रूप में वर्गीकृत दवाओं को प्रतिस्थापित किया जा सकता है, जो पूरी तरह से निर्धारित दवा के अपेक्षित प्रभाव और सुरक्षा प्रोफ़ाइल को बनाए रखने के लिए प्रतिस्थापन पर निर्भर करता है।
यह स्वीकार किया जाना चाहिए कि यूरोपीय संघ और अमेरिका दोनों में, कई विशेषज्ञ फार्माकोकाइनेटिक तुल्यता पर सवाल उठाते हैं क्योंकि ड्रग इंटरचेंजबिलिटी का आकलन करने का एकमात्र तरीका है।कई प्रकाशन दवाओं की जैव समानता के अध्ययन में महत्वपूर्ण कार्यप्रणाली संबंधी कमियों को इंगित करते हैं, जिससे यह तथ्य सामने आ सकता है कि ब्रांडेड और जेनेरिक दवाओं के बीच मौजूदा अंतर की पहचान नहीं की जाएगी। यूरोपीय आवश्यकताओं और एफडीए नियमों के अनुसार, व्यक्तिगत फार्माकोकाइनेटिक संकेतक 20% तक भिन्न हो सकते हैं। यह माना जाता है कि रक्त प्लाज्मा में सक्रिय संघटक की सांद्रता में -20 से + 25% की सीमा में उतार-चढ़ाव चिकित्सकीय रूप से महत्वपूर्ण नहीं हैं, हालांकि, बुजुर्ग रोगियों या रोगियों के अन्य कमजोर समूहों के लिए, यहां तक कि एकाग्रता में इस तरह के मामूली परिवर्तन भी नहीं होते हैं। औषधीय पदार्थ के जोखिम को बढ़ा सकता है दुष्प्रभाव.
उदाहरण के लिए, यह माना जाता है कि कुछ सीमाएं दवाओं के अस्तित्व से जुड़ी हो सकती हैं, जो रक्त प्लाज्मा में दवा के चिकित्सीय सांद्रता के अपेक्षाकृत छोटे प्रसार (कुछ एंटीडिपेंटेंट्स - पेरोक्सेटीन, फ्लुओक्सेटीन, सीतालोप्राम) और / या गैर-रेखीय फार्माकोकाइनेटिक्स द्वारा विशेषता हैं। (मानदंड और एंटीपीलेप्टिक दवाएं)।
इस स्थिति में, इस पैरामीटर में भी छोटे परिवर्तन, जो जैव-समतुल्यता परीक्षण (-20 से + 25% तक) की स्वीकार्य सीमा के भीतर हैं, नैदानिक प्रभावकारिता और/या सहनशीलता के लिए महत्वपूर्ण हो सकते हैं।
फलस्वरूप, ब्रांडेड और जेनेरिक दवाओं के गुणों में महत्वपूर्ण विसंगतियां संभव हैं. उदाहरण के लिए, 100% से नीचे जैव-समतुल्यता मान के साथ, दवा प्रभावी नहीं हो सकती है। इसके विपरीत, माना संकेतक में वृद्धि के साथ, साइड इफेक्ट की संख्या में वृद्धि की उम्मीद की जानी चाहिए। विशेष रूप से चिंता कम चिकित्सीय सूचकांक वाली दवाएं हैं (दवा की न्यूनतम प्रभावी खुराक और इसकी अधिकतम जहरीली खुराक के बीच का अंतर) - डिगॉक्सिन, फ़िनाइटोइन, कार्बामाज़ेपिन, साइक्लोस्पोरिन, वारफारिन। इस स्थिति में फार्माकोकाइनेटिक अध्ययन के लिए आवश्यकताओं को सख्त और विस्तारित करने की आवश्यकता है। मापदंडों में अंतर को 10-15% तक कम करने के मुद्दे पर चर्चा की जा रही है, जिससे बॉर्डरलाइन फार्माकोकाइनेटिक मापदंडों वाली दवाओं की संख्या कम हो जाएगी।
फार्माकोकाइनेटिक मापदंडों में महत्वपूर्ण परिवर्तनशीलता के साथ दवाओं (सेराट्रलाइन, फ्लुओक्सेटीन, क्लोरप्रोमाज़िन, क्लोज़ापाइन) के अस्तित्व पर जैव-समतुल्यता परीक्षण के परिणाम पर एक और सीमा लागू होती है, जो विशेष रूप से, दवा चयापचय प्रक्रियाओं की जटिलता (साइटोक्रोम सिस्टम, की उपस्थिति) पर निर्भर करती है। कई उत्सर्जन मार्ग, आदि।) ऐसी परिवर्तनशीलता प्रकृति में "अंतर-व्यक्तिगत" हो सकती है। एक मामले में, यह जुड़ा हुआ है, उदाहरण के लिए, साइटोक्रोम के आनुवंशिक बहुरूपता के साथ, जो विभिन्न जनसंख्या आबादी में मनाया जाता है, दूसरे में, इन एंजाइमों की कार्यात्मक स्थिति के साथ, जो विभिन्न बाहरी प्रभावों के प्रभाव में एक ही व्यक्ति में बदलता है। कारक (उदाहरण के लिए, अंगूर के रस का उपयोग)। इसलिए, एक समान आहार का सेवन करने वाले स्वयंसेवकों के एक छोटे समूह पर किए गए जैव-समतुल्यता परीक्षण के परिणाम वास्तविक नैदानिक स्थितियों के लिए मान्य नहीं हो सकते हैं।
जैव समानता अध्ययन के दौरान दवाओं की एक दैनिक खुराक का उपयोग करने की प्रवृत्ति को भी गंभीर रूप से माना जाता है।
यह ज्ञात है कि कई दवाएं (एमियोडेरोन, डिजिटलिस तैयारी, साइकोट्रोपिक दवाएं) एक निश्चित अवधि में बार-बार निर्धारित की जाती हैं, और नैदानिक प्रभाव प्राप्त करने के लिए, दवा की एक स्थिर (चिकित्सीय) एकाग्रता प्राप्त करना आवश्यक है। रक्त प्लाज्मा और / या ऊतक, जो स्वस्थ स्वयंसेवकों में जैव-समतुल्यता अध्ययन में उपयोग किए जाने वाले की तुलना में काफी अधिक हो सकता है।
यह भी ध्यान में रखा जाना चाहिए कि वास्तविक नैदानिक अभ्यास में, रोगियों द्वारा लंबे समय तक जेनेरिक दवाएं ली जाती हैं। अलग अलग उम्र, लिंग, शरीर का वजन, अक्सर कॉमरेड (कॉमोर्बिड) पैथोलॉजी से पीड़ित होता है। ऐसी स्थिति में, ब्रांडेड और जेनेरिक दवाओं के फार्माकोकाइनेटिक गुण, उनके बीच छोटे रासायनिक अंतर होने के कारण, काफी भिन्न हो सकते हैं। पैथोलॉजी एक निश्चित मूल्य प्राप्त करती है जठरांत्र पथ. इस रोग के रोगियों को जटिल तंत्रदवा का अवशोषण आसानी से बिगड़ा हुआ है। साथ ही, ब्रांडेड और जेनेरिक दवाओं की रासायनिक संरचना में मामूली अंतर भी उनकी जैव समानता का उल्लंघन कर सकता है।
विशेष रूप से, ऐसी स्थिति उत्पन्न हो सकती है जब जेनरिक में उपयोग किए जाने वाले निष्क्रिय फॉर्मूलेशन (फिलर्स) एक खुराक में निर्धारित किए जाने पर, दवाओं के अवशोषण, वितरण और चयापचय को प्रभावित किए बिना, लंबे समय तक उपयोग के साथ गैस्ट्रोइंटेस्टाइनल ट्रैक्ट, यकृत या की कार्यात्मक स्थिति को प्रभावित कर सकते हैं। गुर्दे इस तरह से कि दवाओं की फार्माकोकाइनेटिक तुल्यता काफी बिगड़ा हुआ है।
एक उदाहरण के रूप में, हम निकरगोलिन की मूल और जेनेरिक दवाओं के अंशों की विभिन्न रचनाओं का हवाला दे सकते हैं, जिनका व्यापक रूप से विभिन्न उम्र के रोगियों द्वारा उपयोग किया जाता है, जिनमें बुजुर्ग रोगी भी शामिल हैं, जो अक्सर पीड़ित होते हैं एक विस्तृत श्रृंखलाआंतरिक अंगों के सहवर्ती रोग।
सहवर्ती दैहिक विकृति की उपस्थिति भी एक अन्य समस्या से जुड़ी है जो जैव-समानता परीक्षण के परिणामों के नैदानिक उपयोग को महत्वपूर्ण रूप से जटिल बनाती है। स्वस्थ स्वयंसेवकों के विपरीत, सहरुग्णता वाले रोगियों को अक्सर विभिन्न सोमाटोट्रोपिक दवाएं लेने के लिए मजबूर किया जाता है, विशेष रूप से, जो पेरिस्टलसिस को बढ़ाते या घटाते हैं, जो आंत में दवा के विनाश को प्रभावित करते हैं। यह संभव है कि मौजूदा होने के कारण, मूल और जेनेरिक दवाओं की रासायनिक संरचना में अंतर कम से कम होने के कारण, अस्पष्ट हो सकता है। तदनुसार, इन दवाओं की जैव-समतुल्यता को बदलने के लिए स्थितियां उत्पन्न होती हैं।
चर्चा की गई आपत्तियां केवल सैद्धांतिक विचार नहीं हैं। संबंधित प्रकाशनों में बायोइक्विलेंस क्रॉस-चेकिंग के परिणामों के बारे में बहुत सारी जानकारी है। विभिन्न दवाएं. इन आंकड़ों से संकेत मिलता है कि जेनरिक का एक बड़ा हिस्सा इस तरह के परीक्षण में विफल रहता है। तो, 1995-1996 में यूके में आयोजित किया गया। 2427 जेनेरिक दवाओं के विश्लेषण में 228 महत्वपूर्ण अंतर पाए गए। संयुक्त राज्य अमेरिका में कोई कम हड़ताली डेटा प्राप्त नहीं हुआ था। FDA ने पाया है कि देश में उपलब्ध 20% तक ब्रांडेड और जेनेरिक दवाएं बायोइक्विवेलेंट नहीं हैं और इसलिए इनका परस्पर उपयोग नहीं किया जा सकता है।
एनालाप्रिल की तैयारी के नैदानिक गैर-समतुल्यता के उदाहरण दिए गए हैं। यह दिखाया गया है कि 4 जेनेरिक एनालाप्रिल के धमनी उच्च रक्तचाप वाले रोगियों में रक्तचाप के लक्ष्य स्तर को प्राप्त करने में नैदानिक प्रभावकारिता प्रसिद्ध निर्मातामूल दवा (रेनिटेक, एमएसडी) की तुलना में कम थी। अध्ययन किए गए जेनरिक फार्माकोकाइनेटिक रूप से रेनिटेक के बराबर थे। प्राप्त परिणामों के आधार पर, लेखकों ने निष्कर्ष निकाला कि जेनेरिक एनालाप्रिल की तैयारी की चिकित्सीय समानता समान नहीं है।
धमनी उच्च रक्तचाप वाले रोगियों में मूल इंडैपामाइड (आरिफॉन, सर्वियर) और इसके जेनरिक की चिकित्सीय गैर-समतुल्यता की रिपोर्ट वी.आई. पेट्रोव एट अल। , जबकि तुलनात्मक दवाओं के फार्माकोकाइनेटिक प्रोफाइल मेल खाते थे।
विशेष महत्व रोगाणुरोधी दवाओं के लिए जेनरिक की समानता है, क्योंकि कम रोगाणुरोधी गतिविधि से चिकित्सा की नैदानिक प्रभावशीलता में कमी हो सकती है, जो गंभीर रूप से बीमार रोगियों के उपचार में विशेष रूप से महत्वपूर्ण है, और रोगाणुओं के प्रतिरोधी रूपों का तेजी से प्रसार होता है। मूल फ्लुकोनाज़ोल (डिफ्लुकन, फाइज़र) और जेनेरिक दवाओं की माइकोलॉजिकल गतिविधि के एक हालिया अध्ययन से पता चला है कि जेनेरिक दवाओं की गतिविधि विभिन्न प्रकारजीनस कैंडिडा का कवक डिफ्लुकन की तुलना में 2 गुना कम है। उसी समय, जेनरिक मूल दवा के जैव-समतुल्य थे।
प्रकाशनों में से एक डेटा प्रदान करता है तुलनात्मक विश्लेषणएबॉट ओरिजिनल क्लैरिथ्रोमाइसिन और एशिया और लैटिन अमेरिका के 13 देशों के 40 जेनरिक। यह पता चला कि 8 तैयारियों में सक्रिय पदार्थ की सामग्री डेवलपर कंपनी के मानकों को पूरा नहीं करती थी, 28 जेनरिक में विघटन पर जारी सक्रिय संघटक की मात्रा मूल की तुलना में काफी कम थी, हालांकि उन सभी में उपयुक्त था विशिष्टता। 40 उत्पादों में से चौबीस ने एबट की संदूषकों के लिए अनुशंसित 3% सीमा को पार कर लिया।
मूल दवा (क्लाफोरन, होचस्ट) की तुलना में 4 पुनरुत्पादित सेफोटैक्सिम तैयारियों में ठोस कणों की मात्रा 10 गुना बढ़ गई थी। जेनरिक में निहित ये कण इस्केमिक ऊतकों में माइक्रोकिरकुलेशन को बाधित कर सकते हैं और गंभीर रोगियों में श्वसन संकट सिंड्रोम और कई अंग विफलता के विकास में योगदान कर सकते हैं।
साहित्य ब्रांडेड और जेनेरिक क्लोजापाइन (क्लोजारिल, नोवार्टिस फार्मास्यूटिकल्स और क्लोजापाइन, जेनिथ गोल्डलाइन फार्मास्यूटिकल्स) की तुलना के परिणाम प्रस्तुत करता है। अध्ययन के दौरान, यह पाया गया कि फार्माकोकाइनेटिक मापदंडों के संदर्भ में इन साइकोट्रोपिक दवाओं के बीच विसंगति सिज़ोफ्रेनिया से पीड़ित 40% रोगियों में देखी गई है।
ब्रांडेड दवाओं एमिट्रिप्टिलाइन हाइड्रोक्लोराइड, नॉर्ट्रिप्टिलाइन हाइड्रोक्लोराइड, डेसिप्रामाइन, ट्रिमिप्रामाइन मैलेट और उनके जेनरिक के बीच जैव समानता में महत्वपूर्ण अंतर थे।
फ़िनाइटोइन, वैल्प्रोइक एसिड की तैयारी के विभिन्न जेनरिक की जैव-समतुल्यता पर 100 से अधिक अध्ययन किए गए हैं, जिसमें मूल और जेनेरिक दवाओं के फार्माकोकाइनेटिक मापदंडों में महत्वपूर्ण विसंगतियां पाई गईं।
चिकित्सीय तुल्यता के बारे में बोलते हुए, हमें आर। मोफसेन एट अल द्वारा अध्ययन का उल्लेख करना चाहिए, जो एक स्थिर मानसिक स्थिति वाले रोगियों में अपनी जेनेरिक दवा के साथ ब्रांडेड क्लोज़ापाइन के असफल प्रतिस्थापन के 7 मामलों का वर्णन करता है जो एक न्यूरोसाइकिएट्रिक बोर्डिंग स्कूल में थे। इस बात पर जोर दिया जाता है कि चिकित्सा में निर्दिष्ट परिवर्तन फार्मेसी द्वारा अप्रत्याशित रूप से किया गया था और न तो डॉक्टरों और न ही संस्थान के चिकित्सा कर्मचारियों को इसके बारे में पता था। उनके लिए, रोगियों में मानसिक विकारों की बहाली के लिए यह एक पूर्ण आश्चर्य था, जिसकी गंभीरता 7 में से 5 मामलों में रोगियों को एक मनोरोग अस्पताल में स्थानांतरित करने के लिए तत्काल उपायों की आवश्यकता थी। इसी तरह का एक मामला पैरॉक्सिटाइन (पैक्सिल) ब्रांड नाम से इसके सामान्य संस्करण में स्विच करते समय सामने आया है।
संयुक्त राज्य अमेरिका में काम कर रहे 301 न्यूरोलॉजिस्टों के एक हालिया सर्वेक्षण में, उनमें से 204 (67.8%) ने दौरे की पुनरावृत्ति का अनुभव किया और 168 (55.8%) ने साइड इफेक्ट में वृद्धि की सूचना दी जब ब्रांड-नाम एंटीपीलेप्टिक दवाओं से जेनेरिक दवाओं पर स्विच किया गया। ।
हम उन 11 मामलों का वर्णन करते हैं जिनमें ब्रांडेड लैमोट्रीजीन को उसके जेनरिक से बदलने के बाद, मिर्गी के दौरे पर नियंत्रण खो गया था।
इन अध्ययनों के परिणामस्वरूप, नॉर्वे सहित कई देशों ने ब्रांडेड एंटीपीलेप्टिक दवाओं से जेनेरिक दवाओं के रोगियों के स्थानांतरण को प्रतिबंधित करने वाले निर्णयों को अपनाया है, और जर्मनी में इस प्रक्रिया की बिल्कुल भी अनुशंसा नहीं की जाती है।
कई नियंत्रित अध्ययनों से पता चला है कि ब्रांड नाम कार्बामाज़ेपिन से जेनेरिक कार्बामाज़ेपिन में स्विच करने पर, दौरे की अचानक पुनरावृत्ति होती है।
मई 2000 में अमेरिकन जर्नल ऑफ कार्डियोलॉजी में प्रकाशित एक अन्य पेपर, 64 इलेक्ट्रोफिजियोलॉजिकल विशेषज्ञों, इलेक्ट्रोफिजियोलॉजी स्टिमुलेशन के लिए नॉर्थ अमेरिकन सोसाइटी के सदस्यों की राय का हवाला देता है, जो आवर्तक अतालता (वेंट्रिकुलर फाइब्रिलेशन, वेंट्रिकुलर टैचीकार्डिया, एट्रियल फाइब्रिलेशन और एट्रियल) के 32 मामलों की रिपोर्ट करते हैं। टैचीकार्डिया) ब्रांडेड एंटीरैडमिक दवा अमियोडेरोन (कॉर्डेरोन, सनोफी-सिंथेलाबो) को उसके जेनरिक से बदलने के दौरान।
यह ध्यान दिया जाना चाहिए कि मूल और जेनेरिक दवाओं के चिकित्सीय तुल्यता पर भी प्रकाशन हैं। एक यादृच्छिक, डबल-ब्लाइंड अध्ययन ने क्रोनिक सिज़ोफ्रेनिया वाले आउट पेशेंट के दो समानांतर समूहों की जांच की, जिनका इलाज ब्रांड-नाम फ़्लुफ़ेनाज़िन डिकनोनेट के साथ किया गया था। पहले समूह को इसके जेनेरिक में बदल दिया गया था, दूसरे समूह को मूल दवा पर छोड़ दिया गया था। 12 सप्ताह के बाद, दोनों समूहों में स्थिति में कोई महत्वपूर्ण परिवर्तन नहीं हुआ, जैसा कि सकारात्मक और नकारात्मक सिंड्रोम के एक विशेष पैमाने द्वारा निर्धारित किया गया था।
के बोल पुराने रोगों, यह ध्यान दिया जाना चाहिए कि उनमें से कई पुनरावृत्ति करते हैं। इसे देखते हुए, आधुनिक सिफारिशें स्टॉप थेरेपी के साथ-साथ दीर्घकालिक रखरखाव चिकित्सा प्रदान करती हैं। व्यवहार में, अक्सर ऐसी स्थिति होती है जब चिकित्सा को रोकना, जिसे अक्सर अस्पताल में किया जाता है, मूल दवा के साथ किया जाता है। भविष्य में, रोगी को छुट्टी मिलने के बाद, "आर्थिक" विचारों के कारण, इस दवा को अक्सर इसकी जेनेरिक दवा से बदल दिया जाता है। ऊपर प्रस्तुत आंकड़ों के आलोक में, यह स्पष्ट है कि प्रश्न में प्रतिस्थापन तभी संभव है जब मूल और जेनेरिक दवाओं के फार्मास्यूटिकल, फार्माकोकाइनेटिक और चिकित्सीय तुल्यता में विश्वास हो।
ऐसी रिपोर्टें हैं कि फार्मास्युटिकल बाजार में जेनेरिक दवाओं की शुरूआत से हमेशा स्वास्थ्य देखभाल की लागत कम नहीं होती है। हाल ही में कनाडा के एक अध्ययन ने विश्लेषण किया कि जेनेरिक और ब्रांड-नाम क्लोज़ापाइन के बीच रिलेप्स दरों में 11% का अंतर जेनेरिक क्लोज़ापाइन के लागत लाभ को नकार देता है। इसी तरह के डेटा एंटीपीलेप्टिक दवाओं के लिए प्राप्त किए गए थे।
उपरोक्त डेटा, कई अन्य लोगों की तरह, रूसी संघ के स्वास्थ्य मंत्रालय के मुख्य नैदानिक औषधविज्ञानी के अनुसार, प्रोफेसर यू.बी. बेलौसोव, जेनेरिक दवाओं की सस्तीता के बारे में मिथक को दूर करते हैं, क्योंकि उनके उपयोग की लागत मूल दवाओं के उपयोग की तुलना में बहुत अधिक है। आम धारणा के विपरीत कि जेनेरिक दवाएं उपचार की प्रत्यक्ष लागत को कम करती हैं, प्रतिस्पर्धा को बढ़ावा देती हैं और ब्रांडेड दवाओं के लिए कम कीमतों को बढ़ावा देती हैं, और यहां तक कि नैदानिक अभ्यास में लागत प्रभावी चिकित्सा प्रौद्योगिकियों को पेश करने का एक तरीका है, कुछ हालिया शोध अन्यथा सुझाव देते हैं।
वैज्ञानिक का मानना है कि सस्ती जेनरिक से मूल दवाओं में संक्रमण रोगियों और समग्र रूप से समाज दोनों के लिए फायदेमंद है। उनका मानना है कि मूल दवाओं पर प्राप्त प्रभावकारिता और सुरक्षा डेटा को उनकी प्रतियों में स्थानांतरित करना अस्वीकार्य है। केवल जेनेरिक के उत्पादन में जीएमपी आवश्यकताओं के अनुपालन के बारे में पूरी जानकारी की उपलब्धता, इसकी फार्माकोकाइनेटिक और चिकित्सीय तुल्यता जब मूल दवा के साथ तुलना की जाती है, तो जेनेरिक के फार्माकोइकोनॉमिक लाभों की खोज करना उचित होता है। अन्यथा, औपचारिक रूप से अनुकूल मूल्य संकेतक बड़ी अतिरिक्त लागतों में बदल सकते हैं, उदाहरण के लिए, अवांछित उपचार के लिए दुष्प्रभाव. यू.बी. के अनुसार बेलौसोवा, वह प्रथा जो रूसी संघ में विकसित हुई है, केवल जैव-समतुल्यता पर डेटा के आधार पर एक जेनेरिक के चिकित्सा उपयोग की अनुमति देना गलत है। चिकित्सीय तुल्यता का निर्धारण करने के लिए, एक विशिष्ट बीमारी में जेनेरिक दवा की प्रभावशीलता के सीमित और बड़े दोनों नैदानिक परीक्षणों का संचालन करना आवश्यक है, स्पष्ट समापन बिंदुओं का उपयोग करके मूल और जेनेरिक दवाओं की तुलनात्मक प्रभावशीलता का अध्ययन। चिकित्सीय तुल्यता का अर्थ प्रतिकूल प्रभावों के पंजीकरण के बाद 5 वर्षों तक गहन निगरानी के साथ जेनरिक की सुरक्षा प्रोफ़ाइल के अध्ययन का संगठन भी है।
जाहिर है, मूल दवाएं हमेशा जेनेरिक दवाओं के विरोध में रहेंगी, लेकिन फार्मास्युटिकल बाजार में उनकी प्रतिस्पर्धा मूल और जेनेरिक दोनों दवाओं के उत्पादन के लिए गुणवत्ता आवश्यकताओं के सख्त अनुपालन पर आधारित होनी चाहिए, जैव-समतुल्यता विश्लेषण के परिणामों पर, साथ ही साथ नैदानिक परीक्षण डेटा। इसलिए, क्लिनिकल प्रैक्टिस में जेनेरिक दवाओं का व्यापक उपयोग उनके फार्मास्युटिकल, फार्माकोकाइनेटिक और सबसे ऊपर, मूल दवाओं के चिकित्सीय समकक्ष के चिकित्सकों के लिए उपलब्ध स्पष्ट संकेतों पर आधारित होना चाहिए।
संदर्भों की सूची संपादकीय में है
एक जेनेरिक दवा (जेनेरिक) की चिकित्सीय तुल्यता और इसे कैसे साबित किया जाए।
N.P.Kutishenko1, S.Yu.Martsevich1,2, I.V.Vashurina1
1FGU GNITs रूस, मास्को के स्वास्थ्य और सामाजिक विकास मंत्रालय के प्रधान मंत्री
2विभाग साक्ष्य आधारित चिकित्सापहले एमजीएमयू उन्हें। आई.एम. सेचेनोव
दवाओं की प्रतियों (जेनेरिक दवाएं, जेनरिक) की प्रभावशीलता और सुरक्षा की समस्या वैज्ञानिकों, डॉक्टरों और जनता के लिए चिंता का विषय बनी हुई है। उसे लगातार वैज्ञानिक सम्मेलनों और संगोष्ठियों में संबोधित किया जाता है, मीडिया में, विशेष वैज्ञानिक अध्ययन उसके लिए समर्पित होते हैं, जिसमें कभी-कभी हजारों रोगी भाग लेते हैं, उदाहरण के लिए, मूल अध्ययन (इंडैपामाइड जेनरिक से एरिफ़ोन मंदता में स्थानांतरण की प्रभावशीलता का मूल्यांकन) रोगियों में धमनी का उच्च रक्तचाप) . और यह सब इस तथ्य के बावजूद कि इस समस्या का वैज्ञानिक हिस्सा मूल रूप से कई अध्ययनों में बहुत पहले हल हो चुका है, और इसका व्यावहारिक हिस्सा कई नियामक दस्तावेजों में परिलक्षित होता है, जिस पर नीचे चर्चा की जाएगी। यह विशेषता है कि मूल दवाओं और जेनरिक के तुलनात्मक मूल्यांकन के लिए समर्पित प्रकाशन अब विदेशी वैज्ञानिक साहित्य में अत्यंत दुर्लभ हैं, हालांकि हाल ही में इस तरह के और भी कई प्रकाशन हुए हैं।
बेशक, कुछ जेनरिक की प्रभावकारिता और सुरक्षा के बारे में कुछ अस्पष्टताएं बनी हुई हैं, हालांकि, हमारी राय में, वे मुख्य रूप से उन आवश्यक शर्तों के अनुपालन के साथ समस्याओं को दर्शाती हैं, जो आधुनिक अवधारणाओं के अनुसार, एक जेनेरिक दवा की चिकित्सीय तुल्यता सुनिश्चित करती हैं।
इस प्रकाशन का उद्देश्य जेनेरिक दवाओं की चिकित्सीय तुल्यता का आकलन करने के लिए बुनियादी सिद्धांतों को याद करना है।
जेनेरिक (जेनेरिक दवा) क्या है
यह अजीब लग सकता है, अभी भी "जेनेरिक" शब्द की एक भी परिभाषा नहीं है: डब्ल्यूएचओ (विश्व स्वास्थ्य संगठन), एफडीए (खाद्य एवं औषधि प्रशासन), ईएमईए (यूरोपीय मेडिसिन एजेंसी), विभिन्न देशों के स्वास्थ्य मंत्रालय अपनी पेशकश करते हैं। पुनरुत्पादित दवा की परिभाषा, साथ ही मानदंड जिसके आधार पर जेनेरिक को मूल दवा के चिकित्सीय रूप से समकक्ष माना जा सकता है। सामान्य तौर पर, ये मानदंड समान होते हैं, हालांकि, प्रभावकारिता और सुरक्षा दोनों के संदर्भ में, मूल दवा के साथ जेनेरिक दवा के अनुपालन को साबित करने के लिए चिकित्सीय तुल्यता अध्ययन करने के महत्व और आवश्यकता का आकलन करने में कुछ अंतर हैं।
निस्संदेह, जेनरिक की तुल्यता का मूल्यांकन करने के लिए सबसे स्पष्ट, विचारशील और वैज्ञानिक रूप से आधारित प्रणाली आज संयुक्त राज्य अमेरिका में मौजूद है, जो एफडीए दस्तावेजों में परिलक्षित होती है। जैसा कि FDA द्वारा परिभाषित किया गया है, चिकित्सीय तुल्यता को फार्मास्युटिकल तुल्यता और जैव-समतुल्यता अध्ययनों के माध्यम से स्थापित किया जाता है। यदि तुल्यता के बारे में कोई संदेह नहीं है, तो दवा को "ए" अक्षर से शुरू होने वाला एक उपयुक्त कोड सौंपा गया है, जिसका अर्थ यह भी है कि इसे एक संभावित संदर्भ दवा (यानी तुलनित्र दवा) माना जा सकता है। यदि जैव-समतुल्यता डेटा फ़ार्मास्यूटिकल रूप से समकक्ष उत्पादों की चिकित्सीय तुल्यता के बारे में संभावित संदेहों को बाहर नहीं करता है या जैव-समतुल्यता अध्ययन नहीं किया गया है (उदाहरण के लिए, सामयिक दवाओं के लिए), तो चिकित्सीय तुल्यता मूल्यांकन कोड "बी" अक्षर से शुरू होता है। इस कोडिंग प्रणाली के अनुसार अधिकांश जेनरिक, एक नियम के रूप में, "एबी" कोड प्राप्त करते हैं - इसका मतलब है कि दवाओं के बीच अंतर संभावित रूप से संभव है, लेकिन इन विट्रो और / और विवो अध्ययनों में पर्याप्त रूप से किए गए परिणामों से तुल्यता की पुष्टि की जाती है। यह ध्यान दिया जाना चाहिए कि मूल दवा और जेनेरिक के चिकित्सीय तुल्यता की पुष्टि करने वाले विशेष नैदानिक अध्ययनों की अपेक्षा नहीं की जाती है।
डब्ल्यूएचओ एक मूल दवा और एक जेनेरिक (मल्टीसोर्स फार्मास्युटिकल उत्पाद) की चिकित्सीय तुल्यता को कुछ अलग तरीके से परिभाषित करता है। डब्ल्यूएचओ की आवश्यकताओं के अनुसार, दो फार्मास्युटिकल उत्पादों को चिकित्सीय रूप से समकक्ष माना जाता है यदि वे फ़ार्मास्यूटिकल रूप से समकक्ष (या फ़ार्मास्युटिकल रूप से वैकल्पिक) हैं और, एक ही दाढ़ की खुराक पर प्रशासन के बाद, प्रभावकारिता और सुरक्षा के संदर्भ में उनका प्रभाव उसी मार्ग के लिए बिल्कुल समान है। प्रशासन और एक ही संकेत के लिए। यह फार्माकोकाइनेटिक, फार्माकोडायनामिक, क्लिनिकल या इन विट्रो अध्ययनों जैसे उपयुक्त जैव-समतुल्यता अध्ययनों द्वारा प्रदर्शित किया जाना चाहिए।
ईएमईए (यूरोपियन मेडिसिन एजेंसी) के दृष्टिकोण से, जैव-समतुल्यता अध्ययन न केवल बुनियादी फार्माकोकाइनेटिक मापदंडों के संदर्भ में एक सामान्य और एक मूल दवा के बीच समानता का प्रदर्शन करने के लिए आवश्यक है। इस तरह के अध्ययन प्रदान करते हैं वास्तविक अवसरमूल दवा के लिए प्राप्त प्रभावकारिता और सुरक्षा पर डेटा को जेनेरिक में स्थानांतरित करना, जबकि चिकित्सीय तुल्यता अध्ययन करना अपेक्षित नहीं है (जैविक दवाओं के अपवाद के साथ)।
रूसी संघीय कानून "द सर्कुलेशन ऑफ मेडिसिन" एक जेनेरिक दवा की अवधारणा का परिचय देता है, लेकिन यह अन्य देशों के दस्तावेजों के साथ कुछ संघर्ष में है। के अनुसार संघीय कानूनरूसी संघ के दिनांक 12 अप्रैल, 2010 एन 61-एफजेड "जेनेरिक दवाओं की जांच के लिए प्रक्रिया करते समय (वे सिर्फ जेनरिक शामिल हैं), दवाओं के नैदानिक परीक्षणों के संचालन के दौरान प्राप्त जानकारी और विशेष मुद्रित प्रकाशनों में प्रकाशित, जैसे साथ ही जैव-समतुल्यता अध्ययन और (या) चिकित्सीय समकक्षता के परिणामों वाले दस्तावेज़। यदि हम दवाओं के चिकित्सीय तुल्यता के अध्ययन के बारे में बात करते हैं, तो यह शब्द एक प्रकार के नैदानिक परीक्षण को संदर्भित करता है, जो एक निश्चित खुराक के रूप में दवाओं के समान गुणों की पहचान करने के लिए किया जाता है, साथ ही साथ समान सुरक्षा और उपस्थिति की उपस्थिति भी होती है। दवाओं के प्रभावकारिता संकेतक, वही नैदानिक प्रभाव जब उनका उपयोग किया जाता है।
चिकित्सीय समकक्षता की पुष्टि के मुद्दे के संबंध में, एफडीए नियमों के साथ कुछ विरोधाभास हैं, और ऐसे नैदानिक परीक्षणों के परिणामों के मूल्यांकन के लिए मानदंड और संचालन की प्रक्रिया को परिभाषित करने वाले कोई दस्तावेज भी नहीं हैं। यदि हम चिकित्सीय तुल्यता का निर्धारण करने के लिए समय-परीक्षण किए गए एफडीए नियमों की ओर मुड़ते हैं, तो पांच शर्तों को बिना किसी असफलता के पूरा किया जाना चाहिए: 1) दवाओं को प्रभावी और सुरक्षित के रूप में पहचाना जाना चाहिए, 2) वे संख्या के संदर्भ में अनुपालन सहित, फार्मास्युटिकल रूप से समकक्ष होना चाहिए। सक्रिय अवयवों की, उनकी शुद्धता, गुणवत्ता, पहचान, 3) जैव-समतुल्यता मानकों का अनुपालन करते हैं और अध्ययन में कम से कम 24-36 स्वयंसेवकों की भागीदारी के साथ, 4) सही ढंग से लेबल किए गए हैं और, अंतिम लेकिन कम से कम नहीं, 5) तदनुसार उत्पादित किए जाते हैं जीएमपी (गुड मैन्युफैक्चरिंग प्रैक्टिस) की आवश्यकताओं के साथ।
चिकित्सीय तुल्यता अध्ययन का महत्व
हालांकि, जेनेरिक दवा के पंजीकरण में जैव-समतुल्यता संकेतकों के महत्व के बावजूद, तुल्यता साबित करने के लिए नैदानिक परीक्षणों के परिणाम एक निश्चित महत्व बनाए रखते हैं। अधिक हद तक, यह जैविक मूल के फार्मास्यूटिकल्स (तथाकथित बायोसिमिलर या बायोजेनेरिक) के एनालॉग्स पर लागू होता है। उनके लिए, चिकित्सीय तुल्यता अध्ययन पंजीकरण की शर्तों में से एक है। निकट भविष्य में, ऐसी दवाएं फार्मास्युटिकल बाजार में तेजी से दिखाई देंगी, क्योंकि कई मूल जैविक उत्पादों (कम आणविक भार हेपराइन सहित) के पेटेंट की वैधता समाप्त हो रही है। इस संबंध में, कुछ जेनेरिक कंपनियों ने बायोसिमिलर के उत्पादन को विकसित करना शुरू कर दिया है, इस तथ्य के बावजूद कि बायोसिमिलर के उत्पादन के लिए रासायनिक संरचना और तकनीक पारंपरिक रासायनिक दवाओं की तुलना में बहुत अधिक जटिल है। चूंकि बायोसिमिलर में एक जटिल त्रि-आयामी स्थानिक संरचना होती है, इसलिए जैविक तरल पदार्थों में उनकी मात्रात्मक सामग्री को सटीक रूप से चिह्नित करना मुश्किल होता है; इसलिए, आमतौर पर यह स्वीकार किया जाता है कि ऐसी दवाओं के लिए पारंपरिक जैव-समानता अध्ययन स्पष्ट रूप से पर्याप्त नहीं हैं। यह नियामक प्राधिकरणों को बायोसिमिलर के निर्माताओं को प्रीक्लिनिकल (टॉक्सिकोलॉजिकल, फार्माकोकाइनेटिक और फार्माकोडायनामिक) और क्लिनिकल अध्ययन (दवा की प्रभावकारिता और सुरक्षा पर डेटा की पूरी प्रस्तुति), साथ ही साथ इम्यूनोजेनेसिटी के अध्ययन पर डेटा का संचालन करने के लिए बाध्य करता है। जैविक उत्पत्ति की तैयारी में हार्मोन, साइटोकिन्स, रक्त जमावट कारक, मोनोक्लोनल एंटीबॉडी, एंजाइम, टीके और कोशिकाओं और ऊतकों पर आधारित तैयारी आदि शामिल हैं।
"सामान्य प्रतिस्थापन"
यह ध्यान दिया जाना चाहिए कि मूल दवाओं और जेनरिक या आपस में अलग-अलग जेनरिक के चिकित्सीय प्रभाव में अंतर, सिद्धांत रूप में, कई अंतरराष्ट्रीय दस्तावेजों द्वारा अनुमति दी जाती है। काफी समय पहले, "जेनेरिक रिप्लेसमेंट" शब्द पेश किया गया था, जिसे एक औषधीय उत्पाद की रिहाई के रूप में समझा जाता है, व्यापारिक नामजो एक डॉक्टर द्वारा निर्धारित से अलग है, और सक्रिय सिद्धांत की रासायनिक संरचना और खुराक समान हैं। वर्ल्ड मेडिकल असेंबली के दस्तावेज चेतावनी देते हैं कि दवाओं का वितरण करते समय जो पूरी तरह से समान नहीं हैं रासायनिक संरचना, जैविक प्रभाव या चिकित्सीय प्रभावकारिता, रोगी को एक अपर्याप्त प्रभाव का अनुभव हो सकता है, अर्थात। साथ विपरित प्रतिक्रियाएंया अपर्याप्त चिकित्सीय प्रभावकारिता के साथ। यह दस्तावेज़ इस तथ्य की ओर विशेष ध्यान आकर्षित करता है कि सार्वजनिक सेवाओंनियंत्रण को डॉक्टरों को एक या विभिन्न निर्माताओं द्वारा निर्मित दवाओं की रासायनिक, जैविक और चिकित्सीय पहचान की डिग्री के बारे में सूचित करना चाहिए, और दवा निर्माण उद्यमों में मौजूद गुणवत्ता नियंत्रण सेवाओं को रासायनिक और जैविक गुणों के मानकों के साथ निर्मित दवाओं के स्थिर अनुपालन की निगरानी करना आवश्यक है। .
सवाल यह उठता है कि क्यों जेनेरिक के नियंत्रण के स्थापित तरीकों के बावजूद, ऐसे जेनरिक अक्सर बाजार में प्रवेश करते हैं जो स्पष्ट रूप से या तो प्रभावकारिता या सुरक्षा के मामले में मूल दवाओं से पूरी तरह मेल नहीं खाते हैं, और कभी-कभी दोनों। दुर्भाग्य से, यह स्थिति हमारे देश के लिए काफी विशिष्ट है। इस प्रश्न का अभी तक कोई निश्चित उत्तर नहीं है, लेकिन, मुझे लगता है, मुख्य बात जेनरिक के प्रीक्लिनिकल मूल्यांकन के सिद्धांतों का उल्लंघन है, जिनका उल्लेख ऊपर किया गया था। यह सर्वविदित है कि रूस में जीएमपी मानक अभी भी हमारे देश में निर्मित अधिकांश दवाओं के उत्पादन में नहीं देखा गया है (यह माना जाता है कि सभी रूसी दवा निर्माताओं का जीएमपी गुणवत्ता मानक में संक्रमण केवल जनवरी 2014 तक होना चाहिए) , और यह अकेले घटिया गुणवत्ता वाले जेनरिक प्राप्त करने का एक अच्छा कारण बनाता है।
जेनेरिक दवाओं का चयन करते समय एक व्यवसायी को क्या निर्देशित किया जाना चाहिए?
एक सरल प्रश्न यह भी उठता है: चिकित्सकों को दवा का चयन करते समय क्या करना चाहिए, विशेष रूप से ऐसे मामलों में जहां यह उपचार दीर्घकालिक है और जिसकी गुणवत्ता रोगी के भाग्य को प्रभावित कर सकती है, उदाहरण के लिए, हृदय में हृदय संबंधी जटिलताओं की माध्यमिक रोकथाम में मरीजों भारी जोखिम. एक ओर, सभी नियमों, साथ ही आर्थिक व्यवहार्यता, डॉक्टर को जेनेरिक का उपयोग पहले स्थान पर करें (यदि यह पंजीकृत है)। दूसरी ओर, कई अच्छी तरह से डिज़ाइन किए गए नैदानिक अध्ययन (अनियंत्रित अध्ययनों की गिनती नहीं है) से संकेत मिलता है कि सभी जेनरिक पूर्ण प्रतियां नहीं हैं। फार्मास्युटिकल कंपनियां इन तथ्यों का कुशलता से उपयोग करती हैं, यह दावा करते हुए कि सभी जेनरिक दोषपूर्ण दवाएं हैं और उनका उपयोग करते हुए, डॉक्टर जानबूझकर कम निर्धारित करते हैं प्रभावी चिकित्सा.
अधिकांश रूसी विशेषज्ञ, उपरोक्त तथ्यों को पहचानते हुए, यह निष्कर्ष निकालते हैं कि उन जेनरिक के साथ चिकित्सीय तुल्यता का अध्ययन करने के लिए प्रत्यक्ष तुलनात्मक अध्ययन करना आवश्यक है जो पहले से पंजीकृत हैं और अक्सर क्लिनिक में निर्धारित होते हैं। रूस में जेनरिक के साथ बनाया गया।
इस प्रकार, एक ओर, इसमें संदेह करने का कोई कारण नहीं है कि एक जेनेरिक - मूल दवा की एक पूरी प्रति - का निर्माण बिल्कुल संभव है। हालांकि, जेनेरिक के विकास और उत्पादन में कुछ विचलन इसकी गुणवत्ता को प्रभावित कर सकते हैं। आदर्श रूप से, इन विचलनों को संपूर्ण प्रीक्लिनिकल नियंत्रण प्रणाली द्वारा दर्ज किया जाना चाहिए, हालांकि, व्यवहार में, जाहिरा तौर पर, यह प्रणाली हमेशा स्पष्ट रूप से नहीं देखी जाती है, जो अपूर्ण समकक्ष जेनरिक की उपस्थिति की ओर ले जाती है। ऐसे मामलों में, जेनेरिक की गुणवत्ता की पुष्टि करने का एकमात्र तरीका चिकित्सीय तुल्यता का अध्ययन करने के लिए व्यवस्थित रूप से अच्छी तरह से डिज़ाइन किए गए तुलनात्मक नैदानिक परीक्षण करना है। इस तरह के अध्ययनों के परिणाम लागत-प्रभावशीलता और इसकी पहुंच दोनों के संदर्भ में हस्तक्षेप की तर्कसंगतता के प्रश्न का अधिक सटीक उत्तर प्रदान करेंगे।
ग्रन्थसूची
- मार्टसेविच एस.यू. दवाओं की प्रतियां, कला में प्रतियों की तरह, भिन्न होती हैं। एआईएफ। स्वास्थ्य 2010; 4:2-3.
- मार्टसेविच एस.यू. प्रतिस्थापन गोलियाँ। सस्ती और महंगी दवाओं में क्या अंतर है? एआईएफ। स्वास्थ्य 2011, 8:35।
- कारपोव यू.ए., नेडोगोडा एस.वी., किसलयक ओ.ए., देव ए.डी. एट अल मूल कार्यक्रम के मुख्य परिणाम। कार्डियोलॉजी 2011; 3:36-41.
- जॉनसन ए, स्टेलास पी, स्टरगियो जी। उच्च रक्तचाप में दवा प्रतिस्थापन की प्रभावशीलता, सुरक्षा और लागत। ब्र जे क्लिन फार्माकोल 70: 3; 320-334।
- www. समान जैविक औषधीय उत्पादों पर दिशानिर्देश (सीएचएमपी/437/04 .)
- जेनेरिक ड्रग सबस्टीट्यूशन पर वर्ल्ड मेडिकल एसोसिएशन स्टेटमेंट, 41वीं वर्ल्ड मेडिकल असेंबली हांगकांग द्वारा अपनाया गया, सितंबर 1989 और WMA जनरल असेंबली, सैंटियागो 2005 में रद्द कर दिया गया।
- VNOK की सिफारिशें "हृदय रोगों के रोगियों की तर्कसंगत फार्माकोथेरेपी"। के हिस्से के रूप में कार्यकारी समूह: मार्टसेविच एस.यू., एनिचकोव डी.ए., बेलोलिपेत्सकाया वी.जी., कोंटसेवया ए.वी., कुटीशेंको एन.पी., लुकिना यू.वी., टॉल्पीगिना एस.एन., शिलोवा ई.वी., याकुसेविच वी.वी. कार्डियोवैस्क टेर प्रोफाइल 2009; 6: परिशिष्ट 4: 56 सी।
- याकुसेविच वी.वी. गुणवत्ता वाली दवा: यह क्या होना चाहिए। कार्डियोलॉजी 2006 में तर्कसंगत फार्माकोथेरेपी; 4:41-46.
- रेवेल्स्की आई.ए. औषधीय पदार्थों और उनके आधार पर तैयारियों के तुलनात्मक शारीरिक मूल्यांकन के लिए एक विधि। Roszdravnadzor 2009 का बुलेटिन; 4:48-51.
- मार्टसेविच एस.यू., कुटीशेंको एन.पी., देव ए.डी. मूल दवाएंऔर कार्डियोलॉजी में जेनरिक। क्या विनिमेयता की समस्या को हल करना संभव है। Roszdravnadzor 2009 का बुलेटिन; 4:48-51.