ऑनलाइन टेस्ट
- क्या आप स्तन कैंसर के प्रति संवेदनशील हैं? (प्रश्न: 8)
स्वतंत्र रूप से यह निर्णय लेने के लिए कि बीआरसीए 1 और बीआरसीए 2 जीन में उत्परिवर्तन निर्धारित करने के लिए आनुवंशिक परीक्षण करना आपके लिए कितना महत्वपूर्ण है, कृपया इस परीक्षण के प्रश्नों का उत्तर दें...
रक्तवर्णकता
हेमोक्रोमैटोसिस क्या है -
प्राथमिक हेमोक्रोमैटोसिस (पीएचसी) एक ऑटोसोमल रिसेसिव, एचएलए-संबंधित बीमारी है जो एक आनुवंशिक दोष के कारण होती है जो एक चयापचय विकार द्वारा विशेषता होती है जिसमें गैस्ट्रोइंटेस्टाइनल ट्रैक्ट में लौह का अवशोषण बढ़ जाता है।
हेमोक्रोमैटोसिस को क्या उत्तेजित करता है/कारण:
इस बीमारी का वर्णन सबसे पहले 1871 में एम. ट्रोइसियर ने एक लक्षण जटिल के रूप में किया था, जो शरीर में आयरन के संचय से जुड़े मधुमेह मेलेटस, त्वचा रंजकता और यकृत सिरोसिस की विशेषता थी। 1889 में, रेक्लिंगहौसेन ने "हेमोक्रोमैटोसिस" शब्द पेश किया, जो बीमारी की विशेषताओं में से एक को दर्शाता है: असामान्य त्वचा का रंग और आंतरिक अंग. यह पाया गया कि आयरन पहले यकृत की पैरेन्काइमल कोशिकाओं में जमा होता है, और फिर अन्य अंगों (अग्न्याशय, हृदय, जोड़ों, पिट्यूटरी ग्रंथि) में जमा हो सकता है।
व्यापकता.जनसंख्या आनुवंशिक अध्ययनों ने पीएचसी की एक दुर्लभ बीमारी के रूप में समझ को बदल दिया है। पीएचसी जीन की व्यापकता 0.03-0.07% है - इसलिए, हाल तक, प्रति 100 हजार जनसंख्या पर 3-8 मामले देखे गए थे। श्वेत आबादी में, समयुग्मजीता की आवृत्ति 0.3% है, विषमयुग्मजी गाड़ी की आवृत्ति 8-10% है। बेहतर निदान के कारण घटनाओं में वृद्धि हुई है। यूरोपीय समुदाय के निवासियों के बीच घटना दर औसतन 1:300 है। डब्ल्यूएचओ के अनुसार, 10% आबादी हेमोक्रोमैटोसिस से ग्रस्त है। पुरुष महिलाओं की तुलना में लगभग 10 गुना अधिक बार बीमार पड़ते हैं।
हेमोक्रोमैटोसिस के दौरान रोगजनन (क्या होता है?)
आम तौर पर, शरीर में लगभग 4 ग्राम आयरन होता है, जिसमें से जी हीमोग्लोबिन, मायोग्लोबिन, कैटालेज़ और अन्य रेस्पिरेटर-बिक्स पिगमेंट या एंजाइम में होता है। लौह भंडार 0.5 ग्राम है, जिनमें से कुछ यकृत में हैं, लेकिन कब हिस्टोलॉजिकल परीक्षावे पारंपरिक तरीकों का उपयोग करके लोहे पर दिखाई नहीं देते हैं। आम तौर पर, मानव दैनिक आहार में लगभग 10-20 मिलीग्राम आयरन (90% मुक्त खड़े, 10% हेम के साथ संयोजन में) होता है, जिसमें से 1-1.5 मिलीग्राम अवशोषित होता है।
अवशोषित आयरन की मात्रा शरीर में इसके भंडार पर निर्भर करती है: जितनी अधिक आवश्यकता, उतना अधिक आयरन अवशोषित होता है। अवशोषण मुख्यतः ऊपरी भागों में होता है छोटी आंतऔर यह एक सक्रिय प्रक्रिया है जिसमें लोहे को सांद्रण प्रवणता के विपरीत आगे ले जाया जा सकता है। हालाँकि, स्थानांतरण तंत्र अज्ञात हैं।
आंतों के म्यूकोसा की कोशिकाओं में साइटोसोल में आयरन पाया जाता है। इसका कुछ हिस्सा फेरिटिन के रूप में बंधा और संग्रहीत होता है, जो बाद में उपकला कोशिकाओं के विलुप्त होने के परिणामस्वरूप या तो उपयोग किया जाता है या खो जाता है। अन्य ऊतकों में चयापचय के लिए इच्छित लौह का कुछ हिस्सा कोशिका के बेसोलेटरल झिल्ली में ले जाया जाता है और ट्रांसफ़रिन से बंध जाता है, जो रक्त में लौह के लिए मुख्य परिवहन प्रोटीन है। कोशिकाओं में, आयरन को फेरिटिन के रूप में जमा किया जाता है - आयरन के साथ प्रोटीन एपोफेरिटिन का एक कॉम्प्लेक्स। टूटे हुए फ़ेरिटिन अणुओं के गुच्छे हीमोसाइडरिन हैं। शरीर में लगभग एक तिहाई लौह भंडार हेमोसाइडरिन के रूप में होता है, जिसकी मात्रा अतिरिक्त लौह संचय से जुड़ी बीमारियों में बढ़ जाती है।
हेमोक्रोमैटोसिस के साथ, पाचन तंत्र में लोहे का अवशोषण 3.0-4.0 मिलीग्राम तक बढ़ जाता है। इस प्रकार, 1 वर्ष के भीतर, यकृत, अग्न्याशय, हृदय और अन्य अंगों और ऊतकों की कोशिकाओं में जमा इसकी अतिरिक्त मात्रा लगभग 1 ग्राम है। अंततः, शरीर के इंट्रा- और बाह्य कोशिकीय पूल आयरन से अत्यधिक संतृप्त हो जाते हैं, जो मुक्त आयरन की अनुमति देता है विषाक्त अंतःकोशिकीय प्रतिक्रियाओं में प्रवेश करना। एक मजबूत रेडॉक्स पदार्थ होने के कारण, आयरन मुक्त हाइड्रॉक्सिल रेडिकल बनाता है, जो बदले में लिपिड, प्रोटीन और डीएनए के मैक्रोमोलेक्यूल्स को नष्ट कर देता है।
लीवर में आयरन के बढ़ते संचय की विशेषता है:
- लिवर की फाइब्रोसिस और सिरोसिस, पैरेन्काइमल कोशिकाओं में लोहे के प्रारंभिक प्रमुख संचय के साथ, कुछ हद तक स्टेलेट रेटिकुलोएन्डोथेलियोसाइट्स में।
- अग्न्याशय, हृदय, पिट्यूटरी ग्रंथि सहित अन्य अंगों में लोहे का जमाव।
- लोहे के अवशोषण में वृद्धि, जिससे इसका अवशोषण और संचय होता है।
यह रोग तथाकथित मिसेन म्यूटेशन से जुड़ा है, यानी ऐसे उत्परिवर्तन जो कोडन के अर्थ में परिवर्तन का कारण बनते हैं और प्रोटीन जैवसंश्लेषण को रोकते हैं।
पीएचसी की आनुवंशिक प्रकृति की पुष्टि एम. साइमन एट अल द्वारा की गई थी। 1976 में, जिन्होंने यूरोपीय आबादी के प्रतिनिधियों में प्रमुख हिस्टोकम्पैटिबिलिटी कॉम्प्लेक्स के कुछ एंटीजन के साथ बीमारी के करीबी संबंध का खुलासा किया। नैदानिक अभिव्यक्ति के लिए, रोगी के पास दो पीएचसी एलील (होमोज़ायगोसिटी) होने चाहिए। रोगी के लिए सामान्य रूप से एक एचएलए हैप्लोटाइप की उपस्थिति पीएचसी एलील के विषमयुग्मजी परिवहन को इंगित करती है। ऐसे व्यक्ति अप्रत्यक्ष संकेत दिखा सकते हैं जो शरीर में आयरन के स्तर में वृद्धि और नैदानिक रूप से महत्वपूर्ण लक्षणों की अनुपस्थिति का संकेत देते हैं। विषमयुग्मजी जीन वाहक समयुग्मजी से अधिक प्रबल होता है। यदि माता-पिता दोनों विषमयुग्मजी हैं, तो छद्मप्रमुख प्रकार का वंशानुक्रम संभव है। हेटेरोजाइट्स में, लोहे का अवशोषण आमतौर पर थोड़ा बढ़ जाता है, रक्त सीरम में लोहे की थोड़ी वृद्धि का पता लगाया जाता है, लेकिन सूक्ष्म तत्व का जीवन-घातक अधिभार नहीं देखा जाता है। उसी समय, यदि हेटेरोज़ायगोट्स लौह चयापचय के विकारों के साथ अन्य बीमारियों से पीड़ित हैं, तो रोग प्रक्रिया के नैदानिक और रूपात्मक लक्षण प्रकट हो सकते हैं।
एचएलए एंटीजन के साथ रोग के घनिष्ठ संबंध ने पीजीसी के लिए जिम्मेदार जीन को स्थानीयकृत करना संभव बना दिया, जो क्रोमोसोम 6 की छोटी भुजा पर स्थित है, एचएलए प्रणाली के ए लोकस के पास और ए 3 एलील और हैप्लोटाइप ए 3 बी 7 या ए 3 बी 14 से जुड़ा हुआ है। . यह तथ्य इसकी पहचान के उद्देश्य से किए गए शोध के आधार के रूप में कार्य करता है।
वंशानुगत हेमोक्रोमैटोसिस को शुरू में एक साधारण मोनोजेनिक बीमारी माना जाता था। वर्तमान में, जीन दोष के अनुसार और नैदानिक तस्वीरपीएचसी के 4 रूप हैं:
- क्लासिकल ऑटोसोमल रिसेसिव HFE-1;
- किशोर एचएफई-2;
- एचएफई-3, ट्रांसफ़रिन रिसेप्टर प्रकार 2 में उत्परिवर्तन के साथ जुड़ा हुआ;
- ऑटोसोमल डोमिनेंट हेमोक्रोमैटोसिस एचएफई-4।
एचएफई जीन की पहचान (हेमोक्रोमैटोसिस के विकास से जुड़ी) थी महत्वपूर्ण बिंदुरोग के सार को समझने में. एचएफई जीन 343 अमीनो एसिड से युक्त एक प्रोटीन संरचना को एनकोड करता है, जिसकी संरचना एमएचसी वर्ग I प्रणाली के अणु के समान है। हेमोक्रोमैटोसिस से पीड़ित व्यक्तियों में इस जीन में उत्परिवर्तन की पहचान की गई है। जातीय रूसियों के बीच एक समयुग्मजी अवस्था में C282Y एलील के वाहक प्रति 1000 लोगों में कम से कम 1 हैं। लौह चयापचय में एचएफई की भूमिका ट्रांसफ़रिन रिसेप्टर (टीएफआर) के साथ एचएफई की बातचीत से प्रदर्शित होती है। टीएफआर के साथ एचएफई का जुड़ाव आयरन-बाउंड ट्रांसफ़रिन के लिए इस रिसेप्टर की आत्मीयता को कम कर देता है। C282U उत्परिवर्तन के साथ, HFE TfR से बिल्कुल भी बंधने में सक्षम नहीं है, और H63D उत्परिवर्तन के साथ, TfR के लिए आत्मीयता कुछ हद तक कम हो जाती है। एक्स-रे क्रिस्टलोग्राफी का उपयोग करके एचएफई की त्रि-आयामी संरचना का अध्ययन किया गया, जिससे एचएफई और 2 मीटर प्रकाश श्रृंखला के बीच बातचीत की प्रकृति को स्थापित करना संभव हो गया, साथ ही हेमोक्रोमैटोसिस की विशेषता वाले उत्परिवर्तन के स्थानीयकरण का निर्धारण करना संभव हो गया।
C282U उत्परिवर्तन से डोमेन में डाइसल्फ़ाइड बंधन टूट जाता है, जो प्रोटीन की सही स्थानिक संरचना के निर्माण और 2m तक इसके बंधन में महत्वपूर्ण है। सबसे बड़ी मात्राएचएफई प्रोटीन का उत्पादन गहरे तहखानों में होता है ग्रहणी. आम तौर पर, क्रिप्टन कोशिकाओं में एचएफई प्रोटीन की भूमिका ट्रांसफ़रिन से बंधे लोहे के अवशोषण को नियंत्रित करना है। एक स्वस्थ व्यक्ति में इसका स्तर बढ़ जाता है सीरम आयरनगहरी क्रिप्ट कोशिकाओं द्वारा इसके अवशोषण में वृद्धि होती है (प्रक्रिया टीएफआर द्वारा मध्यस्थ और एचएफई द्वारा संशोधित होती है)। C282Y उत्परिवर्तन क्रिप्ट कोशिकाओं द्वारा TfR-मध्यस्थता वाले लौह अवशोषण को ख़राब कर सकता है और इस प्रकार शरीर में कम लौह स्थिति का गलत संकेत उत्पन्न कर सकता है।
इंट्रासेल्युलर लौह सामग्री में कमी के कारण, विली के शीर्ष पर स्थानांतरित होने वाले विभेदित एंटरोसाइट्स डीएमटी -1 की बढ़ी हुई मात्रा का उत्पादन करना शुरू कर देते हैं, जिसके परिणामस्वरूप लौह ग्रहण बढ़ जाता है। रोगजनन में मुख्य कड़ी एंजाइम प्रणालियों में एक आनुवंशिक दोष है जो भोजन से सामान्य सेवन के दौरान आंत में लोहे के अवशोषण को नियंत्रित करता है। एचएलए-ए प्रणाली के साथ आनुवंशिक संबंध सिद्ध हो चुका है। इन मार्करों का उपयोग करके लिंकेज असंतुलन के एक अध्ययन में एज़, बी 7, बीटी 4, डी 6 सियोश डी 6 एस 126 ओ के साथ हेमोक्रोमैटोसिस का संबंध दिखाया गया है।
इस दिशा में आगे के शोध और हैप्लोटाइप के विश्लेषण से पता चलता है कि जीन D6 S2238 और D6 S2241 के बीच स्थित है। अनुमानित हेमोक्रोमैटोसिस जीन एचएलए समरूप है, और उत्परिवर्तन कार्यात्मक रूप से महत्वपूर्ण क्षेत्र को प्रभावित करता प्रतीत होता है। शरीर में लौह तत्व को नियंत्रित करने वाला जीन गुणसूत्र 6 पर A3HLA स्थान पर स्थित होता है। यह जीन एक प्रोटीन की संरचना को एनकोड करता है जो ट्रांसफ़रिन रिसेप्टर के साथ इंटरैक्ट करता है और ट्रांसफ़रिन-आयरन कॉम्प्लेक्स के लिए रिसेप्टर की आत्मीयता को कम करता है। इस प्रकार, एचएफई जीन उत्परिवर्तन डुओडनल एंटरोसाइट्स द्वारा आयरन के ट्रांसफ़रिन-मध्यस्थ ग्रहण को बाधित करता है, जिसके परिणामस्वरूप शरीर में कम आयरन सामग्री की उपस्थिति के बारे में एक गलत संकेत बनता है, जिसके परिणामस्वरूप आयरन का उत्पादन बढ़ जाता है। एंटरोसाइट्स के विली में प्रोटीन डीसीटी-1 को बांधना और इसके परिणामस्वरूप आयरन की मात्रा में वृद्धि कैसे होती है।
संभावित विषाक्तता को इसकी क्षमता से समझाया जाता है, चर वैलेंस के साथ एक धातु के रूप में, मूल्यवान मुक्त कण प्रतिक्रियाओं को ट्रिगर करने के लिए जो कोशिका के ऑर्गेनेल और आनुवंशिक संरचनाओं को विषाक्त क्षति पहुंचाती है, कोलेजन संश्लेषण में वृद्धि और ट्यूमर के विकास को जन्म देती है। हेटेरोज़ीगोट्स सीरम आयरन में मामूली वृद्धि दिखाते हैं लेकिन कोई अतिरिक्त आयरन संचय या ऊतक क्षति नहीं होती है।
हालाँकि, ऐसा तब हो सकता है जब हेटेरोज़ायगोट्स लौह चयापचय संबंधी विकारों के साथ अन्य बीमारियों से भी पीड़ित हों।
माध्यमिक हेमोक्रोमैटोसिस अक्सर रक्त रोगों, विलंबित त्वचीय पोर्फिरीया, बार-बार रक्त संक्रमण और लौह युक्त दवाओं के सेवन की पृष्ठभूमि के खिलाफ विकसित होता है।
हेमोक्रोमैटोसिस के लक्षण:
नैदानिक अभिव्यक्तियों की विशेषताएं:
रोग की नैदानिक अभिव्यक्तियाँ वयस्कता की शुरुआत के बाद विकसित होती हैं, जब शरीर में लौह भंडार 20-40 ग्राम या उससे अधिक तक पहुंच जाता है।
रोग के विकास में तीन चरण होते हैं:
- आनुवंशिक प्रवृत्ति के कारण लौह अधिभार के बिना;
- नैदानिक अभिव्यक्तियों के बिना लौह अधिभार;
- नैदानिक अभिव्यक्तियों का चरण।
रोग की शुरुआत धीरे-धीरे होती है। में आरंभिक चरणकई वर्षों से, पुरुषों में गंभीर कमजोरी, थकान, वजन कम होना और यौन क्रिया में कमी की शिकायतें बनी हुई हैं। अक्सर दाहिने हाइपोकॉन्ड्रिअम में दर्द होता है, बड़े जोड़ों के चोंड्रोकैल्सीनोसिस के कारण जोड़ों, त्वचा, अंडकोष में सूखापन और एट्रोफिक परिवर्तन होता है।
रोग के उन्नत चरण की विशेषता क्लासिक ट्रायड द्वारा की जाती है। त्वचा का रंजकता, श्लेष्मा झिल्ली, यकृत सिरोसिस और मधुमेह।
पिग्मेंटेशन आम में से एक है और प्रारंभिक लक्षणहेमोक्रोमैटोसिस इसकी गंभीरता प्रक्रिया की अवधि पर निर्भर करती है। कांस्य, धुएँ के रंग की त्वचा का रंग शरीर के खुले हिस्सों (चेहरे, गर्दन, हाथ), पहले से रंगे हुए क्षेत्रों, बगल, जननांगों पर अधिक दिखाई देता है।
अधिकांश रोगियों में, आयरन मुख्य रूप से यकृत में जमा होता है। लगभग सभी रोगियों में लीवर का बढ़ना देखा जाता है। यकृत की स्थिरता घनी होती है, सतह चिकनी होती है, कुछ मामलों में इसका दर्द स्पर्श करने पर होता है। 25-50% रोगियों में स्प्लेनोमेगाली का पता लगाया जाता है। एक्स्ट्राहेपेटिक लक्षण दुर्लभ हैं। 80% रोगियों में युग्मित मधुमेह देखा जाता है। वह अक्सर इंसुलिन पर निर्भर रहता है।
अंतःस्रावी विकार पिट्यूटरी, एपिफेसिस, अधिवृक्क ग्रंथियों के हाइपोफंक्शन के रूप में देखे जाते हैं। थाइरॉयड ग्रंथि(रोगियों का 1/3) गोनाड। विभिन्न प्रकार 80% से अधिक रोगियों में एंडोक्राइनोपैथी होती है। पैथोलॉजी का सबसे आम रूप है मधुमेह.
पीसीएच के साथ हृदय में लोहे का जमाव 90-100% मामलों में देखा जाता है, हालांकि, हृदय क्षति की नैदानिक अभिव्यक्तियाँ केवल 25-35% रोगियों में पाई जाती हैं। कार्डियोमायोपैथी के साथ हृदय के आकार में वृद्धि, लय गड़बड़ी और दुर्दम्य हृदय विफलता का क्रमिक विकास होता है।
शायद आर्थ्रोपैथी के साथ हेमोक्रोमैटोसिस का संयोजन, चोंड्रोकाल्सीनोसिस, कैल्सीयूरिया के साथ ऑस्टियोपोरोसिस, न्यूरोसाइकियाट्रिक विकार, तपेदिक, पोर्फिरीया कटानिया टार्डा।
गंभीर नैदानिक अभिव्यक्तियों और टर्मिनल हेमोक्रोमैटोसिस के साथ अव्यक्त (आनुवंशिक प्रवृत्ति और न्यूनतम लौह अधिभार वाले रोगियों सहित) आवंटित करें। हेपेटोपैथिक, कार्डियोपैथिक, एंडोक्राइनोलॉजिकल रूप अधिक सामान्य हैं: क्रमशः, धीरे-धीरे प्रगतिशील, तेजी से प्रगतिशील, और एक तीव्र पाठ्यक्रम वाला एक रूप।
पीएचसी की गुप्त अवस्था 30-40% रोगियों में देखी जाती है, जिसका पता रोगियों के रिश्तेदारों की पारिवारिक आनुवंशिक जांच या जनसंख्या स्क्रीनिंग के दौरान लगाया जाता है। वृद्धावस्था समूह के इन लोगों में से कुछ में हल्की कमजोरी, बढ़ी हुई थकान, दाहिने हाइपोकॉन्ड्रिअम में भारीपन की भावना, शरीर के खुले क्षेत्रों में त्वचा का रंजकता, कामेच्छा में कमी और मामूली हेपेटोमेगाली के रूप में न्यूनतम लक्षण होते हैं।
उन्नत नैदानिक अभिव्यक्तियों के चरण में एस्थेनोवैगेटिव सिंड्रोम, पेट में दर्द, कभी-कभी काफी तीव्र, आर्थ्राल्जिया, 50% पुरुषों में कामेच्छा और शक्ति में कमी और 40% महिलाओं में एमेनोरिया की उपस्थिति की विशेषता होती है। इसके अलावा, वजन में कमी, कार्डियालगिया और दिल की धड़कन बढ़ सकती है। पर वस्तुनिष्ठ परीक्षाहेपेटोमेगाली, मेलास्मा, और अग्न्याशय की शिथिलता (इंसुलिन-निर्भर मधुमेह मेलिटस) का पता लगाया जाता है।
पीएचसी के अंतिम चरण में, अंगों और प्रणालियों के विघटन के लक्षण पोर्टल उच्च रक्तचाप के गठन, हेपैटोसेलुलर के विकास के साथ-साथ दाएं और बाएं वेंट्रिकुलर हृदय विफलता के रूप में देखे जाते हैं। मधुमेह कोमा, थकावट। ऐसे रोगियों में मृत्यु के कारण, एक नियम के रूप में, अन्नप्रणाली की वैरिकाज़ नसों से रक्तस्राव, हेपैटोसेलुलर और हृदय विफलता, एसेप्टिक पेरिटोनिटिस और मधुमेह कोमा हैं।
ऐसे रोगियों में ट्यूमर प्रक्रिया विकसित होने की संभावना होती है (55 वर्ष से अधिक उम्र के लोगों में इसके विकास का जोखिम सामान्य आबादी की तुलना में 13 गुना बढ़ जाता है)।
जुवेनाइल हेमोक्रोमैटोसिस बीमारी का एक दुर्लभ रूप है जो कम उम्र (15-30 वर्ष) में होता है और इसमें गंभीर आयरन अधिभार, यकृत और हृदय क्षति के लक्षणों के साथ होता है।
हेमोक्रोमैटोसिस का निदान:
नैदानिक विशेषताएं:
निदान कई अंगों के घावों, एक ही परिवार के कई सदस्यों में रोग के मामलों पर आधारित है। बढ़ी हुई सामग्रीआयरन, मूत्र में आयरन का उत्सर्जन, रक्त सीरम में ट्रांसफ़रिन, फ़ेरिटिन की उच्च सांद्रता। मधुमेह मेलिटस, कार्डियोमायोपैथी, हाइपोगोनाडिज्म और विशिष्ट त्वचा रंजकता के साथ संयुक्त होने पर निदान की संभावना होती है। प्रयोगशाला मानदंडों में हाइपरफ़ेरेमिया, बढ़ा हुआ ट्रांसफ़रिन संतृप्ति सूचकांक (45% से अधिक) शामिल हैं। सीरम फ़ेरिटिन का स्तर और मूत्र में लौह उत्सर्जन (डिस्फ़रल परीक्षण) तेजी से बढ़ता है। बाद इंट्रामस्क्युलर इंजेक्शन 0.5 ग्राम डेस्फेरल, लौह उत्सर्जन 10 मिलीग्राम/दिन (1.5 मिलीग्राम/दिन के मानक पर) तक बढ़ जाता है, IF अनुपात (आयरन/TIB) बढ़ जाता है। व्यवहार में आनुवंशिक परीक्षण की शुरूआत के साथ, हेमोक्रोमैटोसिस वाले लोगों की संख्या कम हो गई है चिकत्सीय संकेतलौह अधिभार. लौह अधिभार विकसित होने के जोखिम वाले समूह में C282Y/H63D उत्परिवर्तन की उपस्थिति के लिए एक अध्ययन किया गया है। यदि रोगी C282Y/H63D का समयुग्मजी वाहक है, तो वंशानुगत हेमोक्रोमैटोसिस का निदान स्थापित माना जा सकता है।
गैर-आक्रामक अनुसंधान विधियों में, एमआरआई का उपयोग करके यकृत में सूक्ष्म तत्व का जमाव निर्धारित किया जा सकता है। यह विधि आयरन से भरे लीवर की सिग्नल तीव्रता को कम करने पर आधारित है। इस मामले में, सिग्नल की तीव्रता में कमी की डिग्री लोहे के भंडार के समानुपाती होती है। विधि आपको अग्न्याशय, हृदय और अन्य अंगों में अतिरिक्त लौह जमाव का निर्धारण करने की अनुमति देती है।
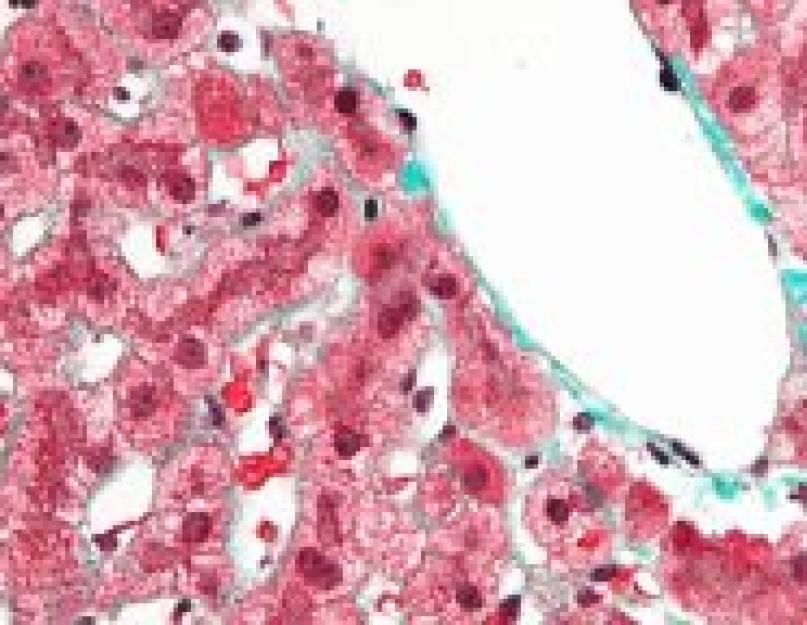
लिवर बायोप्सी से आयरन के प्रचुर मात्रा में जमाव का पता चलता है, जो देता है सकारात्मक प्रतिक्रियापर्ल्स. एक स्पेक्ट्रोफोटोमेट्रिक अध्ययन में, लौह तत्व यकृत के शुष्क भार का 1.5% से अधिक है। परमाणु अवशोषण स्पेक्ट्रोमेट्री का उपयोग करके लिवर आयरन इंडेक्स की बाद की गणना के साथ लिवर बायोप्सी में आयरन के स्तर की मात्रात्मक माप को महत्व दिया जाता है। सूचकांक रोगी की उम्र (वर्षों में) के लिए यकृत में लौह सांद्रता (µmol/g शुष्क वजन में) के अनुपात को दर्शाता है। पीएचसी के मामले में, पहले से ही प्रारंभिक चरण में, यह सूचक 1.9-2.0 के बराबर या उससे अधिक है और यकृत के हेमोसिडरोसिस द्वारा विशेषता अन्य स्थितियों में निर्दिष्ट मूल्य तक नहीं पहुंचता है।
रोग के अव्यक्त चरण में, कार्यात्मक यकृत परीक्षण व्यावहारिक रूप से नहीं बदलते हैं, और हिस्टोलॉजिकल परीक्षा के अनुसार, ग्रेड 4 हेमोसिडरोसिस और पोर्टल पथ के फाइब्रोसिस सूजन घुसपैठ के स्पष्ट संकेतों के बिना देखे जाते हैं।
उन्नत नैदानिक अभिव्यक्तियों के चरण में, यकृत में हिस्टोलॉजिकल परिवर्तन आमतौर पर हेपेटोसाइट्स में हेमोसाइडरिन के बड़े पैमाने पर जमाव और मैक्रोफेज और एपिथेलियम में कम महत्वपूर्ण जमाव के साथ पिगमेंटेड सेप्टल या छोटे-गांठदार सिरोसिस के अनुरूप होते हैं। पित्त नलिकाएं.
रोग के अंतिम चरण में हिस्टोलॉजिकल परीक्षण से लीवर (जैसे मोनो- और मल्टीलोबुलर सिरोसिस), हृदय, अग्न्याशय, थायरॉयड, लार और पसीने की ग्रंथियों, अधिवृक्क ग्रंथियों, पिट्यूटरी ग्रंथि और अन्य अंगों को नुकसान के साथ सामान्यीकृत हेमोसिडरोसिस की तस्वीर का पता चलता है।
आयरन अधिभार कई जन्मजात या अधिग्रहित स्थितियों में देखा जाता है जिसके साथ पीएचसी को अलग करना आवश्यक है।
लौह अधिभार के विकास का वर्गीकरण और कारण:
- हेमोक्रोमैटोसिस के पारिवारिक या जन्मजात रूप:
- जन्मजात एचएफई-संबंधित हेमोक्रोमैटोसिस:
- C282Y के लिए समयुग्मजी;
- C282Y/H63D के लिए मिश्रित विषमयुग्मजीता।
- जन्मजात एचएफई-गैर-संबद्ध हेमोक्रोमैटोसिस।
- किशोर हेमोक्रोमैटोसिस।
- नवजात शिशुओं में आयरन की अधिकता।
- ऑटोसोमल प्रमुख हेमोक्रोमैटोसिस।
- जन्मजात एचएफई-संबंधित हेमोक्रोमैटोसिस:
- अधिग्रहीत लौह अधिभार:
- रुधिर संबंधी रोग:
- आयरन की अधिकता के कारण एनीमिया;
- थैलेसीमिया मेजर;
- साइडरोबलास्टिक एनीमिया;
- क्रोनिक हेमोलिटिक एनीमिया।
- रुधिर संबंधी रोग:
- जीर्ण यकृत रोग:
- हेपेटाइटिस सी;
- शराबी जिगर की बीमारी;
- गैर-अल्कोहलिक स्टीटोहेपेटाइटिस।
रोग को रक्त विकृति विज्ञान (थैलेसीमिया, साइडरोबलास्टिक एनीमिया, वंशानुगत एट्रांसफेरिनमिया, माइक्रोसाइटिक एनीमिया, पोर्फिरीया कटानिया टार्डा), यकृत रोग (अल्कोहल यकृत रोग, क्रोनिक वायरल हेपेटाइटिस, गैर-अल्कोहल स्टीटोहेपेटाइटिस) से भी अलग किया जाना चाहिए।
हेमोक्रोमैटोसिस का उपचार:
हेमोक्रोमैटोसिस के उपचार की विशेषताएं:
आयरन युक्त खाद्य पदार्थों के बिना, प्रोटीन से भरपूर आहार का संकेत दिया जाता है।
शरीर से अतिरिक्त आयरन को निकालने का सबसे सुलभ तरीका रक्तपात है। आमतौर पर सप्ताह में 1-2 बार के अंतराल पर 300-500 मिलीलीटर रक्त निकाला जाता है। रक्तपात की संख्या की गणना हीमोग्लोबिन के स्तर, रक्त हेमाटोक्रिट, फेरिटिन और अतिरिक्त आयरन की मात्रा के आधार पर की जाती है। यह ध्यान में रखा जाता है कि 500 मिलीलीटर रक्त में 200-250 मिलीग्राम आयरन होता है, मुख्य रूप से लाल रक्त कोशिकाओं के हीमोग्लोबिन में। रक्तपात तब तक जारी रखा जाता है जब तक रोगी में एनीमिया विकसित न हो जाए हल्की डिग्री. इस एक्स्ट्राकोर्पोरियल तकनीक का एक संशोधन साइटाफेरेसिस (सीए) है (एक बंद सर्किट में ऑटोप्लाज्मा की वापसी के साथ रक्त के सेलुलर भाग को हटाना)। रक्त कोशिकाओं के यांत्रिक निष्कासन के अलावा, सीए में विषहरण प्रभाव होता है और अपक्षयी-भड़काऊ प्रक्रियाओं की गंभीरता को कम करने में मदद करता है। प्रत्येक रोगी को सीए के 8-10 सत्रों से गुजरना पड़ता है, जिसके बाद 3 महीने के लिए 2-3 सत्रों की मात्रा में सीए या हेमोएक्सफ़्यूज़न का उपयोग करके रखरखाव चिकित्सा में संक्रमण होता है।
औषधि उपचार इंट्रामस्क्युलर या अंतःशिरा में 10% समाधान के 10 मिलीलीटर डेफेरोक्सामाइन (डेस्फेरल, डेस्फेरिन) के उपयोग पर आधारित है। दवा में Fe3+ आयनों के प्रति उच्च विशिष्ट गतिविधि है। वहीं, 500 मिलीग्राम डेस्फेरल शरीर से 42.5 मिलीग्राम आयरन निकाल सकता है। कोर्स की अवधि 20-40 दिन है। साथ ही सिरोसिस, मधुमेह और हृदय विफलता का इलाज किया जाता है। पीएचसी के रोगियों में यकृत ऊतक में अतिरिक्त आयरन की उपस्थिति में अक्सर देखा जाने वाला एनीमिया सिंड्रोम, अपवाही चिकित्सा के उपयोग को सीमित करता है। हमारे क्लिनिक ने सीए की पृष्ठभूमि के खिलाफ पुनः संयोजक एरिथ्रोपोइटिन के उपयोग के लिए एक आहार विकसित किया है। दवा शरीर के डिपो से आयरन के उपयोग में वृद्धि को बढ़ावा देती है, जिसके परिणामस्वरूप सूक्ष्म तत्व के कुल भंडार में कमी आती है और हीमोग्लोबिन के स्तर में वृद्धि होती है। 10-15 सप्ताह के लिए सप्ताह में 2 बार किए जाने वाले सीए सत्रों के दौरान रिओम्बिनेंट एरिथ्रोपोइटिन को 25 एमसीजी/किलोग्राम शरीर के वजन की खुराक पर प्रशासित किया जाता है।
पूर्वानुमान:
पूर्वानुमान ओवरलोड की डिग्री और अवधि से निर्धारित होता है।
बीमारी का कोर्स लंबा है, खासकर वृद्ध लोगों में। समय पर उपचार जीवन को कई दशकों तक बढ़ा देता है। उपचारित रोगियों में 5 वर्षों तक जीवित रहने की दर अनुपचारित रोगियों की तुलना में 2.5-3 गुना अधिक है। लीवर सिरोसिस की उपस्थिति में एचसीसी वाले रोगियों में एचसीसी विकसित होने का जोखिम 200 गुना बढ़ जाता है। अधिकतर मृत्यु लीवर की खराबी के कारण होती है।
यदि आपको हेमोक्रोमैटोसिस है तो आपको किन डॉक्टरों से संपर्क करना चाहिए:
- जठरांत्र चिकित्सक
- पोषण विशेषज्ञ
क्या आपको कुछ परेशान कर रहा हैं? क्या आप हेमोक्रोमैटोसिस, इसके कारणों, लक्षणों, उपचार और रोकथाम के तरीकों, रोग के पाठ्यक्रम और इसके बाद आहार के बारे में अधिक विस्तृत जानकारी जानना चाहते हैं? या क्या आपको निरीक्षण की आवश्यकता है? तुम कर सकते हो डॉक्टर से अपॉइंटमेंट लें– क्लिनिक यूरोप्रयोगशालासदैव आपकी सेवा में! सर्वश्रेष्ठ डॉक्टर आपकी जांच करेंगे, बाहरी संकेतों का अध्ययन करेंगे और लक्षणों के आधार पर बीमारी की पहचान करने में आपकी मदद करेंगे, आपको सलाह देंगे और आवश्यक सहायता प्रदान करेंगे और निदान करेंगे। आप भी कर सकते हैं घर पर डॉक्टर को बुलाओ. क्लिनिक यूरोप्रयोगशालाआपके लिए चौबीसों घंटे खुला रहेगा।
क्लिनिक से कैसे संपर्क करें:
कीव में हमारे क्लिनिक का फ़ोन नंबर: (+38 044) 206-20-00 (मल्टी-चैनल)। क्लिनिक सचिव आपके लिए डॉक्टर से मिलने के लिए एक सुविधाजनक दिन और समय का चयन करेगा। हमारे निर्देशांक और दिशाएं इंगित की गई हैं। इस पर क्लिनिक की सभी सेवाओं के बारे में अधिक विस्तार से देखें।
(+38 044) 206-20-00
यदि आपने पहले कोई शोध किया है, परामर्श के लिए उनके परिणामों को डॉक्टर के पास ले जाना सुनिश्चित करें।यदि अध्ययन नहीं किया गया है, तो हम अपने क्लिनिक में या अन्य क्लिनिकों में अपने सहयोगियों के साथ सभी आवश्यक कार्य करेंगे।
आप? अपने समग्र स्वास्थ्य के प्रति बहुत सावधान रहना आवश्यक है। लोग पर्याप्त ध्यान नहीं देते रोगों के लक्षणऔर यह नहीं जानते कि ये बीमारियाँ जीवन के लिए खतरा हो सकती हैं। ऐसी कई बीमारियाँ हैं जो पहले तो हमारे शरीर में प्रकट नहीं होती हैं, लेकिन अंत में पता चलता है कि, दुर्भाग्य से, उनका इलाज करने में बहुत देर हो चुकी है। प्रत्येक बीमारी के अपने विशिष्ट लक्षण, विशिष्ट बाहरी अभिव्यक्तियाँ होती हैं - तथाकथित रोग के लक्षण. सामान्य तौर पर बीमारियों के निदान में लक्षणों की पहचान करना पहला कदम है। ऐसा करने के लिए, आपको बस इसे साल में कई बार करना होगा। डॉक्टर से जांच कराई जाए, न केवल एक भयानक बीमारी को रोकने के लिए, बल्कि शरीर और पूरे जीव में एक स्वस्थ भावना बनाए रखने के लिए भी।
यदि आप डॉक्टर से कोई प्रश्न पूछना चाहते हैं, तो ऑनलाइन परामर्श अनुभाग का उपयोग करें, शायद आपको वहां अपने प्रश्नों के उत्तर मिलेंगे और पढ़ेंगे स्वयं की देखभाल युक्तियाँ. यदि आप क्लीनिकों और डॉक्टरों के बारे में समीक्षाओं में रुचि रखते हैं, तो अनुभाग में अपनी आवश्यक जानकारी प्राप्त करने का प्रयास करें। पर भी रजिस्टर करें चिकित्सा पोर्टल यूरोप्रयोगशालासाइट पर नवीनतम समाचारों और सूचना अपडेट से अवगत रहने के लिए, जो स्वचालित रूप से आपको ईमेल द्वारा भेजा जाएगा।
जठरांत्र संबंधी मार्ग के रोगों के समूह से अन्य रोग:
| दांतों का पीसना (घर्षण करना)। |
| पेट का आघात |
| पेट का सर्जिकल संक्रमण |
| मौखिक फोड़ा |
| एडेंटिया |
| शराबी जिगर की बीमारी |
| यकृत का अल्कोहलिक सिरोसिस |
| एल्वोलिटिस |
| एनजाइना झेनसुला - लुडविग |
| संज्ञाहरण और गहन देखभाल |
| दांतों का एंकिलोसिस |
| दाँतों की विसंगतियाँ |
| दांतों की स्थिति में विसंगतियाँ |
| अन्नप्रणाली के विकास में विसंगतियाँ |
| दाँत के आकार और आकार में विसंगतियाँ |
| अविवरता |
| ऑटोइम्यून हेपेटाइटिस |
| अचलासिया कार्डिया |
| ग्रासनली अचलासिया |
| पेट के बेजोर |
| रोग और बड-चियारी सिंड्रोम |
| यकृत का शिरापरक रोड़ा रोग |
| क्रोनिक हेमोडायलिसिस पर क्रोनिक रीनल फेल्योर वाले रोगियों में वायरल हेपेटाइटिस |
| वायरल हेपेटाइटिस जी |
| वायरल हेपेटाइटिस टीटीवी |
| इंट्राओरल सबम्यूकोसल फाइब्रोसिस (ओरल सबम्यूकोसल फाइब्रोसिस) |
| बालों वाली ल्यूकोप्लाकिया |
| गैस्ट्रोडोडोडेनल रक्तस्राव |
| भौगोलिक भाषा |
| हेपाटोलेंटिकुलर डिजनरेशन (वेस्टफाल-विल्सन-कोनोवालोव रोग) |
| हेपेटोलिएनल सिंड्रोम (हेपेटो-स्प्लेनिक सिंड्रोम) |
| हेपेटोरेनल सिंड्रोम (कार्यात्मक गुर्दे की विफलता) |
| हेपैटोसेलुलर कार्सिनोमा (एचसीसी) |
| मसूड़े की सूजन |
| हाइपरस्प्लेनिज्म |
| मसूड़े की अतिवृद्धि (मसूड़े की फाइब्रोमैटोसिस) |
| हाइपरसीमेंटोसिस (ओसिफाइंग पेरियोडोंटाइटिस) |
| ग्रसनी-ग्रासनली डायवर्टिकुला |
| हाइटल हर्निया (HH) |
| एक्वायर्ड एसोफेजियल डायवर्टीकुलम |
| गैस्ट्रिक डायवर्टिकुला |
| अन्नप्रणाली के निचले तीसरे भाग का डायवर्टिकुला |
| एसोफेजियल डायवर्टिकुला |
| एसोफेजियल डायवर्टिकुला |
| अन्नप्रणाली के मध्य तीसरे भाग का डायवर्टिकुला |
| एसोफेजियल डिस्केनेसिया |
| पित्त पथ का डिस्केनेसिया (शिथिलता)। |
| लिवर डिस्ट्रोफी |
| ओड्डी डिसफंक्शन का स्फिंक्टर (पोस्टकोलेसिस्टेक्टोमी सिंड्रोम) |
| सौम्य नॉनपिथेलियल ट्यूमर |
| पित्ताशय की सौम्य रसौली |
| सौम्य यकृत ट्यूमर |
| अन्नप्रणाली के सौम्य ट्यूमर |
| सौम्य उपकला ट्यूमर |
| पित्ताश्मरता |
| यकृत का फैटी हेपेटोसिस (स्टीटोसिस)। |
| पित्ताशय की घातक सूजन |
| पित्त नलिकाओं के घातक ट्यूमर |
| पेट के विदेशी शरीर |
| कैंडिडल स्टामाटाइटिस (थ्रश) |
| क्षय |
| कार्सिनॉयड |
| अन्नप्रणाली में सिस्ट और असामान्य ऊतक |
| धब्बेदार दाँत |
| ऊपरी जठरांत्र रक्तस्राव |
| ज़ैंथोग्रानुलोमेटस कोलेसिस्टिटिस |
| मौखिक श्लेष्मा का ल्यूकोप्लाकिया |
| नशीली दवाओं के कारण जिगर की क्षति |
| औषधीय अल्सर |
| पुटीय तंतुशोथ |
| लार ग्रंथि म्यूकोसेले |
| malocclusion |
| दांतों का बिगड़ा हुआ विकास और फूटना |
| दाँत निर्माण संबंधी विकार |
| वंशानुगत कोप्रोपोर्फिरिया |
| इनेमल और डेंटिन की संरचना का वंशानुगत विकार (स्टैंटन-कैपडिपोंट सिंड्रोम) |
| गैर-अल्कोहलिक स्टीटोहेपेटाइटिस |
| यकृत परिगलन |
| पल्प नेक्रोसिस |
| गैस्ट्रोएंटरोलॉजी में आपातकालीन स्थितियाँ |
| ग्रासनली में रुकावट |
| दांतों की अस्थिजनन अपूर्णता |
| आपातकालीन सर्जरी में मरीजों की जांच |
| हेपेटाइटिस बी वायरस वाहकों में तीव्र डेल्टा सुपरइन्फेक्शन |
| तीव्र आंत्र रुकावट |
| तीव्र आंतरायिक (आंतरायिक) पोरफाइरिया |
| मेसेन्टेरिक परिसंचरण की तीव्र गड़बड़ी |
| एक सर्जन के अभ्यास में तीव्र स्त्रीरोग संबंधी रोग |
| पाचन तंत्र से तीव्र रक्तस्राव |
| तीव्र ग्रासनलीशोथ |
| तीव्र अल्कोहलिक हेपेटाइटिस |
| तीव्र आन्त्रपुच्छ - कोप |
| तीव्र एपिकल पेरियोडोंटाइटिस |
| तीव्र अकालकुलस कोलेसिस्टिटिस |
| तीव्र वायरल हेपेटाइटिस ए (एवीएचए) |
| तीव्र वायरल हेपेटाइटिस बी (एवीएचबी) |
| डेल्टा एजेंट के साथ तीव्र वायरल हेपेटाइटिस बी |
आंत में लोहे के सक्रिय अवशोषण के साथ-साथ अन्य अंगों में पदार्थ के संचय के साथ, यकृत का हेमोक्रोमैटोसिस विकसित होता है। यह रोग वंशानुगत मल्टीसिस्टम पैथोलॉजी से संबंधित है, लेकिन अन्य बीमारियों की पृष्ठभूमि के खिलाफ प्राप्त किया जा सकता है। क्लिनिक स्पष्ट, तीव्र है और श्लेष्म झिल्ली और त्वचा के कांस्य रंग में प्रकट होता है। जटिलताएँ - सिरोसिस, कार्डियोमायोपैथी, मधुमेह मेलेटस, आर्थ्राल्जिया, यौन रोग। निदान करने के लिए, विशिष्ट प्रयोगशाला परीक्षण किए जाते हैं। उपचार रक्तपात, आहार चिकित्सा और रोगसूचक चिकित्सा के सिद्धांतों पर आधारित है। संकेतों के अनुसार, प्रभावित अंग का प्रत्यारोपण या आर्थ्रोप्लास्टी की जाती है।
रक्त में आयरन के चयापचय में विफलता से हेमोक्रोमैटोसिस नामक यकृत रोग हो सकता है।
यह क्या है?
हेमोक्रोमैटोसिस क्या है? यह एक गंभीर विकृति है, जिसे त्वचा और आंतरिक अंगों के रंजकता की विशेषता वाली विशिष्ट नैदानिक तस्वीर के कारण कांस्य मधुमेह, पिगमेंटरी सिरोसिस भी कहा जाता है। यह रोग एक अर्ध-व्यवस्थित आनुवंशिक रोग है जो एचएफई जीन में उत्परिवर्तन के कारण होता है। यह रोग अक्सर क्रोमोसोम 6 पर एचएफई जीन के संचरित उत्परिवर्तन से जुड़ा होता है, यही कारण है कि इसे वंशानुगत हेमोक्रोमैटोसिस कहा जाता है।
इडियोपैथिक हेमोक्रोमैटोसिस एक जीन उत्परिवर्तन की पृष्ठभूमि के खिलाफ लौह चयापचय की प्रक्रिया के उल्लंघन से प्रकट होता है, जिसके परिणामस्वरूप पदार्थ अन्य अंगों (हृदय, पिट्यूटरी ग्रंथि, यकृत, जोड़ों) में इसके आगे संचय के साथ आंतों में अवशोषित हो जाता है। अग्न्याशय), ऊतकों में। चल रही प्रक्रिया की पृष्ठभूमि के खिलाफ, एकाधिक अंग विफलता विकसित होती है। रोग हमेशा सिरोसिस, मधुमेह मेलेटस और त्वचा के रंजकता के साथ होता है।
प्रसार
आनुवंशिक विकृतियों में, वंशानुगत हेमोक्रोमैटोसिस सबसे आम में से एक है। सबसे ज्यादा मामले उत्तरी यूरोप में दर्ज किये गये. एक विशिष्ट उत्परिवर्तित हेमोक्रोमैटोसिस जीन, जो पृथ्वी पर 5% लोगों के डीएनए में मौजूद है, रोग की उपस्थिति के लिए जिम्मेदार है, लेकिन यह रोग केवल 0.3% आबादी में विकसित होता है। पुरुषों में इसका प्रचलन महिलाओं की तुलना में 10 गुना अधिक है। 70% रोगियों में, पहले लक्षण 40-60 वर्ष की आयु में दिखाई देते हैं।
हेमोक्रोमैटोसिस के रूप और चरण
एटियलॉजिकल कारकों के अनुसार, निम्न हैं:
- प्राथमिक हेमोक्रोमैटोसिस, यानी वंशानुगत प्रकार। प्राथमिक रूप एंजाइम प्रणालियों की जन्मजात खराबी से जुड़ा है, जो आंतरिक अंगों पर लोहे के संचय को उत्तेजित करता है, जो छठे डीएनए गुणसूत्र पर जीन उत्परिवर्तन का कारण बनता है। 4 उप-प्रपत्र हैं वंशानुगत रोग, जो गंभीरता और स्थान में भिन्न हैं:
 हेमोक्रोमैटोसिस जन्मजात या जीवन के दौरान हो सकता है।
हेमोक्रोमैटोसिस जन्मजात या जीवन के दौरान हो सकता है। - ऑटोसोमल रिसेसिव, एचएफई-संबद्ध (95% रोगियों में विकसित होता है);
- किशोर;
- जन्मजात एचएफई-असंबद्ध;
- ऑटोसोमल डोमिनेंट।
- माध्यमिक रोग, अर्थात्, सामान्यीकृत हेमोसिडरोसिस प्राप्त किया। यह रोग दूसरों की क्षति के कारण प्रकट होता है गंभीर बीमारी. एक्वायर्ड एंजाइम की कमी, जो आयरन के संचय को तेज करती है, होती है:
- आधान के बाद;
- पोषण संबंधी;
- चयापचय;
- नवजात;
- मिश्रित।
 हेमोक्रोमैटोसिस की केवल तीसरी डिग्री होती है विशिष्ट लक्षण.
हेमोक्रोमैटोसिस की केवल तीसरी डिग्री होती है विशिष्ट लक्षण. प्रक्रिया की प्रकृति के अनुसार, जन्मजात और माध्यमिक रोग के 3 चरण होते हैं:
- मैं - प्रकाश, भार के बिना, यानी, लौह चयापचय परेशान है, लेकिन इसकी एकाग्रता मानक से अधिक नहीं है;
- II - मध्यम, अतिभार के साथ, लेकिन स्पर्शोन्मुख;
- III - तीव्र लक्षणों के साथ: रंजकता, हृदय, गुर्दे, यकृत, अग्न्याशय, आदि की शिथिलता।
कारण और रोगजनन
ऐसे कई कारण हैं जो हेमोक्रोमैटोसिस के विकास को भड़काते हैं:
- हेमोक्रोमैटोसिस के अज्ञातहेतुक रूप का कारण खराब आनुवंशिकता है। रोग ठीक करने वाले जीन के अध:पतन के कारण विकसित होता है चयापचय प्रक्रियाएंलोहे की भागीदारी के साथ. एचएफई जीन उत्परिवर्तन जैसी बीमारी विरासत में मिली है।
- अन्य विकृति, जैसे सिरोसिस, हेपेटाइटिस बी और सी का छह महीने से अधिक समय तक इलाज न किया जाना, यकृत के ऊतकों या हेमटोपोइएटिक प्रणाली में घातक ट्यूमर।
- पोर्टल शिरा में पोर्टोकैवल शंटिंग से जुड़े संवहनी ऑपरेशन।
- "फ़िल्टर" पैरेन्काइमा में वसा का संचय, शराब के नशे से जुड़ा नहीं है।
- अग्न्याशय के मुख्य चैनल में रुकावट.
- विशिष्ट अंतःशिरा दवाओं का परिचय जो लौह सांद्रता में वृद्धि को उत्तेजित करता है।
- आधान. शरीर में मौजूद विदेशी लाल रक्त कोशिकाएं हमारी तुलना में तेजी से नष्ट हो जाती हैं। इनकी मृत्यु के फलस्वरूप लोहे का निर्माण होता है।
- निरंतर हेमोडायलिसिस।
- बढ़े हुए हीमोग्लोबिन से जुड़े रोग। जब यह नष्ट हो जाता है तो बड़ी संख्या में मेटाबोलाइट्स और आयरन बनते हैं।
पहले को छोड़कर सभी बिंदु, माध्यमिक विकृति विज्ञान के विकास को भड़काते हैं।
हेमोक्रोमैटोसिस के साथ, अंग के ऊतकों में लोहे का अत्यधिक संचय होता है, जो उन्हें धीरे-धीरे नष्ट करना शुरू कर देता है। सूजन की प्रक्रिया घाव के स्थान पर शुरू होती है। स्थानीय प्रतिरक्षा, घाव को दबाने के लिए, फाइब्रिन स्कारिंग की प्रक्रिया को सक्रिय करती है। परिणामस्वरूप, प्रभावित अंग का फाइब्रोसिस और उसकी विफलता विकसित हो जाती है। सबसे पहले पीड़ित होता है लीवर, जो बाद में सिरोसिस से प्रभावित हो जाता है।
लक्षण और पाठ्यक्रम
प्राथमिक हेमोक्रोमैटोसिस प्रारंभिक चरणों में स्वयं प्रकट नहीं होता है। सामान्य कमजोरी और अस्वस्थता विकसित हो सकती है। जैसे-जैसे बीमारी बढ़ती है, अन्य अंगों की शिथिलता के लक्षण प्रकट होते हैं, जो इस प्रकार व्यक्त होते हैं:
 हेमोक्रोमैटोसिस रंजकता, पेट दर्द, गैस्ट्रोइंटेस्टाइनल विकार और सिरदर्द को भड़काता है।
हेमोक्रोमैटोसिस रंजकता, पेट दर्द, गैस्ट्रोइंटेस्टाइनल विकार और सिरदर्द को भड़काता है। - चेहरे के भाग में, अग्रबाहु के सामने, हाथ के ऊपर, नाभि, निपल्स और जननांगों के पास त्वचा का रंजकता, जो हेमोसाइडरिन और थोड़ी मात्रा में मेलेनिन के जमाव से जुड़ा होता है;
- चेहरे और शरीर पर बालों के विकास में कमी;
- अलग-अलग ताकत का गैर-स्थानीयकृत पेट दर्द;
- गैस्ट्रोइंटेस्टाइनल विकार, जिसमें उल्टी, दस्त, भूख की कमी के साथ मतली शामिल है;
- चक्कर आना;
- उनकी क्षति और विकृति के कारण जोड़ों की मोटर क्षमता की सीमा।
हेमोक्रोमैटस परिवर्तनों के लिए सबसे आम लक्षण जटिल पैरेन्काइमा के सिरोसिस के लक्षण हैं, डर्मिस के मजबूत रंजकता की पृष्ठभूमि के खिलाफ मधुमेह मेलेटस। लक्षण तब प्रकट होते हैं जब आयरन का स्तर 20 ग्राम से अधिक हो जाता है, जो शारीरिक मानक से 5 गुना है।
रोग का कोर्स निरंतर प्रगति की विशेषता है। चिकित्सा की अनुपस्थिति में, अपरिवर्तनीय परिवर्तन और गंभीर जटिलताओं के लक्षण जो मृत्यु की धमकी देते हैं, तुरंत प्रकट होते हैं।
जटिलताएँ और परिणाम
जैसे-जैसे बीमारी बढ़ती है, निम्नलिखित जटिलताएँ विकसित होती हैं:
- जिगर की शिथिलता, जब बुनियादी कार्य नहीं किए जाते हैं।
- कोई भी उल्लंघन हृदय दरऔर कंजेस्टिव कार्डियक डिसफंक्शन।
- विभिन्न प्रकार की संक्रामक जटिलताएँ।
- हृद्पेशीय रोधगलन।
- वैरिकाज़ नसों से रक्तस्राव, अक्सर अन्नप्रणाली और जठरांत्र संबंधी मार्ग में।
- क्रमशः मधुमेह और सिरोसिस की प्रगति के साथ मधुमेह और यकृत कोमा।
- ट्यूमर का विकास, अधिकतर यकृत ऊतकों में।
- मधुमेह मेलेटस, जो 75% मामलों में विकसित होता है।
- हेपेटोमेगाली, जब यकृत का आकार बढ़ जाता है।
- स्प्लेनोमेगाली प्लीहा की मात्रा में वृद्धि है।
- पैरेन्काइमा का फैलाना प्रगतिशील सिरोसिस।
- आर्थ्राल्जिया, जब जोड़ों में गंभीर दर्द होता है। दूसरी और तीसरी अंगुलियों के इंटरफैलेन्जियल जोड़ विशेष रूप से प्रभावित होते हैं।
- यौन विकार जैसे नपुंसकता (पुरुषों में)। महिलाओं में एमेनोरिया विकसित हो जाता है, जिसके परिणामस्वरूप कामेच्छा कम हो जाती है।
- पिट्यूटरी ग्रंथि के घाव और संबंधित हार्मोनल कमी।
निदान
चूँकि हेमोक्रोमैटोसिस भड़काता है विभिन्न रोग, नैदानिक तस्वीर भिन्न हो सकती है। नतीजतन, विभिन्न विशेषज्ञ पैथोलॉजी का निदान करने में सक्षम हैं, जैसे:
 लौह चयापचय विफलता का अंतिम निदान केवल इसके द्वारा ही किया जा सकता है व्यापक परीक्षात्वचा विशेषज्ञ, मूत्र रोग विशेषज्ञ, हृदय रोग विशेषज्ञ और अन्य विशेषज्ञों से।
लौह चयापचय विफलता का अंतिम निदान केवल इसके द्वारा ही किया जा सकता है व्यापक परीक्षात्वचा विशेषज्ञ, मूत्र रोग विशेषज्ञ, हृदय रोग विशेषज्ञ और अन्य विशेषज्ञों से। - गैस्ट्रोएंटेरोलॉजिस्ट;
- हृदय रोग विशेषज्ञ;
- एंडोक्राइनोलॉजिस्ट;
- स्त्री रोग विशेषज्ञ;
- मूत्र रोग विशेषज्ञ;
- रुमेटोलॉजिस्ट;
- त्वचा विशेषज्ञ
लेकिन कारण और नैदानिक तस्वीर की परवाह किए बिना, सभी डॉक्टर रोग संबंधी स्थिति का निदान करने में समान दृष्टिकोण का उपयोग करेंगे। बाद दृश्य निरीक्षणऔर रोगी की शिकायतों का आकलन करते हुए, निदान को स्पष्ट करने और शरीर को नुकसान की गंभीरता निर्धारित करने के लिए जटिल प्रयोगशाला और वाद्य अध्ययन का एक सेट निर्धारित किया जाता है।
निदान का उद्देश्य रोग की पहचान करना है विशिष्ट तरीके, चूँकि परीक्षणों की मानक सूची सूचनात्मक नहीं है। आज, रोग संबंधी स्थिति के निदान के लिए एक चरण-दर-चरण योजना प्रस्तावित है, जिसमें निम्नलिखित चरण शामिल हैं:
- ट्रांसफ़रिन के स्तर का निर्धारण, एक विशिष्ट प्रोटीन जो पूरे शरीर में आयरन के स्थानांतरण में शामिल होता है। मानक 44% से अधिक नहीं है।
- फ़ेरिटिन गणना। रजोनिवृत्ति के बाहर और बाद की महिलाओं में पदार्थ की दर क्रमशः 200 और 300 इकाइयाँ है।
- निदान रक्तपात. विधि का सार थोड़ी मात्रा में रक्त निकालना और सीरम में आयरन की गणना करना है। आमतौर पर, जब सामान्य रक्तप्रवाह में आयरन का स्तर 3 ग्राम कम हो जाता है तो रोगी बेहतर महसूस करता है।
प्रयोगशाला के तरीके
 हेमोक्रोमैटोसिस का निदान रक्त और मूत्र परीक्षण के परिणामों के आधार पर भी किया जाता है।
हेमोक्रोमैटोसिस का निदान रक्त और मूत्र परीक्षण के परिणामों के आधार पर भी किया जाता है। रोग का निदान करने के लिए आवश्यक नैदानिक परीक्षण आयरन के स्तर और पूरे शरीर में इसके चयापचय और परिवहन में शामिल पदार्थों के निर्धारण पर आधारित होते हैं। ऐसा प्रयोगशाला के तरीकेनिदान जैसे:
- आयरन, फ़ेरिटिन, ट्रांसफ़रिन की सांद्रता के लिए विशिष्ट विश्लेषण;
- सकारात्मक डेस्फेरल परीक्षण - उत्सर्जित लौह की गणना के साथ मूत्र परीक्षण;
- रक्त की सामान्य लौह-बाध्यकारी संपत्ति में गिरावट का आकलन।
निदान की पुष्टि करने के लिए, एक पंचर या त्वचीय पंचर किया जाता है, जिसके बाद हेमोसाइडरिन जमा की उपस्थिति/अनुपस्थिति की जांच की जाती है। रोग का वंशानुगत रूप आणविक आनुवंशिक अनुसंधान से प्राप्त आंकड़ों के आधार पर निर्धारित किया जाता है।
अन्य अंगों को क्षति की गंभीरता का आकलन करने और पूर्वानुमान निर्धारित करने के लिए, निम्नलिखित कार्य किए जाते हैं:
- जिगर परीक्षण;
- शर्करा और ग्लाइकोसिलेटेड हीमोग्लोबिन के लिए जैविक तरल पदार्थों का विश्लेषण।
वाद्य तकनीक
निम्न के अलावा नैदानिक अनुसंधानरोगी के जैविक तरल पदार्थों की एक वाद्य जांच की जाती है, जो हमें पाठ्यक्रम की अधिक सटीक तस्वीर, रोग प्रक्रिया की सीमा और शरीर को होने वाले नुकसान का निर्धारण करने की अनुमति देती है। इस प्रयोजन के लिए निम्नलिखित कार्य सौंपे गए हैं:
- जोड़ों का एक्स-रे;
- पेरिटोनियम का अल्ट्रासाउंड;
- ईसीजी, इकोसीजी;
- एमआरआई, .
- हेमोक्रोमैटोसिस क्या है?
- हेमोक्रोमैटोसिस का कारण क्या है?
- हेमोक्रोमैटोसिस के लक्षण
- हेमोक्रोमैटोसिस का निदान
- हेमोक्रोमैटोसिस का उपचार
- यदि आपको हेमोक्रोमैटोसिस है तो आपको किन डॉक्टरों से संपर्क करना चाहिए?
हेमोक्रोमैटोसिस क्या है?
प्राथमिक हेमोक्रोमैटोसिस (पीएचसी) एक ऑटोसोमल रिसेसिव, एचएलए-संबंधित बीमारी है जो एक आनुवंशिक दोष के कारण होती है जो एक चयापचय विकार द्वारा विशेषता होती है जिसमें गैस्ट्रोइंटेस्टाइनल ट्रैक्ट में लौह का अवशोषण बढ़ जाता है।
हेमोक्रोमैटोसिस का कारण क्या है?
इस बीमारी का वर्णन सबसे पहले 1871 में एम. ट्रोइसियर ने एक लक्षण जटिल के रूप में किया था, जो शरीर में आयरन के संचय से जुड़े मधुमेह मेलेटस, त्वचा रंजकता और यकृत सिरोसिस की विशेषता थी। 1889 में, रेक्लिंगहौसेन ने "हेमोक्रोमैटोसिस" शब्द पेश किया, जो बीमारी की विशेषताओं में से एक को दर्शाता है: त्वचा और आंतरिक अंगों का असामान्य रंग। यह पाया गया कि आयरन पहले यकृत की पैरेन्काइमल कोशिकाओं में जमा होता है, और फिर अन्य अंगों (अग्न्याशय, हृदय, जोड़ों, पिट्यूटरी ग्रंथि) में जमा हो सकता है।
व्यापकता.जनसंख्या आनुवंशिक अध्ययनों ने पीएचसी की एक दुर्लभ बीमारी के रूप में समझ को बदल दिया है। पीएचसी जीन की व्यापकता 0.03-0.07% है - इसलिए, हाल तक, प्रति 100 हजार जनसंख्या पर 3-8 मामले देखे गए थे। श्वेत आबादी में, समयुग्मजीता की आवृत्ति 0.3% है, विषमयुग्मजी गाड़ी की आवृत्ति 8-10% है। बेहतर निदान के कारण घटनाओं में वृद्धि हुई है। यूरोपीय समुदाय के निवासियों के बीच घटना दर औसतन 1:300 है। डब्ल्यूएचओ के अनुसार, 10% आबादी हेमोक्रोमैटोसिस से ग्रस्त है। पुरुष महिलाओं की तुलना में लगभग 10 गुना अधिक बार बीमार पड़ते हैं।
हेमोक्रोमैटोसिस के दौरान रोगजनन (क्या होता है?)।
आम तौर पर, शरीर में लगभग 4 ग्राम आयरन होता है, जिसमें से जी हीमोग्लोबिन, मायोग्लोबिन, कैटालेज़ और अन्य रेस्पिरेटर-बिक्स पिगमेंट या एंजाइम में होता है। लोहे का भंडार 0.5 ग्राम है, जिनमें से कुछ यकृत में हैं, लेकिन वे पारंपरिक तरीकों का उपयोग करके लोहे की हिस्टोलॉजिकल परीक्षा के दौरान दिखाई नहीं देते हैं। आम तौर पर, मानव दैनिक आहार में लगभग 10-20 मिलीग्राम आयरन (90% मुक्त खड़े, 10% हेम के साथ संयोजन में) होता है, जिसमें से 1-1.5 मिलीग्राम अवशोषित होता है।
अवशोषित आयरन की मात्रा शरीर में इसके भंडार पर निर्भर करती है: जितनी अधिक आवश्यकता, उतना अधिक आयरन अवशोषित होता है। अवशोषण मुख्य रूप से ऊपरी छोटी आंत में होता है और यह एक सक्रिय प्रक्रिया है जिसमें लोहे को एक सांद्रता प्रवणता के विपरीत आगे ले जाया जा सकता है। हालाँकि, स्थानांतरण तंत्र अज्ञात हैं।
आंतों के म्यूकोसा की कोशिकाओं में साइटोसोल में आयरन पाया जाता है। इसका कुछ हिस्सा फेरिटिन के रूप में बंधा और संग्रहीत होता है, जो बाद में उपकला कोशिकाओं के विलुप्त होने के परिणामस्वरूप या तो उपयोग किया जाता है या खो जाता है। अन्य ऊतकों में चयापचय के लिए इच्छित लौह का कुछ हिस्सा कोशिका के बेसोलेटरल झिल्ली में ले जाया जाता है और ट्रांसफ़रिन से बंध जाता है, जो रक्त में लौह के लिए मुख्य परिवहन प्रोटीन है। कोशिकाओं में, आयरन को फेरिटिन के रूप में जमा किया जाता है - आयरन के साथ प्रोटीन एपोफेरिटिन का एक कॉम्प्लेक्स। टूटे हुए फ़ेरिटिन अणुओं के गुच्छे हीमोसाइडरिन हैं। शरीर में लगभग एक तिहाई लौह भंडार हेमोसाइडरिन के रूप में होता है, जिसकी मात्रा अतिरिक्त लौह संचय से जुड़ी बीमारियों में बढ़ जाती है।
हेमोक्रोमैटोसिस के साथ, पाचन तंत्र में लोहे का अवशोषण 3.0-4.0 मिलीग्राम तक बढ़ जाता है। इस प्रकार, 1 वर्ष के भीतर, यकृत, अग्न्याशय, हृदय और अन्य अंगों और ऊतकों की कोशिकाओं में जमा इसकी अतिरिक्त मात्रा लगभग 1 ग्राम है। अंततः, शरीर के इंट्रा- और बाह्य कोशिकीय पूल आयरन से अत्यधिक संतृप्त हो जाते हैं, जो मुक्त आयरन की अनुमति देता है विषाक्त अंतःकोशिकीय प्रतिक्रियाओं में प्रवेश करना। एक मजबूत रेडॉक्स पदार्थ होने के कारण, आयरन मुक्त हाइड्रॉक्सिल रेडिकल बनाता है, जो बदले में लिपिड, प्रोटीन और डीएनए के मैक्रोमोलेक्यूल्स को नष्ट कर देता है।
लीवर में आयरन के बढ़ते संचय की विशेषता है:
- लिवर की फाइब्रोसिस और सिरोसिस, पैरेन्काइमल कोशिकाओं में लोहे के प्रारंभिक प्रमुख संचय के साथ, कुछ हद तक स्टेलेट रेटिकुलोएन्डोथेलियोसाइट्स में।
- अग्न्याशय, हृदय, पिट्यूटरी ग्रंथि सहित अन्य अंगों में लोहे का जमाव।
- लोहे के अवशोषण में वृद्धि, जिससे इसका अवशोषण और संचय होता है।
यह रोग तथाकथित मिसेन म्यूटेशन से जुड़ा है, यानी ऐसे उत्परिवर्तन जो कोडन के अर्थ में परिवर्तन का कारण बनते हैं और प्रोटीन जैवसंश्लेषण को रोकते हैं।
पीएचसी की आनुवंशिक प्रकृति की पुष्टि एम. साइमन एट अल द्वारा की गई थी। 1976 में, जिन्होंने यूरोपीय आबादी के प्रतिनिधियों में प्रमुख हिस्टोकम्पैटिबिलिटी कॉम्प्लेक्स के कुछ एंटीजन के साथ बीमारी के करीबी संबंध का खुलासा किया। नैदानिक अभिव्यक्ति के लिए, रोगी के पास दो पीएचसी एलील (होमोज़ायगोसिटी) होने चाहिए। रोगी के लिए सामान्य रूप से एक एचएलए हैप्लोटाइप की उपस्थिति पीएचसी एलील के विषमयुग्मजी परिवहन को इंगित करती है। ऐसे व्यक्ति अप्रत्यक्ष संकेत दिखा सकते हैं जो शरीर में आयरन के स्तर में वृद्धि और नैदानिक रूप से महत्वपूर्ण लक्षणों की अनुपस्थिति का संकेत देते हैं। विषमयुग्मजी जीन वाहक समयुग्मजी से अधिक प्रबल होता है। यदि माता-पिता दोनों विषमयुग्मजी हैं, तो छद्मप्रमुख प्रकार का वंशानुक्रम संभव है। हेटेरोजाइट्स में, लोहे का अवशोषण आमतौर पर थोड़ा बढ़ जाता है, रक्त सीरम में लोहे की थोड़ी वृद्धि का पता लगाया जाता है, लेकिन सूक्ष्म तत्व का जीवन-घातक अधिभार नहीं देखा जाता है। उसी समय, यदि हेटेरोज़ायगोट्स लौह चयापचय के विकारों के साथ अन्य बीमारियों से पीड़ित हैं, तो रोग प्रक्रिया के नैदानिक और रूपात्मक लक्षण प्रकट हो सकते हैं।
एचएलए एंटीजन के साथ रोग के घनिष्ठ संबंध ने पीजीसी के लिए जिम्मेदार जीन को स्थानीयकृत करना संभव बना दिया, जो क्रोमोसोम 6 की छोटी भुजा पर स्थित है, एचएलए प्रणाली के ए लोकस के पास और ए 3 एलील और हैप्लोटाइप ए 3 बी 7 या ए 3 बी 14 से जुड़ा हुआ है। . यह तथ्य इसकी पहचान के उद्देश्य से किए गए शोध के आधार के रूप में कार्य करता है।
वंशानुगत हेमोक्रोमैटोसिस को शुरू में एक साधारण मोनोजेनिक बीमारी माना जाता था। वर्तमान में, जीन दोष और नैदानिक तस्वीर के आधार पर, पीजीसी के 4 रूप प्रतिष्ठित हैं:
- क्लासिकल ऑटोसोमल रिसेसिव HFE-1;
- किशोर एचएफई-2;
- एचएफई-3, ट्रांसफ़रिन रिसेप्टर प्रकार 2 में उत्परिवर्तन के साथ जुड़ा हुआ;
- ऑटोसोमल डोमिनेंट हेमोक्रोमैटोसिस एचएफई-4।
रोग के सार को समझने में एचएफई जीन (हेमोक्रोमैटोसिस के विकास से जुड़ा) की पहचान एक महत्वपूर्ण बिंदु थी। एचएफई जीन 343 अमीनो एसिड से युक्त एक प्रोटीन संरचना को एनकोड करता है, जिसकी संरचना एमएचसी वर्ग I प्रणाली के अणु के समान है। हेमोक्रोमैटोसिस से पीड़ित व्यक्तियों में इस जीन में उत्परिवर्तन की पहचान की गई है। जातीय रूसियों के बीच एक समयुग्मजी अवस्था में C282Y एलील के वाहक प्रति 1000 लोगों में कम से कम 1 हैं। लौह चयापचय में एचएफई की भूमिका ट्रांसफ़रिन रिसेप्टर (टीएफआर) के साथ एचएफई की बातचीत से प्रदर्शित होती है। टीएफआर के साथ एचएफई का जुड़ाव आयरन-बाउंड ट्रांसफ़रिन के लिए इस रिसेप्टर की आत्मीयता को कम कर देता है। C282U उत्परिवर्तन के साथ, HFE TfR से बिल्कुल भी बंधने में सक्षम नहीं है, और H63D उत्परिवर्तन के साथ, TfR के लिए आत्मीयता कुछ हद तक कम हो जाती है। एक्स-रे क्रिस्टलोग्राफी का उपयोग करके एचएफई की त्रि-आयामी संरचना का अध्ययन किया गया, जिससे एचएफई और 2 मीटर प्रकाश श्रृंखला के बीच बातचीत की प्रकृति को स्थापित करना संभव हो गया, साथ ही हेमोक्रोमैटोसिस की विशेषता वाले उत्परिवर्तन के स्थानीयकरण का निर्धारण करना संभव हो गया।
C282U उत्परिवर्तन से डोमेन में डाइसल्फ़ाइड बंधन टूट जाता है, जो प्रोटीन की सही स्थानिक संरचना के निर्माण और 2m तक इसके बंधन में महत्वपूर्ण है। एचएफई प्रोटीन की सबसे बड़ी मात्रा ग्रहणी की गहरी तहों में उत्पन्न होती है। आम तौर पर, क्रिप्टन कोशिकाओं में एचएफई प्रोटीन की भूमिका ट्रांसफ़रिन से बंधे लोहे के अवशोषण को नियंत्रित करना है। एक स्वस्थ व्यक्ति में, सीरम आयरन का स्तर बढ़ने से गहरी क्रिप्ट कोशिकाओं (टीएफआर द्वारा मध्यस्थ और एचएफई द्वारा संशोधित एक प्रक्रिया) द्वारा आयरन ग्रहण बढ़ जाता है। C282Y उत्परिवर्तन क्रिप्ट कोशिकाओं द्वारा TfR-मध्यस्थता वाले लौह अवशोषण को ख़राब कर सकता है और इस प्रकार शरीर में कम लौह स्थिति का गलत संकेत उत्पन्न कर सकता है।
इंट्रासेल्युलर लौह सामग्री में कमी के कारण, विली के शीर्ष पर स्थानांतरित होने वाले विभेदित एंटरोसाइट्स डीएमटी -1 की बढ़ी हुई मात्रा का उत्पादन करना शुरू कर देते हैं, जिसके परिणामस्वरूप लौह ग्रहण बढ़ जाता है। रोगजनन में मुख्य कड़ी एंजाइम प्रणालियों में एक आनुवंशिक दोष है जो भोजन से सामान्य सेवन के दौरान आंत में लोहे के अवशोषण को नियंत्रित करता है। एचएलए-ए प्रणाली के साथ आनुवंशिक संबंध सिद्ध हो चुका है। इन मार्करों का उपयोग करके लिंकेज असंतुलन के एक अध्ययन में एज़, बी 7, बीटी 4, डी 6 सियोश डी 6 एस 126 ओ के साथ हेमोक्रोमैटोसिस का संबंध दिखाया गया है।
इस दिशा में आगे के शोध और हैप्लोटाइप के विश्लेषण से पता चलता है कि जीन D6 S2238 और D6 S2241 के बीच स्थित है। अनुमानित हेमोक्रोमैटोसिस जीन एचएलए समरूप है, और उत्परिवर्तन कार्यात्मक रूप से महत्वपूर्ण क्षेत्र को प्रभावित करता प्रतीत होता है। शरीर में लौह तत्व को नियंत्रित करने वाला जीन गुणसूत्र 6 पर A3HLA स्थान पर स्थित होता है। यह जीन एक प्रोटीन की संरचना को एनकोड करता है जो ट्रांसफ़रिन रिसेप्टर के साथ इंटरैक्ट करता है और ट्रांसफ़रिन-आयरन कॉम्प्लेक्स के लिए रिसेप्टर की आत्मीयता को कम करता है। इस प्रकार, एचएफई जीन उत्परिवर्तन डुओडनल एंटरोसाइट्स द्वारा आयरन के ट्रांसफ़रिन-मध्यस्थ ग्रहण को बाधित करता है, जिसके परिणामस्वरूप शरीर में कम आयरन सामग्री की उपस्थिति के बारे में एक गलत संकेत बनता है, जिसके परिणामस्वरूप आयरन का उत्पादन बढ़ जाता है। एंटरोसाइट्स के विली में प्रोटीन डीसीटी-1 को बांधना और इसके परिणामस्वरूप आयरन की मात्रा में वृद्धि कैसे होती है।
संभावित विषाक्तता को इसकी क्षमता से समझाया जाता है, चर वैलेंस के साथ एक धातु के रूप में, मूल्यवान मुक्त कण प्रतिक्रियाओं को ट्रिगर करने के लिए जो कोशिका के ऑर्गेनेल और आनुवंशिक संरचनाओं को विषाक्त क्षति पहुंचाती है, कोलेजन संश्लेषण में वृद्धि और ट्यूमर के विकास को जन्म देती है। हेटेरोज़ीगोट्स सीरम आयरन में मामूली वृद्धि दिखाते हैं लेकिन कोई अतिरिक्त आयरन संचय या ऊतक क्षति नहीं होती है।
हालाँकि, ऐसा तब हो सकता है जब हेटेरोज़ायगोट्स लौह चयापचय संबंधी विकारों के साथ अन्य बीमारियों से भी पीड़ित हों।
माध्यमिक हेमोक्रोमैटोसिस अक्सर रक्त रोगों, विलंबित त्वचीय पोर्फिरीया, बार-बार रक्त संक्रमण और लौह युक्त दवाओं के सेवन की पृष्ठभूमि के खिलाफ विकसित होता है।
हेमोक्रोमैटोसिस के लक्षण
नैदानिक अभिव्यक्तियों की विशेषताएं:
रोग की नैदानिक अभिव्यक्तियाँ वयस्कता की शुरुआत के बाद विकसित होती हैं, जब शरीर में लौह भंडार 20-40 ग्राम या उससे अधिक तक पहुंच जाता है।
रोग के विकास में तीन चरण होते हैं:
- आनुवंशिक प्रवृत्ति के कारण लौह अधिभार के बिना;
- नैदानिक अभिव्यक्तियों के बिना लौह अधिभार;
- नैदानिक अभिव्यक्तियों का चरण।
रोग की शुरुआत धीरे-धीरे होती है। प्रारंभिक चरण में, कई वर्षों में, पुरुषों में गंभीर कमजोरी, थकान, वजन कम होना और यौन क्रिया में कमी की शिकायतें प्रबल होती हैं। अक्सर दाहिने हाइपोकॉन्ड्रिअम में दर्द होता है, बड़े जोड़ों के चोंड्रोकैल्सीनोसिस के कारण जोड़ों, त्वचा, अंडकोष में सूखापन और एट्रोफिक परिवर्तन होता है।
रोग के उन्नत चरण की विशेषता क्लासिक ट्रायड द्वारा की जाती है। त्वचा का रंजकता, श्लेष्मा झिल्ली, यकृत सिरोसिस और मधुमेह।
रंजकता हेमोक्रोमैटोसिस के सामान्य और शुरुआती लक्षणों में से एक है। इसकी गंभीरता प्रक्रिया की अवधि पर निर्भर करती है। कांस्य, धुएँ के रंग की त्वचा का रंग शरीर के खुले हिस्सों (चेहरे, गर्दन, हाथ), पहले से रंगे हुए क्षेत्रों, बगल, जननांगों पर अधिक दिखाई देता है।
अधिकांश रोगियों में, आयरन मुख्य रूप से यकृत में जमा होता है। लगभग सभी रोगियों में लीवर का बढ़ना देखा जाता है। यकृत की स्थिरता घनी होती है, सतह चिकनी होती है, कुछ मामलों में इसका दर्द स्पर्श करने पर होता है। 25-50% रोगियों में स्प्लेनोमेगाली का पता लगाया जाता है। एक्स्ट्राहेपेटिक लक्षण दुर्लभ हैं। 80% रोगियों में युग्मित मधुमेह देखा जाता है। वह अक्सर इंसुलिन पर निर्भर रहता है।
अंतःस्रावी विकार पिट्यूटरी ग्रंथि, पीनियल ग्रंथि, अधिवृक्क ग्रंथियों, थायरॉयड ग्रंथि (1/3 रोगियों) और गोनाड के हाइपोफंक्शन के रूप में देखे जाते हैं। 80% से अधिक रोगियों में विभिन्न प्रकार की एंडोक्रिनोपैथियाँ होती हैं। पैथोलॉजी का सबसे आम रूप मधुमेह मेलिटस है।
पीसीएच के साथ हृदय में लोहे का जमाव 90-100% मामलों में देखा जाता है, हालांकि, हृदय क्षति की नैदानिक अभिव्यक्तियाँ केवल 25-35% रोगियों में पाई जाती हैं। कार्डियोमायोपैथी के साथ हृदय के आकार में वृद्धि, लय गड़बड़ी और दुर्दम्य हृदय विफलता का क्रमिक विकास होता है।
आर्थ्रोपैथी के साथ हेमोक्रोमैटोसिस, चोंड्रोकैल्सीनोसिस, कैल्सीयूरिया के साथ ऑस्टियोपोरोसिस, न्यूरोसाइकिएट्रिक विकार, तपेदिक और पोरफाइरिया कटानिया टार्डा का संयोजन संभव है।
गंभीर नैदानिक अभिव्यक्तियों और टर्मिनल हेमोक्रोमैटोसिस के साथ अव्यक्त (आनुवंशिक प्रवृत्ति और न्यूनतम लौह अधिभार वाले रोगियों सहित) आवंटित करें। हेपेटोपैथिक, कार्डियोपैथिक, एंडोक्राइनोलॉजिकल रूप अधिक सामान्य हैं: क्रमशः, धीरे-धीरे प्रगतिशील, तेजी से प्रगतिशील, और एक तीव्र पाठ्यक्रम वाला एक रूप।
पीएचसी की गुप्त अवस्था 30-40% रोगियों में देखी जाती है, जिसका पता रोगियों के रिश्तेदारों की पारिवारिक आनुवंशिक जांच या जनसंख्या स्क्रीनिंग के दौरान लगाया जाता है। वृद्धावस्था समूह के इन लोगों में से कुछ में हल्की कमजोरी, बढ़ी हुई थकान, दाहिने हाइपोकॉन्ड्रिअम में भारीपन की भावना, शरीर के खुले क्षेत्रों में त्वचा का रंजकता, कामेच्छा में कमी और मामूली हेपेटोमेगाली के रूप में न्यूनतम लक्षण होते हैं।
उन्नत नैदानिक अभिव्यक्तियों के चरण में एस्थेनोवैगेटिव सिंड्रोम, पेट में दर्द, कभी-कभी काफी तीव्र, आर्थ्राल्जिया, 50% पुरुषों में कामेच्छा और शक्ति में कमी और 40% महिलाओं में एमेनोरिया की उपस्थिति की विशेषता होती है। इसके अलावा, वजन में कमी, कार्डियालगिया और दिल की धड़कन बढ़ सकती है। एक वस्तुनिष्ठ परीक्षण से हेपेटोमेगाली, मेलास्मा और बिगड़ा हुआ अग्नाशयी कार्य (इंसुलिन-निर्भर मधुमेह मेलिटस) का पता चलता है।
पीएचसी के अंतिम चरण में, अंगों और प्रणालियों के विघटन के लक्षण पोर्टल उच्च रक्तचाप के गठन, हेपैटोसेलुलर के विकास के साथ-साथ दाएं और बाएं वेंट्रिकुलर हृदय विफलता, मधुमेह कोमा और थकावट के रूप में देखे जाते हैं। ऐसे रोगियों में मृत्यु के कारण, एक नियम के रूप में, अन्नप्रणाली की वैरिकाज़ नसों से रक्तस्राव, हेपैटोसेलुलर और हृदय विफलता, एसेप्टिक पेरिटोनिटिस और मधुमेह कोमा हैं।
ऐसे रोगियों में ट्यूमर प्रक्रिया विकसित होने की संभावना होती है (55 वर्ष से अधिक उम्र के लोगों में इसके विकास का जोखिम सामान्य आबादी की तुलना में 13 गुना बढ़ जाता है)।
जुवेनाइल हेमोक्रोमैटोसिस बीमारी का एक दुर्लभ रूप है जो कम उम्र (15-30 वर्ष) में होता है और इसमें गंभीर आयरन अधिभार, यकृत और हृदय क्षति के लक्षणों के साथ होता है।
हेमोक्रोमैटोसिस का निदान
नैदानिक विशेषताएं:
निदान कई अंगों के घावों, एक ही परिवार के कई सदस्यों में रोग के मामले, ऊंचे लौह स्तर, मूत्र में लौह उत्सर्जन, रक्त सीरम में ट्रांसफ़रिन, फ़ेरिटिन की उच्च सांद्रता पर आधारित है। मधुमेह मेलिटस, कार्डियोमायोपैथी, हाइपोगोनाडिज्म और विशिष्ट त्वचा रंजकता के साथ संयुक्त होने पर निदान की संभावना होती है। प्रयोगशाला मानदंडों में हाइपरफ़ेरेमिया, बढ़ा हुआ ट्रांसफ़रिन संतृप्ति सूचकांक (45% से अधिक) शामिल हैं। सीरम फ़ेरिटिन का स्तर और मूत्र में लौह उत्सर्जन (डिस्फ़रल परीक्षण) तेजी से बढ़ता है। 0.5 ग्राम डेस्फेरल के इंट्रामस्क्युलर प्रशासन के बाद, लौह उत्सर्जन 10 मिलीग्राम/दिन (1.5 मिलीग्राम/दिन के मानक पर) तक बढ़ जाता है, आईएफ अनुपात (आयरन/टीआईबी) बढ़ जाता है। आनुवंशिक परीक्षण को व्यवहार में लाने के साथ, आयरन अधिभार के नैदानिक लक्षणों के बिना हेमोक्रोमैटोसिस वाले लोगों की संख्या में वृद्धि हुई है। लौह अधिभार विकसित होने के जोखिम वाले समूह में C282Y/H63D उत्परिवर्तन की उपस्थिति के लिए एक अध्ययन किया गया है। यदि रोगी C282Y/H63D का समयुग्मजी वाहक है, तो वंशानुगत हेमोक्रोमैटोसिस का निदान स्थापित माना जा सकता है।
गैर-आक्रामक अनुसंधान विधियों में, एमआरआई का उपयोग करके यकृत में सूक्ष्म तत्व का जमाव निर्धारित किया जा सकता है। यह विधि आयरन से भरे लीवर की सिग्नल तीव्रता को कम करने पर आधारित है। इस मामले में, सिग्नल की तीव्रता में कमी की डिग्री लोहे के भंडार के समानुपाती होती है। विधि आपको अग्न्याशय, हृदय और अन्य अंगों में अतिरिक्त लौह जमाव का निर्धारण करने की अनुमति देती है।
लिवर बायोप्सी प्रचुर मात्रा में लौह जमाव को दर्शाती है, जिससे पर्ल्स परीक्षण सकारात्मक आता है। एक स्पेक्ट्रोफोटोमेट्रिक अध्ययन में, लौह तत्व यकृत के शुष्क भार का 1.5% से अधिक है। परमाणु अवशोषण स्पेक्ट्रोमेट्री का उपयोग करके लिवर आयरन इंडेक्स की बाद की गणना के साथ लिवर बायोप्सी में आयरन के स्तर की मात्रात्मक माप को महत्व दिया जाता है। सूचकांक रोगी की उम्र (वर्षों में) के लिए यकृत में लौह सांद्रता (µmol/g शुष्क वजन में) के अनुपात को दर्शाता है। पीएचसी के मामले में, पहले से ही प्रारंभिक चरण में, यह सूचक 1.9-2.0 के बराबर या उससे अधिक है और यकृत के हेमोसिडरोसिस द्वारा विशेषता अन्य स्थितियों में निर्दिष्ट मूल्य तक नहीं पहुंचता है।
रोग के अव्यक्त चरण में, कार्यात्मक यकृत परीक्षण व्यावहारिक रूप से नहीं बदलते हैं, और हिस्टोलॉजिकल परीक्षा के अनुसार, ग्रेड 4 हेमोसिडरोसिस और पोर्टल पथ के फाइब्रोसिस सूजन घुसपैठ के स्पष्ट संकेतों के बिना देखे जाते हैं।
उन्नत नैदानिक अभिव्यक्तियों के चरण में, यकृत में हिस्टोलॉजिकल परिवर्तन आमतौर पर हेपेटोसाइट्स में हेमोसाइडरिन के बड़े पैमाने पर जमाव और मैक्रोफेज, पित्त नली उपकला में कम महत्वपूर्ण के साथ वर्णक सेप्टल या छोटे-गांठदार सिरोसिस के अनुरूप होते हैं।
रोग के अंतिम चरण में हिस्टोलॉजिकल परीक्षण से लीवर (जैसे मोनो- और मल्टीलोबुलर सिरोसिस), हृदय, अग्न्याशय, थायरॉयड, लार और पसीने की ग्रंथियों, अधिवृक्क ग्रंथियों, पिट्यूटरी ग्रंथि और अन्य अंगों को नुकसान के साथ सामान्यीकृत हेमोसिडरोसिस की तस्वीर का पता चलता है।
आयरन अधिभार कई जन्मजात या अधिग्रहित स्थितियों में देखा जाता है जिसके साथ पीएचसी को अलग करना आवश्यक है।
लौह अधिभार के विकास का वर्गीकरण और कारण:
- हेमोक्रोमैटोसिस के पारिवारिक या जन्मजात रूप:
- जन्मजात एचएफई-संबंधित हेमोक्रोमैटोसिस:
- C282Y के लिए समयुग्मजी;
- C282Y/H63D के लिए मिश्रित विषमयुग्मजीता।
- जन्मजात एचएफई-गैर-संबद्ध हेमोक्रोमैटोसिस।
- किशोर हेमोक्रोमैटोसिस।
- नवजात शिशुओं में आयरन की अधिकता।
- ऑटोसोमल प्रमुख हेमोक्रोमैटोसिस।
- जन्मजात एचएफई-संबंधित हेमोक्रोमैटोसिस:
- अधिग्रहीत लौह अधिभार:
- रुधिर संबंधी रोग:
- आयरन की अधिकता के कारण एनीमिया;
- थैलेसीमिया मेजर;
- साइडरोबलास्टिक एनीमिया;
- क्रोनिक हेमोलिटिक एनीमिया।
- रुधिर संबंधी रोग:
- जीर्ण यकृत रोग:
- हेपेटाइटिस सी;
- शराबी जिगर की बीमारी;
- गैर-अल्कोहलिक स्टीटोहेपेटाइटिस।
रोग को रक्त विकृति विज्ञान (थैलेसीमिया, साइडरोबलास्टिक एनीमिया, वंशानुगत एट्रांसफेरिनमिया, माइक्रोसाइटिक एनीमिया, पोर्फिरीया कटानिया टार्डा), यकृत रोग (अल्कोहल यकृत रोग, क्रोनिक वायरल हेपेटाइटिस, गैर-अल्कोहल स्टीटोहेपेटाइटिस) से भी अलग किया जाना चाहिए।
हेमोक्रोमैटोसिस का उपचार
हेमोक्रोमैटोसिस के उपचार की विशेषताएं:
आयरन युक्त खाद्य पदार्थों के बिना, प्रोटीन से भरपूर आहार का संकेत दिया जाता है।
शरीर से अतिरिक्त आयरन को निकालने का सबसे सुलभ तरीका रक्तपात है। आमतौर पर सप्ताह में 1-2 बार के अंतराल पर 300-500 मिलीलीटर रक्त निकाला जाता है। रक्तपात की संख्या की गणना हीमोग्लोबिन के स्तर, रक्त हेमाटोक्रिट, फेरिटिन और अतिरिक्त आयरन की मात्रा के आधार पर की जाती है। यह ध्यान में रखा जाता है कि 500 मिलीलीटर रक्त में 200-250 मिलीग्राम आयरन होता है, मुख्य रूप से लाल रक्त कोशिकाओं के हीमोग्लोबिन में। रक्तपात तब तक जारी रखा जाता है जब तक कि रोगी में हल्का एनीमिया विकसित न हो जाए। इस एक्स्ट्राकोर्पोरियल तकनीक का एक संशोधन साइटाफेरेसिस (सीए) है (एक बंद सर्किट में ऑटोप्लाज्मा की वापसी के साथ रक्त के सेलुलर भाग को हटाना)। रक्त कोशिकाओं के यांत्रिक निष्कासन के अलावा, सीए में विषहरण प्रभाव होता है और अपक्षयी-भड़काऊ प्रक्रियाओं की गंभीरता को कम करने में मदद करता है। प्रत्येक रोगी को सीए के 8-10 सत्रों से गुजरना पड़ता है, जिसके बाद 3 महीने के लिए 2-3 सत्रों की मात्रा में सीए या हेमोएक्सफ़्यूज़न का उपयोग करके रखरखाव चिकित्सा में संक्रमण होता है।
औषधि उपचार इंट्रामस्क्युलर या अंतःशिरा में 10% समाधान के 10 मिलीलीटर डेफेरोक्सामाइन (डेस्फेरल, डेस्फेरिन) के उपयोग पर आधारित है। दवा में Fe3+ आयनों के प्रति उच्च विशिष्ट गतिविधि है। वहीं, 500 मिलीग्राम डेस्फेरल शरीर से 42.5 मिलीग्राम आयरन निकाल सकता है। कोर्स की अवधि 20-40 दिन है। साथ ही सिरोसिस, मधुमेह और हृदय विफलता का इलाज किया जाता है। पीएचसी के रोगियों में यकृत ऊतक में अतिरिक्त आयरन की उपस्थिति में अक्सर देखा जाने वाला एनीमिया सिंड्रोम, अपवाही चिकित्सा के उपयोग को सीमित करता है। हमारे क्लिनिक ने सीए की पृष्ठभूमि के खिलाफ पुनः संयोजक एरिथ्रोपोइटिन के उपयोग के लिए एक आहार विकसित किया है। दवा शरीर के डिपो से आयरन के उपयोग में वृद्धि को बढ़ावा देती है, जिसके परिणामस्वरूप सूक्ष्म तत्व के कुल भंडार में कमी आती है और हीमोग्लोबिन के स्तर में वृद्धि होती है। 10-15 सप्ताह के लिए सप्ताह में 2 बार किए जाने वाले सीए सत्रों के दौरान रिओम्बिनेंट एरिथ्रोपोइटिन को 25 एमसीजी/किलोग्राम शरीर के वजन की खुराक पर प्रशासित किया जाता है।
पूर्वानुमान:
पूर्वानुमान ओवरलोड की डिग्री और अवधि से निर्धारित होता है।
बीमारी का कोर्स लंबा है, खासकर वृद्ध लोगों में। समय पर उपचार जीवन को कई दशकों तक बढ़ा देता है। उपचारित रोगियों में 5 वर्षों तक जीवित रहने की दर अनुपचारित रोगियों की तुलना में 2.5-3 गुना अधिक है। लीवर सिरोसिस की उपस्थिति में एचसीसी वाले रोगियों में एचसीसी विकसित होने का जोखिम 200 गुना बढ़ जाता है। अधिकतर मृत्यु लीवर की खराबी के कारण होती है।
रक्तवर्णकता
हेमोक्रोमैटोसिस क्या है -
प्राथमिक हेमोक्रोमैटोसिस (पीएचसी) एक ऑटोसोमल रिसेसिव, एचएलए-संबंधित बीमारी है जो एक आनुवंशिक दोष के कारण होती है जो एक चयापचय विकार द्वारा विशेषता होती है जिसमें गैस्ट्रोइंटेस्टाइनल ट्रैक्ट में लौह का अवशोषण बढ़ जाता है।
हेमोक्रोमैटोसिस को क्या उत्तेजित करता है/कारण:
इस बीमारी का वर्णन सबसे पहले 1871 में एम. ट्रोइसियर ने एक लक्षण जटिल के रूप में किया था, जो शरीर में आयरन के संचय से जुड़े मधुमेह मेलेटस, त्वचा रंजकता और यकृत सिरोसिस की विशेषता थी। 1889 में, रेक्लिंगहौसेन ने "हेमोक्रोमैटोसिस" शब्द पेश किया, जो बीमारी की विशेषताओं में से एक को दर्शाता है: त्वचा और आंतरिक अंगों का असामान्य रंग। यह पाया गया कि आयरन पहले यकृत की पैरेन्काइमल कोशिकाओं में जमा होता है, और फिर अन्य अंगों (अग्न्याशय, हृदय, जोड़ों, पिट्यूटरी ग्रंथि) में जमा हो सकता है।
व्यापकता.जनसंख्या आनुवंशिक अध्ययनों ने पीएचसी की एक दुर्लभ बीमारी के रूप में समझ को बदल दिया है। पीएचसी जीन की व्यापकता 0.03-0.07% है - इसलिए, हाल तक, प्रति 100 हजार जनसंख्या पर 3-8 मामले देखे गए थे। श्वेत आबादी में, समयुग्मजीता की आवृत्ति 0.3% है, विषमयुग्मजी गाड़ी की आवृत्ति 8-10% है। बेहतर निदान के कारण घटनाओं में वृद्धि हुई है। यूरोपीय समुदाय के निवासियों के बीच घटना दर औसतन 1:300 है। डब्ल्यूएचओ के अनुसार, 10% आबादी हेमोक्रोमैटोसिस से ग्रस्त है। पुरुष महिलाओं की तुलना में लगभग 10 गुना अधिक बार बीमार पड़ते हैं।
हेमोक्रोमैटोसिस के दौरान रोगजनन (क्या होता है?)
आम तौर पर, शरीर में लगभग 4 ग्राम आयरन होता है, जिसमें से जी हीमोग्लोबिन, मायोग्लोबिन, कैटालेज़ और अन्य रेस्पिरेटर-बिक्स पिगमेंट या एंजाइम में होता है। लोहे का भंडार 0.5 ग्राम है, जिनमें से कुछ यकृत में हैं, लेकिन वे पारंपरिक तरीकों का उपयोग करके लोहे की हिस्टोलॉजिकल परीक्षा के दौरान दिखाई नहीं देते हैं। आम तौर पर, मानव दैनिक आहार में लगभग 10-20 मिलीग्राम आयरन (90% मुक्त खड़े, 10% हेम के साथ संयोजन में) होता है, जिसमें से 1-1.5 मिलीग्राम अवशोषित होता है।
अवशोषित आयरन की मात्रा शरीर में इसके भंडार पर निर्भर करती है: जितनी अधिक आवश्यकता, उतना अधिक आयरन अवशोषित होता है। अवशोषण मुख्य रूप से ऊपरी छोटी आंत में होता है और यह एक सक्रिय प्रक्रिया है जिसमें लोहे को एक सांद्रता प्रवणता के विपरीत आगे ले जाया जा सकता है। हालाँकि, स्थानांतरण तंत्र अज्ञात हैं।
आंतों के म्यूकोसा की कोशिकाओं में साइटोसोल में आयरन पाया जाता है। इसका कुछ हिस्सा फेरिटिन के रूप में बंधा और संग्रहीत होता है, जो बाद में उपकला कोशिकाओं के विलुप्त होने के परिणामस्वरूप या तो उपयोग किया जाता है या खो जाता है। अन्य ऊतकों में चयापचय के लिए इच्छित लौह का कुछ हिस्सा कोशिका के बेसोलेटरल झिल्ली में ले जाया जाता है और ट्रांसफ़रिन से बंध जाता है, जो रक्त में लौह के लिए मुख्य परिवहन प्रोटीन है। कोशिकाओं में, आयरन को फेरिटिन के रूप में जमा किया जाता है - आयरन के साथ प्रोटीन एपोफेरिटिन का एक कॉम्प्लेक्स। टूटे हुए फ़ेरिटिन अणुओं के गुच्छे हीमोसाइडरिन हैं। शरीर में लगभग एक तिहाई लौह भंडार हेमोसाइडरिन के रूप में होता है, जिसकी मात्रा अतिरिक्त लौह संचय से जुड़ी बीमारियों में बढ़ जाती है।
हेमोक्रोमैटोसिस के साथ, पाचन तंत्र में लोहे का अवशोषण 3.0-4.0 मिलीग्राम तक बढ़ जाता है। इस प्रकार, 1 वर्ष के भीतर, यकृत, अग्न्याशय, हृदय और अन्य अंगों और ऊतकों की कोशिकाओं में जमा इसकी अतिरिक्त मात्रा लगभग 1 ग्राम है। अंततः, शरीर के इंट्रा- और बाह्य कोशिकीय पूल आयरन से अत्यधिक संतृप्त हो जाते हैं, जो मुक्त आयरन की अनुमति देता है विषाक्त अंतःकोशिकीय प्रतिक्रियाओं में प्रवेश करना। एक मजबूत रेडॉक्स पदार्थ होने के कारण, आयरन मुक्त हाइड्रॉक्सिल रेडिकल बनाता है, जो बदले में लिपिड, प्रोटीन और डीएनए के मैक्रोमोलेक्यूल्स को नष्ट कर देता है।
लीवर में आयरन के बढ़ते संचय की विशेषता है:
- लिवर की फाइब्रोसिस और सिरोसिस, पैरेन्काइमल कोशिकाओं में लोहे के प्रारंभिक प्रमुख संचय के साथ, कुछ हद तक स्टेलेट रेटिकुलोएन्डोथेलियोसाइट्स में।
- अग्न्याशय, हृदय, पिट्यूटरी ग्रंथि सहित अन्य अंगों में लोहे का जमाव।
- लोहे के अवशोषण में वृद्धि, जिससे इसका अवशोषण और संचय होता है।
यह रोग तथाकथित मिसेन म्यूटेशन से जुड़ा है, यानी ऐसे उत्परिवर्तन जो कोडन के अर्थ में परिवर्तन का कारण बनते हैं और प्रोटीन जैवसंश्लेषण को रोकते हैं।
पीएचसी की आनुवंशिक प्रकृति की पुष्टि एम. साइमन एट अल द्वारा की गई थी। 1976 में, जिन्होंने यूरोपीय आबादी के प्रतिनिधियों में प्रमुख हिस्टोकम्पैटिबिलिटी कॉम्प्लेक्स के कुछ एंटीजन के साथ बीमारी के करीबी संबंध का खुलासा किया। नैदानिक अभिव्यक्ति के लिए, रोगी के पास दो पीएचसी एलील (होमोज़ायगोसिटी) होने चाहिए। रोगी के लिए सामान्य रूप से एक एचएलए हैप्लोटाइप की उपस्थिति पीएचसी एलील के विषमयुग्मजी परिवहन को इंगित करती है। ऐसे व्यक्ति अप्रत्यक्ष संकेत दिखा सकते हैं जो शरीर में आयरन के स्तर में वृद्धि और नैदानिक रूप से महत्वपूर्ण लक्षणों की अनुपस्थिति का संकेत देते हैं। विषमयुग्मजी जीन वाहक समयुग्मजी से अधिक प्रबल होता है। यदि माता-पिता दोनों विषमयुग्मजी हैं, तो छद्मप्रमुख प्रकार का वंशानुक्रम संभव है। हेटेरोजाइट्स में, लोहे का अवशोषण आमतौर पर थोड़ा बढ़ जाता है, रक्त सीरम में लोहे की थोड़ी वृद्धि का पता लगाया जाता है, लेकिन सूक्ष्म तत्व का जीवन-घातक अधिभार नहीं देखा जाता है। उसी समय, यदि हेटेरोज़ायगोट्स लौह चयापचय के विकारों के साथ अन्य बीमारियों से पीड़ित हैं, तो रोग प्रक्रिया के नैदानिक और रूपात्मक लक्षण प्रकट हो सकते हैं।
एचएलए एंटीजन के साथ रोग के घनिष्ठ संबंध ने पीजीसी के लिए जिम्मेदार जीन को स्थानीयकृत करना संभव बना दिया, जो क्रोमोसोम 6 की छोटी भुजा पर स्थित है, एचएलए प्रणाली के ए लोकस के पास और ए 3 एलील और हैप्लोटाइप ए 3 बी 7 या ए 3 बी 14 से जुड़ा हुआ है। . यह तथ्य इसकी पहचान के उद्देश्य से किए गए शोध के आधार के रूप में कार्य करता है।
वंशानुगत हेमोक्रोमैटोसिस को शुरू में एक साधारण मोनोजेनिक बीमारी माना जाता था। वर्तमान में, जीन दोष और नैदानिक तस्वीर के आधार पर, पीजीसी के 4 रूप प्रतिष्ठित हैं:
- क्लासिकल ऑटोसोमल रिसेसिव HFE-1;
- किशोर एचएफई-2;
- एचएफई-3, ट्रांसफ़रिन रिसेप्टर प्रकार 2 में उत्परिवर्तन के साथ जुड़ा हुआ;
- ऑटोसोमल डोमिनेंट हेमोक्रोमैटोसिस एचएफई-4।
रोग के सार को समझने में एचएफई जीन (हेमोक्रोमैटोसिस के विकास से जुड़ा) की पहचान एक महत्वपूर्ण बिंदु थी। एचएफई जीन 343 अमीनो एसिड से युक्त एक प्रोटीन संरचना को एनकोड करता है, जिसकी संरचना एमएचसी वर्ग I प्रणाली के अणु के समान है। हेमोक्रोमैटोसिस से पीड़ित व्यक्तियों में इस जीन में उत्परिवर्तन की पहचान की गई है। जातीय रूसियों के बीच एक समयुग्मजी अवस्था में C282Y एलील के वाहक प्रति 1000 लोगों में कम से कम 1 हैं। लौह चयापचय में एचएफई की भूमिका ट्रांसफ़रिन रिसेप्टर (टीएफआर) के साथ एचएफई की बातचीत से प्रदर्शित होती है। टीएफआर के साथ एचएफई का जुड़ाव आयरन-बाउंड ट्रांसफ़रिन के लिए इस रिसेप्टर की आत्मीयता को कम कर देता है। C282U उत्परिवर्तन के साथ, HFE TfR से बिल्कुल भी बंधने में सक्षम नहीं है, और H63D उत्परिवर्तन के साथ, TfR के लिए आत्मीयता कुछ हद तक कम हो जाती है। एक्स-रे क्रिस्टलोग्राफी का उपयोग करके एचएफई की त्रि-आयामी संरचना का अध्ययन किया गया, जिससे एचएफई और 2 मीटर प्रकाश श्रृंखला के बीच बातचीत की प्रकृति को स्थापित करना संभव हो गया, साथ ही हेमोक्रोमैटोसिस की विशेषता वाले उत्परिवर्तन के स्थानीयकरण का निर्धारण करना संभव हो गया।
C282U उत्परिवर्तन से डोमेन में डाइसल्फ़ाइड बंधन टूट जाता है, जो प्रोटीन की सही स्थानिक संरचना के निर्माण और 2m तक इसके बंधन में महत्वपूर्ण है। एचएफई प्रोटीन की सबसे बड़ी मात्रा ग्रहणी की गहरी तहों में उत्पन्न होती है। आम तौर पर, क्रिप्टन कोशिकाओं में एचएफई प्रोटीन की भूमिका ट्रांसफ़रिन से बंधे लोहे के अवशोषण को नियंत्रित करना है। एक स्वस्थ व्यक्ति में, सीरम आयरन का स्तर बढ़ने से गहरी क्रिप्ट कोशिकाओं (टीएफआर द्वारा मध्यस्थ और एचएफई द्वारा संशोधित एक प्रक्रिया) द्वारा आयरन ग्रहण बढ़ जाता है। C282Y उत्परिवर्तन क्रिप्ट कोशिकाओं द्वारा TfR-मध्यस्थता वाले लौह अवशोषण को ख़राब कर सकता है और इस प्रकार शरीर में कम लौह स्थिति का गलत संकेत उत्पन्न कर सकता है।
इंट्रासेल्युलर लौह सामग्री में कमी के कारण, विली के शीर्ष पर स्थानांतरित होने वाले विभेदित एंटरोसाइट्स डीएमटी -1 की बढ़ी हुई मात्रा का उत्पादन करना शुरू कर देते हैं, जिसके परिणामस्वरूप लौह ग्रहण बढ़ जाता है। रोगजनन में मुख्य कड़ी एंजाइम प्रणालियों में एक आनुवंशिक दोष है जो भोजन से सामान्य सेवन के दौरान आंत में लोहे के अवशोषण को नियंत्रित करता है। एचएलए-ए प्रणाली के साथ आनुवंशिक संबंध सिद्ध हो चुका है। इन मार्करों का उपयोग करके लिंकेज असंतुलन के एक अध्ययन में एज़, बी 7, बीटी 4, डी 6 सियोश डी 6 एस 126 ओ के साथ हेमोक्रोमैटोसिस का संबंध दिखाया गया है।
इस दिशा में आगे के शोध और हैप्लोटाइप के विश्लेषण से पता चलता है कि जीन D6 S2238 और D6 S2241 के बीच स्थित है। अनुमानित हेमोक्रोमैटोसिस जीन एचएलए समरूप है, और उत्परिवर्तन कार्यात्मक रूप से महत्वपूर्ण क्षेत्र को प्रभावित करता प्रतीत होता है। शरीर में लौह तत्व को नियंत्रित करने वाला जीन गुणसूत्र 6 पर A3HLA स्थान पर स्थित होता है। यह जीन एक प्रोटीन की संरचना को एनकोड करता है जो ट्रांसफ़रिन रिसेप्टर के साथ इंटरैक्ट करता है और ट्रांसफ़रिन-आयरन कॉम्प्लेक्स के लिए रिसेप्टर की आत्मीयता को कम करता है। इस प्रकार, एचएफई जीन उत्परिवर्तन डुओडनल एंटरोसाइट्स द्वारा आयरन के ट्रांसफ़रिन-मध्यस्थ ग्रहण को बाधित करता है, जिसके परिणामस्वरूप शरीर में कम आयरन सामग्री की उपस्थिति के बारे में एक गलत संकेत बनता है, जिसके परिणामस्वरूप आयरन का उत्पादन बढ़ जाता है। एंटरोसाइट्स के विली में प्रोटीन डीसीटी-1 को बांधना और इसके परिणामस्वरूप आयरन की मात्रा में वृद्धि कैसे होती है।
संभावित विषाक्तता को इसकी क्षमता से समझाया जाता है, चर वैलेंस के साथ एक धातु के रूप में, मूल्यवान मुक्त कण प्रतिक्रियाओं को ट्रिगर करने के लिए जो कोशिका के ऑर्गेनेल और आनुवंशिक संरचनाओं को विषाक्त क्षति पहुंचाती है, कोलेजन संश्लेषण में वृद्धि और ट्यूमर के विकास को जन्म देती है। हेटेरोज़ीगोट्स सीरम आयरन में मामूली वृद्धि दिखाते हैं लेकिन कोई अतिरिक्त आयरन संचय या ऊतक क्षति नहीं होती है।
हालाँकि, ऐसा तब हो सकता है जब हेटेरोज़ायगोट्स लौह चयापचय संबंधी विकारों के साथ अन्य बीमारियों से भी पीड़ित हों।
माध्यमिक हेमोक्रोमैटोसिस अक्सर रक्त रोगों, विलंबित त्वचीय पोर्फिरीया, बार-बार रक्त संक्रमण और लौह युक्त दवाओं के सेवन की पृष्ठभूमि के खिलाफ विकसित होता है।
हेमोक्रोमैटोसिस के लक्षण:
नैदानिक अभिव्यक्तियों की विशेषताएं:
रोग की नैदानिक अभिव्यक्तियाँ वयस्कता की शुरुआत के बाद विकसित होती हैं, जब शरीर में लौह भंडार 20-40 ग्राम या उससे अधिक तक पहुंच जाता है।
रोग के विकास में तीन चरण होते हैं:
- आनुवंशिक प्रवृत्ति के कारण लौह अधिभार के बिना;
- नैदानिक अभिव्यक्तियों के बिना लौह अधिभार;
- नैदानिक अभिव्यक्तियों का चरण।
रोग की शुरुआत धीरे-धीरे होती है। प्रारंभिक चरण में, कई वर्षों में, पुरुषों में गंभीर कमजोरी, थकान, वजन कम होना और यौन क्रिया में कमी की शिकायतें प्रबल होती हैं। अक्सर दाहिने हाइपोकॉन्ड्रिअम में दर्द होता है, बड़े जोड़ों के चोंड्रोकैल्सीनोसिस के कारण जोड़ों, त्वचा, अंडकोष में सूखापन और एट्रोफिक परिवर्तन होता है।
रोग के उन्नत चरण की विशेषता क्लासिक ट्रायड द्वारा की जाती है। त्वचा का रंजकता, श्लेष्मा झिल्ली, यकृत सिरोसिस और मधुमेह।
रंजकता हेमोक्रोमैटोसिस के सामान्य और शुरुआती लक्षणों में से एक है। इसकी गंभीरता प्रक्रिया की अवधि पर निर्भर करती है। कांस्य, धुएँ के रंग की त्वचा का रंग शरीर के खुले हिस्सों (चेहरे, गर्दन, हाथ), पहले से रंगे हुए क्षेत्रों, बगल, जननांगों पर अधिक दिखाई देता है।
अधिकांश रोगियों में, आयरन मुख्य रूप से यकृत में जमा होता है। लगभग सभी रोगियों में लीवर का बढ़ना देखा जाता है। यकृत की स्थिरता घनी होती है, सतह चिकनी होती है, कुछ मामलों में इसका दर्द स्पर्श करने पर होता है। 25-50% रोगियों में स्प्लेनोमेगाली का पता लगाया जाता है। एक्स्ट्राहेपेटिक लक्षण दुर्लभ हैं। 80% रोगियों में युग्मित मधुमेह देखा जाता है। वह अक्सर इंसुलिन पर निर्भर रहता है।
अंतःस्रावी विकार पिट्यूटरी ग्रंथि, पीनियल ग्रंथि, अधिवृक्क ग्रंथियों, थायरॉयड ग्रंथि (1/3 रोगियों) और गोनाड के हाइपोफंक्शन के रूप में देखे जाते हैं। 80% से अधिक रोगियों में विभिन्न प्रकार की एंडोक्रिनोपैथियाँ होती हैं। पैथोलॉजी का सबसे आम रूप मधुमेह मेलिटस है।
पीसीएच के साथ हृदय में लोहे का जमाव 90-100% मामलों में देखा जाता है, हालांकि, हृदय क्षति की नैदानिक अभिव्यक्तियाँ केवल 25-35% रोगियों में पाई जाती हैं। कार्डियोमायोपैथी के साथ हृदय के आकार में वृद्धि, लय गड़बड़ी और दुर्दम्य हृदय विफलता का क्रमिक विकास होता है।
आर्थ्रोपैथी के साथ हेमोक्रोमैटोसिस, चोंड्रोकैल्सीनोसिस, कैल्सीयूरिया के साथ ऑस्टियोपोरोसिस, न्यूरोसाइकिएट्रिक विकार, तपेदिक और पोरफाइरिया कटानिया टार्डा का संयोजन संभव है।
गंभीर नैदानिक अभिव्यक्तियों और टर्मिनल हेमोक्रोमैटोसिस के साथ अव्यक्त (आनुवंशिक प्रवृत्ति और न्यूनतम लौह अधिभार वाले रोगियों सहित) आवंटित करें। हेपेटोपैथिक, कार्डियोपैथिक, एंडोक्राइनोलॉजिकल रूप अधिक सामान्य हैं: क्रमशः, धीरे-धीरे प्रगतिशील, तेजी से प्रगतिशील, और एक तीव्र पाठ्यक्रम वाला एक रूप।
पीएचसी की गुप्त अवस्था 30-40% रोगियों में देखी जाती है, जिसका पता रोगियों के रिश्तेदारों की पारिवारिक आनुवंशिक जांच या जनसंख्या स्क्रीनिंग के दौरान लगाया जाता है। वृद्धावस्था समूह के इन लोगों में से कुछ में हल्की कमजोरी, बढ़ी हुई थकान, दाहिने हाइपोकॉन्ड्रिअम में भारीपन की भावना, शरीर के खुले क्षेत्रों में त्वचा का रंजकता, कामेच्छा में कमी और मामूली हेपेटोमेगाली के रूप में न्यूनतम लक्षण होते हैं।
उन्नत नैदानिक अभिव्यक्तियों के चरण में एस्थेनोवैगेटिव सिंड्रोम, पेट में दर्द, कभी-कभी काफी तीव्र, आर्थ्राल्जिया, 50% पुरुषों में कामेच्छा और शक्ति में कमी और 40% महिलाओं में एमेनोरिया की उपस्थिति की विशेषता होती है। इसके अलावा, वजन में कमी, कार्डियालगिया और दिल की धड़कन बढ़ सकती है। एक वस्तुनिष्ठ परीक्षण से हेपेटोमेगाली, मेलास्मा और बिगड़ा हुआ अग्नाशयी कार्य (इंसुलिन-निर्भर मधुमेह मेलिटस) का पता चलता है।
पीएचसी के अंतिम चरण में, अंगों और प्रणालियों के विघटन के लक्षण पोर्टल उच्च रक्तचाप के गठन, हेपैटोसेलुलर के विकास के साथ-साथ दाएं और बाएं वेंट्रिकुलर हृदय विफलता, मधुमेह कोमा और थकावट के रूप में देखे जाते हैं। ऐसे रोगियों में मृत्यु के कारण, एक नियम के रूप में, अन्नप्रणाली की वैरिकाज़ नसों से रक्तस्राव, हेपैटोसेलुलर और हृदय विफलता, एसेप्टिक पेरिटोनिटिस और मधुमेह कोमा हैं।
ऐसे रोगियों में ट्यूमर प्रक्रिया विकसित होने की संभावना होती है (55 वर्ष से अधिक उम्र के लोगों में इसके विकास का जोखिम सामान्य आबादी की तुलना में 13 गुना बढ़ जाता है)।
जुवेनाइल हेमोक्रोमैटोसिस बीमारी का एक दुर्लभ रूप है जो कम उम्र (15-30 वर्ष) में होता है और इसमें गंभीर आयरन अधिभार, यकृत और हृदय क्षति के लक्षणों के साथ होता है।
हेमोक्रोमैटोसिस का निदान:
नैदानिक विशेषताएं:
निदान कई अंगों के घावों, एक ही परिवार के कई सदस्यों में रोग के मामले, ऊंचे लौह स्तर, मूत्र में लौह उत्सर्जन, रक्त सीरम में ट्रांसफ़रिन, फ़ेरिटिन की उच्च सांद्रता पर आधारित है। मधुमेह मेलिटस, कार्डियोमायोपैथी, हाइपोगोनाडिज्म और विशिष्ट त्वचा रंजकता के साथ संयुक्त होने पर निदान की संभावना होती है। प्रयोगशाला मानदंडों में हाइपरफ़ेरेमिया, बढ़ा हुआ ट्रांसफ़रिन संतृप्ति सूचकांक (45% से अधिक) शामिल हैं। सीरम फ़ेरिटिन का स्तर और मूत्र में लौह उत्सर्जन (डिस्फ़रल परीक्षण) तेजी से बढ़ता है। 0.5 ग्राम डेस्फेरल के इंट्रामस्क्युलर प्रशासन के बाद, लौह उत्सर्जन 10 मिलीग्राम/दिन (1.5 मिलीग्राम/दिन के मानक पर) तक बढ़ जाता है, आईएफ अनुपात (आयरन/टीआईबी) बढ़ जाता है। आनुवंशिक परीक्षण को व्यवहार में लाने के साथ, आयरन अधिभार के नैदानिक लक्षणों के बिना हेमोक्रोमैटोसिस वाले लोगों की संख्या में वृद्धि हुई है। लौह अधिभार विकसित होने के जोखिम वाले समूह में C282Y/H63D उत्परिवर्तन की उपस्थिति के लिए एक अध्ययन किया गया है। यदि रोगी C282Y/H63D का समयुग्मजी वाहक है, तो वंशानुगत हेमोक्रोमैटोसिस का निदान स्थापित माना जा सकता है।
गैर-आक्रामक अनुसंधान विधियों में, एमआरआई का उपयोग करके यकृत में सूक्ष्म तत्व का जमाव निर्धारित किया जा सकता है। यह विधि आयरन से भरे लीवर की सिग्नल तीव्रता को कम करने पर आधारित है। इस मामले में, सिग्नल की तीव्रता में कमी की डिग्री लोहे के भंडार के समानुपाती होती है। विधि आपको अग्न्याशय, हृदय और अन्य अंगों में अतिरिक्त लौह जमाव का निर्धारण करने की अनुमति देती है।
लिवर बायोप्सी प्रचुर मात्रा में लौह जमाव को दर्शाती है, जिससे पर्ल्स परीक्षण सकारात्मक आता है। एक स्पेक्ट्रोफोटोमेट्रिक अध्ययन में, लौह तत्व यकृत के शुष्क भार का 1.5% से अधिक है। परमाणु अवशोषण स्पेक्ट्रोमेट्री का उपयोग करके लिवर आयरन इंडेक्स की बाद की गणना के साथ लिवर बायोप्सी में आयरन के स्तर की मात्रात्मक माप को महत्व दिया जाता है। सूचकांक रोगी की उम्र (वर्षों में) के लिए यकृत में लौह सांद्रता (µmol/g शुष्क वजन में) के अनुपात को दर्शाता है। पीएचसी के मामले में, पहले से ही प्रारंभिक चरण में, यह सूचक 1.9-2.0 के बराबर या उससे अधिक है और यकृत के हेमोसिडरोसिस द्वारा विशेषता अन्य स्थितियों में निर्दिष्ट मूल्य तक नहीं पहुंचता है।
रोग के अव्यक्त चरण में, कार्यात्मक यकृत परीक्षण व्यावहारिक रूप से नहीं बदलते हैं, और हिस्टोलॉजिकल परीक्षा के अनुसार, ग्रेड 4 हेमोसिडरोसिस और पोर्टल पथ के फाइब्रोसिस सूजन घुसपैठ के स्पष्ट संकेतों के बिना देखे जाते हैं।
उन्नत नैदानिक अभिव्यक्तियों के चरण में, यकृत में हिस्टोलॉजिकल परिवर्तन आमतौर पर हेपेटोसाइट्स में हेमोसाइडरिन के बड़े पैमाने पर जमाव और मैक्रोफेज, पित्त नली उपकला में कम महत्वपूर्ण के साथ वर्णक सेप्टल या छोटे-गांठदार सिरोसिस के अनुरूप होते हैं।
रोग के अंतिम चरण में हिस्टोलॉजिकल परीक्षण से लीवर (जैसे मोनो- और मल्टीलोबुलर सिरोसिस), हृदय, अग्न्याशय, थायरॉयड, लार और पसीने की ग्रंथियों, अधिवृक्क ग्रंथियों, पिट्यूटरी ग्रंथि और अन्य अंगों को नुकसान के साथ सामान्यीकृत हेमोसिडरोसिस की तस्वीर का पता चलता है।
आयरन अधिभार कई जन्मजात या अधिग्रहित स्थितियों में देखा जाता है जिसके साथ पीएचसी को अलग करना आवश्यक है।
लौह अधिभार के विकास का वर्गीकरण और कारण:
- हेमोक्रोमैटोसिस के पारिवारिक या जन्मजात रूप:
- जन्मजात एचएफई-संबंधित हेमोक्रोमैटोसिस:
- C282Y के लिए समयुग्मजी;
- C282Y/H63D के लिए मिश्रित विषमयुग्मजीता।
- जन्मजात एचएफई-गैर-संबद्ध हेमोक्रोमैटोसिस।
- किशोर हेमोक्रोमैटोसिस।
- नवजात शिशुओं में आयरन की अधिकता।
- ऑटोसोमल प्रमुख हेमोक्रोमैटोसिस।
- जन्मजात एचएफई-संबंधित हेमोक्रोमैटोसिस:
- अधिग्रहीत लौह अधिभार:
- रुधिर संबंधी रोग:
- आयरन की अधिकता के कारण एनीमिया;
- थैलेसीमिया मेजर;
- साइडरोबलास्टिक एनीमिया;
- क्रोनिक हेमोलिटिक एनीमिया।
- रुधिर संबंधी रोग:
- जीर्ण यकृत रोग:
- हेपेटाइटिस सी;
- शराबी जिगर की बीमारी;
- गैर-अल्कोहलिक स्टीटोहेपेटाइटिस।
रोग को रक्त विकृति विज्ञान (थैलेसीमिया, साइडरोबलास्टिक एनीमिया, वंशानुगत एट्रांसफेरिनमिया, माइक्रोसाइटिक एनीमिया, पोर्फिरीया कटानिया टार्डा), यकृत रोग (अल्कोहल यकृत रोग, क्रोनिक वायरल हेपेटाइटिस, गैर-अल्कोहल स्टीटोहेपेटाइटिस) से भी अलग किया जाना चाहिए।
हेमोक्रोमैटोसिस का उपचार:
हेमोक्रोमैटोसिस के उपचार की विशेषताएं:
आयरन युक्त खाद्य पदार्थों के बिना, प्रोटीन से भरपूर आहार का संकेत दिया जाता है।
शरीर से अतिरिक्त आयरन को निकालने का सबसे सुलभ तरीका रक्तपात है। आमतौर पर सप्ताह में 1-2 बार के अंतराल पर 300-500 मिलीलीटर रक्त निकाला जाता है। रक्तपात की संख्या की गणना हीमोग्लोबिन के स्तर, रक्त हेमाटोक्रिट, फेरिटिन और अतिरिक्त आयरन की मात्रा के आधार पर की जाती है। यह ध्यान में रखा जाता है कि 500 मिलीलीटर रक्त में 200-250 मिलीग्राम आयरन होता है, मुख्य रूप से लाल रक्त कोशिकाओं के हीमोग्लोबिन में। रक्तपात तब तक जारी रखा जाता है जब तक कि रोगी में हल्का एनीमिया विकसित न हो जाए। इस एक्स्ट्राकोर्पोरियल तकनीक का एक संशोधन साइटाफेरेसिस (सीए) है (एक बंद सर्किट में ऑटोप्लाज्मा की वापसी के साथ रक्त के सेलुलर भाग को हटाना)। रक्त कोशिकाओं के यांत्रिक निष्कासन के अलावा, सीए में विषहरण प्रभाव होता है और अपक्षयी-भड़काऊ प्रक्रियाओं की गंभीरता को कम करने में मदद करता है। प्रत्येक रोगी को सीए के 8-10 सत्रों से गुजरना पड़ता है, जिसके बाद 3 महीने के लिए 2-3 सत्रों की मात्रा में सीए या हेमोएक्सफ़्यूज़न का उपयोग करके रखरखाव चिकित्सा में संक्रमण होता है।
औषधि उपचार इंट्रामस्क्युलर या अंतःशिरा में 10% समाधान के 10 मिलीलीटर डेफेरोक्सामाइन (डेस्फेरल, डेस्फेरिन) के उपयोग पर आधारित है। दवा में Fe3+ आयनों के प्रति उच्च विशिष्ट गतिविधि है। वहीं, 500 मिलीग्राम डेस्फेरल शरीर से 42.5 मिलीग्राम आयरन निकाल सकता है। कोर्स की अवधि 20-40 दिन है। साथ ही सिरोसिस, मधुमेह और हृदय विफलता का इलाज किया जाता है। पीएचसी के रोगियों में यकृत ऊतक में अतिरिक्त आयरन की उपस्थिति में अक्सर देखा जाने वाला एनीमिया सिंड्रोम, अपवाही चिकित्सा के उपयोग को सीमित करता है। हमारे क्लिनिक ने सीए की पृष्ठभूमि के खिलाफ पुनः संयोजक एरिथ्रोपोइटिन के उपयोग के लिए एक आहार विकसित किया है। दवा शरीर के डिपो से आयरन के उपयोग में वृद्धि को बढ़ावा देती है, जिसके परिणामस्वरूप सूक्ष्म तत्व के कुल भंडार में कमी आती है और हीमोग्लोबिन के स्तर में वृद्धि होती है। 10-15 सप्ताह के लिए सप्ताह में 2 बार किए जाने वाले सीए सत्रों के दौरान रिओम्बिनेंट एरिथ्रोपोइटिन को 25 एमसीजी/किलोग्राम शरीर के वजन की खुराक पर प्रशासित किया जाता है।
पूर्वानुमान:
पूर्वानुमान ओवरलोड की डिग्री और अवधि से निर्धारित होता है।
बीमारी का कोर्स लंबा है, खासकर वृद्ध लोगों में। समय पर उपचार जीवन को कई दशकों तक बढ़ा देता है। उपचारित रोगियों में 5 वर्षों तक जीवित रहने की दर अनुपचारित रोगियों की तुलना में 2.5-3 गुना अधिक है। लीवर सिरोसिस की उपस्थिति में एचसीसी वाले रोगियों में एचसीसी विकसित होने का जोखिम 200 गुना बढ़ जाता है। अधिकतर मृत्यु लीवर की खराबी के कारण होती है।
यदि आपको हेमोक्रोमैटोसिस है तो आपको किन डॉक्टरों से संपर्क करना चाहिए:
- जठरांत्र चिकित्सक
- पोषण विशेषज्ञ
क्या आपको कुछ परेशान कर रहा हैं? क्या आप हेमोक्रोमैटोसिस, इसके कारणों, लक्षणों, उपचार और रोकथाम के तरीकों, रोग के पाठ्यक्रम और इसके बाद आहार के बारे में अधिक विस्तृत जानकारी जानना चाहते हैं? या क्या आपको निरीक्षण की आवश्यकता है? तुम कर सकते हो डॉक्टर से अपॉइंटमेंट लें– क्लिनिक यूरोप्रयोगशालासदैव आपकी सेवा में! सर्वश्रेष्ठ डॉक्टर आपकी जांच करेंगे, बाहरी संकेतों का अध्ययन करेंगे और लक्षणों के आधार पर बीमारी की पहचान करने में आपकी मदद करेंगे, आपको सलाह देंगे और आवश्यक सहायता प्रदान करेंगे और निदान करेंगे। आप भी कर सकते हैं घर पर डॉक्टर को बुलाओ. क्लिनिक यूरोप्रयोगशालाआपके लिए चौबीसों घंटे खुला रहेगा।
क्लिनिक से कैसे संपर्क करें:
कीव में हमारे क्लिनिक का फ़ोन नंबर: (+38 044) 206-20-00 (मल्टी-चैनल)। क्लिनिक सचिव आपके लिए डॉक्टर से मिलने के लिए एक सुविधाजनक दिन और समय का चयन करेगा। हमारे निर्देशांक और दिशाएं इंगित की गई हैं। इस पर क्लिनिक की सभी सेवाओं के बारे में अधिक विस्तार से देखें।
(+38 044) 206-20-00
यदि आपने पहले कोई शोध किया है, परामर्श के लिए उनके परिणामों को डॉक्टर के पास ले जाना सुनिश्चित करें।यदि अध्ययन नहीं किया गया है, तो हम अपने क्लिनिक में या अन्य क्लिनिकों में अपने सहयोगियों के साथ सभी आवश्यक कार्य करेंगे।
आप? अपने समग्र स्वास्थ्य के प्रति बहुत सावधान रहना आवश्यक है। लोग पर्याप्त ध्यान नहीं देते रोगों के लक्षणऔर यह नहीं जानते कि ये बीमारियाँ जीवन के लिए खतरा हो सकती हैं। ऐसी कई बीमारियाँ हैं जो पहले तो हमारे शरीर में प्रकट नहीं होती हैं, लेकिन अंत में पता चलता है कि, दुर्भाग्य से, उनका इलाज करने में बहुत देर हो चुकी है। प्रत्येक बीमारी के अपने विशिष्ट लक्षण, विशिष्ट बाहरी अभिव्यक्तियाँ होती हैं - तथाकथित रोग के लक्षण. सामान्य तौर पर बीमारियों के निदान में लक्षणों की पहचान करना पहला कदम है। ऐसा करने के लिए, आपको बस इसे साल में कई बार करना होगा। डॉक्टर से जांच कराई जाए, न केवल एक भयानक बीमारी को रोकने के लिए, बल्कि शरीर और पूरे जीव में एक स्वस्थ भावना बनाए रखने के लिए भी।
यदि आप डॉक्टर से कोई प्रश्न पूछना चाहते हैं, तो ऑनलाइन परामर्श अनुभाग का उपयोग करें, शायद आपको वहां अपने प्रश्नों के उत्तर मिलेंगे और पढ़ेंगे स्वयं की देखभाल युक्तियाँ. यदि आप क्लीनिकों और डॉक्टरों के बारे में समीक्षाओं में रुचि रखते हैं, तो अनुभाग में अपनी आवश्यक जानकारी प्राप्त करने का प्रयास करें। मेडिकल पोर्टल पर भी पंजीकरण कराएं यूरोप्रयोगशालासाइट पर नवीनतम समाचारों और सूचना अपडेट से अवगत रहने के लिए, जो स्वचालित रूप से आपको ईमेल द्वारा भेजा जाएगा।
जठरांत्र संबंधी मार्ग के रोगों के समूह से अन्य रोग:
| दांतों का पीसना (घर्षण करना)। |
| पेट का आघात |
| पेट का सर्जिकल संक्रमण |
| मौखिक फोड़ा |
| एडेंटिया |
| शराबी जिगर की बीमारी |
| यकृत का अल्कोहलिक सिरोसिस |
| एल्वोलिटिस |
| एनजाइना झेनसुला - लुडविग |
| संज्ञाहरण और गहन देखभाल |
| दांतों का एंकिलोसिस |
| दाँतों की विसंगतियाँ |
| दांतों की स्थिति में विसंगतियाँ |
| अन्नप्रणाली के विकास में विसंगतियाँ |
| दाँत के आकार और आकार में विसंगतियाँ |
| अविवरता |
| ऑटोइम्यून हेपेटाइटिस |
| अचलासिया कार्डिया |
| ग्रासनली अचलासिया |
| पेट के बेजोर |
| रोग और बड-चियारी सिंड्रोम |
| यकृत का शिरापरक रोड़ा रोग |
| क्रोनिक हेमोडायलिसिस पर क्रोनिक रीनल फेल्योर वाले रोगियों में वायरल हेपेटाइटिस |
| वायरल हेपेटाइटिस जी |
| वायरल हेपेटाइटिस टीटीवी |
| इंट्राओरल सबम्यूकोसल फाइब्रोसिस (ओरल सबम्यूकोसल फाइब्रोसिस) |
| बालों वाली ल्यूकोप्लाकिया |
| गैस्ट्रोडोडोडेनल रक्तस्राव |
| भौगोलिक भाषा |
| हेपाटोलेंटिकुलर डिजनरेशन (वेस्टफाल-विल्सन-कोनोवालोव रोग) |
| हेपेटोलिएनल सिंड्रोम (हेपेटो-स्प्लेनिक सिंड्रोम) |
| हेपेटोरेनल सिंड्रोम (कार्यात्मक गुर्दे की विफलता) |
| हेपैटोसेलुलर कार्सिनोमा (एचसीसी) |
| मसूड़े की सूजन |
| हाइपरस्प्लेनिज्म |
| मसूड़े की अतिवृद्धि (मसूड़े की फाइब्रोमैटोसिस) |
| हाइपरसीमेंटोसिस (ओसिफाइंग पेरियोडोंटाइटिस) |
| ग्रसनी-ग्रासनली डायवर्टिकुला |
| हाइटल हर्निया (HH) |
| एक्वायर्ड एसोफेजियल डायवर्टीकुलम |
| गैस्ट्रिक डायवर्टिकुला |
| अन्नप्रणाली के निचले तीसरे भाग का डायवर्टिकुला |
| एसोफेजियल डायवर्टिकुला |
| एसोफेजियल डायवर्टिकुला |
| अन्नप्रणाली के मध्य तीसरे भाग का डायवर्टिकुला |
| एसोफेजियल डिस्केनेसिया |
| पित्त पथ का डिस्केनेसिया (शिथिलता)। |
| लिवर डिस्ट्रोफी |
| ओड्डी डिसफंक्शन का स्फिंक्टर (पोस्टकोलेसिस्टेक्टोमी सिंड्रोम) |
| सौम्य नॉनपिथेलियल ट्यूमर |
| पित्ताशय की सौम्य रसौली |
| सौम्य यकृत ट्यूमर |
| अन्नप्रणाली के सौम्य ट्यूमर |
| सौम्य उपकला ट्यूमर |
| पित्ताश्मरता |
| यकृत का फैटी हेपेटोसिस (स्टीटोसिस)। |
| पित्ताशय की घातक सूजन |
| पित्त नलिकाओं के घातक ट्यूमर |
| पेट के विदेशी शरीर |
| कैंडिडल स्टामाटाइटिस (थ्रश) |
| क्षय |
| कार्सिनॉयड |
| अन्नप्रणाली में सिस्ट और असामान्य ऊतक |
| धब्बेदार दाँत |
| ऊपरी जठरांत्र रक्तस्राव |
| ज़ैंथोग्रानुलोमेटस कोलेसिस्टिटिस |
| मौखिक श्लेष्मा का ल्यूकोप्लाकिया |
| नशीली दवाओं के कारण जिगर की क्षति |
| औषधीय अल्सर |
| पुटीय तंतुशोथ |
| लार ग्रंथि म्यूकोसेले |
| malocclusion |
| दांतों का बिगड़ा हुआ विकास और फूटना |
| दाँत निर्माण संबंधी विकार |
| वंशानुगत कोप्रोपोर्फिरिया |
| इनेमल और डेंटिन की संरचना का वंशानुगत विकार (स्टैंटन-कैपडिपोंट सिंड्रोम) |
| गैर-अल्कोहलिक स्टीटोहेपेटाइटिस |
| यकृत परिगलन |
| पल्प नेक्रोसिस |
| गैस्ट्रोएंटरोलॉजी में आपातकालीन स्थितियाँ |
| ग्रासनली में रुकावट |
| दांतों की अस्थिजनन अपूर्णता |
| आपातकालीन सर्जरी में मरीजों की जांच |
| हेपेटाइटिस बी वायरस वाहकों में तीव्र डेल्टा सुपरइन्फेक्शन |
| तीव्र आंत्र रुकावट |
| तीव्र आंतरायिक (आंतरायिक) पोरफाइरिया |
| मेसेन्टेरिक परिसंचरण की तीव्र गड़बड़ी |
| एक सर्जन के अभ्यास में तीव्र स्त्रीरोग संबंधी रोग |
| पाचन तंत्र से तीव्र रक्तस्राव |
| तीव्र ग्रासनलीशोथ |
| तीव्र अल्कोहलिक हेपेटाइटिस |
| तीव्र आन्त्रपुच्छ - कोप |
| तीव्र एपिकल पेरियोडोंटाइटिस |
| तीव्र अकालकुलस कोलेसिस्टिटिस |
| तीव्र वायरल हेपेटाइटिस ए (एवीएचए) |
| तीव्र वायरल हेपेटाइटिस बी (एवीएचबी) |
| डेल्टा एजेंट के साथ तीव्र वायरल हेपेटाइटिस बी |
| तीव्र वायरल हेपेटाइटिस ई (एवीएचई) |
प्राथमिक हेमोक्रोमैटोसिस एक ऐसी बीमारी है जिसे वंशानुगत माना जाता है, अर्थात, जो क्रोमोसोमल या जीन प्रकार के उत्परिवर्तन के कारण होता है। ऐसी बीमारी दूसरों से भिन्न होती है, भले ही केवल इसमें, इसकी घटना और विकास की स्थिति में, चिकित्सकों के पास सटीक कारण स्थापित करने का अवसर होता है जिसने इसे उकसाया, क्योंकि यह वंशानुगत तंत्र को नुकसान से जुड़ा हुआ है।
प्राथमिक हेमोक्रोमैटोसिस - जैसा कि ऊपर उल्लेख किया गया है, एक आनुवंशिक रूप से निर्धारित बीमारी, जिसके विकास के परिणामस्वरूप चयापचय के तंत्र में गड़बड़ी होती है, अर्थात् लौह। अतिरिक्त लौह द्रव्यमान ऊतकों और अंगों में जमा हो जाता है। भोजन के साथ शरीर में प्रवेश करने वाला आयरन, जठरांत्र संबंधी मार्ग में इसके अवशोषण की प्रक्रिया के अत्यधिक सक्रियण के परिणामस्वरूप, ऊतकों और अंगों में जमा होना शुरू हो जाता है: अग्न्याशय, यकृत, प्लीहा, मायोकार्डियम, त्वचा, ग्रंथियां अंत: स्रावी प्रणाली, हृदय, पिट्यूटरी ग्रंथि, जोड़ और अन्य।
प्राथमिक हेमोक्रोमैटोसिस को इसका नाम उन्नीसवीं सदी के अंत में मिला, इसके सबसे स्पष्ट लक्षणों में से एक - त्वचा और अंगों के रंजकता के प्रतिबिंब के रूप में। इसके नाम के पर्यायवाची शब्द भी रोग के इसी लक्षण पर आधारित हैं - कांस्य मधुमेह, पिगमेंटरी सिरोसिस। दिलचस्प बात यह है कि, प्राथमिक हेमोक्रोमैटोसिस को सबसे पहले चिकित्सकों द्वारा लक्षणों के एक समूह के रूप में वर्णित किया गया था, विशेषणिक विशेषताएंजो मधुमेह मेलेटस, यकृत का सिरोसिस, त्वचा और श्लेष्मा झिल्ली का रंजकता, ऊतकों और अंगों में लौह तत्व के संचय से उत्पन्न होते हैं।
आजकल, निदान विधियों में सुधार के कारण, हेमोक्रोमैटोसिस की घटनाओं में वृद्धि देखी गई है। जनसंख्या आनुवंशिक अनुसंधान के आगमन के साथ, प्रतिष्ठा गायब हो गई प्राथमिक हेमोक्रोमैटोसिसएक दुर्लभ बीमारी के रूप में. ऐसे अध्ययनों से पता चलता है कि प्राथमिक हेमोक्रोमैटोसिस विकसित होने की संभावना लगभग 0.33 प्रतिशत है। विश्व स्वास्थ्य संगठन की रिपोर्ट है कि दस प्रतिशत आबादी में प्राथमिक हेमोक्रोमैटोसिस विकसित होने की संभावना है। यह भी देखा गया है कि पुरुष महिलाओं की तुलना में प्राथमिक हेमोक्रोमैटोसिस से लगभग दस गुना अधिक प्रभावित होते हैं।
कारण
अक्सर, प्राथमिक हेमोक्रोमैटोसिस की घटना और विकास एचएफई जीन के उत्परिवर्तन से शुरू होता है। प्राथमिक प्रकार के हेमोक्रोमैटोसिस, जो एचएफई जीन उत्परिवर्तन से संबंधित नहीं है, को एक दुर्लभ घटना माना जाता है और यह फेरोपोर्टेशन रोग, किशोर हेमोक्रोमैटोसिस और दुर्लभ नवजात प्रकार, हाइपोट्रांसफेरिनमिया और यूसेरोलोप्लास्मिनमिया की उपस्थिति से जुड़ा हुआ है। शोध के आँकड़ों के अनुसार, एचएफई जीन के कारण होने वाले हेमोक्रोमैटोसिस के अस्सी प्रतिशत मामले समयुग्मजी उत्परिवर्तन C282Y और विषमयुग्मजी उत्परिवर्तन हैं। संयुक्त प्रकार- C282Y/H63D. प्राथमिक हेमोक्रोमैटोसिस एक ऑटोसोमल रिसेसिव बीमारी है, जिसका अर्थ है कि माता और पिता दोनों दोषपूर्ण जीन के वाहक हैं।
प्राथमिक हेमोक्रोमैटोसिस का पैथोफिज़ियोलॉजी
एक स्वस्थ व्यक्ति के शरीर में लगभग चार ग्राम आयरन होता है। आयरन की यह मात्रा हीमोग्लोबिन, कैटालेज़, मायोग्लोबिन और अन्य एंजाइमों और पिगमेंट में निहित होती है श्वसन प्रणाली. जब अत्यधिक लौह सामग्री बीस ग्राम तक पहुंच जाती है तो रोग प्रक्रिया की घटना पर चर्चा की जानी चाहिए। समय के साथ, प्राथमिक हेमोक्रोमैटोसिस में अतिरिक्त आयरन का द्रव्यमान साठ ग्राम तक पहुंच सकता है।
प्राथमिक हेमोक्रोमैटोसिस के लक्षण
हेमोक्रोमैटोसिस के लक्षण तब स्पष्ट हो जाते हैं जब ऊतकों और अंगों में लोहे की सांद्रता बीस से चालीस ग्राम की कुल मात्रा तक पहुंच जाती है, अर्थात, पहले से ही वयस्कता में: पुरुषों के लिए चालीस से साठ साल की उम्र में, और महिलाओं के लिए भी बाद में। पैथोलॉजी का विकास चरणों में होता है:
- प्रथम चरण। इस स्तर पर, आनुवंशिक प्रवृत्ति के कारण रोगी के शरीर में अभी भी आयरन की मात्रा अधिक होती है।
- दूसरे चरण। दूसरे चरण में, आयरन से भरपूर शरीर अभी भी नैदानिक लक्षण नहीं दिखाता है।
- तीसरा चरण. इस अंतिम चरण में, रोगी में नैदानिक अभिव्यक्तियाँ विकसित होती हैं।
हेमोक्रोमैटोसिस का क्रमिक विकास होता है। में प्राथमिक अवस्थाविकास, रोगियों को वर्षों तक उल्लेखनीय थकान और कमजोरी का अनुभव हो सकता है, वजन घटाने का अनुभव हो सकता है, और पुरुषों में, यौन रोग हो सकता है। इसके अलावा रोग के इस चरण में, जोड़ों और दाहिने हाइपोकॉन्ड्रिअम में असहनीय दर्द हो सकता है, त्वचा में एट्रोफिक परिवर्तन और सूखापन होता है, और पुरुषों में, अंडकोष में। विकसित हेमोक्रोमैटोसिस में डॉक्टरों के लिए क्लासिक लक्षण होते हैं, जिसमें तीन घटक होते हैं - श्लेष्म झिल्ली और त्वचा का रंजकता, मधुमेह और यकृत का सिरोसिस।
रंजकता. रक्तस्राव के निदान के मामलों में, चिकित्सा आंकड़ों के अनुसार, रंजकता पहला और सबसे आम लक्षण है। रंजकता की गंभीरता इस बात पर निर्भर करती है कि रोग कितने समय से विकसित हो रहा है। उन जगहों पर जहां पहले से ही रंजकता का अनुभव हो चुका है - हाथ, चेहरा और गर्दन, त्वचा अधिक स्पष्ट धुएँ के रंग का-कांस्य रंग प्राप्त कर लेती है, और हेमोक्रोमैटोसिस में रंजकता जननांगों और बगल को प्रभावित करती है।
ज्यादातर मामलों में, डॉक्टर लीवर में अतिरिक्त आयरन के जमाव का निदान करते हैं। साथ ही, इसके आकार में वृद्धि होती है, ऊतक संघनन होता है और सतह चिकनी हो जाती है। पैल्पेशन पर दर्द संभव है।
अक्सर, हेमोक्रोमैटोसिस का विकास अंतःस्रावी तंत्र की विकृति (अधिवृक्क ग्रंथियों, पिट्यूटरी ग्रंथि, थायरॉयड ग्रंथि, पीनियल ग्रंथि और गोनाड के हाइपरफंक्शन) के साथ होता है।
रोग का उपचार
हेमोक्रोमैटोसिस के उपचार का आधार रोगी के शरीर से अतिरिक्त आयरन को निकालना है। इसके बाद, डॉक्टर बीमारी से प्रभावित अंगों की सामान्य कार्यप्रणाली को संभवतः बहाल करने या बनाए रखने के लिए हर संभव प्रयास करते हैं।

आयरन की अतिरिक्त मात्रा को हटाने के लिए डॉक्टर रक्तपात का सहारा लेते हैं, जो इस उद्देश्य के लिए सबसे सरल माना जाता है। इस प्रक्रिया को फ़्लेबोटॉमी और वेनसेक्शन भी कहा जाता है। इसमें अस्थायी रूप से नस की सतह को काटकर दो सौ से पांच सौ मिलीलीटर रक्त छोड़ा जाता है। जब तक रोगी के रक्त में आयरन का स्तर सामान्य नहीं हो जाता, तब तक कई वर्षों (दो से तीन वर्ष) तक सप्ताह में एक या दो बार रक्तपात किया जाता है। रक्तपात प्रक्रिया के लिए धन्यवाद, शरीर से अतिरिक्त आयरन निकाल दिया जाता है, त्वचा की रंजकता की डिग्री और यकृत का आकार कम हो जाता है, और रोगी की सामान्य भलाई में सुधार होता है।
वैकल्पिक या अतिरिक्त साधनआयरन-बाइंडिंग दवाएं रक्तपात का कारण बन सकती हैं - यह एक समूह है औषधीय औषधियाँ, जो रासायनिक रूप से लोहे से बंधता है और इसे शरीर से निकाल देता है।
हेपेटिक हेमोक्रोमैटोसिस के उपचार में आहार दूसरा सबसे महत्वपूर्ण घटक है। रोगी को आयरन और प्रोटीन (मांस, सेब, एक प्रकार का अनाज, अनार) वाले भोजन की मात्रा कम करने की आवश्यकता होती है, साथ ही शरीर में प्रवेश करने वाले एस्कॉर्बिक एसिड की मात्रा को भी कम करना चाहिए, क्योंकि यह शरीर में आयरन के अवशोषण की डिग्री को बढ़ाता है, और पूरी तरह से शराब पीना बंद करें, जो लीवर की कार्यप्रणाली को ख़राब करती है।
हेमोक्रोमैटोसिस की रोकथाम
हेमोक्रोमैटोसिस का निदान करते समय, आगे की जटिलताओं को रोकने के लिए, रोगी को ऐसे आहार का पालन करना चाहिए जो आयरन, एस्कॉर्बिक एसिड, विटामिन सी, साथ ही बहुत अधिक प्रोटीन वाले खाद्य पदार्थों की खपत को सीमित करता है। हेमोक्रोमैटोसिस की रोकथाम में आयरन-बाइंडिंग दवाएं लेना भी शामिल है, लेकिन केवल डॉक्टर की सख्त निगरानी में। हेमोक्रोमैटोसिस को रोकने के लिए, आपका डॉक्टर खुराक में आयरन सप्लीमेंट लेने की सलाह दे सकता है।
यदि आपके पास अभी भी प्राथमिक हेमोक्रोमैटोसिस के बारे में प्रश्न हैं, तो उन्हें अभी इस साइट पर पूछें!