-
फाइल का प्रारूप:
फाइल का आकार:
काम के प्रकार:
चिकित्सा, शारीरिक शिक्षा, स्वास्थ्य देखभाल
एंजाइम इम्युनोसे के सिद्धांत, मुख्य प्रकार के एलिसा, निदान में आवेदन
आप एक छात्र पत्र लिखने में मदद करने की लागत का पता लगा सकते हैं।
एक पेपर लिखने में मदद करें जो निश्चित रूप से स्वीकार किया जाएगा!
राज्य शैक्षिक संस्थाउच्च व्यावसायिक शिक्षा
रूसी राज्य चिकित्सा विश्वविद्यालय
स्वास्थ्य और सामाजिक विकास के लिए संघीय एजेंसी
सार
"एंजाइम इम्युनोसे के सिद्धांत, एलिसा के मुख्य प्रकार, निदान में आवेदन"
समोइलिकोव पावेल व्लादिमीरोविच
क्लिनिकल विभाग में इंटर्न प्रयोगशाला निदान»
एंजाइम इम्युनोसे के सिद्धांत, मुख्य प्रकार के एलिसा, निदान में आवेदन।
परिचय।
चिकित्सा पद्धति में इम्यूनोसे के तरीकों का व्यापक रूप से उपयोग किया जाता है। आधुनिक चिकित्सा के सभी क्षेत्रों में, प्रतिरक्षा परख, मुख्य रूप से नैदानिक और विश्लेषणात्मक उद्देश्यों के लिए। यह विशेष रूप से महत्वपूर्ण है कि वे जैविक घटकों (हार्मोन, एंजाइम, न्यूरोपैप्टाइड्स, उत्पादों) की पहचान करना संभव बनाते हैं प्रतिरक्षा तंत्र, एंटीजन, आदि) कम और बहुत कम सांद्रता में। इन विधियों द्वारा सभी उत्पादों का पता लगाया जाता है जिनके खिलाफ एंटीबॉडी प्राप्त करना संभव है।
इम्युनोसे एक एंटीजन (एजी) और एक एंटीबॉडी (एटी) का उपयोग करके बातचीत पर आधारित है विभिन्न विकल्पघटकों में से एक (एंजाइम, रेडियोन्यूक्लाइड, फ्लोरोसेंट डाई, और अन्य) की लेबलिंग। प्रतिक्रिया का मूल्यांकन विशेष उपकरणों पर स्वचालित रूप से किया जाता है, जिससे इन विधियों को मानकीकृत करना संभव हो जाता है।
उपयोग किए गए लेबल के प्रकार और परीक्षण की स्थापना के लिए शर्तों के आधार पर, इम्यूनोसे को एंजाइम इम्यूनोसे (एलिसा), रेडियोइम्यूनोसे (आरआईए), इम्यूनोफ्लोरेसेंट और अन्य के रूप में जाना जाता है। जब प्रतिक्रियाओं का मंचन एक या अधिक चरणों में किया जाता है, तो उन्हें प्रत्यक्ष या अप्रत्यक्ष रूप से नामित किया जाता है। जिस माध्यम में प्रतिक्रिया की जाती है वह मायने रखता है। यदि प्रतिक्रिया सतह पर तय किए गए अभिकर्मकों के साथ की जाती है, तो परीक्षण को ठोस चरण परीक्षण के रूप में नामित किया जाता है, उदाहरण के लिए, एलिसा (एंजाइम लिंक्ड इम्यूनोसॉर्बेंट परख)।
इस पत्र में, केवल एंजाइम इम्युनोसे पर विचार किया जाएगा - जीव विज्ञान और चिकित्सा में व्यापक रूप से उपयोग की जाने वाली एक विधि, व्यावहारिक और मौलिक दोनों।
लिंक्ड इम्युनोसॉरबेंट परख।
एलिसा 60 के दशक के मध्य में प्रकट हुआ और मूल रूप से एक हिस्टोलॉजिकल तैयारी में एक एंटीजन की पहचान करने के लिए एक विधि के रूप में विकसित किया गया था, साथ ही एक इम्यूनोडिफ्यूजन परीक्षण और इम्यूनोइलेक्ट्रोफोरेसिस में वर्षा लाइनों की कल्पना करने के लिए, और फिर एंटीजन के मात्रात्मक निर्धारण के लिए उपयोग किया जाने लगा और जैविक तरल पदार्थों में एंटीबॉडी। E. Engvall और R. Pelman ने विधि के विकास में भाग लिया, साथ ही, उनमें से स्वतंत्र रूप से, W. Van Veeman और R. Schurs ने भाग लिया।
चित्रा 1. एलिसा का मूल सिद्धांत।
1) एंटीजन का पता लगाने के लिए। 2) एंटीबॉडी का पता लगाने के लिए।
विधि प्रतिजन के प्रति एंटीबॉडी के विशिष्ट बंधन पर आधारित है, जबकि घटकों में से एक एंजाइम के साथ संयुग्मित होता है; संबंधित क्रोमोजेनिक सब्सट्रेट के साथ प्रतिक्रिया के परिणामस्वरूप, एक रंगीन उत्पाद बनता है, जिसकी मात्रा हो सकती है स्पेक्ट्रोफोटोमेट्रिक रूप से निर्धारित (चित्र। 1)।
अपनी बाध्यकारी गतिविधि को बनाए रखते हुए विभिन्न वाहकों पर एंटीजन और एंटीबॉडी स्थिरीकरण की संभावना की खोज ने जीव विज्ञान और चिकित्सा के विभिन्न क्षेत्रों में एलिसा के उपयोग का विस्तार करना संभव बना दिया है।
मोनोक्लोनल एंटीबॉडी की उपस्थिति ने एलिसा के एक और विकास के रूप में कार्य किया, जिससे इसकी संवेदनशीलता, विशिष्टता और परिणामों की पुनरुत्पादकता को बढ़ाना संभव हो गया।
सैद्धांतिक रूप से, एलिसा आधुनिक इम्यूनोकेमिस्ट्री और रासायनिक एंजाइमोलॉजी के डेटा पर आधारित है, एंटीजन-एंटीबॉडी प्रतिक्रिया के भौतिक-रासायनिक कानूनों के ज्ञान के साथ-साथ विश्लेषणात्मक रसायन विज्ञान के मुख्य सिद्धांतों पर आधारित है। एलिसा की संवेदनशीलता और इसकी अवधि कई मुख्य कारकों द्वारा निर्धारित की जाती है: एंटीजन-एंटीबॉडी प्रतिक्रिया की गतिज और थर्मोडायनामिक विशेषताएं, अभिकर्मकों का अनुपात, एंजाइम गतिविधि और इसके पता लगाने के तरीकों का संकल्प। सामान्य तौर पर, प्रतिजन-एंटीबॉडी प्रतिक्रिया को एक सरल योजना द्वारा वर्णित किया जा सकता है:
+[एजी]↔[एटीएजी]
कम आणविक भार यौगिकों से लेकर वायरस और बैक्टीरिया तक अध्ययन की वस्तुओं की विविधता, साथ ही एलिसा के उपयोग के लिए विभिन्न स्थितियों से जुड़े कार्यों की एक असामान्य रूप से विस्तृत श्रृंखला, इस पद्धति के बहुत बड़ी संख्या में वेरिएंट के विकास को निर्धारित करती है। .
किसी भी एलिसा संस्करण में 3 अनिवार्य चरण होते हैं:
1. इसके लिए विशिष्ट एंटीबॉडी द्वारा परीक्षण यौगिक की मान्यता का चरण, जो एक प्रतिरक्षा परिसर के गठन की ओर जाता है;
2. प्रतिरक्षा परिसर या मुक्त बाध्यकारी साइटों के साथ संयुग्म के कनेक्शन के गठन का चरण;
3. एंजाइम लेबल को पंजीकृत सिग्नल में बदलने का चरण।
एलिसा वर्गीकरण।
एलिसा विधियों का वर्गीकरण कई दृष्टिकोणों पर आधारित है:
1. एलिसा के पहले चरण में मौजूद अभिकर्मकों के प्रकार के अनुसार, प्रतिस्पर्धी और गैर-प्रतिस्पर्धी तरीके प्रतिष्ठित हैं।
ए) प्रतिस्पर्धी एलिसा में, पहले चरण में, सिस्टम में विश्लेषण किए गए यौगिक और इसके एनालॉग दोनों होते हैं, जो एंजाइम के साथ लेबल होते हैं और इसके साथ विशिष्ट बाध्यकारी साइटों के लिए प्रतिस्पर्धा करते हैं।
बी) गैर-प्रतिस्पर्धी तरीकों के लिए, केवल विश्लेषण किए गए यौगिक और इसके लिए विशिष्ट बाध्यकारी केंद्रों के पहले चरण में सिस्टम में उपस्थिति विशेषता है।
2. सभी एलिसा विधियों को सजातीय और विषमांगी में विभाजित किया गया है।
यदि एलिसा के सभी तीन चरणों को समाधान में किया जाता है और मुख्य चरणों के बीच अप्रतिबंधित घटकों से गठित प्रतिरक्षा परिसरों को अलग करने के कोई अतिरिक्त चरण नहीं होते हैं, तो विधि सजातीय लोगों के समूह से संबंधित होती है।
सजातीय एलिसा का आधार, जो आमतौर पर कम आणविक भार वाले पदार्थों को निर्धारित करने के लिए उपयोग किया जाता है, एंजाइम गतिविधि का निषेध है जब इसे एंटीजन या एंटीबॉडी के साथ जोड़ा जाता है। एंटीजन-एंटीबॉडी प्रतिक्रिया के परिणामस्वरूप एंजाइम गतिविधि बहाल हो जाती है।
जब एक एंटीबॉडी एक एंजाइम लेबल वाले एंटीजन से बांधता है, तो उच्च आणविक भार सब्सट्रेट के संबंध में एंजाइम गतिविधि 95% तक बाधित होती है, जो एंजाइम के सक्रिय केंद्र से सब्सट्रेट के स्टेरिक बहिष्करण के कारण होती है। जैसे-जैसे एंटीजन की सांद्रता बढ़ती है, अधिक एंटीबॉडी बंधते हैं और अधिक मुक्त एंटीजन-एंजाइम संयुग्म बनाए जाते हैं जो उच्च आणविक भार सब्सट्रेट को हाइड्रोलाइज कर सकते हैं। विश्लेषण बहुत जल्दी किया जाता है, एक निर्धारण के लिए 1 मिनट की आवश्यकता होती है। विधि की संवेदनशीलता काफी अधिक है। इससे आप पिकोमोल के स्तर पर पदार्थ का निर्धारण कर सकते हैं।
विषम तरीकों के लिए, एक ठोस चरण की भागीदारी के साथ दो-चरण प्रणाली में विश्लेषण करना विशिष्ट है - एक वाहक, और अप्रतिबंधित घटकों (धुलाई) से प्रतिरक्षा परिसरों को अलग करने का एक अनिवार्य चरण जो विभिन्न चरणों (गठन) में हैं प्रतिरक्षा परिसरों ठोस चरण पर हैं, और अप्रतिबंधित परिसरों समाधान में हैं)। विषम विधियाँ, जिनमें पहले चरण में प्रतिरक्षा परिसरों का निर्माण ठोस चरण पर होता है, ठोस-चरण विधियाँ कहलाती हैं।
विधियों को सजातीय-विषम के रूप में वर्गीकृत किया जाता है, यदि पहला चरण - विशिष्ट परिसरों का गठन समाधान में होता है, और फिर घटकों को अलग करने के लिए एक स्थिर अभिकर्मक के साथ एक ठोस चरण का उपयोग किया जाता है।
3. परीक्षण पदार्थ के निर्धारण के सिद्धांत के अनुसार:
ए) किसी पदार्थ (एंटीजन या एंटीबॉडी) की एकाग्रता का प्रत्यक्ष निर्धारण इसके साथ बातचीत करने वाले बाध्यकारी केंद्रों की संख्या से होता है। इस मामले में, एंजाइम लेबल परिणामी विशिष्ट एजी-एटी कॉम्प्लेक्स में होगा। विश्लेषण की एकाग्रता पंजीकृत संकेत के सीधे आनुपातिक होगी।
बी) बाध्यकारी साइटों की कुल संख्या और शेष मुक्त बाध्यकारी साइटों के बीच अंतर से किसी पदार्थ की एकाग्रता का निर्धारण। इस मामले में, विश्लेषण की एकाग्रता में वृद्धि होगी, और रिकॉर्ड किए गए सिग्नल में कमी आएगी, इसलिए, इस मामले में, रिकॉर्ड किए गए सिग्नल के परिमाण पर एक व्युत्क्रम निर्भरता है।
एलिसा में प्रयुक्त घटकों के लक्षण।
एंजाइम।
एंजाइम लेबल का एक अत्यंत शक्तिशाली उत्प्रेरक प्रभाव होता है; एक एंजाइम अणु बड़ी संख्या में सब्सट्रेट अणुओं के साथ प्रतिक्रिया कर सकता है। इस प्रकार, नगण्य मात्रा में मौजूद एक एंजाइम का पता लगाया जा सकता है और उत्पादों के निर्माण से इसकी मात्रा निर्धारित की जा सकती है, यह प्रतिक्रिया उत्प्रेरित करती है। एंजाइमों को लेबल के रूप में उपयोग करने का एक अन्य लाभ कई कार्यात्मक समूहों (सल्फ़हाइड्रील, कार्बोक्सिल, टाइराज़िन अवशेष, आदि) के अणु में उपस्थिति के कारण होता है, जिसके माध्यम से लिगैंड अणुओं को सहसंयोजक रूप से जोड़ा जा सकता है।
एलिसा में प्रयुक्त एंजाइमेटिक मार्करों में निम्नलिखित गुण होने चाहिए:
- विश्लेषण की शर्तों के तहत एंजाइम की उच्च गतिविधि और स्थिरता, संशोधन के दौरान और एंटीबॉडी या अन्य प्रोटीन के साथ संयुग्म में;
- संवेदनशील सब्सट्रेट की उपस्थिति और एंजाइमी प्रतिक्रिया के उत्पादों या सबस्ट्रेट्स को निर्धारित करने की विधि की सादगी;
- सब्सट्रेट सिस्टम को और मजबूत करने के लिए अनुकूलन की संभावना;
- अध्ययन किए गए जैविक द्रव में एंजाइम और उसके अवरोधकों की अनुपस्थिति।
एलिसा कम से कम 15 विभिन्न एंजाइमों का उपयोग कर सकती है। उपरोक्त आवश्यकताओं के अनुसार सबसे बड़ा अनुप्रयोग, हॉर्सरैडिश पेरोक्सीडेज (HRP), क्षारीय फॉस्फेट (AP) और β-D-galactosidase (तालिका 1) पाया गया। तीनों स्थिर हैं और अत्यधिक संवेदनशील प्रतिक्रियाओं को उत्प्रेरित करते हैं। इसके अलावा, इन एंजाइमों द्वारा उत्प्रेरित प्रतिक्रियाओं से उत्पन्न उत्पादों, उपयोग किए गए सब्सट्रेट के आधार पर, न केवल वर्णमिति विधियों द्वारा, बल्कि फ्लोरोसेंट विधियों द्वारा भी पता लगाया जा सकता है। अन्य एंजाइमों का उपयोग बहुत कम बार किया जाता है। यह एचआरपी और एपी की तुलना में उनकी कम विशिष्ट गतिविधि द्वारा समझाया गया है।
सबस्ट्रेट्स।
सब्सट्रेट की पसंद मुख्य रूप से एक लेबल के रूप में उपयोग किए जाने वाले एंजाइम द्वारा निर्धारित की जाती है, क्योंकि एंजाइम-सब्सट्रेट प्रतिक्रिया अत्यधिक विशिष्ट है।
सब्सट्रेट के लिए बुनियादी आवश्यकताएं:
- संयुग्म में एंजाइम का पता लगाने में विधि की उच्च संवेदनशीलता सुनिश्चित करना;
- एंजाइम-सब्सट्रेट प्रतिक्रिया के अच्छी तरह से परिभाषित (उदाहरण के लिए, रंगीन) उत्पादों का निर्माण;
- सब्सट्रेट सुरक्षित, सस्ता, सुलभ और उपयोग में सुविधाजनक होना चाहिए।
तालिका एक।
|
प्राप्ति का स्रोत |
संयुग्मक अभिकर्मक |
|||
|
हॉर्सरैडिश peroxidase |
हॉर्सरैडिश (आर्मोरेसिया रस्टिकाना) |
ओ-फेनिलेनेडियम डाइहाइड्रोक्लोराइड (ओपीडी, 492 एनएम) 5-एमिनोसैलिसिलिक एसिड (450 एनएम), डायमिनोबेंज़िडाइन, ओ-डायनिसिडाइन। |
glutaraldehyde मेटा-पीरियोडेट सोडियम N-succinimidyl-3 (2-pyridyldithio) propionate |
|
|
β-D-galactosidase |
O-nitrophenyl-β-D-galactoside (420 एनएम) |
मेटा-मेलिमिडोबेंजीन-एन-हाइड्रॉक्सीसुसिनिमाइड एस्टर |
||
|
Alkaline फॉस्फेट |
ई. कोलाई, बछड़ा आंतों का म्यूकोसा |
पी-नाइट्रोफिनाइल फॉस्फेट (405 एनएम), 5-ब्रोमो-4-क्लोरो-3-इंडोलिल फॉस्फेट |
glutaraldehyde |
अधिक बार, क्रोमोजेनिक सब्सट्रेट का उपयोग किया जाता है, जो नष्ट होने पर एक रंगीन पदार्थ बनाते हैं। उच्च-ऊर्जा सबस्ट्रेट्स - फ्लोरोसेंट, केमिलुमिनसेंट का उपयोग वादा कर रहा है। ऐसे सबस्ट्रेट्स का उपयोग सैद्धांतिक रूप से एलिसा की संवेदनशीलता को परिमाण के दो आदेशों से बढ़ाना संभव बनाता है।
एंटीजन और एंटीबॉडी।
एलिसा में प्रयुक्त एजी और एटी अत्यधिक शुद्ध और अत्यधिक सक्रिय होना चाहिए। इसके अलावा, एजी में उच्च प्रतिजनता, इष्टतम घनत्व और प्रतिजनी निर्धारकों की संख्या, विदेशीता और एकरूपता होनी चाहिए। एलिसा में उपयोग किए जाने पर वायरस और बैक्टीरिया के कई सिंथेटिक और पुनः संयोजक एंटीजन ने खुद को अच्छी तरह साबित कर दिया है। इसने क्रॉस-रिएक्शन को कम करके विधि की विशिष्टता और प्रतिलिपि प्रस्तुत करने योग्यता में काफी वृद्धि की।
एलिसा में सबसे महत्वपूर्ण अभिकर्मकों में से एक एंटीबॉडी हैं। एलिसा संवेदनशीलता उपयोग किए गए एंटीबॉडी की एकाग्रता, गतिविधि और विशिष्टता पर निर्भर करती है। उपयोग किए जाने वाले एंटीबॉडी विभिन्न वर्ग (IgG या IgM) और उपवर्ग (IgGl, IgG2), एंटी-एलोटाइपिक या एंटी-इडियोटाइपिक के पॉली- या मोनोक्लिनल हो सकते हैं। कम एटी आत्मीयता पर, एजी-एटी कॉम्प्लेक्स के टूटने से सिस्टम से बाउंड एजी को हटा दिया जाता है। मोनोक्लोनल एंटीबॉडी के उपयोग से विधि की संवेदनशीलता और विशिष्टता को बढ़ाया जाता है। इस मामले में, परीक्षण नमूनों में एजी (एटी) की कम सांद्रता का पता लगाना संभव हो जाता है।
संयुग्म गठन
एक संयुग्म एक एंटीजन या एंटीबॉडी है जिसे एंजाइम लेबल के साथ लेबल किया जाता है। संयुग्म का निर्माण एलिसा के महत्वपूर्ण चरणों में से एक है।
संयुग्म बनाते समय, एंजाइम लेबल को पेश करने के लिए ऐसी इष्टतम विधि का चयन किया जाता है ताकि संयुग्म के दोनों घटक अपनी जैविक गतिविधि को बनाए रखें: एंजाइम - सब्सट्रेट के साथ बातचीत करने की क्षमता, और एंटीजन या एंटीबॉडी - एंटीजेनिटी और एंटीजन-बाइंडिंग गतिविधि, क्रमशः। लेबल किए गए, अत्यधिक शुद्ध प्रतिजन की उपस्थिति प्रतिस्पर्धी तरीकों के उपयोग की अनुमति देती है। इस मामले में, स्थिर एंटीबॉडी के लिए बाध्य नहीं संयुग्म की गतिविधि को अंतिम चरण में मापा जा सकता है, जो धोने की प्रक्रिया से बचा जाता है और विश्लेषण को और अधिक सुविधाजनक बनाता है। हालांकि, एंटीजन अपने भौतिक-रासायनिक गुणों और संरचना में विविध हैं, जिसका अर्थ है कि एंटीजन के साथ संयुग्म प्राप्त करने के लिए सार्वभौमिक तरीकों को विकसित करना असंभव है। इस मामले में, एक एंटीजन-एंजाइम संयुग्म प्राप्त करना एक अलग चुनौती है। एलिसा के लिए लेबल किए गए एंटीबॉडी की तैयारी व्यवस्थित रूप से अधिक सुलभ है।
इम्यूनोकेमिकल सक्रिय प्रोटीन के साथ एक एंजाइम का संयुग्मन विभिन्न तरीकों से किया जाता है: रासायनिक क्रॉस-लिंकिंग, एक एंजाइम अणु के एजी या एटी के लिए सहसंयोजक बंधन, और गैर-सहसंयोजक बंधनों के माध्यम से यौगिकों का निर्माण, उदाहरण के लिए, जब के बीच संबंध एंटीजन-एंटीबॉडी इंटरैक्शन के माध्यम से एंजाइम और एजी या एटी को प्रतिरक्षात्मक रूप से किया जाता है।
संयुग्मों की तैयारी के लिए सबसे व्यापक रूप से इस्तेमाल की जाने वाली सहसंयोजक विधियाँ। बाध्यकारी प्रतिक्रिया की पसंद इन प्रोटीन अणुओं में उपलब्ध कार्यात्मक समूहों के प्रकार से निर्धारित होती है। ग्लूटाराल्डिहाइड, सोडियम पीरियोडेट, आदि का उपयोग अभिकर्मकों के रूप में किया जाता है जो एंजाइम को एंटीजन और एंटीबॉडी अणुओं में पेश करने के लिए उपयोग किया जाता है।
ग्लूटाराल्डिहाइड का उपयोग करके संयुग्म प्राप्त करने के लिए एक-चरण और दो-चरणीय विधियां हैं। कम एंजाइमेटिक गतिविधि (मुक्त एंजाइम का 15 - 60%) के साथ विभिन्न आकारों के संयुग्म बन सकते हैं। परिणामी संयुग्म बड़े आकारपरीक्षण पदार्थ के निर्धारण में बाधा डाल सकता है। अपेक्षाकृत कम आणविक भार संयुग्म में एक फैब टुकड़ा और एक एंजाइम अणु होता है।
एक दो-चरण संश्लेषण के परिणामस्वरूप, जिसमें पहले एक क्रॉस-लिंकिंग एजेंट के साथ संशोधित एंजाइम की चरण-दर-चरण तैयारी होती है, इसका अलगाव, और फिर एक एंटीजन (एंटीबॉडी), अणुओं के साथ इसकी बाद की बातचीत होती है। सजातीय संरचना प्रति इम्युनोग्लोबुलिन अणु में 1-2 एंजाइम अणुओं से युक्त होती है और एक उच्च एंजाइमेटिक और प्रतिरक्षाविज्ञानी गतिविधि को बनाए रखती है। हालांकि, बनने वाले ऐसे संयुग्मों की मात्रा कम होती है (हॉर्सरडिश पेरोक्सीडेज के लिए यह 5-10% है)।
महानतम प्रायोगिक उपयोगसोडियम पीरियोडेट के साथ एंजाइम के कार्बोहाइड्रेट घटक के ऑक्सीकरण के आधार पर इम्युनोपरोक्सीडेज संयुग्म प्राप्त करने के लिए एक विधि मिली (संयुग्म के लिए पेरोक्सीडेज का बंधन एंजाइम की प्रारंभिक मात्रा का 70-90% तक पहुंच जाता है)।
एक विश्वसनीय संयुग्म में निम्नलिखित गुण होने चाहिए:
उच्च प्रतिरक्षी बाघ और प्रतिजन के लिए उच्च आत्मीयता ताकि इसे उच्च तनुकरण में उपयोग किया जा सके और इस प्रकार गैर-विशिष्ट बंधन को कम किया जा सके;
कार्य प्रजनन में पर्याप्त विशिष्टता;
बहुलक वाले पर मोनोमेरिक रूपों की प्रबलता, क्योंकि बहुलक रूप गैर-विशेष रूप से प्लास्टिक का पालन करते हैं, जिसके परिणामस्वरूप उच्च पृष्ठभूमि स्तर की प्रतिक्रिया होती है;
एंजाइम और एंटीबॉडी के बीच इष्टतम दाढ़ अनुपात (इष्टतम अनुपात लगभग 1:1 है);
संयुग्म की पर्याप्त एंजाइमेटिक गतिविधि। यह गुण मुख्य रूप से संयुग्मन की स्थितियों और संयुग्म में एंजाइम और एंटीबॉडी अणुओं के अनुपात से निर्धारित होता है।
सॉलिड फ़ेज़
एलिसा के ठोस चरण के रूप में विभिन्न सामग्रियों का उपयोग किया जा सकता है: पॉलीस्टाइनिन, पॉलीविनाइल क्लोराइड, पॉलीप्रोपाइलीन और अन्य पदार्थ। ठोस चरण एक टेस्ट ट्यूब, 96-वेल और अन्य प्लेट्स, बॉल्स, बीड्स, साथ ही नाइट्रोसेल्यूलोज और अन्य झिल्ली की दीवारें हो सकती हैं जो सक्रिय रूप से प्रोटीन को अवशोषित करती हैं।
ठोस चरण पर प्रतिजन या एंटीबॉडी का स्थिरीकरण तीन तरीकों से संभव है:
- प्रोटीन और सिंथेटिक सतह के बीच मजबूत हाइड्रोफोबिक इंटरैक्शन के आधार पर निष्क्रिय सोखना;
- ठोस चरण के लिए सहसंयोजक लगाव;
- इम्यूनोकेमिकल, आदि (गैर-सहसंयोजक और गैर-सोखना लगाव)।
नाइट्रोसेल्यूलोज झिल्ली पर अनुमापन बोर्डों पर एलिसा का संचालन करते समय प्रोटीन के निष्क्रिय सोखना का व्यापक रूप से उपयोग किया जाता है। निष्क्रिय सोखना संतृप्ति के सिद्धांत का पालन करता है और सोखने वाले पदार्थ के आणविक भार के साथ संबंध रखता है। विभिन्न प्रकार की झिल्लियों (नाइट्रोसेल्यूलोज, नायलॉन, आदि) की सोखने की सतह प्लास्टिक की तुलना में 100-1000 गुना अधिक होती है।
पॉलीसेकेराइड और अत्यधिक ग्लाइकोसिलेटेड प्रोटीन में अक्सर पॉलीस्टाइनिन के लिए कम आत्मीयता होती है। उन्हें स्थिर करने के लिए अन्य तरीकों की आवश्यकता होती है, जैसे ग्लूटाराल्डिहाइड के साथ सहसंयोजक लगाव। सहसंयोजक लगाव प्रभावी होता है यदि हाइड्रोफिलिक मोतियों (एग्रोसे) और पॉलीस्टाइन मोतियों को ठोस चरण के रूप में उपयोग किया जाता है।
इम्यूनोकेमिकल विधियां एंटीजन या एंटीबॉडी को स्थिर करने के लिए पूर्व-सोखने वाले "ट्रैप" एंटीबॉडी के उपयोग पर आधारित होती हैं। प्रतिरक्षात्मक रूप से स्थिर प्रतिजन निष्क्रिय रूप से अधिशोषित प्रतिजन की तुलना में 10 गुना अधिक सक्रिय होता है। बैक्टीरिया के लेक्टिन या इम्युनोग्लोबुलिन-बाध्यकारी प्रोटीन का उपयोग किया जा सकता है जो प्लास्टिक या अन्य हाइड्रोफोबिक सतहों पर आसानी से सोख लिए जाते हैं, जैसे कि कॉनकैनावेलिन ए (कॉन ए) या स्टेफिलोकोकल प्रोटीन ए। कॉन ए एचआईवी वायरस के जीपी 120 प्रोटीन को स्थिर करने में सक्षम है।
ठोस चरण की सतह पर मुक्त साइटें जो सॉर्बेड एजेंट से बंधे नहीं हैं, परीक्षण के दौरान अन्य अणुओं को ठीक कर सकती हैं, जिनमें संयुग्म शामिल हैं, जिससे पृष्ठभूमि संकेत में वृद्धि होती है। आधार सामग्री के ठोस चरण पर स्थिरीकरण के बाद गैर-विशिष्ट बंधन को रोकने के लिए, परीक्षण के लिए तटस्थ पदार्थों के साथ उपचार किया जाता है। सबसे लोकप्रिय अवरोधक एजेंट गोजातीय सीरम एल्ब्यूमिन (बीएसए), कैसिइन, आदि हैं। अवरोधक एजेंट की पसंद और इस चरण के लिए शर्तें ठोस चरण के प्रकार, सिस्टम की संवेदनशीलता पर निर्भर करती हैं।
एलिसा मंचन विकल्प।
सामान्य सिद्धांत।
वर्तमान में उपयोग में है बड़ी राशिएलिसा के विभिन्न प्रकार और संशोधन। एंजाइम-लिंक्ड इम्युनोसॉरबेंट परख (एलिसा) के विभिन्न प्रकार व्यापक हो गए हैं।
ठोस चरण एलिसा 1971 में प्रस्तावित किया गया था। ठोस-चरण एलिसा के मूल सिद्धांत, संशोधन की परवाह किए बिना, इस प्रकार हैं:
1. प्रतिक्रिया के पहले चरण में, ठोस चरण पर एंटीजन या एंटीबॉडी का विज्ञापन किया जाता है। इस मामले में, ठोस चरण से बंधे हुए अभिकर्मकों को धोने से आसानी से हटा दिया जाता है।
2. परीक्षण के नमूने को संवेदनशील कुओं में इनक्यूबेट किया जाता है। सकारात्मक नियंत्रण कुओं में मानक अभिकर्मक होते हैं। इस मामले में, ठोस चरण की सतह पर प्रतिरक्षा परिसरों का निर्माण होता है। अनबाउंड घटकों को धोने से हटा दिया जाता है।
3. जब एक एंटीबॉडी-एंजाइम या एंटीजन-एंजाइम संयुग्म जोड़ते हैं और इसे स्थिर प्रतिरक्षा परिसर से बांधते हैं, तो एंजाइम की सक्रिय साइट सब्सट्रेट के साथ बाद की बातचीत के लिए उपलब्ध रहती है। स्थिर संयुग्म के साथ कुओं में सब्सट्रेट के ऊष्मायन से रंग प्रतिक्रिया का विकास होता है। इस प्रतिक्रिया को वांछित स्तर पर रोका जा सकता है, धुंधलापन की गंभीरता का आकलन नेत्रहीन या ऑप्टिकल घनत्व द्वारा किया जा सकता है।
ठोस-चरण विश्लेषण के किसी भी प्रकार में एक महत्वपूर्ण कदम अनबाउंड अभिकर्मकों को धोने की प्रक्रिया है। यह न केवल ठोस चरण पर तय घटकों को कुल्ला करने के लिए महत्वपूर्ण है, बल्कि अभिकर्मकों को परत की पूरी गहराई से हटाने के लिए भी महत्वपूर्ण है। ये विश्लेषण के सबसे अधिक समय लेने वाले और श्रम-गहन चरण हैं। एक मल्टीचैनल पिपेट के साथ एक विशेष उपकरण - एक वॉशर या मैन्युअल रूप से नमूने का उपयोग करके नमूनों को स्वचालित रूप से धोया जा सकता है। एलिसा का संचालन करने के लिए, आपको चाहिए:
- पॉलीस्टाइनिन टैबलेट या अन्य ठोस चरण विकल्पों का उपयोग किया जाता है;
- धोने का घोल;
- संयुग्म (एंजाइमी लेबल वाले एंटीजन या एंटीबॉडी);
- प्रयुक्त सबस्ट्रेट्स का मिश्रण;
- रोक समाधान (रोक अभिकर्मक - प्रतिक्रिया को रोकने के लिए समाधान);
- सकारात्मक और / या नकारात्मक नियंत्रण के लिए उपयोग किए जाने वाले नमूने;
- मानक प्रतिजन (अंशांकन वक्र के निर्माण के लिए);
- सिंगल और मल्टीचैनल पिपेट;
- वॉशर (वॉशर);
- परीक्षण समाधान के ऑप्टिकल घनत्व को निर्धारित करने के लिए एक ऑप्टिकल उपकरण (एलिसा रीडर, एक पाठक जो क्रमिक रूप से सभी कुओं को फोटोमीटर करता है);
- अध्ययन की गई जैविक सामग्री के 5-100 μl।
प्रत्यक्ष एलिसा
1. एंटीजन या एंटीबॉडी (परीक्षण सामग्री) पैनलों के कुओं में सोख लिए जाते हैं। यह ऊपर उल्लेख किया गया था कि एंटीजन विभिन्न प्रकार के प्लास्टिक पर सोखने की उनकी क्षमता में काफी भिन्न होते हैं, यह इस बात पर निर्भर करता है कि वे किस वर्ग के पदार्थों (प्रोटीन, कार्बोहाइड्रेट, या लिपोप्रोटीन) से संबंधित हैं। अक्सर प्रत्यक्ष एलिसा में, ठोस चरण पर स्थिर प्रतिजन कोशिकाएं और अन्य कण प्रतिजन होते हैं।
2. "ठोस चरण पर शेष मुक्त बाध्यकारी साइटों को कैसिइन बीएसए, आदि के साथ ब्लॉक करें (ठोस चरण पर संयुग्म के गैर-विशिष्ट सोखना को रोकने के लिए)।
3. एंजाइम-लेबल एंटीबॉडी या एंटीजन (संयुग्म) को कुओं में जोड़ा जाता है और इनक्यूबेट किया जाता है। संयुग्म का ठोस चरण से बंधन तभी होगा जब सिस्टम के दोनों घटक पूरक हों। संयुग्म के साथ ऊष्मायन के बाद, कुओं को धोया जाता है, इस प्रकार संयुग्म के अनबाउंड भाग को हटा दिया जाता है।
4. उपयोग किए गए एंजाइम के लिए विशिष्ट सब्सट्रेट को फिर कुओं में जोड़ा जाता है और इनक्यूबेट किया जाता है। जब सकारात्मक नियंत्रण कुओं में धुंधलापन का इष्टतम स्तर पहुंच जाता है, तो एंजाइम प्रतिक्रिया बंद हो जाती है।
5. प्रतिक्रिया के लिए लेखांकन। सबसे पहले, प्रतिक्रिया के परिणामों को नेत्रहीन रूप से ध्यान में रखा जाता है। परिणामों के अधिक सटीक विवरण के लिए, धुंधला तीव्रता का मूल्यांकन एक उपयुक्त प्रकाश फिल्टर के साथ एलिसा रीडर पर किया जाता है। विश्लेषण के परिणामों के अनुसार, एकाग्रता पर ऑप्टिकल घनत्व की निर्भरता का एक ग्राफ तैयार किया गया है (चित्र 2)।
चित्रा 2. प्रत्यक्ष एलिसा।
ए) एक एंटीजन का पता लगाने के लिए; बी) एंटीबॉडी का पता लगाने के लिए।
अप्रत्यक्ष एलिसा
एलिसा के इस प्रकार का उपयोग आमतौर पर विशिष्ट एंटीबॉडी का पता लगाने के लिए किया जाता है। मानक प्रतिजन पैनलों के कुओं में सोख लिया जाता है और रोगी से प्राप्त सीरम या अन्य जैविक सामग्री (मस्तिष्कमेरु द्रव, लार, आदि) के नमूनों के साथ इनक्यूबेट किया जाता है। एंटीग्लोबुलिन संयुग्म का उपयोग करके ठोस चरण पर एंटीजन से बंधे विशिष्ट एंटीबॉडी का पता लगाया जाता है। विश्लेषण के उद्देश्य के आधार पर, विभिन्न एंटीग्लोबुलिन अभिकर्मकों का उपयोग किया जाता है जो सभी आइसोटाइप के एंटीबॉडी का पता लगाते हैं, या अलग-अलग वर्गों और इम्युनोग्लोबुलिन के उपवर्गों के लिए विशिष्ट होते हैं। विधि का मुख्य लाभ संयुग्म की सार्वभौमिकता है। किसी भी नमूने में विभिन्न प्रकार के एंटीजन के लिए मानव एंटीबॉडी का पता लगाने के लिए एक ही संयुग्म का उपयोग किया जा सकता है। प्रतिक्रिया व्यवस्थित रूप से सरल है।
एंटीबॉडी का पता लगाने के लिए अप्रत्यक्ष एलिसा के मुख्य चरण:
1. एंटीजन को ठोस चरण पर सोख लिया जाता है, फिर अनबाउंड घटकों से धोया जाता है।
2. फ्री बाइंडिंग साइट्स को ब्लॉक करें। धुलाई की गई।
3. परीक्षण सामग्री को कुओं में जोड़ा जाता है, ऊष्मायन किया जाता है और फिर धोया जाता है। समानांतर में, सकारात्मक और नकारात्मक नियंत्रण वाले नमूने रखे जाते हैं।
4. काम करने वाले कमजोर पड़ने में एंटीग्लोबुलिन संयुग्म जोड़ें, इनक्यूबेट करें, अनबाउंड घटकों को धो लें।
5. सब्सट्रेट पेश किया गया है, ऊष्मायन किया गया है। सकारात्मक नियंत्रण कुओं में धुंधला होने के इष्टतम स्तर तक पहुंचने पर, स्टॉप सॉल्यूशन जोड़कर प्रतिक्रिया को रोक दिया जाता है।
6. एलिसा रीडर पर प्रतिक्रिया उत्पाद की मात्रा को मापें (चित्र 3)।
इष्टतम परख स्थितियों के तहत, विधि अत्यधिक विशिष्ट और संवेदनशील है। यह आपको अध्ययन किए गए रोगियों के सीरा में एंटीबॉडी की नैनोग्राम मात्रा का पता लगाने की अनुमति देता है। संतोषजनक परिणाम प्राप्त करने के लिए, अभिकर्मकों और कार्यप्रणाली का मानकीकरण आवश्यक है। इस एलिसा संस्करण का उपयोग मोनोक्लोनल एंटीबॉडी का परीक्षण करने के लिए भी किया जा सकता है।
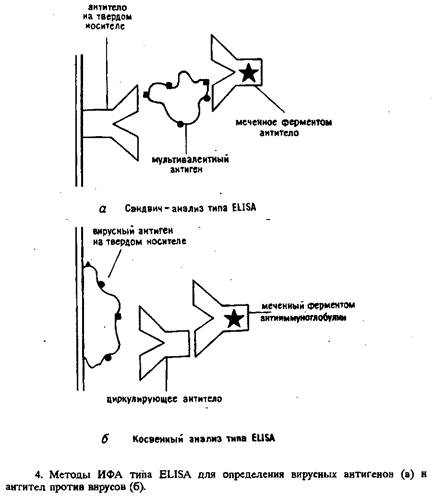
"सैंडविच" - एंटीजन का पता लगाने के लिए एलिसा का एक प्रकार।
इस एलिसा संस्करण का उपयोग करके पता लगाए गए एंटीजन में कई एंटीबॉडी-बाइंडिंग एपिटोप्स होने चाहिए या एक ही विशिष्टता के दोहराव वाले, स्थानिक रूप से अलग किए गए एपिटोप्स होने चाहिए।
एलिसा के इस प्रकार को करते समय, ठोस चरण पर अधिशोषित अत्यधिक विशिष्ट पॉली- या मोनोक्लोनल एंटीबॉडी परीक्षण नमूने के साथ इनक्यूबेट किए जाते हैं। धोने की प्रक्रिया के बाद, उसी एंटीजन में एंजाइम-लेबल एंटीबॉडी (संयुग्म) को कुओं में जोड़ा जाता है, और फिर प्रतिक्रिया के अन्य सभी चरणों को अंजाम दिया जाता है। विश्लेषण के प्रत्येक चरण में एक विशिष्ट परिसर के गठन की दक्षता एंटीजन-एंटीबॉडी प्रतिक्रिया के बाध्यकारी स्थिरांक पर निर्भर करती है।
विश्लेषण के मुख्य चरण:
1. मोनोक्लोनल एंटीबॉडी या आत्मीयता-शुद्ध पॉलीक्लोनल एंटीबॉडी ठोस चरण पर स्थिर होते हैं।
2. परीक्षण नमूना पैनलों के कुओं में पेश किया जाता है, एक सकारात्मक नियंत्रण नमूना और एक नकारात्मक नियंत्रण नमूना विभिन्न कमजोरियों में समानांतर में रखा जाता है। ऊष्मायन और धोया।
3. एंजाइम-लेबल वाले मोनोक्लोनल या पॉलीक्लोनल एंटीबॉडी (संयुग्म) को कुओं में पेश किया जाता है। ऊष्मायन के बाद धुलाई की जाती है।
4. सब्सट्रेट पेश किया गया है, ऊष्मायन किया गया है। सकारात्मक नियंत्रण कुओं में इष्टतम धुंधलापन प्राप्त होने पर प्रतिक्रिया रोक दी जाती है।
5. एलिसा रीडर पर परिणामों के लिए लेखांकन।
विधि का मुख्य लाभ इसकी उच्च संवेदनशीलता है, जो अन्य एलिसा योजनाओं (छवि 4) की क्षमताओं से अधिक है।
चित्रा 3. एंटीबॉडी का पता लगाने के लिए अप्रत्यक्ष एलिसा।
प्रतिस्पर्धी एलिसा।
यह विश्लेषण विकल्प ठोस चरण पर अधिशोषित प्रतिजन के लिए बाध्य करने के लिए लेबल (संयुग्म) और गैर-लेबल (परीक्षण) एंटीबॉडी की प्रतिस्पर्धा पर आधारित है। ठोस चरण से जुड़े एंजाइम की मात्रा मिश्रण में मुक्त एंटीबॉडी की सामग्री के अनुपात में घट जाएगी। प्रतिजन का निर्धारण करने के लिए, एक ही विकल्प का उपयोग किया जाता है, लेकिन इस मामले में वांछित प्रतिजन ठोस चरण की सतह पर स्थिर एंटीबॉडी के लिए बाध्य करने के लिए लेबल, मानक प्रतिजन के साथ प्रतिस्पर्धा करता है।
प्रतिस्पर्धी पद्धति के लिए न्यूनतम संख्या में संचालन, अभिकर्मकों की कम खपत की आवश्यकता होती है, और इसे आसानी से स्वचालित किया जा सकता है। एंटीबॉडी का पता लगाने के लिए एक प्रतिस्पर्धी एलिसा आयोजित करते समय, लेबल किए गए मोनोक्लिनल एंटीबॉडी का उपयोग करना बेहतर होता है, फिर परीक्षण नमूने के साथ संयुग्म की प्रतियोगिता ठोस चरण पर सोखने वाले एंटीजन के एकल एपिटोप के लिए होती है। इस एलिसा संस्करण का उपयोग विभिन्न यौगिकों, जैसे मानव इम्युनोग्लोबुलिन, कैंसर-भ्रूण प्रतिजन, इंसुलिन आदि को निर्धारित करने के लिए किया जाता है। यह संक्रामक एजेंटों के नैदानिक रूप से महत्वपूर्ण एपिटोप्स के लिए एंटीबॉडी का पता लगाने की अनुमति देता है।
एंटीजन का पता लगाने के लिए विश्लेषण के मुख्य चरण (चित्र 5):
1. एंटीजन का पता लगाने के लिए विशिष्ट मोनोक्लोनल एंटीबॉडी ठोस चरण पर स्थिर होते हैं।
2. एंजाइम और परीक्षण नमूने के साथ लेबल किए गए एंटीजन को पैनलों के कुओं में एक ज्ञात एकाग्रता में जोड़ें। ऊष्मायन और धुलाई करें। समानांतर में, सकारात्मक और नकारात्मक नियंत्रण आसन्न कुओं में रखे जाते हैं। विभिन्न तनुकरणों में एक मानक गैर-लेबल प्रतिजन का उपयोग करके अंशांकन का निर्माण करना।
3. सकारात्मक नियंत्रण कुओं में इष्टतम धुंधला विकसित होने पर सब्सट्रेट जोड़ें, इनक्यूबेट करें, प्रतिक्रिया रोकें।
4. एलिसा रीडर पर प्रतिक्रिया के लिए लेखांकन।
इस मामले में, परीक्षण नमूने में एंटीजन की मात्रा ठोस चरण पर एंजाइमी गतिविधि के विपरीत आनुपातिक है।
निरोधात्मक एलिसा।
एलिसा के इस प्रकार में, परीक्षण नमूने में मौजूद एंटीजन एंजाइम-लेबल वाले मोनोक्लोनल एंटीबॉडी से बांधता है और ठोस चरण पर स्थिर मानक एंटीजन के साथ उनकी बातचीत को रोकता है। संयुग्म के लिए विशिष्ट एंटीजन की सम ट्रेस मात्रा के नमूने में उपस्थिति स्थिर एंटीजन के लिए लेबल एंटीबॉडी के बंधन को रोक देगी। निषेध की डिग्री समाधान में प्रतिजन की सामग्री के सीधे आनुपातिक है। मात्रात्मक विश्लेषण के लिए, मानक एंटीजन के सीरियल कमजोर पड़ने का उपयोग करके एक अंशांकन वक्र बनाया जाता है। एंटीजन का पता लगाने के लिए निरोधात्मक एलिसा के मुख्य चरण (चित्र 6)।
1. पैनलों के कुओं में मानक एंटीजन को सोखें। अनुमापन द्वारा लेबल एंटीबॉडी के एक कार्यशील कमजोर पड़ने का चयन करें।
चित्रा 4. "सैंडविच" - एलिसा संस्करण।
चित्र 5 प्रतिस्पर्धी एलिसा चित्र 6 निरोधात्मक एलिसा
2. संयुग्म परीक्षण नमूने, मानक प्रतिजन और सकारात्मक नियंत्रण नमूनों के कमजोर पड़ने के साथ काम कर रहे कमजोर पड़ने पर पूर्व-ऊष्मायन किया जाता है।
3. मिश्रण को पैनलों के कुओं में स्थानांतरित किया जाता है। 100% बंधन को नियंत्रित करने के लिए, केवल लेबल एंटीबॉडी को कई कुओं में जोड़ा जाता है, बिना निरोधात्मक प्रतिजन के। पैनलों को इनक्यूबेट किया जाता है और फिर धोया जाता है।
4. सब्सट्रेट जोड़ें।
5. परिणाम रिकॉर्ड करें।
परीक्षण नमूने में निर्धारित किए जाने वाले प्रतिजन की सांद्रता ठोस चरण पर एंजाइमी गतिविधि के व्युत्क्रमानुपाती होती है।
एलिसा का उपयोग न केवल घुलनशील एंटीजन या एंटीबॉडी को निर्धारित करने के लिए किया जा सकता है, बल्कि विभिन्न प्रोटीन उत्पन्न करने वाली कोशिकाओं के लिए भी किया जा सकता है।
एलिसा दाग विधि ( एलिसपोट).
1983 में, एलिसा तकनीक को इन विट्रो में एंटीबॉडी या एंटीजन (जैसे, साइटोकिन्स) को स्रावित करने वाली लिम्फोइड कोशिकाओं का पता लगाने के लिए अनुकूलित किया गया था। विधि को ELISPOT (एंजाइमेटिक इम्यूनोसे या स्पॉट मेथड) कहा जाता है। विधि का मुख्य सिद्धांत:
1. एक पॉलीस्टायर्न कुएं की सतह पर (24-वेल सेल कल्चर पैनल का उपयोग करके), एंटीजन या एंटीबॉडी को सोख लिया जाता है, जो "ट्रैपिंग" अभिकर्मकों के रूप में काम करते हैं।
2. अध्ययन की गई लिम्फोइड कोशिकाओं को जोड़ा जाता है, 37 डिग्री सेल्सियस पर कई घंटों तक सुसंस्कृत किया जाता है, जिससे उन्हें एक निश्चित स्थान पर कब्जा करने और एक स्रावी कार्य करने का अवसर मिलता है। ऐसी कोशिकाओं द्वारा स्रावित प्रतिपिंडों या प्रतिजनों को ठोस चरण पर अधिशोषित अभिकर्मकों द्वारा ग्रहण किया जाता है।
3. सेल लाइसिंग डिटर्जेंट के साथ वाशिंग सॉल्यूशन का उपयोग करके कोशिकाओं को हटा दिया जाता है।
4. स्रावी उत्पादों के संचय की साइटों को एंजाइम (एंटीग्लोबुलिन अभिकर्मक) से जुड़े एंटीबॉडी जोड़कर दिखाया जाता है।
5. सब्सट्रेट-एग्रोसे मिश्रण जोड़ा जाता है (इस्तेमाल किए गए सबस्ट्रेट्स को agarose में घुलना चाहिए और अघुलनशील प्रतिक्रिया उत्पादों का निर्माण करना चाहिए), भूरे या नीले धब्बे ठोस चरण की सतह पर बनते हैं (उपयोग किए गए एंजाइम और सब्सट्रेट के आधार पर), उन क्षेत्रों का खुलासा करते हैं जहां कोशिकाएं हैं स्थित थे।
परिणामी धब्बों को एक माइक्रोस्कोप के तहत गिना जाता है, यह स्रावी कोशिकाओं की संख्या होगी।
एक नाइट्रोसेल्यूलोज झिल्ली को एक ठोस चरण के रूप में इस्तेमाल किया जा सकता है। इस मामले में, कई फायदे हैं: एनसीएम की उच्च सोखना क्षमता के कारण, "ट्रैपिंग" अभिकर्मक के रूप में उपयोग किए जाने वाले एंटीजन की काफी कम मात्रा की आवश्यकता होती है, इसके अलावा, सब्सट्रेट में agarose को शामिल करने की कोई आवश्यकता नहीं है।
एक साथ स्रावित कोशिकाओं की संख्या और कुएं में स्रावित प्रतिजन या एंटीबॉडी की कुल मात्रा का निर्धारण करके, जो एक अलग सब्सट्रेट का उपयोग करते समय संभव है, एक एकल कोशिका द्वारा स्रावित पदार्थ की मात्रा निर्धारित करना संभव है।
इस पद्धति ने उन कोशिकाओं की संख्या का आकलन करने के लिए व्यापक आवेदन पाया है जो adsorbed एंटीबॉडी द्वारा कब्जा किए गए एंटीजन को स्रावित करते हैं, इसका उपयोग साइटोकिन्स (IL-1, IL-2, IL-4, IL-6) को स्रावित करने वाली कोशिकाओं की संख्या निर्धारित करने के लिए किया जाता है। आईएफएन-वाई, टीएनएफ-ए)।
सिग्नल प्रवर्धन प्रणाली।
उच्च-आत्मीयता एंटीबॉडी का उपयोग करते समय, व्यक्तिगत एलिसा वेरिएंट की संवेदनशीलता बहुत अधिक होती है और सैद्धांतिक रूप से एकल एंटीजन अणुओं का पता लगाना संभव हो जाता है, लेकिन व्यवहार में संवेदनशीलता कई कारकों द्वारा सीमित होती है: एंजाइम गतिविधि, सिग्नल तीव्रता और सिग्नल लेखांकन विधियां . सिग्नल एम्प्लीफिकेशन सिस्टम विभिन्न एलिसा वेरिएंट की संवेदनशीलता को बढ़ाना संभव बनाता है। इनमें से कुछ प्रणालियों पर विचार करें:
एविडिन-बायोटिन की परस्पर क्रिया के आधार पर।
बायोटिन कोएंजाइम अणु (मिमी 244 दा) बायोटिनिल-एन-हाइड्रॉक्सीसुसीमाइड का उपयोग करके एंटीबॉडी के साथ संयुग्मित होते हैं। एक छोटा बायोटिन अणु अपनी प्रतिरक्षा या एंजाइमी गुणों का उल्लंघन किए बिना एक इम्युनोग्लोबुलिन या अन्य प्रोटीन से जुड़ना आसान होता है। इस मामले में एंजाइम अंडे के सफेद ग्लाइकोप्रोटीन एविडिन से बंधा होता है। बायोटिन के लिए एविडिन की बाध्यकारी आत्मीयता बहुत अधिक है (कॉम्प्लेक्स का पृथक्करण स्थिरांक 10-15 mol है), एविडिन-एंजाइम संयुग्म एंटीजन-एंटीबॉडी-बायोटिन कॉम्प्लेक्स पर मजबूती से तय होता है। उपयुक्त सब्सट्रेट जोड़ने के बाद, प्रतिक्रिया उत्पाद स्पेक्ट्रोफोटोमेट्रिक रूप से या ल्यूमिनेसेंस तीव्रता द्वारा निर्धारित किया जाता है।
एक एविडिन अणु में चार समान सबयूनिट होते हैं, जो चार बायोटिन अणुओं के साथ बातचीत करने में सक्षम होते हैं, जो इसे दो बायोटिन युक्त यौगिकों के बीच एक लिंकिंग अणु के रूप में उपयोग करने की अनुमति देता है। इस मामले में, एंजाइम भी बायोटिनाइलेटेड होता है, और एविडिन एक सेतु के रूप में कार्य करता है, जो बायोटिन अवशेषों वाले दो अणुओं को जोड़ता है। मुक्त एविडिन को परिणामी एंटीजन-एंटीबॉडी-बायोटिन कॉम्प्लेक्स में जोड़ा जाता है, इसके बाद बायोटिनाइलेटेड एंजाइम होता है। प्रतिक्रिया रिकॉर्ड करें।
एविडिन प्रोटीन को अन्य अणुओं पर गैर-विशिष्ट रूप से अवशोषित किया जा सकता है; इसलिए, एक अन्य बायोटिन-बाध्यकारी प्रोटीन, स्ट्रेप्टाविडिन, जीवाणु स्ट्रेप्टोमाइसेस एविडिनी में पाया जाता है, का तेजी से उपयोग किया जा रहा है। स्ट्रेप्टाविडिन भी बायोटिन के साथ एक मजबूत परिसर बनाता है और इसमें चार समान सबयूनिट होते हैं।
एविडिन-बायोटिन कॉम्प्लेक्स के उपयोग से एलिसा की संवेदनशीलता में उल्लेखनीय वृद्धि संभव हो जाती है, क्योंकि संयुग्म के संश्लेषण के दौरान दर्जनों बायोटिन अणु एक एटी अणु से बंधे हो सकते हैं। संयुग्म (बायोटिन के साथ एंटीबॉडी और एंजाइम) प्राप्त करना काफी आसान है और इसके साथ उनकी प्रतिरक्षात्मक और एंजाइमेटिक गतिविधि में न्यूनतम परिवर्तन होते हैं। बायोटिन के साथ एंजाइमों के संयुग्मों का उपयोग सार्वभौमिक अभिकर्मकों के रूप में किया जा सकता है।
रसायनयुक्त प्रतिक्रियाओं का उपयोग।
विधि की संवेदनशीलता को बढ़ाने और विश्लेषण के समय को कम करते हुए, एलिसा में एक संकेत प्राप्त करने के लिए केमिलुमिनसेंट प्रतिक्रियाओं का उपयोग किया जा सकता है। हॉर्सरैडिश पेरोक्साइड का व्यापक रूप से एलिसा में एक लेबल के रूप में उपयोग किया जाता है, और इसका पता लगाने के लिए विभिन्न रसायनयुक्त प्रतिक्रियाओं का भी उपयोग किया जा सकता है। हाइड्रोजन पेरोक्साइड के साथ ऑक्सीकृत होने पर केमिलुमिनसेंट प्रतिक्रियाएं ल्यूमिनॉल की चमक की क्षमता पर आधारित होती हैं। प्रत्यक्ष विश्लेषण में, एक एंजाइमैटिक प्रतिक्रिया हाइड्रोजन पेरोक्साइड का उत्पादन करती है और ल्यूमिनॉल का ऑक्सीकरण करती है; यह प्रतिक्रिया हॉर्सरैडिश पेरोक्सीडेज द्वारा उत्प्रेरित होती है। संकेत को बढ़ाने के लिए, विभिन्न यौगिकों का उपयोग किया जाता है, उदाहरण के लिए, ल्यूसिफरिन, फिनोल, इस मामले में, ल्यूमिनेसेंस की तीव्रता 10-100 गुना बढ़ जाती है, कुछ मामलों में 500 गुना (बढ़ी हुई रसायनयुक्त विश्लेषण)। ल्यूमिनसेंट सिग्नल बहुत स्थिर है, इसका स्तर अधिकतम 30 एस में पहुंच जाता है (तुलना के लिए: ओपीडी के साथ एक संकेतक के रूप में रंग प्रतिक्रिया पूरी तरह से केवल 30 मिनट में विकसित होती है)।
ल्यूमिनॉल या इसके डेरिवेटिव के साथ अप्रत्यक्ष विश्लेषण में, एंटीबॉडी को लेबल किया जाता है। मुक्त अवस्था में ऐसा लेबल प्रकाश की रिहाई के साथ हाइड्रोजन पेरोक्साइड द्वारा ऑक्सीकृत होने में सक्षम है। यदि यह एक जटिल बना है, तो यह ऑक्सीकरण करने की क्षमता खो देता है।
कैस्केड सिस्टम के आधार पर।
एलिसा की संवेदनशीलता को बढ़ाने के लिए एंजाइम कैस्केड सिस्टम का उपयोग किया जा सकता है। इस मामले में, पहले एंटीबॉडी-बाध्य एंजाइम का परिणाम दूसरे एंजाइम प्रणाली के लिए एक कम करने योग्य सब्सट्रेट में होता है। दूसरा एंजाइम सिस्टम सब्सट्रेट-साइक्लिक या रेडॉक्सीसाइक्लिक हो सकता है। इस मामले में एंजाइमेटिक लेबल फॉस्फो-ग्लूकोइसोमेरेज़, एल्डोलेज़ हो सकते हैं, alkaline फॉस्फेट. अंतिम प्रतिक्रिया उत्पाद नेत्रहीन या स्पेक्ट्रोफोटोमेट्रिक रूप से निर्धारित किया जाता है।
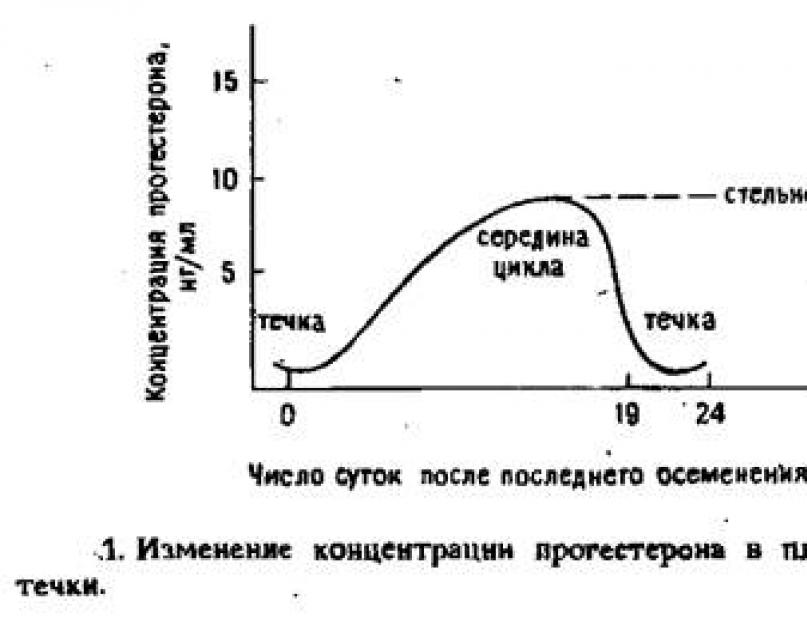
एलिसा प्रवर्धन प्रणाली उच्च संवेदनशीलता प्राप्त करती है। इस तरह के एलिसा सिस्टम का उपयोग हार्मोन (थायरॉयड-उत्तेजक, प्रोजेस्टेरोन, आदि) के स्तर को निर्धारित करने के लिए किया जाता है।
एलिसा का व्यावहारिक अनुप्रयोग।
एलिसा ने विधि की सापेक्ष सादगी और उच्च संवेदनशीलता के कारण चिकित्सा और जीव विज्ञान के विभिन्न क्षेत्रों में व्यापक आवेदन पाया है। एलिसा का सफलतापूर्वक उपयोग किया गया है:
जैविक नमूनों में हार्मोन और दवाओं के स्तर का पता लगाना और उनका निर्धारण करना;
एक विशिष्ट प्रतिजन के खिलाफ एंटीबॉडी के आइसोटाइप निर्धारण (IgG, IgM और अन्य);
प्रतिरक्षा परिसरों का पता लगाना;
ट्यूमर मार्करों का पता लगाना;
रक्त सीरम प्रोटीन (फेरिटिन, फाइब्रोनेक्टिन, आदि) का निर्धारण;
कुल IgE और विशिष्ट IgE एंटीबॉडी का निर्धारण;
मायोक्लोनल एंटीबॉडी के लिए स्क्रीनिंग;
जैविक तरल पदार्थों में साइटोकिन्स की परिभाषा।
विधि संवेदनशीलता
एलिसा ने पहले नैदानिक अभ्यास में व्यापक रूप से उपयोग किए जाने वाले एग्लूटीनेशन, वर्षा और आरआईए के तरीकों को बदल दिया है। उपरोक्त विधियों की तुलना में, एलिसा कम श्रमसाध्य और कम समय लेने वाली है, बड़ी संख्या में एक ही प्रकार के विश्लेषण करने के लिए सुविधाजनक है।
एलिसा एंजाइम लेबलिंग की उच्च संवेदनशीलता के साथ एक इम्यूनोकेमिकल परख की अनूठी विशिष्टता को जोड़ती है। विधि की संवेदनशीलता (संवेदनशीलता के तहत एंटीबॉडी या एंटीजन की न्यूनतम पता लगाने योग्य मात्रा का मतलब है) निम्नलिखित कारकों द्वारा निर्धारित किया जाता है: एंटीबॉडी की आत्मीयता, मोनोक्लोनल एंटीबॉडी का उपयोग बेहतर है; एंजाइम की विशिष्ट गतिविधि; संकेत तीव्रता; संकेत संवेदनशीलता। विभिन्न एलिसा वेरिएंट उनकी संवेदनशीलता में भिन्न हैं। ठोस-चरण एलिसा के अलग-अलग प्रकार एक नमूने में एकल अणुओं का पता लगाना संभव बनाते हैं। एलिसा की औसत संवेदनशीलता 10 -9 - 10 -12 mol है।
ग्रंथ सूची।
- गैलाक्टोनोव वी.जी. इम्यूनोलॉजी। मॉस्को यूनिवर्सिटी प्रेस, 1998
- किशकुन ए.ए. नैदानिक अभ्यास में संक्रामक रोगों के निदान के लिए प्रतिरक्षाविज्ञानी अध्ययन और तरीके। चिकित्सा समाचार एजेंसी, 2009 उपदंश का निदान करने के लिए अन्य विधियों का उपयोग किया जा सकता है: एक प्रतिक्रिया के साथ एंजाइम इम्युनोसे (एलिसा) ...
एंजाइम इम्युनोसे के सिद्धांत, मुख्य प्रकार के एलिसा, निदान में आवेदन
क्लिनिकल प्रयोगशाला निदान विभाग के समोइलिकोव पावेल व्लादिमीरोविच इंटर्न
रूसी राज्य चिकित्सा विश्वविद्यालय
परिचय।
चिकित्सा पद्धति में इम्यूनोसे के तरीकों का व्यापक रूप से उपयोग किया जाता है। आधुनिक चिकित्सा के सभी क्षेत्रों में, इम्यूनोसे का उपयोग मुख्य रूप से नैदानिक और विश्लेषणात्मक उद्देश्यों के लिए किया जाता है। यह विशेष रूप से महत्वपूर्ण है कि वे कम और बहुत कम सांद्रता पर जैविक घटकों (हार्मोन, एंजाइम, न्यूरोपैप्टाइड्स, प्रतिरक्षा प्रणाली उत्पाद, एंटीजन, आदि) की पहचान करना संभव बनाते हैं। इन विधियों द्वारा सभी उत्पादों का पता लगाया जाता है जिनके खिलाफ एंटीबॉडी प्राप्त करना संभव है।
प्रतिरक्षा विश्लेषण एक घटक (एंजाइम, रेडियोन्यूक्लाइड, फ्लोरोसेंट डाई, और अन्य) में से एक के लिए विभिन्न लेबलिंग विकल्पों का उपयोग करके एक एंटीजन (एजी) और एक एंटीबॉडी (एटी) की बातचीत पर आधारित है। प्रतिक्रिया का मूल्यांकन विशेष उपकरणों पर स्वचालित रूप से किया जाता है, जिससे इन विधियों को मानकीकृत करना संभव हो जाता है।
उपयोग किए गए लेबल के प्रकार और परीक्षण की स्थापना के लिए शर्तों के आधार पर, इम्यूनोसे को एंजाइम इम्यूनोसे (एलिसा), रेडियोइम्यूनोसे (आरआईए), इम्यूनोफ्लोरेसेंट और अन्य के रूप में जाना जाता है। जब प्रतिक्रियाओं का मंचन एक या अधिक चरणों में किया जाता है, तो उन्हें प्रत्यक्ष या अप्रत्यक्ष रूप से नामित किया जाता है। जिस माध्यम में प्रतिक्रिया की जाती है वह मायने रखता है। यदि प्रतिक्रिया सतह पर तय किए गए अभिकर्मकों के साथ की जाती है, तो परीक्षण को ठोस चरण परीक्षण के रूप में नामित किया जाता है, उदाहरण के लिए, एलिसा (एंजाइम लिंक्ड इम्यूनोसॉर्बेंट परख)।
इस पत्र में, केवल एंजाइम इम्युनोसे पर विचार किया जाएगा - जीव विज्ञान और चिकित्सा में व्यापक रूप से उपयोग की जाने वाली एक विधि, व्यावहारिक और मौलिक दोनों।
लिंक्ड इम्युनोसॉरबेंट परख।
एलिसा 60 के दशक के मध्य में प्रकट हुआ और मूल रूप से एक हिस्टोलॉजिकल तैयारी में एक एंटीजन की पहचान करने के लिए एक विधि के रूप में विकसित किया गया था, साथ ही एक इम्यूनोडिफ्यूजन परीक्षण और इम्यूनोइलेक्ट्रोफोरेसिस में वर्षा लाइनों की कल्पना करने के लिए, और फिर एंटीजन के मात्रात्मक निर्धारण के लिए उपयोग किया जाने लगा और जैविक तरल पदार्थों में एंटीबॉडी। E. Engvall और R. Pelman ने विधि के विकास में भाग लिया, साथ ही, उनमें से स्वतंत्र रूप से, W. Van Veeman और R. Schurs ने भाग लिया।
चित्रा 1. एलिसा का मूल सिद्धांत।
1) एंटीजन का पता लगाने के लिए। 2) एंटीबॉडी का पता लगाने के लिए।
विधि प्रतिजन के प्रति एंटीबॉडी के विशिष्ट बंधन पर आधारित है, जबकि घटकों में से एक एंजाइम के साथ संयुग्मित होता है; संबंधित क्रोमोजेनिक सब्सट्रेट के साथ प्रतिक्रिया के परिणामस्वरूप, एक रंगीन उत्पाद बनता है, जिसकी मात्रा हो सकती है स्पेक्ट्रोफोटोमेट्रिक रूप से निर्धारित (चित्र। 1)।
अपनी बाध्यकारी गतिविधि को बनाए रखते हुए विभिन्न वाहकों पर एंटीजन और एंटीबॉडी स्थिरीकरण की संभावना की खोज ने जीव विज्ञान और चिकित्सा के विभिन्न क्षेत्रों में एलिसा के उपयोग का विस्तार करना संभव बना दिया है।
मोनोक्लोनल एंटीबॉडी की उपस्थिति ने एलिसा के एक और विकास के रूप में कार्य किया, जिससे इसकी संवेदनशीलता, विशिष्टता और परिणामों की पुनरुत्पादकता को बढ़ाना संभव हो गया।
सैद्धांतिक रूप से, एलिसा आधुनिक इम्यूनोकेमिस्ट्री और रासायनिक एंजाइमोलॉजी के डेटा पर आधारित है, एंटीजन-एंटीबॉडी प्रतिक्रिया के भौतिक-रासायनिक कानूनों के ज्ञान के साथ-साथ विश्लेषणात्मक रसायन विज्ञान के मुख्य सिद्धांतों पर आधारित है। एलिसा की संवेदनशीलता और इसकी अवधि कई मुख्य कारकों द्वारा निर्धारित की जाती है: एंटीजन-एंटीबॉडी प्रतिक्रिया की गतिज और थर्मोडायनामिक विशेषताएं, अभिकर्मकों का अनुपात, एंजाइम गतिविधि और इसके पता लगाने के तरीकों का संकल्प। सामान्य तौर पर, प्रतिजन-एंटीबॉडी प्रतिक्रिया को एक सरल योजना द्वारा वर्णित किया जा सकता है:
+[एजी]↔[एटीएजी]
कम आणविक भार यौगिकों से लेकर वायरस और बैक्टीरिया तक अध्ययन की वस्तुओं की विविधता, साथ ही एलिसा के उपयोग के लिए विभिन्न स्थितियों से जुड़े कार्यों की एक असामान्य रूप से विस्तृत श्रृंखला, इस पद्धति के बहुत बड़ी संख्या में वेरिएंट के विकास को निर्धारित करती है। .
किसी भी एलिसा संस्करण में 3 अनिवार्य चरण होते हैं:
1. इसके लिए विशिष्ट एंटीबॉडी द्वारा परीक्षण यौगिक की मान्यता का चरण, जो एक प्रतिरक्षा परिसर के गठन की ओर जाता है;
2. प्रतिरक्षा परिसर या मुक्त बाध्यकारी साइटों के साथ संयुग्म के कनेक्शन के गठन का चरण;
3. एंजाइम लेबल को पंजीकृत सिग्नल में बदलने का चरण।
एलिसा वर्गीकरण।
एलिसा विधियों का वर्गीकरण कई दृष्टिकोणों पर आधारित है:
1. एलिसा के पहले चरण में मौजूद अभिकर्मकों के प्रकार के अनुसार, प्रतिस्पर्धी और गैर-प्रतिस्पर्धी तरीके प्रतिष्ठित हैं।
ए) प्रतिस्पर्धी एलिसा में, पहले चरण में, सिस्टम में विश्लेषण किए गए यौगिक और इसके एनालॉग दोनों होते हैं, जो एंजाइम के साथ लेबल होते हैं और इसके साथ विशिष्ट बाध्यकारी साइटों के लिए प्रतिस्पर्धा करते हैं।
बी) गैर-प्रतिस्पर्धी तरीकों के लिए, केवल विश्लेषण किए गए यौगिक और इसके लिए विशिष्ट बाध्यकारी केंद्रों के पहले चरण में सिस्टम में उपस्थिति विशेषता है।
2. सभी एलिसा विधियों को सजातीय और विषमांगी में विभाजित किया गया है।
यदि एलिसा के सभी तीन चरणों को समाधान में किया जाता है और मुख्य चरणों के बीच अप्रतिबंधित घटकों से गठित प्रतिरक्षा परिसरों को अलग करने के कोई अतिरिक्त चरण नहीं होते हैं, तो विधि सजातीय लोगों के समूह से संबंधित होती है।
सजातीय एलिसा का आधार, जो आमतौर पर कम आणविक भार वाले पदार्थों को निर्धारित करने के लिए उपयोग किया जाता है, एंजाइम गतिविधि का निषेध है जब इसे एंटीजन या एंटीबॉडी के साथ जोड़ा जाता है। एंटीजन-एंटीबॉडी प्रतिक्रिया के परिणामस्वरूप एंजाइम गतिविधि बहाल हो जाती है।
जब एक एंटीबॉडी एक एंजाइम लेबल वाले एंटीजन से बांधता है, तो उच्च आणविक भार सब्सट्रेट के संबंध में एंजाइम गतिविधि 95% तक बाधित होती है, जो एंजाइम के सक्रिय केंद्र से सब्सट्रेट के स्टेरिक बहिष्करण के कारण होती है। जैसे-जैसे एंटीजन की सांद्रता बढ़ती है, अधिक एंटीबॉडी बंधते हैं और अधिक मुक्त एंटीजन-एंजाइम संयुग्म बनाए जाते हैं जो उच्च आणविक भार सब्सट्रेट को हाइड्रोलाइज कर सकते हैं। विश्लेषण बहुत जल्दी किया जाता है, एक निर्धारण के लिए 1 मिनट की आवश्यकता होती है। विधि की संवेदनशीलता काफी अधिक है। इससे आप पिकोमोल के स्तर पर पदार्थ का निर्धारण कर सकते हैं।
विषम तरीकों के लिए, एक ठोस चरण की भागीदारी के साथ दो-चरण प्रणाली में विश्लेषण करना विशिष्ट है - एक वाहक, और अप्रतिबंधित घटकों (धुलाई) से प्रतिरक्षा परिसरों को अलग करने का एक अनिवार्य चरण जो विभिन्न चरणों (गठन) में हैं प्रतिरक्षा परिसरों ठोस चरण पर हैं, और अप्रतिबंधित परिसरों समाधान में हैं)। विषम विधियाँ, जिनमें पहले चरण में प्रतिरक्षा परिसरों का निर्माण ठोस चरण पर होता है, ठोस-चरण विधियाँ कहलाती हैं।
विधियों को सजातीय-विषम के रूप में वर्गीकृत किया जाता है, यदि पहला चरण - विशिष्ट परिसरों का गठन समाधान में होता है, और फिर घटकों को अलग करने के लिए एक स्थिर अभिकर्मक के साथ एक ठोस चरण का उपयोग किया जाता है।
3. परीक्षण पदार्थ के निर्धारण के सिद्धांत के अनुसार:
ए) किसी पदार्थ (एंटीजन या एंटीबॉडी) की एकाग्रता का प्रत्यक्ष निर्धारण इसके साथ बातचीत करने वाले बाध्यकारी केंद्रों की संख्या से होता है। इस मामले में, एंजाइम लेबल परिणामी विशिष्ट एजी-एटी कॉम्प्लेक्स में होगा। विश्लेषण की एकाग्रता पंजीकृत संकेत के सीधे आनुपातिक होगी।
बी) बाध्यकारी साइटों की कुल संख्या और शेष मुक्त बाध्यकारी साइटों के बीच अंतर से किसी पदार्थ की एकाग्रता का निर्धारण। इस मामले में, विश्लेषण की एकाग्रता में वृद्धि होगी, और रिकॉर्ड किए गए सिग्नल में कमी आएगी, इसलिए, इस मामले में, रिकॉर्ड किए गए सिग्नल के परिमाण पर एक व्युत्क्रम निर्भरता है।
एलिसा में प्रयुक्त घटकों के लक्षण।
एंजाइम।
एंजाइम लेबल का एक अत्यंत शक्तिशाली उत्प्रेरक प्रभाव होता है; एक एंजाइम अणु बड़ी संख्या में सब्सट्रेट अणुओं के साथ प्रतिक्रिया कर सकता है। इस प्रकार, नगण्य मात्रा में मौजूद एक एंजाइम का पता लगाया जा सकता है और उत्पादों के निर्माण से इसकी मात्रा निर्धारित की जा सकती है, यह प्रतिक्रिया उत्प्रेरित करती है। एंजाइमों को लेबल के रूप में उपयोग करने का एक अन्य लाभ कई कार्यात्मक समूहों (सल्फ़हाइड्रील, कार्बोक्सिल, टाइराज़िन अवशेष, आदि) के अणु में उपस्थिति के कारण होता है, जिसके माध्यम से लिगैंड अणुओं को सहसंयोजक रूप से जोड़ा जा सकता है।
एलिसा में प्रयुक्त एंजाइमेटिक मार्करों में निम्नलिखित गुण होने चाहिए:
- विश्लेषण की शर्तों के तहत एंजाइम की उच्च गतिविधि और स्थिरता, संशोधन के दौरान और एंटीबॉडी या अन्य प्रोटीन के साथ संयुग्म में;
- संवेदनशील सब्सट्रेट की उपस्थिति और एंजाइमी प्रतिक्रिया के उत्पादों या सबस्ट्रेट्स को निर्धारित करने की विधि की सादगी;
- सब्सट्रेट सिस्टम को और मजबूत करने के लिए अनुकूलन की संभावना;
- अध्ययन किए गए जैविक द्रव में एंजाइम और उसके अवरोधकों की अनुपस्थिति।
एलिसा कम से कम 15 विभिन्न एंजाइमों का उपयोग कर सकती है। उपरोक्त आवश्यकताओं के अनुसार सबसे बड़ा अनुप्रयोग, हॉर्सरैडिश पेरोक्सीडेज (HRP), क्षारीय फॉस्फेट (AP) और β-D-galactosidase (तालिका 1) पाया गया। तीनों स्थिर हैं और अत्यधिक संवेदनशील प्रतिक्रियाओं को उत्प्रेरित करते हैं। इसके अलावा, इन एंजाइमों द्वारा उत्प्रेरित प्रतिक्रियाओं से उत्पन्न उत्पादों, उपयोग किए गए सब्सट्रेट के आधार पर, न केवल वर्णमिति विधियों द्वारा, बल्कि फ्लोरोसेंट विधियों द्वारा भी पता लगाया जा सकता है। अन्य एंजाइमों का उपयोग बहुत कम बार किया जाता है। यह एचआरपी और एपी की तुलना में उनकी कम विशिष्ट गतिविधि द्वारा समझाया गया है।
सबस्ट्रेट्स।
सब्सट्रेट की पसंद मुख्य रूप से एक लेबल के रूप में उपयोग किए जाने वाले एंजाइम द्वारा निर्धारित की जाती है, क्योंकि एंजाइम-सब्सट्रेट प्रतिक्रिया अत्यधिक विशिष्ट है।
सब्सट्रेट के लिए बुनियादी आवश्यकताएं:
- संयुग्म में एंजाइम का पता लगाने में विधि की उच्च संवेदनशीलता सुनिश्चित करना;
- एंजाइम-सब्सट्रेट प्रतिक्रिया के अच्छी तरह से परिभाषित (उदाहरण के लिए, रंगीन) उत्पादों का निर्माण;
- सब्सट्रेट सुरक्षित, सस्ता, सुलभ और उपयोग में सुविधाजनक होना चाहिए।
तालिका एक।
एलिसा में एंजाइम और उनके सबस्ट्रेट्स सबसे व्यापक रूप से उपयोग किए जाते हैं।
| फ़्रीमेंट | प्राप्ति का स्रोत | एम.एम. (केडीए) | सब्सट्रेट (फोटोमेट्री के लिए अनुशंसित तरंग दैर्ध्य, एनएम) | संयुग्मक अभिकर्मक |
| हॉर्सरैडिश peroxidase | हॉर्सरैडिश (आर्मोरेसिया रस्टिकाना) | 40 | ओ-फेनिलेनेडियम डाइहाइड्रोक्लोराइड (ओपीडी, 492 एनएम) 5-एमिनोसैलिसिलिक एसिड (450 एनएम), डायमिनोबेंज़िडाइन, ओ-डायनिसिडाइन। | glutaraldehyde मेटा-पीरियोडेट सोडियम N-succinimidyl-3 (2-pyridyldithio) propionate |
| β-D-galactosidase | ई कोलाई | 540 | O-nitrophenyl-β-D-galactoside (420 एनएम) | मेटा-मेलिमिडोबेंजीन-एन-हाइड्रॉक्सीसुसिनिमाइड एस्टर |
| Alkaline फॉस्फेट | ई. कोलाई, बछड़ा आंतों का म्यूकोसा | 84-150 | पी-नाइट्रोफिनाइल फॉस्फेट (405 एनएम), 5-ब्रोमो-4-क्लोरो-3-इंडोलिल फॉस्फेट | glutaraldehyde |
अधिक बार, क्रोमोजेनिक सब्सट्रेट का उपयोग किया जाता है, जो नष्ट होने पर एक रंगीन पदार्थ बनाते हैं। उच्च-ऊर्जा सबस्ट्रेट्स - फ्लोरोसेंट, केमिलुमिनसेंट का उपयोग वादा कर रहा है। ऐसे सबस्ट्रेट्स का उपयोग सैद्धांतिक रूप से एलिसा की संवेदनशीलता को परिमाण के दो आदेशों से बढ़ाना संभव बनाता है।
एंटीजन और एंटीबॉडी।
एलिसा में प्रयुक्त एजी और एटी अत्यधिक शुद्ध और अत्यधिक सक्रिय होना चाहिए। इसके अलावा, एजी में उच्च प्रतिजनता, इष्टतम घनत्व और प्रतिजनी निर्धारकों की संख्या, विदेशीता और एकरूपता होनी चाहिए। एलिसा में उपयोग किए जाने पर वायरस और बैक्टीरिया के कई सिंथेटिक और पुनः संयोजक एंटीजन ने खुद को अच्छी तरह साबित कर दिया है। इसने क्रॉस-रिएक्शन को कम करके विधि की विशिष्टता और प्रतिलिपि प्रस्तुत करने योग्यता में काफी वृद्धि की।
एलिसा में सबसे महत्वपूर्ण अभिकर्मकों में से एक एंटीबॉडी हैं। एलिसा संवेदनशीलता उपयोग किए गए एंटीबॉडी की एकाग्रता, गतिविधि और विशिष्टता पर निर्भर करती है। उपयोग किए जाने वाले एंटीबॉडी विभिन्न वर्ग (IgG या IgM) और उपवर्ग (IgGl, IgG2), एंटी-एलोटाइपिक या एंटी-इडियोटाइपिक के पॉली- या मोनोक्लिनल हो सकते हैं। कम एटी आत्मीयता पर, एजी-एटी कॉम्प्लेक्स के टूटने से सिस्टम से बाउंड एजी को हटा दिया जाता है। मोनोक्लोनल एंटीबॉडी के उपयोग से विधि की संवेदनशीलता और विशिष्टता को बढ़ाया जाता है। इस मामले में, परीक्षण नमूनों में एजी (एटी) की कम सांद्रता का पता लगाना संभव हो जाता है।
संयुग्म गठन
एक संयुग्म एक एंटीजन या एंटीबॉडी है जिसे एंजाइम लेबल के साथ लेबल किया जाता है। संयुग्म का निर्माण एलिसा के महत्वपूर्ण चरणों में से एक है।
संयुग्म बनाते समय, एंजाइम लेबल को पेश करने के लिए ऐसी इष्टतम विधि का चयन किया जाता है ताकि संयुग्म के दोनों घटक अपनी जैविक गतिविधि को बनाए रखें: एंजाइम - सब्सट्रेट के साथ बातचीत करने की क्षमता, और एंटीजन या एंटीबॉडी - एंटीजेनिटी और एंटीजन-बाइंडिंग गतिविधि, क्रमशः। लेबल किए गए, अत्यधिक शुद्ध प्रतिजन की उपस्थिति प्रतिस्पर्धी तरीकों के उपयोग की अनुमति देती है। इस मामले में, स्थिर एंटीबॉडी के लिए बाध्य नहीं संयुग्म की गतिविधि को अंतिम चरण में मापा जा सकता है, जो धोने की प्रक्रिया से बचा जाता है और विश्लेषण को और अधिक सुविधाजनक बनाता है। हालांकि, एंटीजन अपने भौतिक-रासायनिक गुणों और संरचना में विविध हैं, जिसका अर्थ है कि एंटीजन के साथ संयुग्म प्राप्त करने के लिए सार्वभौमिक तरीकों को विकसित करना असंभव है। इस मामले में, एक एंटीजन-एंजाइम संयुग्म प्राप्त करना एक अलग चुनौती है। एलिसा के लिए लेबल किए गए एंटीबॉडी की तैयारी व्यवस्थित रूप से अधिक सुलभ है।
इम्यूनोकेमिकल सक्रिय प्रोटीन के साथ एक एंजाइम का संयुग्मन विभिन्न तरीकों से किया जाता है: रासायनिक क्रॉस-लिंकिंग, एक एंजाइम अणु के एजी या एटी के लिए सहसंयोजक बंधन, और गैर-सहसंयोजक बंधनों के माध्यम से यौगिकों का निर्माण, उदाहरण के लिए, जब के बीच संबंध एंटीजन-एंटीबॉडी इंटरैक्शन के माध्यम से एंजाइम और एजी या एटी को प्रतिरक्षात्मक रूप से किया जाता है।
संयुग्मों की तैयारी के लिए सबसे व्यापक रूप से इस्तेमाल की जाने वाली सहसंयोजक विधियाँ। बाध्यकारी प्रतिक्रिया की पसंद इन प्रोटीन अणुओं में उपलब्ध कार्यात्मक समूहों के प्रकार से निर्धारित होती है। ग्लूटाराल्डिहाइड, सोडियम पीरियोडेट, आदि का उपयोग अभिकर्मकों के रूप में किया जाता है जो एंजाइम को एंटीजन और एंटीबॉडी अणुओं में पेश करने के लिए उपयोग किया जाता है।
ग्लूटाराल्डिहाइड का उपयोग करके संयुग्म प्राप्त करने के लिए एक-चरण और दो-चरणीय विधियां हैं। कम एंजाइमेटिक गतिविधि (मुक्त एंजाइम का 15 - 60%) के साथ विभिन्न आकारों के संयुग्म बन सकते हैं। परिणामी बड़े आकार के संयुग्म परीक्षण पदार्थ के निर्धारण में बाधा डाल सकते हैं। अपेक्षाकृत कम आणविक भार संयुग्म में एक फैब टुकड़ा और एक एंजाइम अणु होता है।
एक दो-चरण संश्लेषण के परिणामस्वरूप, जिसमें पहले एक क्रॉस-लिंकिंग एजेंट के साथ संशोधित एंजाइम की चरण-दर-चरण तैयारी होती है, इसका अलगाव, और फिर एक एंटीजन (एंटीबॉडी), अणुओं के साथ इसकी बाद की बातचीत होती है। सजातीय संरचना प्रति इम्युनोग्लोबुलिन अणु में 1-2 एंजाइम अणुओं से युक्त होती है और एक उच्च एंजाइमेटिक और प्रतिरक्षाविज्ञानी गतिविधि को बनाए रखती है। हालांकि, बनने वाले ऐसे संयुग्मों की मात्रा कम होती है (हॉर्सरडिश पेरोक्सीडेज के लिए यह 5-10% है)।
सोडियम पीरियडेट के साथ एंजाइम के कार्बोहाइड्रेट घटक के ऑक्सीकरण के आधार पर इम्युनोपरोक्सीडेज संयुग्म प्राप्त करने की विधि (संयुग्म के लिए पेरोक्सीडेज का बंधन एंजाइम की प्रारंभिक मात्रा के 70-90% तक पहुंच जाता है), सबसे बड़ा व्यावहारिक अनुप्रयोग पाया गया है।
एक विश्वसनीय संयुग्म में निम्नलिखित गुण होने चाहिए:
उच्च प्रतिरक्षी बाघ और प्रतिजन के लिए उच्च आत्मीयता ताकि इसे उच्च तनुकरण में उपयोग किया जा सके और इस प्रकार गैर-विशिष्ट बंधन को कम किया जा सके;
कार्य प्रजनन में पर्याप्त विशिष्टता;
बहुलक वाले पर मोनोमेरिक रूपों की प्रबलता, क्योंकि बहुलक रूप गैर-विशेष रूप से प्लास्टिक का पालन करते हैं, जिसके परिणामस्वरूप उच्च पृष्ठभूमि स्तर की प्रतिक्रिया होती है;
एंजाइम और एंटीबॉडी के बीच इष्टतम दाढ़ अनुपात (इष्टतम अनुपात लगभग 1:1 है);
संयुग्म की पर्याप्त एंजाइमेटिक गतिविधि। यह गुण मुख्य रूप से संयुग्मन की स्थितियों और संयुग्म में एंजाइम और एंटीबॉडी अणुओं के अनुपात से निर्धारित होता है।
सॉलिड फ़ेज़
एलिसा के ठोस चरण के रूप में विभिन्न सामग्रियों का उपयोग किया जा सकता है: पॉलीस्टाइनिन, पॉलीविनाइल क्लोराइड, पॉलीप्रोपाइलीन और अन्य पदार्थ। ठोस चरण एक टेस्ट ट्यूब, 96-वेल और अन्य प्लेट्स, बॉल्स, बीड्स, साथ ही नाइट्रोसेल्यूलोज और अन्य झिल्ली की दीवारें हो सकती हैं जो सक्रिय रूप से प्रोटीन को अवशोषित करती हैं।
ठोस चरण पर प्रतिजन या एंटीबॉडी का स्थिरीकरण तीन तरीकों से संभव है:
- प्रोटीन और सिंथेटिक सतह के बीच मजबूत हाइड्रोफोबिक इंटरैक्शन के आधार पर निष्क्रिय सोखना;
- ठोस चरण के लिए सहसंयोजक लगाव;
- इम्यूनोकेमिकल, आदि (गैर-सहसंयोजक और गैर-सोखना लगाव)।
नाइट्रोसेल्यूलोज झिल्ली पर अनुमापन बोर्डों पर एलिसा का संचालन करते समय प्रोटीन के निष्क्रिय सोखना का व्यापक रूप से उपयोग किया जाता है। निष्क्रिय सोखना संतृप्ति के सिद्धांत का पालन करता है और सोखने वाले पदार्थ के आणविक भार के साथ संबंध रखता है। विभिन्न प्रकार की झिल्लियों (नाइट्रोसेल्यूलोज, नायलॉन, आदि) की सोखने की सतह प्लास्टिक की तुलना में 100-1000 गुना अधिक होती है।
पॉलीसेकेराइड और अत्यधिक ग्लाइकोसिलेटेड प्रोटीन में अक्सर पॉलीस्टाइनिन के लिए कम आत्मीयता होती है। उन्हें स्थिर करने के लिए अन्य तरीकों की आवश्यकता होती है, जैसे ग्लूटाराल्डिहाइड के साथ सहसंयोजक लगाव। सहसंयोजक लगाव प्रभावी होता है यदि हाइड्रोफिलिक मोतियों (एग्रोसे) और पॉलीस्टाइन मोतियों को ठोस चरण के रूप में उपयोग किया जाता है।
इम्यूनोकेमिकल विधियां एंटीजन या एंटीबॉडी को स्थिर करने के लिए पूर्व-सोखने वाले "ट्रैप" एंटीबॉडी के उपयोग पर आधारित होती हैं। प्रतिरक्षात्मक रूप से स्थिर प्रतिजन निष्क्रिय रूप से अधिशोषित प्रतिजन की तुलना में 10 गुना अधिक सक्रिय होता है। बैक्टीरिया के लेक्टिन या इम्युनोग्लोबुलिन-बाध्यकारी प्रोटीन का उपयोग किया जा सकता है जो प्लास्टिक या अन्य हाइड्रोफोबिक सतहों पर आसानी से सोख लिए जाते हैं, जैसे कि कॉनकैनावेलिन ए (कॉन ए) या स्टेफिलोकोकल प्रोटीन ए। कॉन ए एचआईवी वायरस के जीपी 120 प्रोटीन को स्थिर करने में सक्षम है।
ठोस चरण की सतह पर मुक्त साइटें जो सॉर्बेड एजेंट से बंधे नहीं हैं, परीक्षण के दौरान अन्य अणुओं को ठीक कर सकती हैं, जिनमें संयुग्म शामिल हैं, जिससे पृष्ठभूमि संकेत में वृद्धि होती है। आधार सामग्री के ठोस चरण पर स्थिरीकरण के बाद गैर-विशिष्ट बंधन को रोकने के लिए, परीक्षण के लिए तटस्थ पदार्थों के साथ उपचार किया जाता है। सबसे लोकप्रिय अवरोधक एजेंट गोजातीय सीरम एल्ब्यूमिन (बीएसए), कैसिइन, आदि हैं। अवरोधक एजेंट की पसंद और इस चरण के लिए शर्तें ठोस चरण के प्रकार, सिस्टम की संवेदनशीलता पर निर्भर करती हैं।
एलिसा मंचन विकल्प।
वर्तमान में, एलिसा की विभिन्न किस्मों और संशोधनों की एक बड़ी संख्या का उपयोग किया जाता है। एंजाइम-लिंक्ड इम्युनोसॉरबेंट परख (एलिसा) के विभिन्न प्रकार व्यापक हो गए हैं।
ठोस चरण एलिसा 1971 में प्रस्तावित किया गया था। ठोस-चरण एलिसा के मूल सिद्धांत, संशोधन की परवाह किए बिना, इस प्रकार हैं:
पर जीर्ण रूपप्रक्रिया, क्योंकि तीव्र रूप यह कार्यविधिसंबंधित विभागों में संक्रमण फैलाने में योगदान दे सकता है मूत्र तंत्र. प्रयोगशाला निदान के तरीके गोनोकोकल संक्रमण: · सूक्ष्म (बैक्टीरियोस्कोपिक), · सांस्कृतिक (बैक्टीरियोलॉजिकल)। आणविक जैविक। 2.3.1 सूक्ष्म परीक्षा विधियाँ यदि...


यह भुला दिया जाता है कि एफ्लाटॉक्सिन और अन्य विषाक्त पदार्थों का निर्धारण निष्कर्षण द्वारा उनके अलगाव से पहले किया जाना चाहिए। यह आवश्यकता इम्युनोसे और अधिक शास्त्रीय विश्लेषणात्मक विधियों जैसे पतली परत क्रोमैटोग्राफी और उच्च प्रदर्शन तरल क्रोमैटोग्राफी दोनों के लिए सही है। विश्लेषण के निष्कर्षण संचालन की आवश्यकता एक उपयुक्त के विकास को जटिल बनाती है ...
और इसी के रोगज़नक़ के साथ शरीर की बातचीत स्पर्शसंचारी बिमारियों. इसके अलावा, इसी तरह के कई रोग नैदानिक तस्वीर(जैसे रिकेट्सियोसिस, एंटरोवायरल संक्रमण) केवल सीरोलॉजिकल रूप से विभेदित किया जा सकता है, जो संक्रामक रोगों के निदान में सीरोलॉजिकल तरीकों के महत्व को दर्शाता है। 3.6 सीरोलॉजिकल प्रतिक्रियाएं सीरोलॉजिकल प्रतिक्रियाओं में निर्दिष्ट हैं ...
एचआईवी संक्रमण और एड्स का पता केवल रोगी के शरीर में रोगज़नक़ की पहचान करके ही लगाया जा सकता है। हालांकि, ऐसा करना काफी मुश्किल है। एड्स के निदान के लिए एक अधिक सामान्य विधि विभिन्न प्रतिरक्षाविज्ञानी प्रतिक्रियाओं (एंजाइम इम्यूनोएसे, फ्लोरोसेंट एंटीबॉडी विधि, लेटेक्स एग्लूटिनेशन टेस्ट, इम्युनोब्लॉटिंग) का उपयोग करके विशिष्ट एंटीवायरल एंटीबॉडी का पता लगाने पर आधारित है। ...
एंजाइम इम्युनोसे के सिद्धांत, मुख्य प्रकार के एलिसा, निदान में आवेदन
एंजाइम इम्युनोसे के सिद्धांत, मुख्य प्रकार के एलिसा, निदान में आवेदन
क्लिनिकल प्रयोगशाला निदान विभाग के समोइलिकोव पावेल व्लादिमीरोविच इंटर्न
रूसी राज्य चिकित्सा विश्वविद्यालय
परिचय।
चिकित्सा पद्धति में इम्यूनोसे के तरीकों का व्यापक रूप से उपयोग किया जाता है। आधुनिक चिकित्सा के सभी क्षेत्रों में, इम्यूनोसे का उपयोग मुख्य रूप से नैदानिक और विश्लेषणात्मक उद्देश्यों के लिए किया जाता है। यह विशेष रूप से महत्वपूर्ण है कि वे कम और बहुत कम सांद्रता पर जैविक घटकों (हार्मोन, एंजाइम, न्यूरोपैप्टाइड्स, प्रतिरक्षा प्रणाली उत्पाद, एंटीजन, आदि) की पहचान करना संभव बनाते हैं। इन विधियों द्वारा सभी उत्पादों का पता लगाया जाता है जिनके खिलाफ एंटीबॉडी प्राप्त करना संभव है।
प्रतिरक्षा विश्लेषण एक घटक (एंजाइम, रेडियोन्यूक्लाइड, फ्लोरोसेंट डाई, और अन्य) में से एक के लिए विभिन्न लेबलिंग विकल्पों का उपयोग करके एक एंटीजन (एजी) और एक एंटीबॉडी (एटी) की बातचीत पर आधारित है। प्रतिक्रिया का मूल्यांकन विशेष उपकरणों पर स्वचालित रूप से किया जाता है, जिससे इन विधियों को मानकीकृत करना संभव हो जाता है।
उपयोग किए गए लेबल के प्रकार और परीक्षण की स्थापना के लिए शर्तों के आधार पर, इम्यूनोसे को एंजाइम इम्यूनोसे (एलिसा), रेडियोइम्यूनोसे (आरआईए), इम्यूनोफ्लोरेसेंट और अन्य के रूप में जाना जाता है। जब प्रतिक्रियाओं का मंचन एक या अधिक चरणों में किया जाता है, तो उन्हें प्रत्यक्ष या अप्रत्यक्ष रूप से नामित किया जाता है। जिस माध्यम में प्रतिक्रिया की जाती है वह मायने रखता है। यदि प्रतिक्रिया सतह पर तय किए गए अभिकर्मकों के साथ की जाती है, तो परीक्षण को ठोस चरण परीक्षण के रूप में नामित किया जाता है, उदाहरण के लिए, एलिसा (एंजाइम लिंक्ड इम्यूनोसॉर्बेंट परख)।
इस पत्र में, केवल एंजाइम इम्युनोसे पर विचार किया जाएगा - जीव विज्ञान और चिकित्सा में व्यापक रूप से उपयोग की जाने वाली एक विधि, व्यावहारिक और मौलिक दोनों।
लिंक्ड इम्युनोसॉरबेंट परख।
एलिसा 60 के दशक के मध्य में प्रकट हुआ और मूल रूप से एक हिस्टोलॉजिकल तैयारी में एक एंटीजन की पहचान करने के लिए एक विधि के रूप में विकसित किया गया था, साथ ही एक इम्यूनोडिफ्यूजन परीक्षण और इम्यूनोइलेक्ट्रोफोरेसिस में वर्षा लाइनों की कल्पना करने के लिए, और फिर एंटीजन के मात्रात्मक निर्धारण के लिए उपयोग किया जाने लगा और जैविक तरल पदार्थों में एंटीबॉडी। E. Engvall और R. Pelman ने विधि के विकास में भाग लिया, साथ ही, उनमें से स्वतंत्र रूप से, W. Van Veeman और R. Schurs ने भाग लिया।
चित्रा 1. एलिसा का मूल सिद्धांत।
1) एंटीजन का पता लगाने के लिए। 2) एंटीबॉडी का पता लगाने के लिए।
विधि प्रतिजन के प्रति एंटीबॉडी के विशिष्ट बंधन पर आधारित है, जबकि घटकों में से एक एंजाइम के साथ संयुग्मित होता है; संबंधित क्रोमोजेनिक सब्सट्रेट के साथ प्रतिक्रिया के परिणामस्वरूप, एक रंगीन उत्पाद बनता है, जिसकी मात्रा हो सकती है स्पेक्ट्रोफोटोमेट्रिक रूप से निर्धारित (चित्र। 1)।
अपनी बाध्यकारी गतिविधि को बनाए रखते हुए विभिन्न वाहकों पर एंटीजन और एंटीबॉडी स्थिरीकरण की संभावना की खोज ने जीव विज्ञान और चिकित्सा के विभिन्न क्षेत्रों में एलिसा के उपयोग का विस्तार करना संभव बना दिया है।
मोनोक्लोनल एंटीबॉडी की उपस्थिति ने एलिसा के एक और विकास के रूप में कार्य किया, जिससे इसकी संवेदनशीलता, विशिष्टता और परिणामों की पुनरुत्पादकता को बढ़ाना संभव हो गया।
सैद्धांतिक रूप से, एलिसा आधुनिक इम्यूनोकेमिस्ट्री और रासायनिक एंजाइमोलॉजी के डेटा पर आधारित है, एंटीजन-एंटीबॉडी प्रतिक्रिया के भौतिक-रासायनिक कानूनों के ज्ञान के साथ-साथ विश्लेषणात्मक रसायन विज्ञान के मुख्य सिद्धांतों पर आधारित है। एलिसा की संवेदनशीलता और इसकी अवधि कई मुख्य कारकों द्वारा निर्धारित की जाती है: एंटीजन-एंटीबॉडी प्रतिक्रिया की गतिज और थर्मोडायनामिक विशेषताएं, अभिकर्मकों का अनुपात, एंजाइम गतिविधि और इसके पता लगाने के तरीकों का संकल्प। सामान्य तौर पर, प्रतिजन-एंटीबॉडी प्रतिक्रिया को एक सरल योजना द्वारा वर्णित किया जा सकता है:
+[एजी]↔[एटीएजी]
कम आणविक भार यौगिकों से लेकर वायरस और बैक्टीरिया तक अध्ययन की वस्तुओं की विविधता, साथ ही एलिसा के उपयोग के लिए विभिन्न स्थितियों से जुड़े कार्यों की एक असामान्य रूप से विस्तृत श्रृंखला, इस पद्धति के बहुत बड़ी संख्या में वेरिएंट के विकास को निर्धारित करती है। .
किसी भी एलिसा संस्करण में 3 अनिवार्य चरण होते हैं:
1. इसके लिए विशिष्ट एंटीबॉडी द्वारा परीक्षण यौगिक की मान्यता का चरण, जो एक प्रतिरक्षा परिसर के गठन की ओर जाता है;
2. प्रतिरक्षा परिसर या मुक्त बाध्यकारी साइटों के साथ संयुग्म के कनेक्शन के गठन का चरण;
3. एंजाइम लेबल को पंजीकृत सिग्नल में बदलने का चरण।
एलिसा वर्गीकरण।
एलिसा विधियों का वर्गीकरण कई दृष्टिकोणों पर आधारित है:
1. एलिसा के पहले चरण में मौजूद अभिकर्मकों के प्रकार के अनुसार, प्रतिस्पर्धी और गैर-प्रतिस्पर्धी तरीके प्रतिष्ठित हैं।
ए) प्रतिस्पर्धी एलिसा में, पहले चरण में, सिस्टम में विश्लेषण किए गए यौगिक और इसके एनालॉग दोनों होते हैं, जो एंजाइम के साथ लेबल होते हैं और इसके साथ विशिष्ट बाध्यकारी साइटों के लिए प्रतिस्पर्धा करते हैं।
बी) गैर-प्रतिस्पर्धी तरीकों के लिए, केवल विश्लेषण किए गए यौगिक और इसके लिए विशिष्ट बाध्यकारी केंद्रों के पहले चरण में सिस्टम में उपस्थिति विशेषता है।
2. सभी एलिसा विधियों को सजातीय और विषमांगी में विभाजित किया गया है।
यदि एलिसा के सभी तीन चरणों को समाधान में किया जाता है और मुख्य चरणों के बीच अप्रतिबंधित घटकों से गठित प्रतिरक्षा परिसरों को अलग करने के कोई अतिरिक्त चरण नहीं होते हैं, तो विधि सजातीय लोगों के समूह से संबंधित होती है।
सजातीय एलिसा का आधार, जो आमतौर पर कम आणविक भार वाले पदार्थों को निर्धारित करने के लिए उपयोग किया जाता है, एंजाइम गतिविधि का निषेध है जब इसे एंटीजन या एंटीबॉडी के साथ जोड़ा जाता है। एंटीजन-एंटीबॉडी प्रतिक्रिया के परिणामस्वरूप एंजाइम गतिविधि बहाल हो जाती है।
जब एक एंटीबॉडी एक एंजाइम लेबल वाले एंटीजन से बांधता है, तो उच्च आणविक भार सब्सट्रेट के संबंध में एंजाइम गतिविधि 95% तक बाधित होती है, जो एंजाइम के सक्रिय केंद्र से सब्सट्रेट के स्टेरिक बहिष्करण के कारण होती है। जैसे-जैसे एंटीजन की सांद्रता बढ़ती है, अधिक एंटीबॉडी बंधते हैं और अधिक मुक्त एंटीजन-एंजाइम संयुग्म बनाए जाते हैं जो उच्च आणविक भार सब्सट्रेट को हाइड्रोलाइज कर सकते हैं। विश्लेषण बहुत जल्दी किया जाता है, एक निर्धारण के लिए 1 मिनट की आवश्यकता होती है। विधि की संवेदनशीलता काफी अधिक है। इससे आप पिकोमोल के स्तर पर पदार्थ का निर्धारण कर सकते हैं।
विषम तरीकों के लिए, एक ठोस चरण की भागीदारी के साथ दो-चरण प्रणाली में विश्लेषण करना विशिष्ट है - एक वाहक, और अप्रतिबंधित घटकों (धुलाई) से प्रतिरक्षा परिसरों को अलग करने का एक अनिवार्य चरण जो विभिन्न चरणों (गठन) में हैं प्रतिरक्षा परिसरों ठोस चरण पर हैं, और अप्रतिबंधित परिसरों समाधान में हैं)। विषम विधियाँ, जिनमें पहले चरण में प्रतिरक्षा परिसरों का निर्माण ठोस चरण पर होता है, ठोस-चरण विधियाँ कहलाती हैं।
विधियों को सजातीय-विषम के रूप में वर्गीकृत किया जाता है, यदि पहला चरण - विशिष्ट परिसरों का गठन समाधान में होता है, और फिर घटकों को अलग करने के लिए एक स्थिर अभिकर्मक के साथ एक ठोस चरण का उपयोग किया जाता है।
3. परीक्षण पदार्थ के निर्धारण के सिद्धांत के अनुसार:
ए) किसी पदार्थ (एंटीजन या एंटीबॉडी) की एकाग्रता का प्रत्यक्ष निर्धारण इसके साथ बातचीत करने वाले बाध्यकारी केंद्रों की संख्या से होता है। इस मामले में, एंजाइम लेबल परिणामी विशिष्ट एजी-एटी कॉम्प्लेक्स में होगा। विश्लेषण की एकाग्रता पंजीकृत संकेत के सीधे आनुपातिक होगी।
बी) बाध्यकारी साइटों की कुल संख्या और शेष मुक्त बाध्यकारी साइटों के बीच अंतर से किसी पदार्थ की एकाग्रता का निर्धारण। इस मामले में, विश्लेषण की एकाग्रता में वृद्धि होगी, और रिकॉर्ड किए गए सिग्नल में कमी आएगी, इसलिए, इस मामले में, रिकॉर्ड किए गए सिग्नल के परिमाण पर एक व्युत्क्रम निर्भरता है।
एलिसा में प्रयुक्त घटकों के लक्षण।
एंजाइम।
एंजाइम लेबल का एक अत्यंत शक्तिशाली उत्प्रेरक प्रभाव होता है; एक एंजाइम अणु बड़ी संख्या में सब्सट्रेट अणुओं के साथ प्रतिक्रिया कर सकता है। इस प्रकार, नगण्य मात्रा में मौजूद एक एंजाइम का पता लगाया जा सकता है और उत्पादों के निर्माण से इसकी मात्रा निर्धारित की जा सकती है, यह प्रतिक्रिया उत्प्रेरित करती है। एंजाइमों को लेबल के रूप में उपयोग करने का एक अन्य लाभ कई कार्यात्मक समूहों (सल्फ़हाइड्रील, कार्बोक्सिल, टाइराज़िन अवशेष, आदि) के अणु में उपस्थिति के कारण होता है, जिसके माध्यम से लिगैंड अणुओं को सहसंयोजक रूप से जोड़ा जा सकता है।
एलिसा में प्रयुक्त एंजाइमेटिक मार्करों में निम्नलिखित गुण होने चाहिए:
- विश्लेषण की शर्तों के तहत एंजाइम की उच्च गतिविधि और स्थिरता, संशोधन के दौरान और एंटीबॉडी या अन्य प्रोटीन के साथ संयुग्म में;
- संवेदनशील सब्सट्रेट की उपस्थिति और एंजाइमी प्रतिक्रिया के उत्पादों या सबस्ट्रेट्स को निर्धारित करने की विधि की सादगी;
- सब्सट्रेट सिस्टम को और मजबूत करने के लिए अनुकूलन की संभावना;
- अध्ययन किए गए जैविक द्रव में एंजाइम और उसके अवरोधकों की अनुपस्थिति।
एलिसा कम से कम 15 विभिन्न एंजाइमों का उपयोग कर सकती है। उपरोक्त आवश्यकताओं के अनुसार सबसे बड़ा अनुप्रयोग, हॉर्सरैडिश पेरोक्सीडेज (HRP), क्षारीय फॉस्फेट (AP) और β-D-galactosidase (तालिका 1) पाया गया। तीनों स्थिर हैं और अत्यधिक संवेदनशील प्रतिक्रियाओं को उत्प्रेरित करते हैं। इसके अलावा, इन एंजाइमों द्वारा उत्प्रेरित प्रतिक्रियाओं से उत्पन्न उत्पादों, उपयोग किए गए सब्सट्रेट के आधार पर, न केवल वर्णमिति विधियों द्वारा, बल्कि फ्लोरोसेंट विधियों द्वारा भी पता लगाया जा सकता है। अन्य एंजाइमों का उपयोग बहुत कम बार किया जाता है। यह एचआरपी और एपी की तुलना में उनकी कम विशिष्ट गतिविधि द्वारा समझाया गया है।
सबस्ट्रेट्स।
सब्सट्रेट की पसंद मुख्य रूप से एक लेबल के रूप में उपयोग किए जाने वाले एंजाइम द्वारा निर्धारित की जाती है, क्योंकि एंजाइम-सब्सट्रेट प्रतिक्रिया अत्यधिक विशिष्ट है।
सब्सट्रेट के लिए बुनियादी आवश्यकताएं:
- संयुग्म में एंजाइम का पता लगाने में विधि की उच्च संवेदनशीलता सुनिश्चित करना;
- एंजाइम-सब्सट्रेट प्रतिक्रिया के अच्छी तरह से परिभाषित (उदाहरण के लिए, रंगीन) उत्पादों का निर्माण;
- सब्सट्रेट सुरक्षित, सस्ता, सुलभ और उपयोग में सुविधाजनक होना चाहिए।
तालिका एक।
एलिसा में एंजाइम और उनके सबस्ट्रेट्स सबसे व्यापक रूप से उपयोग किए जाते हैं।
| फ़्रीमेंट | प्राप्ति का स्रोत | एम.एम. (केडीए) | सब्सट्रेट (फोटोमेट्री के लिए अनुशंसित तरंग दैर्ध्य, एनएम) | संयुग्मक अभिकर्मक |
| हॉर्सरैडिश peroxidase | हॉर्सरैडिश (आर्मोरेसिया रस्टिकाना) | 40 |
ओ-फेनिलेनेडियम डाइहाइड्रोक्लोराइड (ओपीडी, 492 एनएम) 5-एमिनोसैलिसिलिक एसिड (450 एनएम), डायमिनोबेंज़िडाइन, ओ-डायनिसिडाइन। |
glutaraldehyde मेटा-पीरियोडेट सोडियम N-succinimidyl-3 (2-pyridyldithio) propionate |
| β-D-galactosidase | ई कोलाई | 540 | O-nitrophenyl-β-D-galactoside (420 एनएम) | मेटा-मेलिमिडोबेंजीन-एन-हाइड्रॉक्सीसुसिनिमाइड एस्टर |
| Alkaline फॉस्फेट | ई. कोलाई, बछड़ा आंतों का म्यूकोसा | 84-150 | पी-नाइट्रोफिनाइल फॉस्फेट (405 एनएम), 5-ब्रोमो-4-क्लोरो-3-इंडोलिल फॉस्फेट | glutaraldehyde |
अधिक बार, क्रोमोजेनिक सब्सट्रेट का उपयोग किया जाता है, जो नष्ट होने पर एक रंगीन पदार्थ बनाते हैं। उच्च-ऊर्जा सबस्ट्रेट्स - फ्लोरोसेंट, केमिलुमिनसेंट का उपयोग वादा कर रहा है। ऐसे सबस्ट्रेट्स का उपयोग सैद्धांतिक रूप से एलिसा की संवेदनशीलता को परिमाण के दो आदेशों से बढ़ाना संभव बनाता है।
एंटीजन और एंटीबॉडी।
एलिसा में प्रयुक्त एजी और एटी अत्यधिक शुद्ध और अत्यधिक सक्रिय होना चाहिए। इसके अलावा, एजी में उच्च प्रतिजनता, इष्टतम घनत्व और प्रतिजनी निर्धारकों की संख्या, विदेशीता और एकरूपता होनी चाहिए। एलिसा में उपयोग किए जाने पर वायरस और बैक्टीरिया के कई सिंथेटिक और पुनः संयोजक एंटीजन ने खुद को अच्छी तरह साबित कर दिया है। इसने क्रॉस-रिएक्शन को कम करके विधि की विशिष्टता और प्रतिलिपि प्रस्तुत करने योग्यता में काफी वृद्धि की।
एलिसा में सबसे महत्वपूर्ण अभिकर्मकों में से एक एंटीबॉडी हैं। एलिसा संवेदनशीलता उपयोग किए गए एंटीबॉडी की एकाग्रता, गतिविधि और विशिष्टता पर निर्भर करती है। उपयोग किए जाने वाले एंटीबॉडी विभिन्न वर्ग (IgG या IgM) और उपवर्ग (IgGl, IgG2), एंटी-एलोटाइपिक या एंटी-इडियोटाइपिक के पॉली- या मोनोक्लिनल हो सकते हैं। कम एटी आत्मीयता पर, एजी-एटी कॉम्प्लेक्स के टूटने से सिस्टम से बाउंड एजी को हटा दिया जाता है। मोनोक्लोनल एंटीबॉडी के उपयोग से विधि की संवेदनशीलता और विशिष्टता को बढ़ाया जाता है। इस मामले में, परीक्षण नमूनों में एजी (एटी) की कम सांद्रता का पता लगाना संभव हो जाता है।
संयुग्म गठन
एक संयुग्म एक एंटीजन या एंटीबॉडी है जिसे एंजाइम लेबल के साथ लेबल किया जाता है। संयुग्म का निर्माण एलिसा के महत्वपूर्ण चरणों में से एक है।
संयुग्म बनाते समय, एंजाइम लेबल को पेश करने के लिए ऐसी इष्टतम विधि का चयन किया जाता है ताकि संयुग्म के दोनों घटक अपनी जैविक गतिविधि को बनाए रखें: एंजाइम - सब्सट्रेट के साथ बातचीत करने की क्षमता, और एंटीजन या एंटीबॉडी - एंटीजेनिटी और एंटीजन-बाइंडिंग गतिविधि, क्रमशः। लेबल किए गए, अत्यधिक शुद्ध प्रतिजन की उपस्थिति प्रतिस्पर्धी तरीकों के उपयोग की अनुमति देती है। इस मामले में, स्थिर एंटीबॉडी के लिए बाध्य नहीं संयुग्म की गतिविधि को अंतिम चरण में मापा जा सकता है, जो धोने की प्रक्रिया से बचा जाता है और विश्लेषण को और अधिक सुविधाजनक बनाता है। हालांकि, एंटीजन अपने भौतिक-रासायनिक गुणों और संरचना में विविध हैं, जिसका अर्थ है कि एंटीजन के साथ संयुग्म प्राप्त करने के लिए सार्वभौमिक तरीकों को विकसित करना असंभव है। इस मामले में, एक एंटीजन-एंजाइम संयुग्म प्राप्त करना एक अलग चुनौती है। एलिसा के लिए लेबल किए गए एंटीबॉडी की तैयारी व्यवस्थित रूप से अधिक सुलभ है।
इम्यूनोकेमिकल सक्रिय प्रोटीन के साथ एक एंजाइम का संयुग्मन विभिन्न तरीकों से किया जाता है: रासायनिक क्रॉस-लिंकिंग, एक एंजाइम अणु के एजी या एटी के लिए सहसंयोजक बंधन, और गैर-सहसंयोजक बंधनों के माध्यम से यौगिकों का निर्माण, उदाहरण के लिए, जब के बीच संबंध एंटीजन-एंटीबॉडी इंटरैक्शन के माध्यम से एंजाइम और एजी या एटी को प्रतिरक्षात्मक रूप से किया जाता है।
संयुग्मों की तैयारी के लिए सबसे व्यापक रूप से इस्तेमाल की जाने वाली सहसंयोजक विधियाँ। बाध्यकारी प्रतिक्रिया की पसंद इन प्रोटीन अणुओं में उपलब्ध कार्यात्मक समूहों के प्रकार से निर्धारित होती है। ग्लूटाराल्डिहाइड, सोडियम पीरियोडेट, आदि का उपयोग अभिकर्मकों के रूप में किया जाता है जो एंजाइम को एंटीजन और एंटीबॉडी अणुओं में पेश करने के लिए उपयोग किया जाता है।
ग्लूटाराल्डिहाइड का उपयोग करके संयुग्म प्राप्त करने के लिए एक-चरण और दो-चरणीय विधियां हैं। कम एंजाइमेटिक गतिविधि (मुक्त एंजाइम का 15 - 60%) के साथ विभिन्न आकारों के संयुग्म बन सकते हैं। परिणामी बड़े आकार के संयुग्म परीक्षण पदार्थ के निर्धारण में बाधा डाल सकते हैं। अपेक्षाकृत कम आणविक भार संयुग्म में एक फैब टुकड़ा और एक एंजाइम अणु होता है।
एक दो-चरण संश्लेषण के परिणामस्वरूप, जिसमें पहले एक क्रॉस-लिंकिंग एजेंट के साथ संशोधित एंजाइम की चरण-दर-चरण तैयारी होती है, इसका अलगाव, और फिर एक एंटीजन (एंटीबॉडी), अणुओं के साथ इसकी बाद की बातचीत होती है। सजातीय संरचना प्रति इम्युनोग्लोबुलिन अणु में 1-2 एंजाइम अणुओं से युक्त होती है और एक उच्च एंजाइमेटिक और प्रतिरक्षाविज्ञानी गतिविधि को बनाए रखती है। हालांकि, बनने वाले ऐसे संयुग्मों की मात्रा कम होती है (हॉर्सरडिश पेरोक्सीडेज के लिए यह 5-10% है)।
सोडियम पीरियडेट के साथ एंजाइम के कार्बोहाइड्रेट घटक के ऑक्सीकरण के आधार पर इम्युनोपरोक्सीडेज संयुग्म प्राप्त करने की विधि (संयुग्म के लिए पेरोक्सीडेज का बंधन एंजाइम की प्रारंभिक मात्रा के 70-90% तक पहुंच जाता है), सबसे बड़ा व्यावहारिक अनुप्रयोग पाया गया है।
एक विश्वसनीय संयुग्म में निम्नलिखित गुण होने चाहिए:
उच्च प्रतिरक्षी बाघ और प्रतिजन के लिए उच्च आत्मीयता ताकि इसे उच्च तनुकरण में उपयोग किया जा सके और इस प्रकार गैर-विशिष्ट बंधन को कम किया जा सके;
कार्य प्रजनन में पर्याप्त विशिष्टता;
बहुलक वाले पर मोनोमेरिक रूपों की प्रबलता, क्योंकि बहुलक रूप गैर-विशेष रूप से प्लास्टिक का पालन करते हैं, जिसके परिणामस्वरूप उच्च पृष्ठभूमि स्तर की प्रतिक्रिया होती है;
एंजाइम और एंटीबॉडी के बीच इष्टतम दाढ़ अनुपात (इष्टतम अनुपात लगभग 1:1 है);
संयुग्म की पर्याप्त एंजाइमेटिक गतिविधि। यह गुण मुख्य रूप से संयुग्मन की स्थितियों और संयुग्म में एंजाइम और एंटीबॉडी अणुओं के अनुपात से निर्धारित होता है।
सॉलिड फ़ेज़
एलिसा के ठोस चरण के रूप में विभिन्न सामग्रियों का उपयोग किया जा सकता है: पॉलीस्टाइनिन, पॉलीविनाइल क्लोराइड, पॉलीप्रोपाइलीन और अन्य पदार्थ। ठोस चरण एक टेस्ट ट्यूब, 96-वेल और अन्य प्लेट्स, बॉल्स, बीड्स, साथ ही नाइट्रोसेल्यूलोज और अन्य झिल्ली की दीवारें हो सकती हैं जो सक्रिय रूप से प्रोटीन को अवशोषित करती हैं।
ठोस चरण पर प्रतिजन या एंटीबॉडी का स्थिरीकरण तीन तरीकों से संभव है:
- प्रोटीन और सिंथेटिक सतह के बीच मजबूत हाइड्रोफोबिक इंटरैक्शन के आधार पर निष्क्रिय सोखना;
- ठोस चरण के लिए सहसंयोजक लगाव;
- इम्यूनोकेमिकल, आदि (गैर-सहसंयोजक और गैर-सोखना लगाव)।
नाइट्रोसेल्यूलोज झिल्ली पर अनुमापन बोर्डों पर एलिसा का संचालन करते समय प्रोटीन के निष्क्रिय सोखना का व्यापक रूप से उपयोग किया जाता है। निष्क्रिय सोखना संतृप्ति के सिद्धांत का पालन करता है और सोखने वाले पदार्थ के आणविक भार के साथ संबंध रखता है। विभिन्न प्रकार की झिल्लियों (नाइट्रोसेल्यूलोज, नायलॉन, आदि) की सोखने की सतह प्लास्टिक की तुलना में 100-1000 गुना अधिक होती है।
पॉलीसेकेराइड और अत्यधिक ग्लाइकोसिलेटेड प्रोटीन में अक्सर पॉलीस्टाइनिन के लिए कम आत्मीयता होती है। उन्हें स्थिर करने के लिए अन्य तरीकों की आवश्यकता होती है, जैसे ग्लूटाराल्डिहाइड के साथ सहसंयोजक लगाव। सहसंयोजक लगाव प्रभावी होता है यदि हाइड्रोफिलिक मोतियों (एग्रोसे) और पॉलीस्टाइन मोतियों को ठोस चरण के रूप में उपयोग किया जाता है।
इम्यूनोकेमिकल विधियां एंटीजन या एंटीबॉडी को स्थिर करने के लिए पूर्व-सोखने वाले "ट्रैप" एंटीबॉडी के उपयोग पर आधारित होती हैं। प्रतिरक्षात्मक रूप से स्थिर प्रतिजन निष्क्रिय रूप से अधिशोषित प्रतिजन की तुलना में 10 गुना अधिक सक्रिय होता है। बैक्टीरिया के लेक्टिन या इम्युनोग्लोबुलिन-बाध्यकारी प्रोटीन का उपयोग किया जा सकता है जो प्लास्टिक या अन्य हाइड्रोफोबिक सतहों पर आसानी से सोख लिए जाते हैं, जैसे कि कॉनकैनावेलिन ए (कॉन ए) या स्टेफिलोकोकल प्रोटीन ए। कॉन ए एचआईवी वायरस के जीपी 120 प्रोटीन को स्थिर करने में सक्षम है।
ठोस चरण की सतह पर मुक्त साइटें जो सॉर्बेड एजेंट से बंधे नहीं हैं, परीक्षण के दौरान अन्य अणुओं को ठीक कर सकती हैं, जिनमें संयुग्म शामिल हैं, जिससे पृष्ठभूमि संकेत में वृद्धि होती है। आधार सामग्री के ठोस चरण पर स्थिरीकरण के बाद गैर-विशिष्ट बंधन को रोकने के लिए, परीक्षण के लिए तटस्थ पदार्थों के साथ उपचार किया जाता है। सबसे लोकप्रिय अवरोधक एजेंट गोजातीय सीरम एल्ब्यूमिन (बीएसए), कैसिइन, आदि हैं। अवरोधक एजेंट की पसंद और इस चरण के लिए शर्तें ठोस चरण के प्रकार, सिस्टम की संवेदनशीलता पर निर्भर करती हैं।
एलिसा मंचन विकल्प।
सामान्य सिद्धांत।
वर्तमान में, एलिसा की विभिन्न किस्मों और संशोधनों की एक बड़ी संख्या का उपयोग किया जाता है। एंजाइम-लिंक्ड इम्युनोसॉरबेंट परख (एलिसा) के विभिन्न प्रकार व्यापक हो गए हैं।
ठोस चरण एलिसा 1971 में प्रस्तावित किया गया था। ठोस-चरण एलिसा के मूल सिद्धांत, संशोधन की परवाह किए बिना, इस प्रकार हैं:
1. प्रतिक्रिया के पहले चरण में, ठोस चरण पर एंटीजन या एंटीबॉडी का विज्ञापन किया जाता है। इस मामले में, ठोस चरण से बंधे हुए अभिकर्मकों को धोने से आसानी से हटा दिया जाता है।
2. परीक्षण के नमूने को संवेदनशील कुओं में इनक्यूबेट किया जाता है। सकारात्मक नियंत्रण कुओं में मानक अभिकर्मक होते हैं। इस मामले में, ठोस चरण की सतह पर प्रतिरक्षा परिसरों का निर्माण होता है। अनबाउंड घटकों को धोने से हटा दिया जाता है।
इसी तरह के सार:
रक्त समूह का निर्धारण, आरएच-संबद्धता, एरिथ्रोसाइट एंटीजन की टाइपिंग और एंटी-एरिथ्रोसाइट एंटीबॉडी का पता लगाना न केवल रोकथाम के लिए किया जाना चाहिए।
लिम्फोइड सिस्टम की कोशिकाएं: प्रतिरक्षा प्रतिक्रिया के विकास के दौरान बातचीत; शारीरिक विनियमन के तरीके।
क्लैमाइडियोसिस - निदान और उपचार के लिए आधुनिक दृष्टिकोण क्लैमाइडिया का पता लगाने के लिए साइटोस्कोपिक तरीके साइटोस्कोपिक विधि में, साथ ही प्रोवाचेक के साइटोप्लाज्मिक समावेशन कोशिकाओं की खोज के साथ, ...
पिछली गर्भधारण की उपस्थिति, उनके प्रतिकूल परिणाम (गर्भपात, मृत जन्म, एचडीएन के साथ बच्चों का जन्म), साथ ही साथ रक्त आधान का इतिहास, महिलाओं को नवजात शिशु के हेमोलिटिक रोग के विकास के लिए जोखिम में डालता है।
एंटीजन-एंटीबॉडी इंटरैक्शन की मुख्य अभिव्यक्तियाँ। लेबल किए गए अभिकर्मकों का उपयोग करके एंटीजन और एंटीबॉडी का प्रतिरक्षाविज्ञानी विश्लेषण। पूरक गतिविधि का सार। प्रभावकारक कोशिकाओं के निर्धारण के लिए तरीके। ट्रांसजेनिक जानवर और लक्षित जीन वितरण।
निरंतर सतह पर प्रतिरक्षी प्रतिक्रियाओं का पता लगाने के लिए इलेक्ट्रोकेमिकल और ऑप्टिकल विधियों का उपयोग और उनके अनुप्रयोग क्लिनिकल अभ्यास. प्रसार तरंगों की उत्पत्ति, प्रतिदीप्ति के पूर्ण आंतरिक परावर्तन की विधि।
एन्हांस्ड केमिलुमिनेसेंस का उपयोग करके पेरोक्सीडेज लेबल का निर्धारण। पोर्टेबल उपकरणों का उपयोग करके प्रदर्शन किए गए एंजाइम इम्यूनोसे के लिए तेज विधियों का विकास। तालमेल और वृद्धि की डिग्री। प्रकाश उत्सर्जन की तीव्रता और अवधि।
प्रयोगशाला निदान के लक्षण विषाणु संक्रमणइलेक्ट्रॉन माइक्रोस्कोपी का उपयोग करना। जांच के लिए प्रभावित ऊतक के वर्गों की तैयारी। इम्यूनोइलेक्ट्रॉन माइक्रोस्कोपी की विधि का विवरण। इम्यूनोलॉजिकल अनुसंधान के तरीके, विश्लेषण के पाठ्यक्रम का विवरण।
इम्यूनोसे के तरीकों और तकनीकों में सुधार, संयोजन और विस्तार। एंटीबॉडी की खोज और पहचान, एग्लूटीनेशन पैदा करने की उनकी क्षमता। लेटेक्स एग्लूटिनेशन के साथ इम्युनोसे के लिए एक स्वचालित परिसर का उपयोग।
एविडिन-बायोटिन प्रतिक्रिया का दो-केंद्र इम्युनोसे में उपयोग। विभिन्न एंटीजन एपिटोप्स की मान्यता द्वारा स्थिर और बायोटिनाइलेटेड एंटीबॉडी की तैयारी का चयन। एविडिन और स्ट्रेप्टाविडिन के लक्षण, बायोटिनाइलेटेड प्रोटीन प्राप्त करना।
रेडियोइम्यूनोसे और इम्यूनोरेडियोमेट्रिक विश्लेषण के तरीके। पशु चिकित्सा में इम्यूनोसे के आवेदन के क्षेत्र, इम्यूनोडायग्नोस्टिक किट के उपभोक्ता। पशुओं में प्रजनन क्षमता और उर्वरता का निदान। पशु चिकित्सा में प्रतिरक्षा विश्लेषण का विकास।
विधि एक एंटीबॉडी के संयुग्मन पर आधारित है या एक एंजाइम के साथ हैप्टेन है, जो एंटीबॉडी या हैप्टेन द्वारा विशिष्टता के नुकसान और एंजाइम द्वारा उत्प्रेरक गतिविधि के नुकसान का कारण नहीं बनता है। हालांकि, एंटीजन-एंटीबॉडी कॉम्प्लेक्स के भीतर, हैप्टेन-एंजाइम या एंटीबॉडी-एंजाइम संयुग्म अपनी उत्प्रेरक गतिविधि खो देते हैं।
एंजाइम के साथ एंटीबॉडी अणुओं का कनेक्शन मुख्य रूप से ग्लूटाराल्डिहाइड की मदद से किया जाता है, एक द्वि-कार्यात्मक अभिकर्मक जो प्रोटीन अणुओं के ई-एमिनो समूहों के साथ बातचीत करता है। विधि के संशोधन के आधार पर, पेरोक्सीडेज, β-galactosidase, क्षारीय और एसिड फॉस्फेट (कम अक्सर एसिटाइलकोलाइन, ग्लूकोमाइलेज, ग्लूकोज ऑक्सीडेज), या लाइसोजाइम, ग्लूकोज-6-फॉस्फेट डिहाइड्रोजनेज और मैलेट डिहाइड्रोजनेज को सफलतापूर्वक एक एंजाइम के रूप में उपयोग किया जाता है, जो निर्भर करता है पद्धति में संशोधन के संबंध में। एंटीबॉडी लेबलिंग के लिए उपयोग किया जाने वाला एंजाइम एंटीजन युक्त परीक्षण कोशिकाओं में मौजूद नहीं होना चाहिए, क्योंकि अंतर्जात एंजाइमेटिक गतिविधि की अनुमति नहीं है।
एलिसा के मंचन के लिए कई विकल्प हैं। सजातीय और विषमांगी एलिसा के बीच भेद। सजातीय एलिसा का आधार, कम आणविक भार वाले पदार्थों (हैप्टेंस) को निर्धारित करने के लिए उपयोग किया जाता है, एंजाइम गतिविधि का निषेध है जब इसे हैप्टेन के साथ जोड़ा जाता है (एंजाइम गतिविधि एजी-एटी प्रतिक्रिया के परिणामस्वरूप बहाल हो जाती है) या, इसके विपरीत, एजी-एटी प्रतिक्रिया के परिणामस्वरूप मार्कर एंजाइम गतिविधि का नुकसान। इसलिए, AG युक्त मिश्रण से मुक्त AG को हटाना बाध्य रूप, प्रतिरक्षा परिसरों के भाग के रूप में असंभव है। इसके विपरीत, विषम एलिसा के साथ, एजी या एटी एक ठोस चरण (आमतौर पर प्लास्टिक) पर तय होता है, और बार-बार धोने से अप्राप्य प्रतिक्रिया घटकों को हटा दिया जाता है।
एलिसा में, प्रतिस्पर्धी और गैर-प्रतिस्पर्धी विश्लेषण के तरीकों को प्रतिष्ठित किया जाता है।
प्रतिस्पर्धी एलिसा का प्रदर्शन किया जा सकता है यदि एंटीजन की मात्रा निर्धारित करना आवश्यक है, जिसे शुद्ध रूप में प्राप्त किया जा सकता है। इस मामले में पहला कदम एक रासायनिक प्रतिक्रिया या भौतिक-रासायनिक बातचीत के कारण वाहक को एंटीबॉडी का लगाव होगा। अतिरिक्त एंटीबॉडी को धोने से हटा दिया जाता है, और लेबल किए गए एंटीजन की कड़ाई से परिभाषित मात्रा और लक्ष्य एंटीजन की मात्रा में अंतर को पेश करके, एक अंशांकन वक्र बनाया जाता है। प्रतिक्रिया के अंत में, एंटीबॉडी के कारण एजी-एटी प्रतिरक्षा परिसरों को ठोस चरण से जोड़ा जाता है, और अतिरिक्त एंटीजन को धोने से हटा दिया जाता है, एंजाइम के लिए सब्सट्रेट जोड़ा जाता है, एक निश्चित समय के बाद प्रतिक्रिया बंद हो जाती है, और एंजाइमी प्रतिक्रिया के उत्पादों का वर्णमिति निर्धारण किया जाता है।
एक अन्य प्रतिस्पर्धी एलिसा में, एंटीजन मुख्य रूप से ठोस चरण से बंधा होता है। धोने के बाद, एंजाइम-लेबल एंटीबॉडी और मानक या परीक्षण प्रतिजन जोड़े जाते हैं। लेबल किए गए एंटीबॉडी के बंधन को विघटित एंटीजन द्वारा प्रतिस्पर्धात्मक रूप से बाधित किया जाता है। एंजाइमी प्रतिक्रिया उत्पादों की मात्रा भंग प्रतिजन की एकाग्रता के व्युत्क्रमानुपाती होती है।
गैर-प्रतिस्पर्धी तरीकों में डबल एंटीबॉडी विधि शामिल है, या इसे कभी-कभी "सैंडविच विधि" के रूप में जाना जाता है।
सॉलिड फेज फिक्स्ड एंटीबॉडीज को स्टैंडर्ड या एनालाइट एंटीजन के साथ इनक्यूबेट किया जाता है। धोने के बाद, लेबल किए गए एंटीबॉडी (एक ही एंटीजन के लिए विशिष्ट) की अधिकता को जोड़ा जाता है, और आसन्न एंटीबॉडी को धोया जाता है। एंजाइमी प्रतिक्रिया का उत्पाद बाध्य प्रतिजन की मात्रा के आनुपातिक मात्रा में बनता है। अक्सर बिना लेबल वाले द्वितीयक एंटीबॉडी का उपयोग किया जाता है; इस मामले में प्रतिक्रिया को आईजीजी (द्वितीय एंटीबॉडी) के लिए विशिष्ट एंजाइम-लेबल एंटीबॉडी के बंधन से आंका जाता है। किसी भी मामले में, पहली और दूसरी एंटीबॉडी विभिन्न प्रजातियों के जानवरों से संबंधित होनी चाहिए। एक अप्रत्यक्ष, गैर-प्रतिस्पर्धी एलिसा का उपयोग अक्सर एंटीबॉडी का पता लगाने के लिए एंजाइम इम्युनोसे के लिए किया जाता है।
एंटीजन को ठोस चरण पर तय किया जाता है, धोने के बाद, एंटीबॉडी समाधान के साथ ऊष्मायन किया जाता है। यदि एंटीबॉडी का विशिष्ट बंधन हुआ है, तो उन्हें एंजाइम-लेबल वाले एंटीग्लोबुलिन सीरम, एक एंजाइमेटिक प्रतिक्रिया का उपयोग करके निर्धारित किया जा सकता है।
वर्णित लोगों के अलावा, ठोस चरण एलिसा के निम्नलिखित संशोधनों को जाना जाता है। बाध्य एंटीबॉडी के साथ लेबल और बिना लेबल वाले एंटीजन को सह-ऊष्मायन करने के बजाय, कोई केवल मानक या विश्लेषण एंटीजन को सीधे इनक्यूबेट कर सकता है, और फिर, धोने के बाद, एंजाइम-लेबल एंटीजन की अधिकता के साथ इनक्यूबेट कर सकता है जो "निर्विवाद" एंटीबॉडी के साथ इंटरैक्ट करता है।
इसके अलावा, मानक या परीक्षण प्रतिजन को एंजाइम-लेबल एंटीबॉडी की अधिकता के साथ और अंत में इनक्यूबेट किया जा सकता है रोग प्रतिरोधक क्षमता का पता लगनाइस मिश्रण को ठोस प्रावस्था पर नियत प्रतिजन में मिला दें। ठोस चरण पर प्रतिजन से बंधे मुक्त एंजाइम-लेबल एंटीबॉडी की मात्रा निर्धारित की जाती है। दोनों ही मामलों में, एंजाइमी प्रतिक्रिया उत्पाद की एकाग्रता विश्लेषण किए गए प्रतिजन की एकाग्रता के समानुपाती होती है। परिणामों को फोटोमेट्रिक रूप से ध्यान में रखा जाता है।
वर्तमान में जारी एक बड़ी संख्या कीसीरम या अन्य जैविक तरल पदार्थों में एंटीबॉडी का पता लगाने और एंटीजन का पता लगाने के लिए विभिन्न प्रकार के एलिसा डायग्नोस्टिक किट। उत्तरार्द्ध प्रेरक एजेंट हो सकते हैं विभिन्न रोग(कॉक्ससेकी बी वायरस, हेपेटाइटिस ए और बी, एड्स, हर्पीज सिम्प्लेक्स, रूबेला; ब्रुसेला, विब्रियो कोलेरा, साल्मोनेला, ट्रेपोनिमा, ई. कोलाई), साथ ही विभिन्न प्रोटीन, जिसकी सामग्री का निर्धारण रक्त या स्राव में होता है नैदानिक रुचि (स्वप्रतिपिंड, गैर-विशिष्ट सुरक्षा के कारक, हार्मोन, साइटोकिन्स, तीव्र चरण प्रोटीन, आदि)।
कार्यप्रणाली।एलिसा के लिए निम्नलिखित बफर समाधान आवश्यक हैं।
1. बफर संलग्न करें- 0.05 एम सोडियम-कार्बोनेट-बाइकार्बोनेट बफर (सीबीबी) (पीएच 9.5-9.7) एक ठोस वाहक पर एंटीजन या एंटीबॉडी के सोखने के लिए। बफर संरचना: 1.18 ग्राम ना 2 सीओ 3; 3.47 ग्राम NaHCO 3 ; 200 मिलीग्राम नैनो 3। आसुत जल के साथ बफर वॉल्यूम को 1 एल तक समायोजित किया जाता है।
2. ऊष्मायन बफर- फॉस्फेट-खारा समाधान (पीएच 7.3-7.5), जिसका उपयोग वाहक पर पहले घटक के सोखने के बाद प्रतिक्रिया में पेश किए गए घटकों को पतला करने के लिए किया जाता है। बफर संरचना: 17.9 जी ना 2 एचपीओ 4 12 एच 2 ओ; 0.8 ग्राम NaH 2 PO 4 2H 2 O; 42.5 ग्राम NaCl; 2.5 मिली ट्वीन-20। 20-25 सी के तापमान पर संग्रहीत आसुत जल के साथ बफर की मात्रा 5 लीटर तक समायोजित की जाती है।
3. बफर धो लो- आइसोटोनिक सोडियम क्लोराइड घोल जिसमें 0.05% ट्वीन -20 होता है। 0.05% ट्वीन-20 के साथ फॉस्फेट खारा को वॉश बफर के रूप में भी इस्तेमाल किया जा सकता है। पेरोक्सीडेज के लिए सब्सट्रेट ऑर्थोफेनिलेनेडियम या 5-एमिनोसैलिसिलिक एसिड है।
ऑर्थोफेनिलेनेडियम को अस्थायी रूप से निम्नानुसार तैयार किया जाता है: 10 मिलीग्राम ऑर्थोफेनिलेनेडियम, 6.1 मिली 0.1 एम साइट्रिक एसिड, 6.4 एमएल 0.2 एम ना 2 एचपीओ 4 ´ 12 एच 2 ओ (पूर्ण विघटन के लिए पानी के स्नान में गर्मी), 12, 5 मिली डिस्टिल्ड पानी, 0.35 मिली 3% एच 2 ओ 2।
आसुत जल के 100 मिलीलीटर में 80 मिलीग्राम 5-एमिनोसैलिसिलिक एसिड घोलें, समाधान के पीएच को 1 एम NaOH के साथ 6.0 एक्स टेम्पोर में समायोजित करें। उपयोग करने से पहले, प्रत्येक 9 मिलीलीटर समाधान के लिए, 0.05% एच 2 ओ 2 का 1 मिलीलीटर जोड़ें।
एलिसा को फ्लैट बॉटम कुओं और स्वचालित पिपेट के साथ पॉलीस्टाइनिन प्लेटों की आवश्यकता होती है। मात्रात्मक लेखांकन के लिए, एक स्पेक्ट्रोफोटोमीटर का उपयोग किया जाता है - 492 एनएम की तरंग दैर्ध्य पर एक विलुप्त होने वाला रिकॉर्डर।
प्रतिक्रिया तकनीक। एलिसा का पहला चरण एक कार्बोनेट-बाइकार्बोनेट बफर पर प्रति ठोस चरण में 0.2 मिलीलीटर की मात्रा में 1-2 घंटे के लिए एंटीबॉडी या एंटीजन (10-20 माइक्रोग्राम / एमएल की एकाग्रता पर) के उचित कमजोर पड़ने का शर्बत है। 37 डिग्री सेल्सियस का तापमान और 4 डिग्री सेल्सियस के तापमान पर 10-12 घंटे। फिर कुओं को कमरे के तापमान पर 5 मिनट (2 बार) के लिए 0.05% ट्वीन -20 के साथ 0.05% ट्वीन -20 के साथ धोने के पानी के साथ (वाहक पर adsorbed एंटीबॉडी या एंटीजन को हटाने के लिए) धोया जाता है। उसके बाद, सीबीबी पर गोजातीय सीरम एल्ब्यूमिन के 1% घोल का 0.2 मिली प्रत्येक कुएं में मिलाया जाता है और 37 डिग्री सेल्सियस के तापमान पर 1 घंटे के लिए इनक्यूबेट किया जाता है ताकि कुओं के सतह क्षेत्रों को कवर किया जा सके जो पहले के सोखने के बाद मुक्त रहते हैं। एक ठोस वाहक पर प्रतिक्रिया का घटक। कुएं को अनबाउंड गोजातीय सीरम एल्ब्यूमिन से धोया जाता है और परीक्षण सामग्री (एंटीजन या एंटीबॉडी) को 0.05% ट्वीन -20 के साथ फॉस्फेट-सलाइन समाधान (पीएच 7.2) में 0.2 मिलीलीटर कमजोर पड़ने में जोड़ा जाता है। सामग्री के प्रत्येक कमजोर पड़ने को दो कुओं में इंजेक्ट किया जाता है और 37 डिग्री सेल्सियस के तापमान पर 1-3 घंटे के लिए थर्मोस्टैट में रखा जाता है। एंटीजन या एंटीबॉडी जो प्रतिरक्षा प्रतिक्रिया में प्रतिक्रिया नहीं करते हैं उन्हें धोया जाता है और परीक्षण एंटीजन या एंटीबॉडी के खिलाफ 0.2 मिलीलीटर संयुग्मित एंटीबॉडी को 0.05% ट्वीन -20 के साथ फॉस्फेट-सलाइन समाधान में काम कर रहे कमजोर पड़ने में जोड़ा जाता है। फिर उन्हें 37 डिग्री सेल्सियस पर 2 घंटे के लिए इनक्यूबेट किया जाता है। अनबाउंड संयुग्म को 10 मिनट के लिए 3 बार बफर से धोया जाता है।
सब्सट्रेट समाधान (क्रोमोजेन) के 0.1 मिलीलीटर को कुएं में जोड़ा जाता है और कमरे के तापमान पर अंधेरे में 30 मिनट के लिए ऊष्मायन किया जाता है। पेरोक्सीडेज की उपस्थिति में ऊष्मायन के दौरान, ऑर्थोफेनिलेनेडियम में बदल जाता है पीला, और अमीनोसैलिसिलिक एसिड - भूरे रंग में।
सब्सट्रेट को अच्छी तरह से विभाजित करने की प्रतिक्रिया को रोकने के लिए 1 एम एनएच 2 एसओ 4 (या 1 एम NaOH) के 0.1 मिलीलीटर जोड़ें।
प्रतिक्रिया नियंत्रण - जांच किए गए एंटीजन या एंटीबॉडी को प्रतिक्रिया के एक समरूप घटक के साथ बदल दिया जाता है।
संयुग्म नियंत्रण - सीबीडी पर 1% गोजातीय सीरम एल्ब्यूमिन का 0.2 मिली + काम करने वाले कमजोर पड़ने में संयुग्मित एंटीबॉडी के 0.2 मिली।
प्रतिक्रिया परिणामों को नेत्रहीन या यंत्रवत् रूप से ध्यान में रखा जाता है। जब दृश्य लेखांकन परीक्षण सामग्री के उच्चतम कमजोर पड़ने को प्रकट करता है, जिसमें रंग नियंत्रण (गोजातीय सीरम एल्ब्यूमिन) की तुलना में अधिक तीव्र होता है। स्पेक्ट्रोफोटोमीटर का उपयोग करके प्रतिक्रिया के परिणामों को ध्यान में रखते हुए, परीक्षण सामग्री के उच्चतम कमजोर पड़ने को सकारात्मक माना जाता है, जहां विलुप्त होने का स्तर विषम प्रतिक्रिया घटक के संबंधित कमजोर पड़ने के विलुप्त होने के स्तर से कम से कम 2 गुना अधिक होता है।