Bakterioloogiliste uuringute kasutamise võimalused silmahaiguste korral on piiratud patoloogilise fookuse ligipääsetavuse piiridega. Kui see paikneb silma tagumises segmendis, on uurimistööks materjali hankimine sageli väga keeruline ning bakterioloogilise diagnoosi võimalus sellistel juhtudel on loomulikult välistatud. Bakterioloogilise diagnostika peamiseks kasutusvaldkonnaks silmapraktikas on silma välissilma haigused, aga ka läbistavad haavad, mille uurimise käigus saab materjali. kirurgiline ravi haavade korral või võõrkeha eemaldamisel. Üldiselt tuleb märkida, et kirurgilised sekkumised bakterioloogilise materjali saamise võimaluste ring laieneb tunduvalt.
Materjali hankimine uurimistööks
Materjali saamiseks sidekesta kotist kasutatakse plaatinasilmust (kui seda pole käepärast, võib kasutada elektripliidi spiraalniidist valmistatud aasa või mõnda muud instrumenti (klaaspulk, spaatel vms), mis on eel- steriliseeritakse kaltsineerimisega alkoholipõleti leegis. Alumist silmalaugu tõmmates jahutatud silmusega püütakse alumise fornixi sügavusest kinni konjunktiivierituse tükk.Tuleb vältida silmuse puudutamist naha ja servadega silmalaugude, et mitte viia materjali sisse võõrast mikrofloorat.Soovitav on võtta materjal enne ravi algust ja hommikul, kui eritis on rikkalikum.Lima ja mäda puudumisel (näiteks , kui uurite tervet sidekesta enne operatsiooni), peaksite kasutama pisaravedelikku või kergelt kraapima sidekesta pinda (vastavalt Lindnerile).Kuid sellistel juhtudel on parem kasutada Elynnigi meetodit: laske üks tilk steriilset füsioloogilist soolalahust. konjunktiivikotti Pasteuri pipetist lahust või puljongit ja mõne sekundi pärast imege see tilk.
Sama eest üldreeglid materjal saadakse pisarakotist, pigistades selle sisu välja, ja haavandilise blefariidiga silmalau servast, olles eelnevalt eemaldanud haavandilt kooriku.
Sarvkesta materjali võtmisel tuleb olla väga ettevaatlik, eriti hiiliva sarvkesta haavandi korral. Silmus (või muu nüri instrument) tuleb suunata kaldu haavandi pinnale ja võtta materjali selle progresseeruvast servast. Selleks on vaja anesteesiat (3 tilka 1% dikaiini) ja silmamuna fikseerimist.
Silma läbitungivate haavade uurimise materjalina võite kasutada haava väljutamist (kui see on olemas), püüdes seda silmuse või marli tampooniga, esikambri täpi või ekstraheerimisega. võõras keha, mis asetatakse 1-2 ml soolalahusega steriilsesse katseklaasi. Pärast torude loksutamist kasutatakse lahust uurimiseks.
Eeskambrist saab uurimistööks materjali saada lõikeriistalt paratsenteesi ajal või punktsiooniga. Pärast sarvkesta anesteseerimist (3 tilka 1% dikaiini lahust) ja silmamuna viltu fikseerimist limbus süstitakse süstlanõel, mis torgatakse eeskambrisse (olge ettevaatlik, et mitte vigastada vikerkesta ja läätsekapslit!) ja 0,3 ml esikambri sisu aspireeritakse.
Endoftalmiidi korral võib tekkida vajadus saada materjali klaaskehast. Silmamuna punktsioon tehakse pärast anesteesiat (1 ml 2% novokaiini lahust sidekesta all) terava ja piisavalt laia valendiku nõelaga, mis süstitakse ekvaatorile lähemale. Aspireeritud 0,3-0,5 ml silmasisest sisu.
Saadud materjali uuritakse, et tuvastada mikroob ja määrata selle tüüp (mikrobioloogiline diagnoos). Materjali saab uurida:
- slaidil (bakterioskoopiline meetod);
- põllukultuurides (tegelik bakterioloogiline meetod);
- loomkatses (bioloogiline meetod).
Bakterioskoopiline meetod
saab kasutada igas silmahaiglas lihtsa laboriseadmed ja mõned reaktiivid.
Selleks peab teil olema järgmine:
- metallist silmus;
- puhtad klaasslaidid (puhtal klaasil valgub veetilk laiali ega võta kerakuju);
- alus alusklaaside jaoks (klaasvardad või paks vasktraat);
- destilleeritud vesi;
- alkohol;
- pintsetid;
- filterpaber;
- Lugoli lahus (jood 1 g, kaaliumjodiid 2 g, destilleeritud vesi 300 ml);
- värvilahused (eelistatavalt kummipurkidega pipetidega suletud pudelites).
Puhastamiseks keedetakse uued klaasid 1% soodalahuses (võib kasutada tuhka), seejärel pestakse vee, nõrga soolhappe ja uuesti veega. Kasutusel olnud klaasid asetatakse 1-2 tunniks väävelhappesse, seejärel keedetakse soodalahuses, pestakse veega ja kastetakse 96-kraadisesse alkoholi. Klaase säilitatakse kas piirituses või pärast piirituse pühkimist kuivas, jahvatatud korgiga purkides.
Kõige sagedamini kasutatavad värvid on: Tsilya karboolfuksiin (põhifuksiin 1 g, kristalne karboolhape 5 g, alkohol 96 ° 10 ml, glütseriin - mõni tilk, destilleeritud vesi 100 ml). Värvimiseks lahjendatakse Tsilya magenta tavaliselt 10 korda destilleeritud veega (lahjendatud või vesi magenta). Metüleensinine (metüleensinine 10 g, alkohol 96 ° 100 ml). Sellest valmistatakse leeliseline sinine Leffler (sinise alkoholilahus 30 ml, 1% kaalium- või naatriumleelis 1 ml, destilleeritud vesi 100 ml). Karboolne emajuurviolett (valmistatud samamoodi nagu Tsilya karboolfuksia).
Mikroobe uuritakse kas elusal kujul ("purustatud" ja "rippuvate" tilkade meetodid) või surmatakse (värvilises preparaadis). Elusuuring paljastab peamiselt mikroobide võimet aktiivselt liikuda, samas kui värvitud preparaadid võimaldavad nende morfoloogiat hästi uurida.
On lihtsaid värvimismeetodeid, kui tavaliselt kasutatakse ühte värvi, ja keerukaid värvimismeetodeid, mis paljastavad mikroobiraku füüsikalis-keemilise struktuuri mõningaid tunnuseid ja on seetõttu diferentsiaaldiagnostilise väärtusega.
Värvitud preparaatide valmistamise tehnika on järgmine. Materjal kantakse puhtale slaidile ja jaotatakse pinnale ühtlaselt ringi või ovaali kujul. Määrimine peaks olema piisavalt õhuke. Paksu mäda olemasolul tuleks esmalt slaidile valada üks tilk destilleeritud vett ja materjal selles tilgas segada. Smeep kuivatatakse õhu käes. Kuivanud preparaadiga klaas võetakse pöidla ja nimetissõrmega servadest ülespoole suunatud tõmbega ja kinnitatakse, lastes kolm korda läbi piiritusepõleti leegi (selle heleda ja tumeda osa piiril). Piisava fikseerimise korral on sõrmedes tunda kerget põletustunnet. Fikseeritud määrdumine on määrdunud. Valmistatakse mitu preparaati, vähemalt kaks, millest üks värvitakse lihtsal viisil (Leffleri metüleensinine, lahjendatud Ziehl fuchsin), teine - Grami meetodil.
Leffleri värvimine:
- määrdumisele asetatakse tükk filterpaberit ja 3-5 minutiks valatakse Leffleri sinise lahust;
- ravim pestakse destilleeritud veega ja kuivatatakse.
Grami plekk:
- määrdumisele asetatakse tükk filterpaberit, millele valatakse 1-2 minutiks emajuurvioletti lahust;
- värv kurnatakse, paber eemaldatakse ja ilma veega loputamata valatakse Lugoli lahus 1 minutiks preparaadisse; samal ajal kui määrdumine muutub mustaks;
- Lugoli lahus kurnatakse ja äigepreparaadi värvus muudetakse alkoholiga (eelistatult kastes ravimit alkoholiklaasi, kuni lillad ojad lakkavad voolamast);
- pestakse põhjalikult veega;
- valage määre lahjendatud fuksiaga 1-2 minutiks;
- tühjendage värv, peske ravim veega ja kuivatage.
Mugav Grami meetod, mida on modifitseerinud Sinev, kes soovitas kasutada eelnevalt ettevalmistatud filterpaberi tükke, mis on leotatud emajuurvioletti lahuses ja kuivatatud. Preparaadile kantakse eelnevalt 2-3 tilka vett ja seejärel asetatakse need paberitükid. Seejärel jätkake ülalkirjeldatud viisil.
Smearide mikroskoopia tehakse sukelläätsega. Loeffleri järgi värvides värvitakse kõik mikroobid siniseks; kui värvida Grami järgi - kas sinakasvioletne (grampositiivsed mikroobid) või punane (gramnegatiivsed mikroobid).
Silma välissilma haigustega seotud mikroobide piiratud arv ja neile iseloomulikud morfoloogilised tunnused võimaldavad sageli õiget mikrobioloogilist diagnoosi panna ainult bakterioskoopilise uuringu abil.
Bakterioloogiline meetod
muutub vajalikuks juhtudel, kui äigepreparaadi uuring ei ole mikroobi tüübi kindlakstegemiseks piisav või on vaja määrata isoleeritud patogeeni tundlikkus antibakteriaalsete ravimite suhtes.
Viidates bakterioloogilise meetodi üksikasjalikuks tutvumiseks mikrobioloogia erijuhenditele, peatume siin ainult selle meetodi põhimõtetel. Esimene tööetapp taandub teatud tüüpi mikroobide isoleerimisele, st puhaskultuuride saamisele. Selleks kasutavad nad materjali mehaanilist eraldamist külvi ajal ja söötmeid, mis on kõige sobivamad väidetavate patogeenide arendamiseks (valikulised söötmed). Söötmel kasvatatud üksikute kolooniate uuesti külvamisel saadakse puhaskultuur, mida uuritakse mikroskoobi all (valmistatakse äigepreparaadid) ja subkultuuritakse diferentsiaaldiagnostilisele söötmele patogeeni biokeemiliste omaduste uurimiseks.
Enamiku silma jaoks patogeensete mikroobide kõrged nõudmised kultiveerimistingimustes viisid nende eraldamiseks eelistatavalt looduslikku valku sisaldavatele söötmetele. Need on näiteks Elschnigi sööde (üks osa hobuse seerumit või astsiidivedelikku ja kaks osa puljongit), hüübinud Loeffleri seerum (kolm osa vadakut ja üks osa puljongit 1% peptooni, 0,5% NaCl ja 1% viinamarjasuhkruga), vereagar Leventhal (agar ja 5-10% defibrineeritud veri).
Mis puudutab mikroobide tundlikkuse määramist antibiootikumide suhtes, siis lihtsaim viis selleks on kasutada kaubanduslikult toodetud filterpaberist kettaid, mis on leotatud antibiootikumilahustes ja kuivatatud vaakumis. Uurimismaterjal (mäda, punkt, ekstraheeritud võõrkeha) asetatakse steriilsesse katsutisse soolalahusega (1,5-2 ml). Pärast loksutamist valatakse vedelik Petri tassidesse, eelistatavalt kahte – ühes suhkruga, teises vereagariga – ning loksutades jaotatakse ühtlaselt söötme pinnale. Seejärel asetatakse agari pinnale üksteisest ja tasside servadest 2 cm kaugusele erinevate antibiootikumidega kettad. Topsid asetatakse termostaadi (37°) ja järgmisel päeval hinnatakse mikroobi tundlikkuse astet testitud antibiootikumide suhtes ketaste ümber oleva kasvupeetuse tsooni suuruse järgi. Kasvu inhibeerimise tsooni puudumine näitab mikroobi tundlikkust selle antibiootikumi suhtes.
bioloogiline meetod
oftalmoloogilises praktikas kasutatakse seda ainult juhtudel, kui raske diagnoosi korral võib toksogeenne omadus olla määrav mikroobi tüübi määramisel (näiteks kui diferentsiaaldiagnostika difteeriabatsill ja kseroosibatsill).
Silma viirushaiguste laboratoorne diagnostika
Praegu tehakse viiruste, sealhulgas trahhoomiviiruse (joonis 77) spetsiaalne uuring, kultiveerides neid koekultuurides (kana embrüo, hiire astsiitkartsinoom jne) ja elektronmikroskoopias.
Riis. 77. Rakusulused trahhoomis.
AT kliiniline praktika trahhoomi diagnoosimiseks kasutatakse sidekesta kraapimise tsütoloogilise uuringu meetodit Provachek-Halbershtedteri kehade (inklusioonide) olemasolu või puudumise tuvastamiseks. Selleks kraabitakse nüri skalpelli või objektiklaasi servaga maha sidekesta epiteelkate (ilma vereta), mis kantakse õhukese kihina klaasklaasile, kuivatatakse õhu käes 5 minutit ja fikseeritakse. langetades 15-20 minutiks klaasis metüülalkoholi või Nikiforovi seguga (etüüleeter ja absoluutne alkohol võrdsetes kogustes). Värvimine toimub 3-4 tunni jooksul värskelt valmistatud Romanovsky-Giemsa värvi lahusega (kiirusega üks tilk värvi 1 ml destilleeritud vee kohta). Seejärel pestakse preparaati voolava veega, kuivatatakse õhu käes ja uuritakse mikroskoobi all. Sel juhul värvuvad epiteelirakkude tuumad roosa värv, protoplasma - helesinises, kandmisel - sinine, sinakasvioletne värv (joon. 77). Viimased esinevad peeneteralise massi hulgas paiknevate kookoidsete moodustistena ja neid tunnustatakse trahhomatoosse viiruse kandjatena. Neid leidub sagedamini värskete ravimata trahhoomi juhtude korral, kuid neid võib esineda ka paratrahhoomse konjunktiviidi korral.
Uurimine Viimastel aastatel avastas uue nakkava vormi viirushaigus silmad - epideemiline keratokonjunktiviit ja selle haiguse konjunktiivi kraapimise tsütoloogiline uuring võimaldas tuvastada epiteelirakkudes omapäraseid kandmisi, mis on täiesti erinevad Prsvacheki kehadest (B. L. Polyak, N. V. Ploshinskaya).
Üks usaldusväärsemaid uurimismeetodeid, mida tehakse haiglate ja kliinikute laborites, on bakterioloogiline. See on üsna keeruline, kuid väga oluline analüüs, mille järgi saavad teadlased täpselt öelda, milline patogeen vaevuse põhjustas.
Kõige sagedamini kohtab lihtne mees tänaval sellist asja nagu bakposev. Tegelikult on see vaid üks bakterioloogilise meetodi komponentidest.
Bakterioloogiline uurimismeetod on edasise uurimise eesmärgil inimeselt bioloogilise materjali võtmine, mille käigus uuritakse materjali teatud bakterite esinemise suhtes. Selleks asetatakse katseklaaside kogutud sisu spetsiaalsesse söötmesse, milles baktereid "kasvatatakse". Ja vastavalt sellele, kus on kasv ja paljunemine, määratakse nakkuse allikas.
Seda tüüpi uuringud on selles valdkonnas levinud nakkushaigused millal valida õige ravi on vaja täpselt teada patogeeni, kuna mõned bakterid on resistentsed isegi kõige tugevamate antibiootikumide suhtes lai valik tegevused.
Lisaks kasutatakse seda tüüpi uuringuid paljudes ühiskondlike toitlustusettevõtete sanitaar- ja epidemioloogilistes kontrollides, et tõkestada konkreetse haiguse levikut.
Praeguseks kasutatakse sageli bakterioloogilist meetodit või, nagu on lihtsam öelda, bakposevit ja spetsialisti põhiülesanne on inimeselt materjali võtmine kuni selle ajani, mil tema jaoks antimikroobset ravi alustatakse.
![]() Mikrobioloogia on üks neist täppisteadustest, mis ei salli vigu. Seetõttu pole mikrobioloogiks saamine nii lihtne. Vaja on sihikindlust, tähelepanelikkust ja ka tahtejõudu, sest sageli on vaja kuude kaupa istuda sama materjali peal, et vähemalt mingigi tulemus saada.
Mikrobioloogia on üks neist täppisteadustest, mis ei salli vigu. Seetõttu pole mikrobioloogiks saamine nii lihtne. Vaja on sihikindlust, tähelepanelikkust ja ka tahtejõudu, sest sageli on vaja kuude kaupa istuda sama materjali peal, et vähemalt mingigi tulemus saada.
Mikrobioloogias on bakterioloogiline uurimismeetod oluline, kuna see võimaldab uurida baktereid, jälgida neid neile soodsas keskkonnas ning uurida ka reaktsiooni konkreetsele ravimile.
Lisaks on tänu bakterite uurimisele nüüdseks saanud võimalikuks kindlaks teha, milline patogeen konkreetset haigust põhjustab, ja päästa palju elusid. Seetõttu on sellel meetodil mikrobioloogias nii oluline koht.
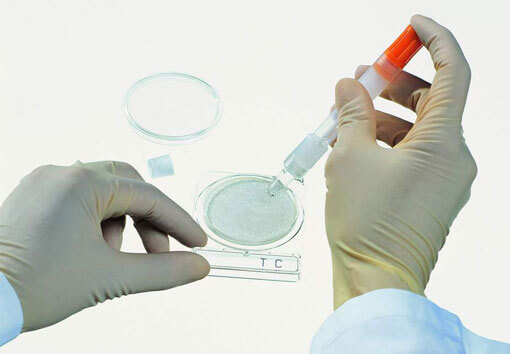
Materjali kogumine analüüsiks
Kõige usaldusväärsemate tulemuste saamiseks tuleb laboritöötaja või õde on vaja järgida kõiki hügieeniprotseduure, samuti instrumenti hästi steriliseerida. Alles siis saab proove võtta.
Kõige sagedamini võetakse inimeselt bakterioloogiliseks uuringuks materjalid:
- Cal. Tavaliselt on selline analüüs ette nähtud, kui inimesel on kõik sooleinfektsiooni sümptomid. See on vajalik, sest peaaegu kõigil kehasse sisenevatel bakteritel on hävitav toime ja mitte iga antibiootikum ei suuda positiivselt mõjutada igat tüüpi patogeene.
- Ninaneelu ja neelu lima. Kõige sagedamini võetakse ninaneelu ja neelu analüüse sagedase kurguvalu, aga ka pikaajalise nohu korral, sest enamasti on sellisel juhul haigusetekitaja palju tõsisem, kui arstid enne kurgu saamist eeldavad. tulemused.
- Nende bronhide flegm. Kui inimesel on kopsupõletik, siis saadetakse ta kindlasti sellele analüüsile.
- Uriin. Patsiendi uriin bakterioloogiliseks uuringuks urogenitaalsüsteemi infektsiooni kahtluse korral.
- Seljaaju vedelik. Mõnikord satuvad patsiendid haiglasse jäsemete halvatusega, kuid samal ajal puuduvad neil teiste haiguste sümptomid, st ajutegevusega on kõik korras, närvilõpmete kaudu ka juhtivusega. Siin võib põhjus peituda nakkuse tungimises selgroog. See on luuletaja, et põhjus võimalikult kiiresti teada saada, on vaja saaki võtta.
- Põletikukollete sisu.
- Tsüsti sisu.
Lisateavet analüüsi "taimestiku külv" kohta leiate videost.
Tänu nendele materjalidele Inimkeha saate läbi viia täpse uuringu ja probleemi tuvastada. Tõsi, vaatamata paljudele edusammudele mikrobioloogias, ei tehta bakterioloogilist külvamist nii kiiresti.
Tulemuste tähtaeg
Hoolimata asjaolust, et kõik spetsialistid soovivad analüüse saada võimalikult kiiresti ja sageli pole aega lihtsalt istuda ja oodata, on teatud tähtajad, mille järel saate uuringu tulemused kätte.
Mikrobioloogias on selged ajaraamid, mis näevad välja umbes sellised:
- Kui analüüsiks võeti väljaheiteid, saab tulemuse saada viie päeva jooksul. Halvimal juhul võib juhtum kesta kuni nädala. Kuid juba viiendal päeval saavad arstid patogeeni kohta ligikaudu kokku võtta.
- Kui analüüsid võeti ninaneelust, siis keskmiselt kuue päeva pärast on tulemused valmis.
- Kui analüüs võetaks, siis peaks ootama kümme päeva, kuna analüüs on väga mahukas ja selle valmimine võtab palju rohkem aega.
- Kui teil on vaja välja selgitada kehafloora, peate ootama neli kuni seitse päeva, olenevalt sellest, kuidas bakterid avalduvad.
- Kui tehti urogenitaaltrakti analüüs, siis täpsed tulemused valmivad nädalaga ehk 7 päeva pärast.
Juhul, kui analüüsid võetakse haiglas viibivalt patsiendilt, saab tema raviarst tulemused teada juba umbes neljandal või viiendal päeval, kuna enamasti asub labor otse haiglas.
Kuid kui testid tehakse lihtsas munitsipaalkliinikus, peate olema valmis viivitusteks. Tulemuste võimalikult kiireks saamiseks ja nende võimalikult usaldusväärseks muutmiseks on parem pöörduda otse mõne linna labori poole. Igaüks neist pakub tasulisi teenuseid.
 Nagu iga teine uuring, hõlmab bakterioloogiline meetod mitut etappi, millest igaüks pole vähem oluline kui eelmine.
Nagu iga teine uuring, hõlmab bakterioloogiline meetod mitut etappi, millest igaüks pole vähem oluline kui eelmine.
Esimene etapp sisaldab:
- Koolitus. Uuritav materjal on vaja korralikult võtta, viia laborisse, vajadusel töödelda.
- Rikastamine. See protseduur viiakse läbi ainult siis, kui bakterite arvust saadud materjalis ei piisa. Enamasti juhtub see verega. Sel juhul asetatakse osa verest sooja kohta temperatuuril, mis soodustab bakterite paljunemist.
- Mikroskoopia. Pärast kõigi ülaltoodud protseduuride läbiviimist on vaja materjali uurida mikroskoobi all, et määrata kindlaks mikrofloora, kogus ja ka peamised omadused.
- Kolooniate loomine. Pärast erinevate mikrofloorade tuvastamist mikroskoobi all eraldatakse igaüks neist ja asetatakse spetsiaalsesse anumasse.
Teine etapp sisaldab:
- Kolooniate omaduste uurimine. See protseduur hõlmab bakterite käitumise, nende paljunemise kiiruse, kohanemise jne uurimist. Juhul, kui ühes koloonias on moodustunud veel mitu teist, on vaja uurida igaühe omadusi.
- puhas kultuur. Siin pannakse iga koloonia spetsiaalselt selle jaoks mõeldud konteinerisse ja nad jälgivad, mis edasi saab.
Kolmas etapp sisaldab:
- Kasvukiiruse ja kultuuri puhtuse mõõtmine. Sõltuvalt sellest, kui kiiresti paljunemine toimus ja ka sellest, kas sellest tekkisid teised kultuurid, on võimalik kindlaks teha bakterite perekond. Seega saavad teadlased lahuse värvuse järgi täpselt öelda, kuidas bakteril on kehale hävitav mõju.
- Antibiootikumide kontroll. Pärast seda, kui spetsialist suutis kultuuri tüübi täpselt kindlaks määrata, peab ta kontrollima, kas ta reageerib teatud antibiootikumidele.
Bakterioloogiline uurimismeetod on üsna keeruline protsess, mis nõuab keskendumist ja kannatlikkust. Seetõttu ei taha kõik arstihariduse saanud inimesed saada mikrobioloogiks.
Kas märkasite viga? Valige see ja klõpsake Ctrl+Enter et meile teada anda.
Bakterioloogiline meetod seisneb patogeeni puhaskultuuri (sama liigi baktereid sisaldava populatsiooni) eraldamises ja selle patogeeni tuvastamine on peamine bakterioloogilise uurimise meetod.
Mikroorganismide omaduste uurimist bakterioloogilises laboris, et teha kindlaks kuulumine teatud süstemaatilisesse rühma (liiki, perekonda), nimetatakse nende tuvastamiseks.
Üldiselt on bakterioloogiline uurimismeetod mitmeetapiline bakterioloogiline uuring, mis kestab 18-24 tundi.
Bakterioloogiline meetod – kuidas seda tehakse?
Bakterioloogilisel meetodil asetatakse anaeroobsed kultuurid anaerostaati. Õhk eemaldatakse õhupallist ja asendatakse gaasiseguga, mis ei sisalda hapnikku.
Bakterioloogilise meetodi aluseks on patogeeni puhaskultuuri eraldamine, mis toimub uuringu esimeses etapis. Patogeeni puhaskultuuri eraldamiseks nakatatakse võetud materjal. Külvamine toimub reeglina tihedale toitekeskkonnale, mis valitakse väidetava patogeeni omaduste põhjal.
Bakterioloogilise meetodi puhul kasutatakse võimalusel söödet, millel kasvab ainult teatud tüüpi baktereid - valikulist söödet ehk söödet, mis võimaldab eristada väidetavat patogeeni teistest mikroorganismidest, või muul viisil diferentsiaaldiagnostilist söödet.
Näiteks bakterioloogilises diagnostikas sooleinfektsioonid- Difteeriabatsilli isoleerimiseks kasutatakse endosöödet, telluriitsöödet jne. Oportunistlike mikroorganismide isoleerimisel bakterioloogilisel meetodil toimub võetud materjali külvamine universaalsele toitekeskkonnale. Sellise söötme näide on vereagar.
Kõik manipulatsioonid, mis on seotud bakterikultuuride eraldamisega, viiakse läbi põleti leegi kohal.
Bakterioloogilise meetodiga toimub materjali inokuleerimine toitekeskkonnale kas klaas- või metallist spaatliga või bakterisilmuse abil nii, et uuritavas materjalis olevad bakterid hajuvad üle toitekeskkonna pinna. Sellise hajutamise tulemusena satub iga bakterirakk oma keskkonnaosasse.
Patogeeni puhaskultuuri eraldamisel patoloogilisest materjalist, mis on oluliselt saastunud võõra mikroflooraga, kasutatakse sageli puhaskultuuri isoleerimise bioloogilist meetodit. Seda tehakse järgmiselt: nad nakatavad uuritava materjaliga patogeeni suhtes tundlikke laboriloomi. Bioloogilise meetodi teine näide on patsiendi uurimisel pneumokokkide sisalduse suhtes rögas, süstitakse materjal intraperitoneaalselt valgetele hiirtele. Nende verest saadakse 4-6 tunni pärast pneumokokkide puhaskultuur.
Juhul, kui bakterioloogilise uurimismeetodi tulemusena eeldatakse, et uuritavas materjalis on väike kogus patogeeni, viiakse nakatamine selle akumuleerimiseks vedelal toitainekeskkonnal, nn rikastamiseks. sööde, mis on selle mikroorganismi jaoks optimaalne. Järgmisena külvatakse uuesti vedelast toitainekeskkonnast Petri tassidesse valatud tahkesse söötmesse. Patogeeniga nakatatud sööde asetatakse termostaati, tavaliselt teatud temperatuuril, mis on bakterioloogilise meetodi jaoks oluline.
Bakterioloogilise uurimismeetodi teises etapis uuritakse ühest bakterirakust pärinevaid tihedal toitekeskkonnal kasvanud bakterikolooniaid. (koloonia ja on patogeeni puhaskultuur). Kolooniate mikroskoopiline ja makroskoopiline uurimine toimub peegeldunud ja läbiva valguse käes: palja silmaga, väikese suurendusega mikroskoobi all, suurendusklaasiga.
Märgitakse ära kolooniate kultuurilised omadused: kuju, suurus, värvus, servade ja pinna iseloom, struktuur, konsistents. Lisaks kasutatakse määrde valmistamiseks osa igast sihitud kolooniast. Grami äigepreparaadid värvitakse mikroskoopiliselt, määrates isoleeritud kultuuri toonilised (seos värvusega) ja morfoloogilised omadused ning kontrollides samaaegselt selle puhtust.
Ülejäänud koloonia inokuleeritakse katseklaasidesse selle liigi jaoks optimaalse söötmega, näiteks kaldagariga, et koguda terviklikuma uuringu jaoks puhas kultuur. Torusid liigutatakse 18-24 tundi termostaadis. Teises etapis loendatakse lisaks ülaltoodud uuringutele sageli ka kasvanud kolooniate arv.
See on eriti oluline oportunistlike patogeenide põhjustatud haiguste puhul. Selliste haiguste korral on lubatud patogeeni juhtivat rolli hinnata ainult selle sisalduse järgi patoloogilises materjalis piisavas koguses. suurel hulgal ja selle patogeeni ülekaal muu taimestiku ees.
Sellise uuringu läbiviimiseks valmistatakse võetud uuritavast materjalist järjestikused lahjendused, millest külvatakse toitekeskkonnaga tassidesse, loendatakse kasvanud kolooniate arv, korrutatakse lahjendusega, millest saadakse mikroorganismide sisaldus. materjalis määratakse.
Bakterioloogilise meetodi kolmas etapp on patogeeni isoleeritud puhaskultuuri tuvastamine ja tundlikkuse määramine antibiootikumide ja muude kemoterapeutiliste ravimite suhtes. Eraldatud bakterikultuuri identifitseeritakse tooniliste, morfoloogiliste, biokeemiliste, kultuuriliste, toksikogeensete ja antigeensete omaduste järgi.
Esimese sammuna võetakse kald-agaril kasvatatud kultuurist määrd, uuritakse bakterite morfoloogiat ja kontrollitakse kasvanud bakterite kultuuri puhtust. Järgmisena inokuleeritakse isoleeritud puhas bakterikultuur Hissi söötmele. Biokeemiliste omaduste määramiseks on soovitav inokuleerida muudele söötmetele.
Bakterite ensümaatilised ehk biokeemilised omadused tulenevad ensüümidest, mis osalevad valkude, süsivesikute lagundamisel, põhjustades erinevate substraatide redutseerimist ja oksüdatsiooni.
Veelgi enam, iga tüüpi bakterid toodavad selle jaoks pidevat ensüümide komplekti. Kõige sagedamini kasutatakse antigeensete omaduste uurimisel klaasi aglutinatsioonireaktsiooni.
Toksiini moodustumine mikroobides määratakse toksiini neutraliseerimise reaktsiooniga antitoksiiniga in vivo või in vitro. Mõnel juhul uuritakse ka teisi virulentsustegureid. Ülaltoodud uuringud, mis viiakse läbi bakterioloogilises laboris, võimaldavad meil määrata patogeeni perekonna või tüübi.
Sealhulgas nakkuse allika tuvastamiseks, et tuvastada haiguse epideemiline ahel, viiakse läbi bakterite spetsiifiline tuvastamine. Bakterite spetsiifilise identifitseerimise olemus on fagovari või fagotüübi määramine, isoleeritud antigeensete bakterite erinevate omaduste uurimine. Faagi tüübi määramise protsessi nimetatakse faagi tüpiseerimiseks. Faagi tüpiseerimine toimub koos kõhutüüfus, stafülokoki infektsioonid, paratüüfus B.
Toitesöötmega tassile, mis on külvatud spaatliga isoleeritud puhaskultuuriga, kandke tilkhaaval erinevaid diagnostilisi faage. Kui kultuur on selle faagi suhtes tundlik, täheldatakse bakterioloogilise uuringu tulemusena nn negatiivseid kolooniaid (naastud), mis näevad välja nagu hävitatud bakterite ümarate alade moodustised. Patogeeni kultuur võib olla tundlik mitme või ühe faagi suhtes.
Ravimiresistentsete bakterivormide laialdase leviku tõttu on ratsionaalse keemiaravi määramiseks vaja määrata patogeeni isoleeritud puhaskultuuri antibiogramm - resistentsus või tundlikkus kemoterapeutiliste ravimite suhtes. Antibiogrammi jaoks kasutatakse kas paberketta meetodit või kõige täpsemat, kuid tülikamat seerialahjendusmeetodit.
Paberketta meetod põhineb bakterite kasvu pärssiva tsooni tuvastamisel antibiootikumidega immutatud ketaste ümber. Seerialahjenduste meetodi kasutamise korral lahjendatakse katseklaasides keemiline preparaat - vedela toitainekeskkonnaga antibiootikum, misjärel inokuleeritakse katseklaasidesse sama palju baktereid. Tulemused registreeritakse bakterite kasvu puudumise või olemasolu järgi. Tüvede identsuse määramise bakterioloogilise uurimismeetodi tulemusena võib saadud antibiogramm olla ka epidemioloogilisel eesmärgil.
Bakterikandja tuvastamisel võib teha korduvaid uuringuid, kuna materjali ühes osas on võimalik patogeeni mitte tuvastada.
Praegu on kaasaegses maailmas bakterite tüübi ja perekonna määramiseks kiirendatud meetodeid. Niisiis kasutatakse Venemaal indikaatorpaberite süsteemi - SIB, mis võimaldab isoleerida puhast bakterikultuuri 6-12 tunni pärast ja kasutamata suurt hulka toitaineid. Immunofluorestsentsmeetodit kasutatakse laialdaselt ka nakkushaiguste kiireks diagnoosimiseks (vt Seroloogilised uuringud).
Bakterioloogiline uurimismeetod (BLMI)- meetod, mis põhineb bakterite puhaskultuuride eraldamisel toitekeskkonnas kultiveerimise teel ja nende identifitseerimisel liikide järgi, mis põhineb mikroorganismide morfoloogiliste, kultuuriliste, biokeemiliste, geneetiliste, seroloogiliste, bioloogiliste, ökoloogiliste omaduste uurimisel.
Infektsioonide bakterioloogiline diagnostika viiakse läbi tervishoiuministeeriumi poolt heaks kiidetud standardsete diagnostikaskeemide abil.
Puhas kultuur - toitekeskkonnas kasvatatud sama liigi bakterid, mille omadusi uuritakse.
Kurna- sama liigi mikroorganismide identifitseeritud puhaskultuur, mis on eraldatud kindlast allikast kindlal ajal. Sama liigi tüved võivad biokeemiliste, geneetiliste, seroloogiliste, bioloogiliste ja muude omaduste ning isoleerimise koha ja aja poolest oluliselt erineda.
BLMI eesmärgid:
1. Etioloogiline diagnoos: mikroorganismide puhaskultuuri eraldamine ja selle tuvastamine.
2. Lisaomaduste, näiteks mikroorganismi tundlikkuse määramine antibiootikumide ja bakteriofaagide suhtes.
3. Mikroorganismide arvukuse määramine (oluline UPM-i põhjustatud infektsioonide diagnoosimisel).
4. Mikroorganismide tüpiseerimine ehk liigisiseste erinevuste määramine uuringu põhjal geneetiline ja epidemioloogiline(fagovarid ja serovarid) markerid. Seda kasutatakse epidemioloogilistel eesmärkidel, kuna see võimaldab teil tuvastada erinevatest patsientidest ja väliskeskkonna erinevatest objektidest eraldatud mikroorganismide ühisust erinevates haiglates, geograafilistes piirkondades.
BLMI sisaldab mitut etappi, erinevad aeroobide, fakultatiivsete anaeroobide ja kohustuslike anaeroobide puhul.
I. BLMI etapid aeroobide ja fakultatiivsete anaeroobide puhaskultuuri eraldamisel.
Lava.
A. Materjali kogumine, transport, ladustamine, eeltöötlus. Mõnikord toimub enne külvamist materjali valikuline töötlemine, võttes arvesse isoleeritud mikroorganismi omadusi. Näiteks enne röga või muu materjali uurimist happekindla Mycobacterium tuberculosis'e esinemise suhtes töödeldakse materjali happe- või leeliselahustega.
B. Külvamine rikastuskeskkonnas(vajadusel).See viiakse läbi, kui uuritav materjal sisaldab vähesel määral baktereid, näiteks verekultuuri eraldamisel. Selleks nakatatakse söötmesse suures mahus palaviku kõrgusel võetud veri (8–10 ml täiskasvanutel, 4–5 ml lastel) vahekorras 1:10 (vere bakteritsiidse toime ületamiseks tegurid); külvi inkubeeritakse temperatuuril 37 0 C 18-24 tundi.
B. Uuritava materjali mikroskoopia. Uuritavast materjalist valmistatakse äige, värvitakse Grami või muu meetodiga ja uuritakse mikroskoobiga. Hinnake olemasolevat mikrofloorat, selle kogust. Edasiste uuringute käigus tuleks primaarses äigepreparaadis esinevad mikroorganismid eraldada.
G. Külv toitekeskkonnale isoleeritud kolooniate saamiseks. Materjal inokuleeritakse silmuse või spaatliga mehaanilise eraldamise teel diferentsiaaldiagnostilise või selektiivse söötmega plaadil, et saada isoleeritud kolooniaid. Pärast külvamist pööratakse roog tagurpidi (et vältida kolooniate määrimist kondensatsioonivedeliku tilkadega), allkirjastatakse ja asetatakse 18-24 tunniks termostaadi temperatuurile 37 0 C.
Tuleb meeles pidada, et mikroobikultuuride külvamisel ja ümberkülvamisel tuleks töötaja tähelepanu juhtida aseptikareeglite täitmisele, et vältida toitekeskkonna saastumist ning vältida teiste nakatumist ja eneseinfektsiooni!
Oportunistlike mikroorganismide põhjustatud infektsioonide korral, kui patoloogilises materjalis esinevate mikroorganismide arv on oluline, tehakse materjali kvantitatiivne nakatamine, mille jaoks valmistatakse materjali 100-kordsete lahjenduste seeria (tavaliselt 3 lahjendust). steriilses isotoonilises naatriumkloriidi lahuses katseklaasides. Pärast seda külvatakse 50 μl igast lahjendusest Petri tasside toitesöötmele.
Lava.
A. Kolooniate morfotüüpide uurimine söötmel, nende mikroskoopia. Nad vaatavad nõud läbi ja märgivad optimaalset toitainekeskkonda, kasvukiirust ja mikroorganismide kasvu iseloomu. Vali õppida isoleeritud kolooniad, mis asuvad piki lööki, keskusele lähemal. Kui kasvab mitut tüüpi kolooniaid, uuritakse igaüht eraldi. Hinnake kolooniate tunnuseid (tabel 7). Vajadusel vaadeldakse põllukultuuridega nõusid läbi suurendusklaasi või väikese suurendusega objektiivi ja kitsendatud avaga mikroskoobi abil. Uuritakse erinevate kolooniate morfotüüpide toonilisi omadusi, selleks valmistatakse ette osa uuritavast kolooniast. määrima, värvitakse Grami või muude meetoditega, mikroskoopiliselt ja määrake kultuuri puhtuse morfoloogia. Vajadusel pange indikatiivne RA klaasil polüvalentsete seerumitega.
B. Puhta kultuuri kogunemine. Puhta kultuuri akumuleerimiseks subkultuuritakse kõigi morfotüüpidega isoleeritud kolooniad eraldi katseklaasidesse kaldus agari või mõne muu toitainekeskkonnaga ja inkubeeritakse termostaadis +37 0 C juures (see temperatuur on optimaalne enamiku mikroorganismide jaoks, kuid see võib olla erinev, näiteks jaoks Campylobacterium spp.- +42 0 C, Candida spp. ja Yersinia pestis- +25 0 C).
Kligleri söödet kasutatakse tavaliselt enterobakterite akumulatsioonikeskkonnana.
Kligleri söötme koostis: MPA, 0,1% glükoosi, 1% laktoosi, vesiniksulfiidreaktiiv (raudsulfaat + naatriumtiosulfaat + naatriumsulfit), fenoolpunase indikaator. Söötme algvärv on vaarikapunane, sööde on katseklaasides “viltu”: sellel on sammas (2/3) ja kaldpind (1/3).
Kligleri söötmesse külvatakse pinnale löömise ja kolonni süstimisega.
Lava.
A. Kasvu arvestamine akumulatsioonisöötmel, kultuuri puhtuse hindamine grammi määrdumisel. kasvumustrid isoleeritud puhas kultuur. Visuaalselt puhast kultuuri iseloomustab ühtlane kasv. Kell mikroskoopiline uurimine sellisest kultuurist valmistatud värvitud äigepreparaadist leitakse selles erinevates vaateväljades morfoloogiliselt ja toonilt homogeensed rakud. Kuid teatud tüüpi bakteritele omase väljendunud pleomorfismi korral võib puhaskultuuri määrdudes esineda samaaegselt erineva morfoloogiaga rakke.
Kui akumulatsioonisöötmena kasutati Kligleri indikaatorsöödet, siis hinnatakse selle värvimuutusi kolonnis ja kaldus osas, mille järgi määratakse biokeemilised omadused: glükoosi, laktoosi käärimine ja vesiniksulfiidi tootmine. Laktoosi lagunemisel muutub söötme kaldus osa kollaseks, glükoosi lagunemisel muutub kolonn kollaseks. CO 2 moodustumisel suhkrute lagunemisel tekivad gaasimullid või kolonni purunemine. Vesiniksulfiidi tootmisel täheldatakse sissepritse ajal mustamist, mis on tingitud raudsulfaadi muundamisest raudsulfiidiks.
Kligleri söötme värvuse muutumise olemus (joonis 23) on seletatav lämmastikku sisaldavate ainete lagunemise ebaühtlase intensiivsusega mikroorganismide poolt ning leeliseliste produktide moodustumisega aeroobsel (kaldpinnal) ja anaeroobsel (aeroobsel pinnal) veerus) tingimused.
Aeroobsetes tingimustes toimub kaldpinnal intensiivsem leelise moodustumine kui keskmise kolonni korral. Seetõttu neutraliseeritakse söötmes väheses koguses oleva glükoosi lagunemisel kaldpinnal moodustunud hape kiiresti. Samas ei suuda leeliselised saadused hapet neutraliseerida keskkonnas suure kontsentratsiooniga sisalduva laktoosi lagunemisel.
Kolonni anaeroobsetes tingimustes moodustuvad leeliselised produktid ebaolulises koguses, seega tuvastatakse siin glükoosi käärimine.
Riis. 23. Kligliri indikaatorkeskkond:
1 - algustäht,
2 - kasvuga E. coli
3- kasvuga S. paratyphi B,
4 - kasvuga S. typhi
E. coli lagundavad glükoosi ja laktoosi gaasi moodustumisega, ei tooda vesiniksulfiidi. Need põhjustavad samba ja kaldosa kollaseks muutumist kandja purunemisega.
S. paratyphi lagundavad glükoosi gaaside moodustumisega, laktoosnegatiivne. Need põhjustavad samba kollaseks muutumist katkestustega, kaldus osa ei muuda värvi ja jääb vaarikaseks. Kus S. paratyphi B toota vesiniksulfiidi (süstimise ajal ilmub must värv), S. paratyphi A vesiniksulfiidi ei toodeta.
S. typhi lagundavad glükoosi ilma gaasi moodustumiseta, laktoosnegatiivne, toodavad vesiniksulfiidi. Nende tõttu muutub kolonn ilma katkestusteta kollaseks, kaldus osa ei muuda värvi ja jääb vaarikaseks, süstimise ajal ilmub must värv.
Shigella spp. glükoospositiivsed, laktoosnegatiivsed, ei tooda vesiniksulfiidi. Need põhjustavad samba kollaseks muutumist (olenevalt serovarist pausidega või ilma), kaldus osa ei muuda värvi ja jääb karmiinpunaseks.
B. Puhta kultuuri lõplik tuvastamine(eraldatud mikroorganismi süstemaatilise asukoha määramine liigi või variandi tasemel) ja eraldatud kultuuri tundlikkuse spektri määramine antibiootikumide suhtes.
Puhaskultuuri tuvastamiseks selles etapis biokeemilised, geneetilised, seroloogilised ja bioloogilised märgid(Tabel 8).
Tavapärases laboripraktikas ei ole identifitseerimise käigus vaja kõiki omadusi uurida. Kasutatakse informatiivseid, ligipääsetavaid, lihtsaid teste, millest piisab eraldatud mikroorganismi liigilise (variandi) kuuluvuse määramiseks.
26. Bakterioloogiline meetod nakkushaiguste diagnoosimiseks.
Bakterioloogiline meetod seisneb patogeeni puhaskultuuri (sama liigi baktereid sisaldava populatsiooni) eraldamises ja selle patogeeni tuvastamine on peamine bakterioloogilise uurimise meetod.
Mikroorganismide omaduste uurimist bakterioloogilises laboris, et teha kindlaks kuulumine teatud süstemaatilisesse rühma (liiki, perekonda), nimetatakse nende tuvastamiseks.
Üldjuhul on bakterioloogiliseks uurimismeetodiks mitmeetapiline bakterioloogiline uuring, mis kestab 18-24 tundi.
Bakterioloogilisel meetodil asetatakse anaeroobsed kultuurid anaerostaati. Õhk eemaldatakse õhupallist ja asendatakse gaasiseguga, mis ei sisalda hapnikku.
Bakterioloogilise meetodi aluseks on patogeeni puhaskultuuri eraldamine, mis toimub uuringu esimeses etapis. Patogeeni puhaskultuuri eraldamiseks nakatatakse võetud materjal. Külvamine toimub reeglina tihedale toitekeskkonnale, mis valitakse väidetava patogeeni omaduste põhjal.
Bakterioloogilise meetodi puhul kasutatakse võimalusel söödet, millel kasvab ainult teatud tüüpi baktereid - valikulist söödet ehk söödet, mis võimaldab eristada väidetavat patogeeni teistest mikroorganismidest, või muul viisil diferentsiaaldiagnostilist söödet.
Bakterioloogilise meetodiga toimub materjali inokuleerimine toitekeskkonnale kas klaas- või metallist spaatliga või bakterisilmuse abil nii, et uuritavas materjalis olevad bakterid hajuvad üle toitekeskkonna pinna. Sellise hajutamise tulemusena satub iga bakterirakk oma keskkonnaosasse.
Juhul, kui bakterioloogilise uurimismeetodi tulemusena eeldatakse, et uuritavas materjalis on väike kogus patogeeni, viiakse nakatamine selle akumuleerimiseks vedelal toitainekeskkonnal, nn rikastamiseks. sööde, mis on selle mikroorganismi jaoks optimaalne. Järgmisena külvatakse uuesti vedelast toitainekeskkonnast Petri tassidesse valatud tahkesse söötmesse. Patogeeniga nakatatud sööde asetatakse termostaati, tavaliselt teatud temperatuuril, mis on bakterioloogilise meetodi jaoks oluline.
Bakterioloogilise uurimismeetodi teises etapis uuritakse ühest bakterirakust pärinevaid tihedal toitekeskkonnal kasvanud bakterikolooniaid. (koloonia ja on patogeeni puhaskultuur). Kolooniate mikroskoopiline ja makroskoopiline uurimine toimub peegeldunud ja läbiva valguse käes: palja silmaga, väikese suurendusega mikroskoobi all, suurendusklaasiga.
Märgitakse ära kolooniate kultuurilised omadused: kuju, suurus, värvus, servade ja pinna iseloom, struktuur, konsistents. Lisaks kasutatakse määrde valmistamiseks osa igast sihitud kolooniast. Grami äigepreparaadid värvitakse mikroskoopiliselt, määrates isoleeritud kultuuri toonilised (seos värvusega) ja morfoloogilised omadused ning kontrollides samaaegselt selle puhtust.
Ülejäänud koloonia inokuleeritakse katseklaasidesse selle liigi jaoks optimaalse söötmega, näiteks kaldagariga, et koguda terviklikuma uuringu jaoks puhas kultuur. Torusid liigutatakse 18–24 tundi termostaadis. Teises etapis loendatakse lisaks ülaltoodud uuringutele sageli ka kasvanud kolooniate arv.
Sellise uuringu läbiviimiseks valmistatakse võetud uuritavast materjalist järjestikused lahjendused, millest külvatakse toitekeskkonnaga tassidesse, loendatakse kasvanud kolooniate arv, korrutatakse lahjendusega, millest saadakse mikroorganismide sisaldus. materjalis määratakse.
Bakterioloogilise meetodi kolmas etapp on patogeeni isoleeritud puhaskultuuri tuvastamine ja tundlikkuse määramine antibiootikumide ja muude kemoterapeutiliste ravimite suhtes. Eraldatud bakterikultuuri identifitseeritakse tooniliste, morfoloogiliste, biokeemiliste, kultuuriliste, toksikogeensete ja antigeensete omaduste järgi.
Esimese sammuna võetakse kald-agaril kasvatatud kultuurist määrd, uuritakse bakterite morfoloogiat ja kontrollitakse kasvanud bakterite kultuuri puhtust. Järgmisena inokuleeritakse isoleeritud puhas bakterikultuur Hissi söötmele. Biokeemiliste omaduste määramiseks on soovitav inokuleerida muudele söötmetele.
Toksiini moodustumine mikroobides määratakse toksiini neutraliseerimise reaktsiooniga antitoksiiniga in vivo või in vitro. Mõnel juhul uuritakse ka teisi virulentsustegureid. Ülaltoodud uuringud, mis viiakse läbi bakterioloogilises laboris, võimaldavad meil määrata patogeeni perekonna või tüübi.
Paberketta meetod põhineb bakterite kasvu pärssiva tsooni tuvastamisel antibiootikumidega immutatud ketaste ümber. Seerialahjenduste meetodi kasutamise korral lahjendatakse katseklaasides keemiline preparaat - vedela toitainekeskkonnaga antibiootikum, misjärel inokuleeritakse katseklaasidesse sama arv baktereid. Tulemused registreeritakse bakterite kasvu puudumise või olemasolu järgi. Tüvede identsuse määramise bakterioloogilise uurimismeetodi tulemusena võib saadud antibiogramm olla ka epidemioloogilisel eesmärgil.
Bakterikandja tuvastamisel võib teha korduvaid uuringuid, kuna materjali ühes osas on võimalik patogeeni mitte tuvastada.