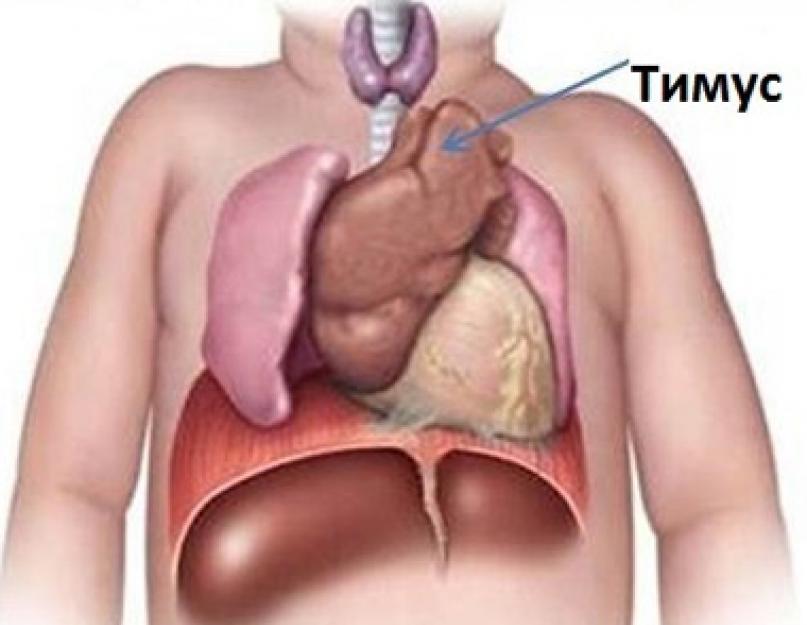
В организме детей есть уникальный и до конца еще не разгаданный орган - вилочковая, или зобная, железа. Свое название она получила потому, что по форме действительно напоминает вилку, а расположена в области, где бывает зоб. Медицинское ее название - тимус от греческого thymus - душа, жизненная сила. Видимо, древние врачеватели уже имели представление о ее роли в организме.
Что такое вилочковая железа у детей? Это - смешанный орган, относящийся одновременно и к иммунной, и к эндокринной системе. Ее лимфатическая ткань способствует вызреванию главных защитных клеток организма - Т-лимфоцитов. Клетки железистого эпителия вырабатывают в кровь более 20 гормонов (тимин, тимозин, тимопоэтин, Т-активин и другие).
Эти гормоны стимулируют различные функции организма: состояние иммунной, двигательной, нервно-психической системы, рост тела, общее самочувствие и так далее. Поэтому тимус называют «точкой счастья», и считают, что именно благодаря таким функциям этой железы дети более подвижны, веселы и жизнерадостны, чем взрослые. Считается также, что именно с исчезновением тимуса начинается процесс старения организма.
Важно! Если ребенок вял, утомляем, малоподвижен, часто болеет - это может указывать на недостаточность функции вилочковой железы.
Какие нормальные размеры и расположение железы у детей?
Вилочковая железа формируется еще у плода на 7-й неделе беременности, она активно функционирует первые 5 лет жизни, после чего начинается ее постепенная атрофия. К 25 годам она полностью перестает функционировать, а к 40 годам у большинства людей ее ткань редуцируется, исчезает.
Зобная железа расположена позади грудины на уровне бифуркации трахеи (разделения ее на правый и левый бронхи), состоит из 2-х долей, расположенных справа и слева от трахеи. Размер ее у новорожденных составляет 4×5 см, толщина - 5-6 мм, масса 15-20 г, такие параметры имеет вилочковая железа у детей до года.
Тимус в норме у детей растет параллельно с ростом тела до наступления пубертатного периода (11-14 лет), достигая к этому времени размеров 8×16 см и массы до 30-35 г, после чего рост органа прекращается и начинается его обратное развитие. В целом размеры вилочковой железы у детей зависят от их роста, а масса ее составляет 1/250 часть массы тела.
Когда увеличивается тимус у детей и как проявляется?
Родителям нередко приходится сталкиваться с увеличением (гиперплазией) вилочковой железы у ребенка. Чаще всего это наблюдается в первые 3 года жизни, причинами гиперплазии вилочковой железы у детей могут быть:
- Недостаток аминокислот (белка) в питании ребенка.
- Недостаток витаминов.
- Диатез лимфоидной ткани (разрастание лимфоузлов).
- Частые инфекции.
- Аллергия.
- Наследственный фактор.
У грудничка тимус может быть увеличен еще с внутриутробного периода, в результате неблагоприятных воздействий: инфекционных заболеваний матери, патологического течения беременности.
Тимомегалия (увеличение железы) у младенцев проявляется увеличением веса ребенка, бледностью кожи, повышенной потливостью, приступами кашля, повышением температуры тела. Состояние ребенка ухудшается в положении лежа на спине - усиливается кашель, появляется цианоз (синюшность) носа, затрудняется глотание, появляется срыгивание пищи. Характерным является синюшно-фиолетовый оттенок кожи во время плача малыша.

Важно! Увеличение вилочковой железы у детей грудного возраста может напоминать простудное заболевание, что в этот период бывает редко. Поэтому обследование тимуса в таких случаях обязательно.
Почему развивается гипоплазия железы, каковы ее симптомы?
Гораздо реже встречается гипоплазия вилочковой железы у детей, то есть ее уменьшение. Как правило, это врожденная патология, сочетающаяся с другими врожденными аномалиями:
- недоразвитием грудной клетки;
- пороками органов средостения - сердца, дыхательных путей;
- с синдромом Ди Джорджи - аномалия развития паращитовидных желез и тимуса;
- с синдромом Дауна - хромосомным заболеванием.
Это очень тяжелая патология, которая проявляется отставанием ребенка в росте и весе, снижением всех жизненных процессов, развитием судорожного синдрома, кишечного дисбактериоза, присоединением различных инфекций. Смертность у таких детей очень высока, если своевременно не начато интенсивное лечение.

Какие применяются методы диагностики?
Современный метод исследования вилочковой железы у детей - ультразвуковое сканирование. Оно не сопряжено с облучением и может без опасений выполняться сколько угодно раз, например, для контроля за лечением. Новые допплеровские технологии УЗИ вилочковой железы у детей позволяют получить максимально точные данные о размерах, расположении и структуре железы.
Обязательно выполняется лабораторное исследование: клинический анализ крови, иммунологические тесты, определение количества белка и микроэлементов (электролитов). При врожденной патологии проводятся генетические исследования.

Как проводится лечение железы у детей?
Лечение вилочковой железы у детей зависит от степени изменения ее размеров, состояния иммунитета, общего состояния и возраста ребенка, наличия сопутствующих заболеваний. В общем алгоритм лечения таков:
- Нормализация рациона питания (достаточное количество белка и витаминов).
- Режим дня с достаточными физическими нагрузками и полноценным отдыхом.
- Закаливание, занятия спортом, физкультурой.
- Прием натуральных иммуностимуляторов.
- Обязательный прием антигистаминных препаратов во время простуды, при развитии аллергических реакций.
Важно! Детям с гиперплазией тимуса противопоказан аспирин, он способствует усилению разрастания железы и развитию аспириновой астмы.
В тяжелых случаях гиперплазии тимуса у детей назначается гормональная терапия (Преднизолон, Гидрокортизон, Кортеф).
Если вилочковая железа увеличена у ребенка чрезмерно, по показаниям выполняют операцию - резекцию железы (тимэктомию). После удаления тимуса ребенок несколько лет находится под диспансерным наблюдением.
Ребенка с гиперплазией тимуса нужно тщательно беречь от простудных заболеваний и инфекций, избегать пребывания его в коллективах, местах скопления людей. Плановую вакцинацию проводят как обычно, при этом учитывают состояние ребенка, чтобы у него не было на этот момент простуды, аллергии, диатеза и других заболеваний.

Вилочковая железа играет важную роль для поддержания состояния здоровья у детей раннего возраста. Поэтому часто болеющим детям необходимо пройти ее обследование и, если это необходимо, лечение.

Описание:
Аплазия тимуса - это группа заболеваний, обусловленная генетическими дефектами иммунной системы.
Симптомы:
1. Синдром Ди-Джорджа. Наряду с аплазией железы возможна аплазия паращитовидных желез с проявлениями. В патогенезе имеет место дефицит циркулирующих Т-лимфоцитов, резкое угнетение реакции клеточного иммунитета, относительное увеличение числа В-лимфоцитов и сохранение реакции гуморального иммунитета (нормальный уровень иммуноглобулинов в крови,).
Характерными признаками заболевания являются, начиная с неонатального периода, рецидивирующие инфекции дыхательной и пищеварительной систем. Обычно сочетается с аномалиями развития дуги аорты, нижней челюсти, мочек уха, с гипоплазией лимфатических узлов и недоразвитием тимусзависимых зон.
2. Синдром Незелофа - аутосомно-рецессивная аплазия тимуса с лимфопенией, без аплазии околощитовидных желез, но с недоразвитием тимусзависимых зон в лимфатических узлах и селезенке.
Также выявляется резкое снижение реактивности Т-лимфоцитов (дефицит клеточной системы иммунитета).
С неонатального периода отмечаются рецидивирующие бронхиты, энтероколиты вирусной или грибковой этиологии, герпетические высыпания, . Дефицит Т-лимфоцитов и угнетение реакции клеточного иммунитета более выражены, чем при синдроме Ди-Джорджа. Больные погибают в раннем возрасте.
3. Синдром Луи-Бара - иммунологическая недостаточность при -телеангиэктазии, характеризуется аутосомно-рецессивным наследованием аплазии железы, протекает с уменьшением лимфоцитов в тимусзависимых зонах лимфатических узлов и селезенке, демиелинизации в мозжечке.
Многосистемные сложные расстройства:
1) неврологические (атаксия, нарушение координации и т. д.);
2) сосудистые (телеаниэктазии кожи и конъюнктивы);
3) психические (умственная отсталость);
4) эндокринные (нарушение функций надпочечников, половых желез). С раннего детства появляются рецидивирующие синусо-пульмональные инфекции.
Нарушение клеточного иммунитета сопровождается поражением Т- и В-систем иммунитета, дефицитом IgA В сыворотке крови оонаруживаются эмориональные оелки (α- и β-фетопротеины). У таких больных чаще развиваются злокачественные новообразования (чаще, лимфогранулематоз).
4. «Швейцарский синдром» - аутосомно-рецессивная тяжелая комбинированная иммунологическая недостаточность. Лимфопеническая агаммаглобулинемия, аплазия или гипоплазия тимуса сочетаются с гипоплазией всей лимфоидной ткани. Резкая гипоплазия вилочковой железы, гипоплазия лимфатических узлов и лимфоидных образований селезенки, кишечника.
С неонатального периода рецидивирующие грибковые, вирусные и бактериальные поражения кожи и слизистых оболочек носоглотки, дыхательных путей, кишечника. У таких детей вилочковую железу трудно идентифицировать.
Наряду с резким угнетением реакций клеточного иммунитета выявляется дефицит гуморального иммунитета (дефицит Т- и В-лимфоцитов). Дети обычно погибают в первые полгода жизни.
Причины возникновения:
Эта группа заболеваний обусловлена генетическими дефектами иммунной системы.
Врожденная, или первичная, аплазия (или гипоплазия) вилочковой железы характеризуется полным отсутствием тимической паренхимы или крайне слабым ее развитием, что определяет наличие тяжелой комбинированной иммунологической недостаточ¬ности вследствие резкого уменьшения содержания Т- и В-лимфоцитов и отсутствием телец вилочковой железы.
Все эти заболевания сопровождаются рецидивирующими воспалительными заболеваниями, чаще легочной или кишечной локализации, которые нередко являются непосредственной причиной гибели больных. Поэтому дети, особенно раннего возраста, страдающие рецидивирующими воспалительными заболеваниями, должны быть тщательно обследованы на функциональное состояние тимуса.
Подобные изменения находят у детей при ряде заболеваний, объединенных в группу иммунодефицитных. Наиболее выраженные дефекты развития вилочковой железы обнаружены при следующих синдромах.
Лечение:
Эта группа заболеваний обусловлена генетическими дефектами иммунной системы.
Врожденная, или первичная, аплазия (или гипоплазия) вилочковой железы характеризуется полным отсутствием тимической паренхимы или крайне слабым ее развитием, что определяет наличие тяжелой комбинированной иммунологической недостаточ¬ности вследствие резкого уменьшения содержания Т- и В-лимфоцитов и отсутствием телец вилочковой железы.
Все эти заболевания сопровождаются рецидивирующими воспалительными заболеваниями, чаще легочной или кишечной локализации, которые нередко являются непосредственной причиной гибели больных. Поэтому дети, особенно раннего возраста, страдающие рецидивирующими воспалительными заболеваниями, должны быть тщательно обследованы на функциональное состояние тимуса.
Подобные изменения находят у детей при ряде заболеваний, объединенных в группу иммунодефицитных. Наиболее выраженные дефекты развития вилочковой железы обнаружены при следующих синдромах.
1.
Синдром Ди-Джорджа.
Наряду с аплазией железы возможна аплазия паращитовидных желез с проявлениями гипопаратиреоза. В патогенезе имеет место дефицит циркулирующих Т-лимфоцитов, резкое угнетение реакции клеточного иммунитета, относительное увеличение числа В-лимфоцитов и сохранение реакции гуморального иммунитета (нормальный уровень иммуноглобулинов в крови, гипокальциемия).
Характерными признаками заболевания являются судороги, начиная с неонатального периода, рецидивирующие инфекции дыхательной и пищеварительной систем. Обычно сочетается с аномалиями развития дуги аорты, нижней челюсти, мочек уха, с гипоплазией лимфатических узлов и недоразвитием тимусзависимых зон.
2. Синдром Незелофа
- аутосомно-рецессивная аплазия тимуса с лимфопенией, без аплазии околощитовидных желез, но с недоразвитием тимусзависимых зон в лимфатических узлах и селезенке.
Также выявляется резкое снижение реактивности Т-лимфоцитов (дефицит клеточной системы иммунитета).
С неонатального периода отмечаются рецидивирующие бронхиты, пневмонии, энтероколиты вирусной или грибковой этиологии, герпетические высыпания, сепсис.
Дефицит Т-лимфоцитов и угнетение реакции клеточного иммунитета более выражены, чем при синдроме Ди-Джорджа. Больные погибают в раннем возрасте.
3. Синдром Луи-Бара
- иммунологическая недостаточность при атаксии-телеангиэктазии, характеризуется аутосомно-рецессивным наследованием аплазии железы, протекает с уменьшением лимфоцитов в тимусзависимых зонах лимфатических узлов и селезенке, демиелинизации в мозжечке.
Многосистемные сложные расстройства:
1) неврологические (атаксия, нарушение координации и т. д.);
2) сосудистые (телеаниэктазии кожи и конъюнктивы);
3) психические (умственная отсталость);
4) эндокринные (нарушение функций надпочечников, половых желез). С раннего детства появляются рецидивирующие синусо-пульмональные инфекции.
Нарушение клеточного иммунитета сопровождается поражением Т- и В-систем иммунитета, дефицитом IgA В сыворотке крови оонаруживаются эмориональные оелки (α- и β-фетопротеины). У таких больных чаще развиваются злокачественные новообразования (чаще лимфосаркомы, лимфогранулематоз).
4.
«Швейцарский синдром»
- аутосомно-рецессивная тяжелая комбинированная иммунологическая недостаточность. Лимфопеническая агаммаглобулинемия, аплазия или гипоплазия тимуса сочетаются с гипоплазией всей лимфоидной ткани. Резкая гипоплазия вилочковой железы, гипоплазия лимфатических узлов и лимфоидных образований селезенки, кишечника.
С неонатального периода рецидивирующие грибковые, вирусные и бактериальные поражения кожи и слизистых оболочек носоглотки, дыхательных путей, кишечника. У таких детей вилочковую железу трудно идентифицировать.
Наряду с резким угнетением реакций клеточного иммунитета выявляется дефицит гуморального иммунитета (дефицит Т- и В-лимфоцитов). Дети обычно погибают в первые полгода жизни.
Диагностика.
Врожденная аплазия и гипоплазия вилочковой железы устанавливается на основании клиники рецидивирующих инфекций. Для подтверждения его используются иммунологические исследования: определение количества Т- и В-лимфоцитов и их функциональной активности, концентрации иммуноглобулинов и уровень гормона железы в крови.
С целью ранней диагностики иммунодефицитных состояний, обусловленных аплазией вилочковой железы, используют определение количества лимфоцитов в периферической крови, сывороточных иммуноглобулинов, титра изогемагглютининов.
Лечение. Восстановительная и заместительная иммунотерапия. С этой целью проводится трансплантация вилочковой железы или костного мозга, введение иммуноглобулинов, гормонов вилочковой железы. Применение кортикостероидов, обладающих иммунодепрессивным действием, противопоказано.
Thymic Hypoplasia (DigeorgeSyndrome)
Гипоплазия или аплазия тимуса, паращитовидных желез и аномалии других структур формируются единовременно (например, пороки сердца, почечные патологии, аномалии лицевого черепа, в том числе волчья пасть и др.) и обусловлены делецией в хромосоме 22 q11.
Диагностические критерииВовлечение в процесс > 2 перечисленных ниже органов системы:
- тимус;
- паращитовидная железа;
- сердечно-сосудистая система.
Может наблюдаться транзиторная гипокальциемия, вызывающая судороги у новорожденных.
Сывороточные иммуноглобулины обычно в пределах нормы, но могут быть ниже, особенно IgA; уровень IgEможет быть выше нормы.
Снижено число Т-клеток и относительно повышен процент В-клеток. Соотношение хелперов и супрессоров в норме.
При полной выраженности синдрома пациенты обычно восприимчивы к оппортунистическим инфекциям (.Pneumocystisjiroveci ,грибы, вирусы), и возможен летальный исход при переливании крови вследствие реакции «трансплантат против хозяина». При частичном синдроме (с вариабельной гипоплазией) развитие и ответ на инфекцию могут быть адекватными.
Тимус часто отсутствует; при эктопии тимуса гистология в норме.
Фолликулы лимфатических узлов в норме, но в паракортикальных и тимусзависимых зонах наблюдаются участки клеточного истощения. Риск развития рака и аутоиммунных заболеваний не повышен.
Опухоли тимуса
Более 40% опухолей тимуса сопровождается паратимическими синдромами, развивающимися впоследствии и в трети случаев носящими множественный характер.
Ассоциируются
Большая миастения примерно в 35% случаев, причем в 5% случаев может появляться на 6-й год после иссечения тимомы. Тимома развивается у 15% пациентов с большой миастенией.
Приобретенная гипогаммаглобулинемия. 7-13% взрослых пациентов имеют ассоциированную ти- мому; после тимэктомии состояние не улучшается.
Истинная красно-клеточная аплазия (ИККА) выявляется приблизительно у 5% пациентов с ти- момой.
50% случаев ИККА ассоциировано с тимомой, у 25% улучшение наступает после тимэктомии. Тимома может протекать одновременно или развиться в последующем, но не предшествовать грану- лоцитопении или тромбоцитопении или им обоим в / 3 случаев; тимэктомия в данном случае бесполезна. ИККА встречается у / 3 пациентов с гипогаммаглобулинемий и тимомой.
У ребенка постоянные простудные с характерными симптомами (кашель, насморк, озноб,боль в горле), а врачи ставят один и тот же диагноз - ОРВИ?
По сути все верно, но давайте смотреть вглубь проблемы. Простудные заболевания очень часто возникают на фоне угнетенной иммунной системы организма.
Тимус в детском возрасте как раз таки и является одной из главных причин ослабления иммунитета. И с этим нужно вовремя бороться, дабы не допустить усугубления ситуации.
В данной статье мы поговорим о том, что такое вилочковая железа у, за что она отвечает, как реагировать родителям при проявлении первых симптомов проблем с тимусом и можно ли остановить это заболевание.
Немного теории
Как заявляют врачи, вилочковая железа является одним из самых важных органов в организме. Она защищает людей от многих заболеваний и борется с чужеродными микроорганизмами.
Но давайте подробно разберемся в механизме действия тимуса и рассмотрим принцип его строения в организме ребенка.
Что это и за что отвечает
Тимус (вилочковая железа, зобная железа) - V-образный орган в грудной полости человека, отвечающий за предотвращения аутоиммунных заболеваний.
Слово «тимус» в переводе с греческого означает «жизненная сила». Чаще всего проблемы с вилочковой железой наблюдаются именно в детском возрасте.
Причин тому очень много, и врачи до сих пор не знают точного ответа на вопрос: почему у ребенка увеличена вилочковая железа.
Некоторые сведения говорят о том, что причинами нарушения функционирования вилочковой железы являются: негативное влияние извне (радиационный фон, плохая экология и т.д.), генетические предрасположенности, различные нарушения в организме матери во время, нефропатия, острые инфекционные заболевания матери во время ношения ребенка.
Знаете ли вы? Американские ученые пришли к выводу, что СПИД можно побороть. Для этого необходимо научиться стимулировать выработку Т-хеллеров в зобной железе.
Тимус начинает свой активный рост с первого дня рождения. В этот момент его вес составляет всего 15 грамм. Рост продолжается вплоть до полного полового созревания, и в 15-16 лет этот орган достигает веса в 30-40 г.
С этого момента рост набирает обратный ход, и вилочковая железа постепенно уменьшается. К 70 годам жизни человека она весит не более 7 г.
Вилочковая железа имеет дольчатую форму строения. Внутри ее сохраняются В-лимфоциты и Т-лимфоциты, которые отвечают за охрану организма от чужеродных клеток.
Тимус является центральным и самым важным органом иммунной системы организма. Его угнетенная активность приводит к повышенному риску развития онкологических заболеваний.
Иногда неправильный механизм действия тимуса приводит к тому, что его Т-лимфоциты начинают вести борьбу с нормальными клетками собственного организма.

В любом случае, тимус - важная составляющая любого детского организма, и его нужно своевременно лечить в случае каких-либо патологических нарушений.
Роль вилочковой железы в организме человека была открыта совсем недавно, а именно в 1961 году в Австралии. Тогда ученый по имени Д. Миллер проводил испытания на новорожденных крысах.
В ходе испытаний он удалял вилочковые железы и наблюдал за реакцией организма животных (в частности, на реакцию трансплантации органов).
Как результат: угнетенная выработка антител (Т-лимфоцитов) и полное отторжение организмом любых пересаженных органов.
Вывод из этого такой: тимус способствует выработке и дальнейшему обучению защитных лимфоцитов. Кроме того, он не позволяет лимфоцитам атаковать собственный организм (если, конечно, в этом организме не развивается опухоль).
Где находится
Часто вопросы о том, где находится вилочковая железа, ставят в тупик даже взрослых людей. Тимус расположен в полости грудной клетки.
 Если этот орган развивается в нормальном темпе и при его развитии не наблюдается никаких патологических изменений в организме малыша, то проецируется он на 10-15 мм над рукояткой грудины.
Если этот орган развивается в нормальном темпе и при его развитии не наблюдается никаких патологических изменений в организме малыша, то проецируется он на 10-15 мм над рукояткой грудины.
Нижним концом он может достигать 3 или 4 ребра. В случаях, если у ребенка наблюдается увеличение вилочковой железы, то ее нижний конец может достигать 5 ребра.
Как проходит диагностика
На сегодняшний день самым популярным и точным методом диагностики тимуса является рентгенографическое исследование. Оно проводится только в тех случаях, когда УЗИ дает недостаточно четкое понимание о состоянии вилочковой железы.
При увеличении главного органа иммунной системы на снимках проявляется характерная треугольная или овальная лентовидная тень. Врачи, пользуясь методом J. Gewolb, могут определить степень увеличения тимуса (всего их существует 3).
Важно! Для стимуляции вилочковой железы необходимо регулярно осуществлять тепловые процедуры (посещать бани, сауны и т.д.).
 Существует морфометрическая методика определения уровня увеличения вилочковой железы у детей. Ее суть заключается в расчете коэффициента расширения тени тимуса.
Существует морфометрическая методика определения уровня увеличения вилочковой железы у детей. Ее суть заключается в расчете коэффициента расширения тени тимуса.
То есть, исследователь рассчитывает соотношение величины зобной железы к общему объему грудной клетки. В более сложных ситуациях целесообразно применять импульсную или многоосевую рентгенографию, томографию или пневмомедиастинографию.
Несмотря на такой широкий спектр возможностей современной диагностики, рентгенографические методы не всегда эффективны, так как на выходе часто получаются недостаточно точные результаты.
В большинстве медицинских учреждений России, Украины, Беларуси, Молдовы основным диагностическим методом исследования тимуса является УЗИ.
Если вы приведете своего ребенка в местную клинику, то, в первую очередь (возможно, после пальпации), врачи отправят его на ультразвуковое исследование.
 Диагностика вилочковой железы при помощи УЗИ у детей разных возрастных категорий проходит следующим образом:
Диагностика вилочковой железы при помощи УЗИ у детей разных возрастных категорий проходит следующим образом:
- новорожденных и детей в возрасте до 9 месяцев зачастую укладывают на кушетку и запрокидывают голову назад. Затем проводится процедура УЗИ;
- детей в возрасте от 9 до 18-20 месяцев обследуют в положении «сидя»;
- начиная с двухлетнего возраста процедуру УЗИ можно проводить в положении «стоя».
Многие родители не знают, что такое УЗИ тимуса у детей, как проходит процедура и для чего это вообще нужно.
На самом деле, в данном конкретном случае ультразвуковое исследование (УЗИ) поможет определить состояние вилочковой железы у ребенка (требуется ли дальнейшее лечение, или изменение незначительное и не требует терапевтических вмешательств).
Знаете ли вы? Ученые создали «укол молодости », который заставит организм взрослого человека ощутить новый и мощный прилив сил. Данная процедура подразумевает введение в тимус стволовых клеток. Как говорят эксперты, такой укол омолодит тимус, а соответственно - и стареющий организм.
 Исследование проходит при помощи специального аппарата с линейным датчиком. С помощью такого датчика проводится поперечное сканирование верхнего отдела грудной клетки ребенка.
Исследование проходит при помощи специального аппарата с линейным датчиком. С помощью такого датчика проводится поперечное сканирование верхнего отдела грудной клетки ребенка.
Датчик устанавливается параллельно грудине и рукоятке. Предварительно на грудину наносится специальная гелеобразная консистенция.
После процедуры УЗИ врачи определяют объем тимуса согласно полученным данным (длине, ширине и высоте), затем вычисляется масса органа на основе заранее рассчитанного объема и специальных коэффициентов, которые стандартизированы в медицинской литературе.
Когда известна масса вилочковой железы, врачи могут поставить соответствующий диагноз ребенку.
Нормы и отклонения
После проведенных исследований вилочковой железы врачи ставят диагноз на основе полученных данных.
Зачастую серьезных нарушений этого крошечного органа не наблюдается, и даже самое обычное увеличение тимуса (тимомегалия) не является опасной болезнью. Особо острые случаи (гиперплазия или гипоплазия), к большому счастью, наблюдаются крайне редко.

Нормальные показатели
Неважно, каким именно диагностическим методом проводили исследования тимуса (УЗИ, рентгенография и пр.), все сводится к расчету общего объема и веса данного органа.
На основании этих данных ставится конкретный диагноз. Нормальными показателями размеров тимуса для новорожденного малыша считаются: длина - 41 мм, ширина - 33 мм, толщина - 21 мм, общий объем - 13900 мм³.
Следует уточнить, что приведенные данные являются эталонными, и допускаются небольшие отклонения в ту или иную сторону. Как заявляют опытные специалисты, в нормальном состоянии вес тимуса должен составлять 0,3% от общего веса тела ребенка.
Для допускается вес вилочковой железы в диапазоне от 15 до 45 г, для подростков - от 25 до 30 г. В иных случаях врачи ставят диагноз: тимомегалия.
Увеличение (тимомегалия)
Тимомегалия, в большинстве случаев, является наследственным заболеванием и наблюдается у детей до 6 лет. Частота заболеваний тимомегалией у детей до 3-х лет составляет 13-34%, у детей от 3-х до 6-ти лет - 3-12%.
 После 6-ти лет данное заболевание редко встречается. Однако, в противном случае, таких детей вносят в группу риска по развитию аутоиммунных и онкологических заболеваний.
После 6-ти лет данное заболевание редко встречается. Однако, в противном случае, таких детей вносят в группу риска по развитию аутоиммунных и онкологических заболеваний.
Важно! Замедление роста тимуса происходит только по достижению 12-летнего возраста.
Исследователи в области биологии и медицины выделяют две формы тимомегалии: приобретенную и врожденную.
Первая из них может развиваться на фоне внешних воздействий или перенесенных патологических изменений и заболеваний (аддисонова болезнь, онкология надпочечников, пневмония, ОРВИ, васкулит).
Врожденная тимомегалия подразумевает правильно сформированный тимус, который имеет размеры больше допустимых. Такой порок практически во всех случаях не несет угрозы жизни и здоровью ребенка.
Тимомегалия может быть трех ступеней тяжести. Они отличаются согласно показателям КТТИ (кардиотимикоторакального индекса).
Показатель КТТИ до 0,33 говорит о том, что малыш полностью здоров, показатель в рамках от 0,33 до 0,37 говорит о том, что у ребенка развита первая степень тимомегалии.
 Показатели для установления диагноза тимомегалия второй степени должны находиться в рамках 0,37 – 0,42, третьей степени - свыше 0,42.
Показатели для установления диагноза тимомегалия второй степени должны находиться в рамках 0,37 – 0,42, третьей степени - свыше 0,42.
Гиперплазия и гипоплазия тимуса
Гиперплазия - острое заболевание вилочковой железы. На ее фоне начинают активно разрастаться клетки в мозговой и корковой части с одновременным формированием новых образований в тимусе.
При данном заболевании, в отличие от тимомегалии, размеры тимуса могут оставаться в норме, однако нарушаются структурная и функциональная составляющие.
Для точного определения диагноза УЗ-исследование не подойдет. В этом случае проводят рентгенографическое исследование с последующим определением характера тени вилочковой железы.
Основными причинами гиперплазии принято считать:
- онкологию;
- анемию и сердечно-сосудистые заболевания;
- аутоиммунные и эндокринные заболевания.
Гипоплазия тимуса или синдром Ди Джорджи, в большинстве случаев, возникает в случае внутриутробного инфицирования плода. Вследствие этого у новорожденного ребенка вилочковая железа недоразвита или вообще отсутствует.
 При гипоплазии у ребенка наблюдается поражения лицевой ткани и общие нарушения в строении лицевых органов.
При гипоплазии у ребенка наблюдается поражения лицевой ткани и общие нарушения в строении лицевых органов.
Кроме того, у ребенка наблюдаются нарушения в строении сердца, почек. Некоторые ученые также склонны предполагать, что к синдрому Ди Джорджи существует генетическая предрасположенность.
Знаете ли вы? Если вилочковую железу полностью удалить после пятилетнего возраста ребенка, то это никаким образом не повлияет на качество его жизни. Дело в том, что за первые пять лет тимус успевает выработать такое количество Т-лимфоцитов, которое будет защищать организм человека до глубокой старости.
В любом случае, при недоразвитом тимусе симптомы гипоплазии могут сами исчезнуть после шестилетнего возраста.
Однако все это время ребенок может быть подвержен инфекционным заболеваниям, не переносить процессы переливания крови и трансплантации органов.
Стоит ли переживать
Однозначный ответ на вопрос о том, стоит ли проводить лечение тимуса, может дать только опытный специалист после тщательной диагностики этого крошечного органа.

Симптомы, не требующие дополнительной помощи
Следует отметить, что при любых симптомах любого лучше обращаться к врачу за консультацией. Пусть он скажет, что ваш ребенок здоров, и согласитесь, вам этого будет достаточно для спокойствия на душе.
Мировые специалисты в области иммунологии говорят, что слегка увеличенная вилочковая железа у новорожденных детей - это норма. Увеличение с возрастом приходит в норму и все симптомы исчезают.
Однако в младенческом возрасте могут проявляться следующие симптомы, которые не имеют серьезных последствий:
- слегка увеличены лимфатические узлы;
- небольшое увеличение миндалин и;
- вес ребенка слегка увеличен.
Когда стоит обратиться к врачу
Существует целый ряд симптомов нарушения функциональности или изменения в размерах тимуса.
 Именно в таких случаях необходимо в краткие сроки посетить педиатра, а затем - иммунолога:
Именно в таких случаях необходимо в краткие сроки посетить педиатра, а затем - иммунолога:
- резкие скачки массы тела малыша;
- на груди образовывается венозная сетка (мраморный рисунок);
- частые срыгивания после кормления;
- возникновение кашля в горизонтальном положении;
- сильное увеличение в размерах лимфатических узлов и миндалин;
- частота заболеваний ОРВИ увеличивается в несколько раз;
- во время плача ребенка его кожа приобретает фиолетовый оттенок;
- угнетенный мышечный тонус;
- нарушение сердечного ритма;
- гипергидроз;
- у ребенка постоянно мерзнут окончания рук и ног;
- аномалии развития суставов;
- гипотония;
- крипторхизм, фимоз, гипоплазия;
- бледность (из-за анемии, проявляющейся вследствие недостачи в организме макроэлементов железа);
- потливость и длительная субфебрильная температура.
В более острых случаях, при сильном увеличении тимуса (с показателями КТТИ свыше 0,42), у ребенка могут набухать шейные вены, появляться одышка, цианоз. Такое происходит из-за сдавливания вилочковой железой жизненно важных органов.

Как проходит лечение
При тимомегалии 1 и 2 степени врачи разрешают проводить вакцинации, но только под строгим наблюдением. Помимо этого периодически оценивается состояние здоровья маленького пациента.
Вакцинация при тимомегалии 3 степени запрещена, так как иммунная система организма малыша работает неправильно и не сможет нормально отвергать даже малые количества инородных организмов.
В некоторых конкретных случаях педиатр советуется с эндокринологом и иммунологом, после чего дает добро на вакцинацию (например, вакцина против полиомиелита).
Важно! Крепкий сон и длительное пребывание на свежем воздухе способствуют скорому выздоровлению при тимомегалии.
Лечение ребенка проводят только в острых случаях, когда проблемы с вилочковой железой могут отражаться на других органов и систем организма.
Лечение бывает различных характеров, и назначается только специалистами медицинских учреждений после соответствующей диагностики.
 Ниже приведем основные моменты в лечении проблем с тимусом.
Ниже приведем основные моменты в лечении проблем с тимусом.

Знаете ли вы? Легкие постукивания кончиками пальцев по месту расположения тимуса позволят приобрести заряд энергии на весь день.
Как правило, симптоматика проблем с вилочковой железой пропадает по достижению ребенком 3-6 летнего возраста.
Иногда тимомегалия может переходить в другие заболевания, и чтобы это предотвратить, при первых симптомах болезни необходимо сразу же обращаться к врачу.
Профилактика
На сегодняшний день механизмы развития данного синдрома неизвестны, поэтому профилактические меры не могут дать высокий результат.
Известно, что тимомегалия у детей может развиваться на фоне неправильного образа жизни беременной мамы. Поэтому профилактическими мерами можно считать здоровый образ жизни женщины.
 Профилактические меры увеличенной вилочковой железы у грудничков и детей старших возрастных категорий направлены на избегание стрессовых ситуаций, регулярные занятия спортом (для старших детей).
Профилактические меры увеличенной вилочковой железы у грудничков и детей старших возрастных категорий направлены на избегание стрессовых ситуаций, регулярные занятия спортом (для старших детей).
Напоследок хотелось бы отметить, что родителям не следует пугаться тимомегалии у детей до 3-х лет. Ранее мы приводили некоторые статистические данные, и согласно им, примерно у каждого четвертого ребенка в нашей стране имеются проблемы с вилочковой железой.
Главное в этом деле: своевременное обращение к врачу и целенаправленное лечение (если такая необходимость существует).
Эта группа заболеваний обусловлена генетическими дефектами иммунной системы.
Врожденная, или первичная, аплазия (или гипоплазия) вилочковой железы характеризуется полным отсутствием тимической паренхимы или крайне слабым ее развитием, что определяет наличие тяжелой комбинированной иммунологической недостаточ¬ности вследствие резкого уменьшения содержания Т- и В-лимфоцитов и отсутствием телец вилочковой железы.
Все эти заболевания сопровождаются рецидивирующими воспалительными заболеваниями, чаще легочной или кишечной локализации, которые нередко являются непосредственной причиной гибели больных. Поэтому дети, особенно раннего возраста, страдающие рецидивирующими воспалительными заболеваниями, должны быть тщательно обследованы на функциональное состояние тимуса.
Подобные изменения находят у детей при ряде заболеваний, объединенных в группу иммунодефицитных. Наиболее выраженные дефекты развития вилочковой железы обнаружены при следующих синдромах.
1.
Синдром Ди-Джорджа.
Наряду с аплазией железы возможна аплазия паращитовидных желез с проявлениями гипопаратиреоза. В патогенезе имеет место дефицит циркулирующих Т-лимфоцитов, резкое угнетение реакции клеточного иммунитета, относительное увеличение числа В-лимфоцитов и сохранение реакции гуморального иммунитета (нормальный уровень иммуноглобулинов в крови, гипокальциемия).
Характерными признаками заболевания являются судороги, начиная с неонатального периода, рецидивирующие инфекции дыхательной и пищеварительной систем. Обычно сочетается с аномалиями развития дуги аорты, нижней челюсти, мочек уха, с гипоплазией лимфатических узлов и недоразвитием тимусзависимых зон.
2. Синдром Незелофа
- аутосомно-рецессивная аплазия тимуса с лимфопенией, без аплазии околощитовидных желез, но с недоразвитием тимусзависимых зон в лимфатических узлах и селезенке.
Также выявляется резкое снижение реактивности Т-лимфоцитов (дефицит клеточной системы иммунитета).
С неонатального периода отмечаются рецидивирующие бронхиты, пневмонии, энтероколиты вирусной или грибковой этиологии, герпетические высыпания, сепсис.
Дефицит Т-лимфоцитов и угнетение реакции клеточного иммунитета более выражены, чем при синдроме Ди-Джорджа. Больные погибают в раннем возрасте.
3. Синдром Луи-Бара
- иммунологическая недостаточность при атаксии-телеангиэктазии, характеризуется аутосомно-рецессивным наследованием аплазии железы, протекает с уменьшением лимфоцитов в тимусзависимых зонах лимфатических узлов и селезенке, демиелинизации в мозжечке.
Многосистемные сложные расстройства:
1) неврологические (атаксия, нарушение координации и т. д.);
2) сосудистые (телеаниэктазии кожи и конъюнктивы);
3) психические (умственная отсталость);
4) эндокринные (нарушение функций надпочечников, половых желез). С раннего детства появляются рецидивирующие синусо-пульмональные инфекции.
Нарушение клеточного иммунитета сопровождается поражением Т- и В-систем иммунитета, дефицитом IgA В сыворотке крови оонаруживаются эмориональные оелки (α- и β-фетопротеины). У таких больных чаще развиваются злокачественные новообразования (чаще лимфосаркомы, лимфогранулематоз).
4.
«Швейцарский синдром»
- аутосомно-рецессивная тяжелая комбинированная иммунологическая недостаточность. Лимфопеническая агаммаглобулинемия, аплазия или гипоплазия тимуса сочетаются с гипоплазией всей лимфоидной ткани. Резкая гипоплазия вилочковой железы, гипоплазия лимфатических узлов и лимфоидных образований селезенки, кишечника.
С неонатального периода рецидивирующие грибковые, вирусные и бактериальные поражения кожи и слизистых оболочек носоглотки, дыхательных путей, кишечника. У таких детей вилочковую железу трудно идентифицировать.
Наряду с резким угнетением реакций клеточного иммунитета выявляется дефицит гуморального иммунитета (дефицит Т- и В-лимфоцитов). Дети обычно погибают в первые полгода жизни.
Диагностика.
Врожденная аплазия и гипоплазия вилочковой железы устанавливается на основании клиники рецидивирующих инфекций. Для подтверждения его используются иммунологические исследования: определение количества Т- и В-лимфоцитов и их функциональной активности, концентрации иммуноглобулинов и уровень гормона железы в крови.
С целью ранней диагностики иммунодефицитных состояний, обусловленных аплазией вилочковой железы, используют определение количества лимфоцитов в периферической крови, сывороточных иммуноглобулинов, титра изогемагглютининов.
Лечение. Восстановительная и заместительная иммунотерапия. С этой целью проводится трансплантация вилочковой железы или костного мозга, введение иммуноглобулинов, гормонов вилочковой железы. Применение кортикостероидов, обладающих иммунодепрессивным действием, противопоказано.
Частые респираторные и вирусные заболевания ребенка имеют стандартное объяснение – угнетенный иммунитет, пропускающий возбудителей в растущий организм. Почему ослабевают защитные силы, родители теряются в догадках и пытаются улучшить положение введением в детский рацион витаминов. Но причина частой заболеваемости существует, относится она к сфере эндокринологии и называется гиперплазия вилочковой железы.
Роль тимуса в организме
Вилочковая железа, она же тимус является частью иммунной системы. У ребенка орган располагается вверху грудины и достигает корня языка. Формируется он во время внутриутробного развития. После появления на свет тимус у детей продолжает расти до пубертатного периода. Орган похож на вилку, его структура мягкая и дольчатая. Из первоначальных 15 г к периоду полового созревания он увеличивается до 37 г. Длина тимуса в младенчестве – около 5 см, в юности – 16 см. К старости железа уменьшается и превращается в жировую ткань весом 6 г. Серо-розовый окрас меняется на желтоватый оттенок.
Тимусу отводится важная роль в жизнедеятельности организма. Он регулирует развитие Т-лимфоцитов – иммунных клеток, задачей которых является борьба с чужеродными антигенами. Природные защитники ограждают ребенка от инфицирования и вирусно-бактериального поражения.
В случае увеличения тимус хуже выполняет свою работу, отчего иммунитет ослабевает. В результате малыш становится более восприимчивым к возбудителям разнообразных патологий, и его походы к педиатру учащаются.
Причины развития гиперплазии
Тимомегалия – другое определение разросшегося тимуса, передается генетически. У грудничков она развивается по нескольким причинам:
- поздняя беременность;
- проблемы с вынашиванием плода;
- инфекционные заболевания женщины в период ожидания малыша.
Патологическому разрастанию вилочковой железы у старших детей способствует дефицит белка в рационе. Длительное белковое голодание организма сказывается на функциях тимуса, понижает уровень лейкоцитов и угнетает иммунитет.

Еще одним виновником тимомегалии может послужить лимфатический диатез. Если лимфоткань склонна к аномальному росту, она ухудшает состояние ребенка и влияет на внутренние органы. Вилочковая железа страдает, а ее изменения обнаруживаются случайно при изучении ответов рентгенограммы органов грудины.
Внешние признаки тимомегалии
Понять, что вилочковая железа малыша увеличена, помогают некоторые характерные признаки. У новорожденных проблема распознается по избыточному весу и колебаниям массы тела в большую и меньшую стороны.
Происходят они довольно быстро. Мамы могут заметить повышенную потливость крохи, частые срыгивания и кашель, беспричинно донимающий ребенка в лежачем положении.
Со стороны кожи гиперплазия проявляется бледностью или синюшностью. Синеватый оттенок покровы приобретают при плаче или напряжении. На тканях также появляется специфический мраморный рисунок и проступает венозная сетка на груди. Мышечный тонус ослабевает. Разрастанию вилочковой железы сопутствует увеличение лимфоузлов, миндалин, аденоидов. Нормальная ритмика сердца сбивается.

Половая сфера на гиперплазию тимуса реагирует по-своему. У девочек наблюдается гипоплазия половых органов. Мальчики страдают от фимоза и крипторхизма.
Как выявляют аномалию тимуса
Информативным методом оценки состояния вилочковой железы является УЗИ. Предварительной подготовки данный вид обследования не требует. Специалист обрабатывает грудину ребенка проводящим гелем и водит по участку датчиком аппарата. Малышей возрастом до двух лет обследуют в положении сидя или лежа. Деткам постарше сонографию делают стоя.
Мама должна сообщить диагносту точный вес малыша. В норме исследуемый орган имеет массу, приравненную к 0,3 % веса тела. Превышение этого параметра говорит о тимомегалии. Протекает гиперплазия в трех степенях. Устанавливают их согласно КТТИ – кардиотимикоторакальному индексу. У ребенка диагностику проводят по таким границам КТТИ:
- 0,33 – 0,37 – I степень;
- 0,37 – 0,42 – II степень;
- свыше 0,42 – III степень.
Несмотря на аномалию, коррекцию размеров вилочковой железы обычно не проводят – орган самостоятельно возвращается к нормальным параметрам ближе к 6 годам. Но для укрепления иммунитета врачи назначают особые препараты и дают родителям рекомендации касательно режима дня и питания ребенка. Восстановление органа происходит быстрее при достаточном количестве часов сна и организации длительных прогулок на свежем воздухе.

Консервативные и срочные мероприятия
Курс консервативного лечения тимомегалии базируется на кортикостероидах и специальной диете. В составе продуктов должен главенствовать витамин C. Вещество содержится в апельсинах и лимонах, болгарском перце, цветной капусте и брокколи. Получить полезную аскорбиновую кислоту детский организм может из ягод черной смородины, плодов шиповника и облепихи.
Если вилочковая железа чрезмерно увеличена и доктор считает нужным от нее избавиться, он направит ребенка на операцию. После проведения тимэктомии пациента берут на постоянный контроль. Если же гиперплазия протекает без ярких клинических симптомов, ни медикаментозную, ни хирургическую терапию не проводят. Малышу требуется только динамическое наблюдение.
Качество жизни детей
Как будет протекать жизнь малыша при разрастании вилочковой железы, рассказывает доктор Комаровский. Если у крохи диагностирована I стадия тимомегалии, серьезной опасности еще не существует. Это лишь намёк на то, что дитя нуждается в регулярном оздоровлении.
При развитии отклонения до II степени ребенок может посещать детские коллективы и общественные мероприятия. О лечении гиперплазии еще можно не задумываться, а вот своевременное прохождение вакцинации от разных недугов – процедура обязательная.
Самой тяжелой степенью является третья, при которой болезнь способна давать осложнения. Критичной ситуация становится для детей старше 6 лет. Расшатанный иммунитет не справляется с защитой организма, наблюдаются сбои в работе надпочечников. Если специалист выявит у малыша тимусо-надпочечниковую недостаточность, кроху нужно срочно отправлять в стационар. При отсутствии положительной динамики от медикаментозной коррекции состояния вилочковой железы врач вправе настоять на операции.
Не считайте легкую степень тимомегалии несерьезной проблемой. Обязательно обследуйте тимус у малыша возрастом до года и сделайте иммунограмму для уточнения диагноза. После 6 лет ребенок нуждается в грамотной коррекции иммунного фона. Как можно скорее добейтесь улучшения состояния малыша, ведь запущенные случаи грозят летальным исходом.
При этом синдроме внутриутробно поражаются клетки эмбриона, из которых развиваются паращитовидные железы и тимус. В результате паращитовидные железы и тимус либо недоразвиты, либо полностью отсутствуют у ребенка. Поражаются и ткани, из которых формируется лицо. Это выражается недоразвитием нижней челюсти, короткой верхней губой, характерными глазными щелями, низким расположением и деформацией ушных раковин. Кроме того, у детей отмечаются врожденные нарушения со стороны сердца и крупных сосудов. Заболевание появляется спорадически, но есть предположения, что оно обусловлено генетически и наследуется аутосомно-рецессивным путем.
Клинически синдром Ди Джорджи проявляется уже при рождении. Характерны диспропорции лица, пороки сердца. Наиболее характерным симптомом в период новорожденности являются гипокальциемические судороги (вследствие недоразвития паращитовидных желез). Иммунодефицитный синдром развивается чаще во втором полугодии жизни грудного ребенка и клинически проявляется часто повторяющимися инфекциями, вызванными вирусами, грибками и условно-патогенными бактериями, вплоть до тяжелых септических процессов. В зависимости от степени недоразвития вилочковой железы симптомы иммунного дефицита могут быть очень различными (от тяжелых до легких), в связи с чем при легких случаях говорят о частичном синдроме Ди Джорджи. В крови обнаруживаются пониженный уровень кальция и повышенный уровень фосфора и понижение либо полное отсутствие гормона паращитовидных желез, что подтверждает недоразвитие или отсутствие паращитовидных желез.
Thymic Hypoplasia (DigeorgeSyndrome)
Гипоплазия или аплазия тимуса, паращитовидных желез и аномалии других структур формируются единовременно (например, пороки сердца, почечные патологии, аномалии лицевого черепа, в том числе волчья пасть и др.) и обусловлены делецией в хромосоме 22 q11.
Диагностические критерииВовлечение в процесс > 2 перечисленных ниже органов системы:
- тимус;
- паращитовидная железа;
- сердечно-сосудистая система.
Может наблюдаться транзиторная гипокальциемия, вызывающая судороги у новорожденных.
Сывороточные иммуноглобулины обычно в пределах нормы, но могут быть ниже, особенно IgA; уровень IgEможет быть выше нормы.
Снижено число Т-клеток и относительно повышен процент В-клеток. Соотношение хелперов и супрессоров в норме.
При полной выраженности синдрома пациенты обычно восприимчивы к оппортунистическим инфекциям (.Pneumocystisjiroveci ,грибы, вирусы), и возможен летальный исход при переливании крови вследствие реакции «трансплантат против хозяина». При частичном синдроме (с вариабельной гипоплазией) развитие и ответ на инфекцию могут быть адекватными.
Тимус часто отсутствует; при эктопии тимуса гистология в норме.
Фолликулы лимфатических узлов в норме, но в паракортикальных и тимусзависимых зонах наблюдаются участки клеточного истощения. Риск развития рака и аутоиммунных заболеваний не повышен.
Опухоли тимуса
Более 40% опухолей тимуса сопровождается паратимическими синдромами, развивающимися впоследствии и в трети случаев носящими множественный характер.
Ассоциируются
Большая миастения примерно в 35% случаев, причем в 5% случаев может появляться на 6-й год после иссечения тимомы. Тимома развивается у 15% пациентов с большой миастенией.
Приобретенная гипогаммаглобулинемия. 7-13% взрослых пациентов имеют ассоциированную ти- мому; после тимэктомии состояние не улучшается.
Истинная красно-клеточная аплазия (ИККА) выявляется приблизительно у 5% пациентов с ти- момой.
50% случаев ИККА ассоциировано с тимомой, у 25% улучшение наступает после тимэктомии. Тимома может протекать одновременно или развиться в последующем, но не предшествовать грану- лоцитопении или тромбоцитопении или им обоим в / 3 случаев; тимэктомия в данном случае бесполезна. ИККА встречается у / 3 пациентов с гипогаммаглобулинемий и тимомой.
ПЕРВИЧНЫЕ ИММУНОДЕФИЦИТЫ (ПИДС).
В основе ПИДС чаще лежат генетические дефекты иммунной системы на уровне афферентного или эфферентного звена. ДляПИДС с преимущественным дефектом клеточного (Т-) иммунитета связано с нарушением дифференцировки стволовой клетки предшественницы Т-клеток, с нарушением образования Т-лимфоцитов вследствие агенезии тимуса, дисплазии или гипоплазии его. При ПИДС с дефектом гуморального (В-) иммунитета может быть обусловлена нарушением дифференцировки стволовой клетки предшественницы В-клеток, с активацией Т-супрессоров, цитотоксических Т-лимфоцитов.
При комбинированных ПИДС могут иметь место один или несколько из перечисленных факторов сочетанного поражения Т-В- систем иммунитета или дефект ферментов, обеспечивающих нормальную работу иммунной системы.
Клиническими проявления ПИДС являются: снижение сопротивляемости к инфекциям, увеличением частоты инфекционных заболеваний, тяжестью и длительностью их течения, развитием тяжелых и необычных осложнений, заболеваемостью инфекционными болезнями, обусловленными микроорганизмами с низкой патогенностью. При дефекте гуморального иммунитета наблюдается предрасположенность к инфекционным болезням, вызванным грамположительными бактериями, при дефекте клеточного иммунитета – грибами, вирусами, микобактериями и грамотрицательными микробами. При ПИДС возрастает частота опухолевых заболеваний преимущественно лимфоидной ткани и аутоиммунных заболеваний.
Для понимания патологоанатомических изменений в органах иммуногенеза при ПИДС необходимо знать, что тимус, как в филогенезе, так и в онтогенезе человека формируется раньше других органов иммунитета (2-х месяцев внутриутробного развития), раньше других органов заселяется лимфоцитами и к моменту рождения ребенка является полностью сформированным. Его функция как органа иммуногенеза играет ведущую роль в перинатальном периоде и в первые годы жизни ребенка. Поэтому изменения в тимусе имеют основное значение в оценке иммунной системе детей, а, следовательно, и в решении вопроса о наличие ПИДС.
^
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ ТИМУСА
У недоношенных новорожденных и плодов 28-30 недель тимус незрелый – дольки виде пластов ретикулоэпителия, не заселены или умеренно заселены лимфоцитами, зрелые дольки присутствуют, в них хорошо различимы корковый и мозговой слой. Если незрелый тимус находят у доношенного новорожденного или у ребенка первых лет жизни, это является показателем функциональной неполноценности иммунной системы данного ребенка, которая с возрастом может исчезнуть, Такая незрелость тимуса является неблагоприятным фоновым состоянием, при котором возникают инфекционные заболевания с тяжелым течением и даже летальным исходом.
В постнатальном онтогенезе тимус претерпевает возрастную инволюцию, которая начинается с 5-7 летнего возраста и завершается к периоду полового созревания.
^
ВОЗРАСТНАЯ ИНВОЛЮЦИЯ ТИМУСА
Развивается жировая ткань, которая внедряется в дольки тимуса. Дольки уменьшаются в размерах, количество лимфоцитов в них убывает, деление на корковый и мозговой слой исчезает, тельца Гассаля становятся гомогенными, частично обызвествляются, новообразование их прекращается. При этом дольки тимуса в виде мелких островков, располагаются среди жировой ткани, сохраняются в любом возрасте. Жировая ткань особенно развита в период полового созревания и в возрасте 18-20 лет. При этом тимус имеет вид крупного жирового тела. В пожилом возрасте жировая ткань тимуса постепенно атрофируется и склерозируется.
^
АКЦИДЕНТАЛЬНАЯ ТРАНСФОРМАЦИЯ (или инволюция) ТИМУСА
Резкое уменьшение массы тимуса, возникающее под влиянием различных заболеваний, травмы, голодания, охолождения было названо акцидентальной инволюцией тимуса (латинское слово accedentis в буквальном переводе значит случайность).
Этиология АТ многообразна, что свидетельствует о стереотипности указанного явления и об отсутствии какой-либо специфичности по отношению к агенту, вызвавшему эту реакцию тимуса. АТ наблюдается при различных заболеваниях у детей, как инфекционной и неинфекционной природы, при лейкозах и злокачественных опухолях, при нарушении обмена, при белковом голодании (квашиоркор), муковисцидозе, лекарственном воздействии, например, глюкокортикоидной, цитостатической, лучевой терапии. Выделяют 5 фаз АТ тимуса.
I фаза - начинается с пролиферации в субкапсулярной зоне коры тимуса преТ-лимфоцитов, усиливается дифференцировка их в зрелые Т-лимфоциты. Началом инволютивных процессов следует считать II фазу.
II фаза – так называемая картина «звездного неба», т.к. в корковом слое тимуса идет увеличение количества макрофагов, при этом паралельно идет гибель Т-лимфоцитов, за счет апаптоза.
III фаза - гибель лимфоцитов в корковом слое при сохраненных лимфоцитах в мозговом слое. Это ведет к инверсии слоев тимических долек, идет постепенное коллабирование коркового слоя. В междольковых перегородках много тучных клеток, эозинофилов, макрофагов, фибробластов. Увеличивается количество телец Гассаля, они появляются в мозговом слое и даже в корковом, но они мелкие. Внутри тимических телец могут накапливаться лимфоциты, нейтрофилы, эозинофилы с явлениями кариопикноза и рексиса.
IV фаза – опустошение медулярной зоны, за счет гибели лимфоцитов, тимические дольки коллабированы, тимические тельца сливаются, образуя кистозно расширенные полости, заполненные гомогенными эозинофильными массами, отдельные обызвествляются. Соединительнотканная капсула тимуса и междольковая соединительная ткань расширена, в ней островки жировой ткани, инфильтрация лимфоцитами, эозинофилами, макрофагами, тучными клетками.
V фаза - нарастает огрубение стромы, от тимических долек остается узкие тяжи клеточных скоплений с включением в них тимических телец, которые полностью обызвествлены. Крупные сосуды и капсула резко склерозированы, среди стромы жировая ткань.
Таким образом IV - V фазы АТ отличаются лишь степенью склероза стромы и его сосудистого русла.
^
ЧАСТНЫЕ ФОРМЫ ПИДС
М
орфологической точки зрения изменения в тимусе при ПИДС можно охарактеризовать как дисплазию и гипоплазию органа.
ДИСПЛАЗИЯ
- НАРУШЕНИЕ ФОРМИРОВАНИЯ СОСТАВНЫХ ТКАНЕВЫХ ЭЛЕМЕНТОВ ТИМУСА ВО ВНУТРИУТРОБНОМ ПЕРИОДЕ (ЭМБРИОНАЛЬНОМ И РАННЕМ ФЕТАЛЬНОМ ПЕРИОДЕ) и характеризуется отсутствием или недоразвитием ретикулоэпителия, отсутствие (частичное или полное) заселения тимических долек лимфоцитами, а также нарушением формирования в постнатальном периоде с появлением признаков несвоевременной жировой трансформации тимуса. Согласно этого определения выделяют несколько вариантов дисплазии тимуса. Последующая классификация приводится по ВОЗ (1978г.).
^
ДИСПЛАЗИЯ ТИМУСА
- первый вариант -
по ВОЗ швейцарский тип Гланцманна-Риникера. Отсутствие или резкое недоразвитие ретикулоэпителия и скудное заселение долек лимфоцитами. Тяжелый комбинированный иммунодефицит (ТКИД), нарушается и клеточный и гуморальный иммунитет. Тип наследования аутосомно-рецессивный. В патогенезе главным является дефект лимфоидной стволовой клетки. Клинически характеризуется непостоянной лимфо - и лейкопенией. Инфекционные заболевания развиваются в первые месяцы жизни, и приводит к смерти в 6-8 месячном возрасте. При патанатомическом исследовании множественные некрозы и воспалительные инфильтраты в коже, которые являются источником сепсиса. Описаны дерматиты по типу Лейнера, эксфолиативной эритродермии типа Риттера или гистиоцитоза Х. Бактериальные инфекции сочетаются с вирусными – генерализованной ветряной оспой, коревой гигантоклеточной пневмонией, генерализованной цитомегалией, простым герпесом, аденовирусной инфекцией, поражениями грибами и пневмоцистами. Данный синдром может с лимфомами, гемолитико-уремическим синдромом, гемолитической аутоиммунной анемией, муковисцидозом и гипотиреозом.
Масса тимуса уменьшена в 5-10 раз, ретикулоэпителий недоразвит, тимические тельца отсутствуют или очень мелкие, единичны. Лимфоцитов очень мало, деление на корковый и мозговой слои нет. Лимфоидная ткань периферических органов в состоянии гипоплазии: лимфоидные фолликулы не развиты, зоны в лимфатических узлах не различимы, ткань узлов состоит из ретикулярной стромы, миелоидных элементов и малого количества лимфоцитов.
- второй вариант по ВОЗ синдром Незелофа (алимфоцитоз). Дисплазия тимуса характеризуется наличием ретикулоэпителия, который формирует дольки тимуса с множественными железистоподобными структурами, тельца Гассаля отсутствуют, лимфоциты, единичные. Страдает клеточный иммунитет. Наследуется рецессивно, сцеплен с Х – хромосомой. Патогенетическая суть сводится к нарушению дифференцировки предшественников Т-лимфоцитов в зрелые Т-лимфоциты, в связи с дисплазией тимуса. Иногда у больных отмечается недостаток сывороточных Ig, вследствие нарушения дифференцировки В-лимфоцитов. Инфекционные заболевания – пневмонии, кандидоз, коревая пневмония, генерализованный БЦЖ-ит, простой герпес, сепсис, обусловленный грамотрицательной флорой. Продолжительность жизни 1-2 года. Масса тимуса уменьшена. В лимфатических узлах, селезенке мало лимфоцитов в тимус зависимых зонах, встречаются плазмобласты. В костном мозге до 3% плазматических клеток.
- третий вариант по ВОЗ это ТКИД с дефицитом аденозиндезаминазы. Характерно поражение В – и Т – клеточного звена. Характерно рецидивирующие инфекции, вызванные Кандидами, пневмоцистами, синегнойной палочкой, цитомегаловирусами, вирусами герпеса, ветряной оспы. Часто сочетается с нарушением формирования хрящевой ткани. Без пересадки костного мозга смерть наступает в первые год жизни.
Имеет 2 типа наследования аутосомно-рецессивный (у 40%) – при этой форме нет фермента аденозиндеаминаза: при этом идет накопление деоксиаминазина, который токсичен для незрелых лимфоцитов (особо Т-л). Рецессивный, связанный с Х-хромосомой (у 50%) – мутация, которая воздействует на белок, являющийся рецептором для ИЛ-2,4,7. Морфологические изменения зависят от типа генетического дефекта. При 1-ом типе наследования - тимус маленький, без лимфоцитов. В других случаях лимфоидная ткань – гипопластична с уменьшением зон Т-клеток и Т - и В-зон.
- четвертый вариант
по ВОЗ Синдром Ди Джорджа
(гипоплазия или агенезия вилочковой железы). Обусловлен нарушением развития 3- и 4- го глоточного карманов, из которых развивается тимус, околощитовидные железы. У этих больных отсутствует клеточный иммунитет, т.к. имеется гипоплазия или аплазия тимуса, развивается тетания, т.к. нет паращитовидных желез, врожденные пороки сердца и крупных сосудов. Могут меняться внешний вид лица: гипертелоризм, антимонголоидный разрез глаз, низко посаженные уши, а также атрезия пищевода, гипотиреоз, тетрадо Фалло, гипоплазия почек и мочеточников. Из-за нарушения клеточного иммунитета нет защиты против грибковых и вирусных инфекций. Т-зависимые зоны в тимусе, селезенке отсутствуют. Плазматические клетки не страдают и уровень иммуноглобулинов неизменен. Данный синдром обусловлен нарушениями эмбриогенеза на 6-8-ой недели беременности.
- пятый вариант по ВОЗ синдром Луи – Бар (атаксия-теленангиэктазия Луи – Бар). Характерно дефицит клеточного и отчасти гуморального иммунитета в сочетании с прогрессирующей мозжечковой атаксией и околобульбарными телеангиэктазиями. Морфологически - дисплазия тимуса дольки состоят из ретикулоэпителия, нет телец Гассаля, снижение Т – лимфоцитов, дольки не делятся на корковую и мозговую зону. В ретикулоэпителии образуются гигантские клетки с гиперхромными ядрами. В периферических органах иммуногенеза гипоплазия Т-зависимых зон. В мозжечке – атрофия коры с расширением IV желудочка. При микроскопии – дистрофия или полное исчезновение грушевидных нейроцитов (клеток Пуркинье) и зернистого слоя. Такие изменения наблюдаются в передних рогах спинного мозга, гипотолямусе и диемилинизация задних столбов. В поперечной мускулатуре - вторичная атрофия, печени – очаговые некрозы, жировая дистрофия, лимфоциплазмоцитарная инфильтрация портальных трактов. В почках – хронический пиелонефрит. В легких – бронхоэктазы, абсцессы, пневмосклероз. Характерно сочетание АТЭ со злокачественными опухолями: лимфомами, лимфогранулематозом, лейкозами, медулобластомами, аденкарциномами, дисгерминомами.
Этот дефект обусловлен дефектом конечной дифференцировки Т – лимфоцитов, также аномалия плазматических мембран лимфоцитов. Наследуется по аутосомно-рецессивному типу. Часто отмечается дефицит Ig A, Ig E, IgG 2 , IgG 4 . Атаксия развивается с 4-х летнего возраста (с нарушения походки) и постепенно прогрессирует. Телеангиэктазии обнаруживаются к 1-му году жизни на бульбарной конъюнктиве, затем и в других областях. Отмечается поседение волос, потливость, атрофические дерматиты, экзема, новообразования кожи и выраженная отсталость физического развития. Вторичные половые признаки не развиваются. Менструации нерегулярные. Больные доживают до 39-41 лет.
- шестой вариант по ВОЗ агаммаглобулинемия Брутона, сцепленная с Х-хромосомой
. Характеризуется несвоевременной жировой трансформацией тимуса. Одна из самых чаще встречаемых первичных ИД. При ней отсутствует сывороточный иммуноглобулин IgG или его мало. Чаще у мальчиков, начало 8-9 месяцев: когда уменьшается кол-во иммуноглобулинов от матери. Появляются рецидивирующий конъюктевит, отит, фарингит, бронхит, пневмония, кожные инфекции (пиодермии) чаще вызываются стафилококком или гемофильной палочкой. Клеточный иммунитет не нарушен. При болезни Брутона часто развиваются аутоиммунные болезни (ревматоидный артрит, СКВ, дерматомиозит). Резко снижено или нет В-лимфоцитов. Л\у и селезенка не имеют герментативных центров, а л\у, селезенке, костном мозге и соединительной ткани, нет плазмацитов, небные миндалины в виде рудиментов, Т-лимфоциты остаются в норме.
- седьмой вариант
Хроническая гранулематозная болезнь (ХГБ, фатальная гранулематозная болезнь детей) характеризуется дефектом бактерицидной функции фагоцитов с повторными гнойно-гранулематозными процессами в коже, легких, лимфатических узлах, печени, с гипергаммаглобулинемией, анемией, лейкоцитозом.
Выделяют 2 формы ХГБ
^
1.
Наиболее распространенная, наследуется по рецессивному типу, сцепленная с Х хромосомой. Болеют мальчики (до 4-х лет), протекает тяжело.
2.
Встречается редко, наследуется по аутосомно-рецессивному типу, болеют дети обоих полов, протекает более легко. Первыми клиническими симптомами являются кожные поражения на 1-ом месяце жизни в виде экзематозных изменений с нагноением в области ушных раковин и вокруг носа, плюс регионарный лимфаденит, далее в процесс вовлекаются печень, легкие, л.узлы, кости, в которых формируются абсцессы. При патанатомическом исследовании – преждевременная жировая трансформация тимуса, во внутренних органах гранулемы, состоящие из моноцитов, нейтрофильных лейкоцитов, с последующим гнойным расплавлением и рубцеванием. При этом макрофаги и нейтрофилы нагружены ГАГ и липидами, данные клетки встречаются легких, тимусе, селезенке, л\узлах, печени. Отмечается гепато-спленомегалия.
Общий вариабельный иммунодефицит.
Это гетерогенная группа может быть врожденной или приобретенной, спорадической или семейной (с непостоянным типом наследования). Характерно – гипогаммаглобулинемия, дефект всех классов АТ, но иногда только IgG. У данных больных содержание В-лимфоцитов в крови и лимфоидной ткани не нарушено, но при этом В-лимфоциты не трансформируются в плазмоциты, нет секреции АТ. Клинически - рецидивирующие бактериальные инфекции, энтеровирусные инфекции, герпес, лямблиоз Гистологически – гиперплазия В-клеточных зон л\фолликулов,л\у, селезенке. У них высока частота развития ревматоидного артирита: пернициозной и гемолитической анемии.
^ Изолированный дефицит IgA. Характерен низкий уровень сывороточного и секреторного IgA. Данный дефицит может быть как семейным, так и приобретенным после токсоплазмоза, кори и др. вирусных инфекций. При дефиците IgА нарушается защита слизистых оболочек и развивается инфекции дыхательных путей, ЖКТ, МПС, аллергия респираторного тракта и аутоиммунные болезни (СКВ, ревматоидный артрит). Суть состоит в дефекте дифференцировки В-лимфоцитов, продуцирующих IgA. У них часто развиваются анафилактические реакции.
уют. Плазматические клетки не страдают и уровень иммуноглобулинов неизменен. Данный синдром обусловлен нарушениями эмбриогенеза на 8-ой недели беременности.
^
ГИПОПЛАЗИЯ ТИМУСА
Гипоплазия – характеризуется наличием всех структурных элементв тимуса (ретикулоэпителия, лимфоцитов), но дальнейшее развитие их не происходит, что сопровождается уменьшением массы тимуса.
^ Гипоплазия тимуса характерна для иммунодефицита с тромбоцитопенией и экземой (синдром Вискотта – Олдрича) имеет рецессивный путь наследования и связано с Х- хромосомой. Характерно тромбоцитопения, экзема, рецидивирующие инфекции, рано наступает летальный исход. Морфологически - тимус нормального строения, но имеет место прогрессирующее вторичное истощение Т-лимфоцитов в периферической крови и паракортикальных (тимусзависимых) зонах л\у со снижением клеточного иммунитета. Уровень IgM в сыворотке крови низкий, IgG – норма. Возрастает уровень IgA и Е. Часто развиваются злокачественные лимфомы.
Генетический дефицит системы комплемента
- врожденный дефицит С1, С2, С4 повышает риск развития иммунокомплексных заболеваний (СКВ).
ТИМОМЕГАЛИЯ
ТМ – увеличение массы органа в 3-4 раза по сравнению с нормой, отсутствие стереотипных фазовых изменений (включающих III-IV фазы АТ) в условиях стрессового или антигенного воздействия. С клинической позиции ТМ диагностируется рентгенологически на основании увеличения кардиотимикоторокального индекса > 0.38 . ТМ наблюдается у детей, часто болеющих ОРВИ (4-6 раз в год), при инфекционно-аллергических миокардите, ревматизме, кардиомиопатии, менингококцемии, бронхиальной астме. У этих детей чаще рахит, врожденные пороки сердца и ЦНС. При инфекционных заболеваниях у детей с ТМ смерть наступает в ранние сроки болезни. Микроскопически выделяют следующие ТМ:
В корковой зоне определяется пролиферация макрофагов и лимфобластов (первая фаза АТ) – картина «звездного неба», тимические тельца немногочисленны, мелкие, в основном клеточного строения (состоят из 3-5 кольцевидно-расположенных ретикулоэпителиальных клеток), локализуются в мозговом слое. Такой вариант встречается у детей, умерших от ОРВИ и менингококцемии в ранние сроки с момента болезни.
В корковой зоне тимуса крупные скопления, состоящие из лимфоцитов, напоминающие лимфоидные фолликулы, тельца Гассаля мелкие, либо клеточного строения, либо гомогенно-эозинофильные с сохраненными ретикулоэпителиальными клетками, расположенных на периферии. Наблюдаются при ревматизме, инфекционно-аллергическом миокардите, бронхиальной астме, кардиомиопатии, подострых и хронических аллергических реакциях.
В дольках тимуса сохраняется деление на зоны, но корковая зона преобладает над мозговой. Тимические тельца мелкие, малочисленные, клеточного строения. Наблюдается при инфекционно-аллергическом миокардите, ОРВИ, осложнившиеся пневмонией, в сочетании с пороками сердца и ЦНС.
ВРОЖДЕННЫЙ (ПЕРВИЧНЫЙ) ИММУНОДЕФИЦИТ Морфологические проявления первичной недостаточности иммунного ответа связаны, как правило, с врожденными аномалиями тимуса, либо сочетанием этих аномалий с недоразвитием селезенки и лимфатических узлов. Аплазия, гипоплазия тимуса сопровождаются дефицитом клеточного звена иммунитета или комбинированным иммунным дефицитом. При аплазии (агенезии) тимус отсутствует полностью, при гипоплазии размеры его уменьшены, деление на кору и мозговое вещество нарушено, число лимфоцитов резко снижено. В селезенке размеры фолликулов значительно уменьшены, светлые центры и плазматические клетки отсутствуют. В лимфатических узлах отсутствуют фолликулы и корковый слой (В-зависимые зоны), сохранен лишь околокорковый слой (Т-зависимая зона). Морфологические изменения в селезенке и в лимфатических узлах характерны для наследственных иммунодефицитных синдромов, связанных с дефектом как гуморального, так и клеточного иммунитета. Все типы врожденного иммунодефицита редки. В настоящее время наиболее изученными являются:
тяжелый комбинированный иммунодефицит (ТКИ);
гипоплазия тимуса (синдром Дай Джоджа);
синдром Незелофа;
врожденная агаммаглобулинемия (болезнь Брутона);
общий вариабельный (переменный) иммунодефицит;
изолированный дефицит IgA;
иммунодефициты, связанные с наследственными заболеваниями (синдром Вискотта-Олдрича, синдром атаксии-телеангиоэктазии, синдром Блюма)
дефицит комплемента
Тяжелый комбинированный иммунодефицит (ТКИ) – это одна из наиболее тяжелых форм врожденного иммунодефицита. Он характеризуется дефектом стволовых лимфоидных клеток (1 на рис. 5), что приводит к нарушению образования и T-, и B-лимфоцитов. Нарушается процесс опускания тимуса с шеи в средостение. В нем резко снижено количество лимфоцитов. Их также мало в лимфатических узлах (рис. 6Б), селезенке, лимфоидной ткани кишечника и периферической крови. В сыворотке отсутствуют иммуноглобулины (табл. 7). Недостаточность и клеточного, и гуморального иммунитета является причиной разнообразных тяжелых инфекционных (вирусных, грибковых, бактериальных) заболеваний (табл. 8), возникающих сразу после рождения, что приводит к ранней гибели (обычно на первом году жизни). Тяжелый комбинированный иммунодефицит представляет собой несколько различных врожденных болезней. Все они характеризуются нарушением дифференцировки стволовых клеток. Большинство больных имеют аутосомно-рецессивную форму (швейцарский тип); у некоторых – рецессивная форма, связанная с Х-хромосомой. Более половины пациентов с аутосомно-рецессивной формой имеют недостаток фермента аденозин-дезаминазы (АДА) в клетках. При этом не происходит преобразование аденозина в инозин, что сопровождается накоплением аденозина и его лимфотоксических метаболитов. У некоторых пациентов с тяжелым комбинированным иммунодефицитом обнаруживается недостаток нуклеотидфосфолипазы и инозинфосфолипазы, что также приводит к накоплению лимфотоксических метаболитов. Отсутствие АДА в амниотических клетках позволяет ставить диагноз в пренатальном периоде. Для лечения этих больных используется трансплантация костного мозга. Гипоплазия тимуса (синдром Дай Джоджа) характеризуется недостатком T-лимфоцитов (2 на рис. 5) в крови, в тимус зависимых зонах лимфатических узлов и селезенки (рис. 6В). Общее количество лимфоцитов в периферической крови уменьшено. У больных обнаруживаются признаки недостаточности клеточного иммунитета, которые проявляются в виде тяжелых вирусных и грибковых инфекционных заболеваний в детстве (табл. 8). Развитие В-лимфоцитов обычно не нарушено. Активность T-хелперов практически отсутствует, однако концентрация иммуноглобулинов в сыворотке обычно нормальная (табл. 7). При тимусной гипоплазии генетические дефекты не выявлены. Это состояние характеризуется также отсутствием паращитовидных желез, неправильным развитием дуги аорты и лицевого черепа. При отсутствии паращитовидных желез наблюдается выраженная гипокальциемия, приводящая к смерти в раннем возрасте. T-лимфопения при синдроме Незелофа сочетается с нарушением их функции. Предполагается, что это происходит в результате нарушения созревания Т-клеток в тимусе. Синдром Незелофа отличается от синдрома Дай Джоджа характерной ассоциацией повреждений других структур, развивающихся из третьего и четвертого глоточных карманов. Паращитовидные железы, при этом синдроме не повреждаются. Тимусная гипоплазия успешно лечится методом трансплантации человеческого эмбрионального тимуса, что восстанавливает T-клеточеный иммунитет. Врожденная агаммаглобулинемия (болезнь Брутона) – генетически обусловленное рецессивное, связанное с Х хромосомой, заболевание, которое наблюдается главным образом у мальчиков и характеризуется нарушением образования B-лимфоцитов (3 на рис. 5). Пре-В клетки (CD10 позитивные) обнаруживаются, но зрелые B-лимфоциты отсутствуют в периферической крови и в B-зонах лимфатических узлов, миндалин и селезенке. В лимфатических узлах отсутствуют реактивные фолликулы и плазматические клетки (рис. 6Г). Недостаточность гуморального иммунитета проявляется в заметном уменьшении или отсутствии иммуноглобулинов в сыворотке. Тимус и T-лимфоциты развиваются нормально и клеточный иммунитет не нарушается (табл. 7). Общее количество лимфоцитов в периферической крови находится в пределах нормы, потому что количество T-клеток, которые обычно составляют 80-90% лимфоцитов крови, находится в пределах нормы. Инфекционные заболевания у ребенка развиваются обычно во второй половине первого года жизни после того, как уровень пассивно переданных материнское антитела падает (табл. 8). Лечение таких больных производится путем введения иммуноглобулинов. Общий вариабельный иммунодефицит включает в себя несколько различных болезней, характеризуемые уменьшением уровня отдельных или всех классов иммуноглобулинов. Количество лимфоцитов в периферической крови, включая количество B-клеток, является обычно нормальным. Количество плазматических клеток обычно уменьшено, возможно в результате дефекта трансформации B-лимфоцитов (4 на рис. 5). В некоторых случаях наблюдается избыточное увеличение Т-супрессоров (5 на рис. 5), особенно при приобретенной форме болезни, которая развивается у взрослых. В некоторых случаях описано наследственная передача заболевания с различными типами наследования. Недостаток гуморального иммунного ответа ведет к рецидивирующим бактериальным инфекционным болезням и лямблиозу (табл. 8). Профилактическое введение гаммаглобулинов менее эффективно, чем при агаммаглобулинемии Брутона. Изолированный дефицит IgA – наиболее частый иммунодефицит, встречающийся у одного из 1000 людей. Он возникает в результате дефекта конечной дифференцировки плазматических клеток, секретирующих IgA (4 на рис. 5). У некоторых больных этот дефект связан с ненормальной функцией Т-супрессоров (5 на рис. 5). У большинства больных дефицит IgA протекает асимптоматически. Лишь у небольшого количества больных имеется предрасположенность к возникновению легочных и кишечных инфекций, так как у них определяется недостаток секреторного IgA в слизистых оболочках. У больных с выраженным дефицитом IgA в крови определяются анти-IgA антитела. Эти антитела могут реагировать с IgA, которые присутствуют в переливаемой крови, что приводит к развитию гиперчувствительности I типа.
Иммунодефициты, связанные с наследственными заболеваниями Синдром Вискотта-Олдрича – наследственное рецессивное заболевание, связанное с Х хромосомой, которое характеризуется экземой, тромбоцитопенией и иммунодефицитом. Дефицит T-лимфоцитов может развиваться в ходе болезни, при этом уровень IgM в сыворотке снижен. У больных развиваются рецидивирующие вирусные, грибковые и бактериальные инфекционные болезни, часто возникают лимфомы.Атаксия-телеангиоэктазия – наследственное заболевание, передающееся аутосомно рецессивно, характеризуемое мозжечковой атаксией, телеангиоэктазией кожи и дефицитами T-лимфоцитов, IgA и IgE. Возможно, что данная патология связанна с наличием дефекта в механизмах репарации ДНК, что приводит к появлению многократных разрывов нитей ДНК, особенно в хромосомах 7 и 11 (гены рецепторов T-клеток). Иногда у данных больных развиваются лимфомы.Синдром Блюма передается аутосомно рецессивно, проявляется в виде других дефектов в репарации ДНК. В клинике наблюдается дефицит иммуноглобулина и часто возникают лимфомы.
Дефицит комплемента Дефицит различных факторов комплемента встречается редко. Наиболее часто наблюдается дефицит фактора C2. Проявления дефицита фактора С3 клинически сходны с симптомами врожденной агаммаглобулинемии и характеризуются рецидивирующими бактериальными инфекционными заболеваниями в детстве. Дефицит ранних факторов комплемента (C1, C4, и C2) связан с возникновением аутоиммунных заболеваний, особенно системной красной волчанки. Дефицит конечных факторов комплемента (C6, C7 и C8) предрасполагает к возникновению рецидивирующих инфекционных болезней, вызванных Neisseria .
ВТОРИЧНЫЙ (ПРИОБРЕТЕННЫЙ) ИММУНОДЕФИЦИТ Иммунодефицит различной степени встречается довольно часто. Он возникает как вторичное явление при различных болезнях, или в результате лекарственной терапии (табл. 9) и очень редко является первичной болезнью.
|
Механизм |
|
|
Первичное заболевание |
Очень редкое; типично проявляется как гипогаммаглобулинемия у стариков. Обычно в результате увеличения количества Т-супрессоров. |
|
Вторичный при других заболеваниях |
|
|
Белково-калорийное голодание |
Гипогаммаглобулинемия |
|
Дефицит железа | |
|
Постинфекционный (лепра, корь) |
Часто – лимфопения, обычно преходящая |
|
Болезнь Ходжкина |
Нарушение функции Т-лимфоцитов |
|
Множественная (распространенная) миелома |
Нарушение синтеза иммуноглобулинов |
|
Лимфома или лимфоцитарная лейкемия |
Снижение количества нормальных лимфоцитов |
|
Поздние стадии злокачественных опухолей |
Снижение функции Т-лимфоцитов, др. неизвестные механизмы |
|
Опухоли тимуса |
Гипогаммаглобулинемия |
|
Хроническая почечная недостаточность |
Неизвестен |
|
Сахарный диабет |
Неизвестен |
|
Вызванный лекарствами иммунодефицит |
Встречается часто; вызывается кортикостероидами, противоопухолевыми препаратами, радиотерапией или при иммуносупрессии после трансплантации органов |
|
ВИЧ-инфекция (СПИД) |
Снижение количества Т-лимфоцитов, особенно Т-хелперов |
Морфология синдрома приобретенного иммунодефицита (СПИД) не имеет специфической картины и отличается на разных этапах его развития. Изменения наблюдаются как в центральных, так и в периферических органах иммуногенеза (наиболее выражены изменения в лимфоузлах). В тимусе может выявляться акцидентальная инволюция, атрофия. Акцидентальная инволюция тимуса представляет собой быстрое уменьшение его массы и объема, что сопровождается уменьшением количества Т-лимфоцитов и снижением продукции тимических гормонов. Наиболее частые причины акцидентальной инволюции – это вирусные инфекции, интоксикации, стресс. При устранении причины этот процесс обратим. При неблагоприятном исходе происходит атрофия вилочковой железы. Атрофия тимуса сопровождается коллапсом сети эпителиальных клеток, уменьшением долек паренхимы в объеме, петрификацией тимических телец, разрастанием волокнистой соединительной и жировой ткани. Резко снижено количество Т-лимфоцитов. Лимфатические узлы в начальном периоде увеличены в объеме, а затем подвергаются атрофии и склерозу. Различают три морфологических стадии изменений при вторичном иммунодефиците:
фолликулярной гиперплазии;
псевдоангиоиммунобластной гиперплазии;
истощения лимфоидной ткани.
Фолликулярная гиперплазия характеризуется системным увеличением лимфатических узлов до 2-3 см. Множество резко увеличенных фолликулов заполняют практически всю ткань лимфатического узла. Фолликулы очень объемные, с большими зародышевыми центрами. В них выявляются иммунобласты. Митозы многочисленны. Морфометрически можно констатировать нарушение соотношения субпопуляций Т-клеток, но они вариабельны и не имеют диагностической ценности. Псевдоангиоиммунобластная гиперплазия характеризуется выраженной гиперплазией венул (посткапилляров), структура фолликулов фрагментирована, либо не определяется. Лимфатический узел диффузно инфильтрирован плазмоцитами, лимфоцитами, иммунобластами, гистиоцитами. Происходит значительное уменьшение до 30% Т-лимфоцитов. Наблюдается непропорциональное нарушение соотношения субпопуляций лимфоцитов, что зависит в некоторой степени от причины, вызвавшей иммунодефицит. Так, например, у лиц ВИЧ инфицированных, характерно не только снижение Т-хелперов, но и снижение соотношения СD4/СD8 (хелперно-супрессорное соотношение), которое всегда меньше 1,0. Этот признак является главной особенностью иммунологического дефекта при СПИДе, обучловленного ВИЧ инфекцией. Для этой стадии иммунодефицита характерно развитие оппортунистических инфекций. Истощение лимфоидной ткани сменяет на заключительном этапе иммунодефицита лимфоидную гиперплазию. Лимфатические узлы в этой стадии маленькие. Структура лимфатического узла на всем протяжении не определяется, сохранены лишь капсула и его форма. Резко выражен склероз и гиалиноз пучков коллагеновых волокон. Популяция Т-лимфоцитов практически не выявляется, сохранены единичные иммунобласты, плазмобласты и макрофаги. Для этой стадии иммунодефицита характерно развитие злокачественных опухолей. Значение вторичного (приобретенного) иммунодефицита. Иммуннодефицит всегда сопровождается развитием оппортунистических инфекций и на заключительном этапе развитием злокачественных опухолей, чаще всего саркомы Капоши и злокачественных В-клеточных лимфом. Возникновение инфекционных заболеваний зависит от типа иммунодефицита:
дефицит T-клеток предрасполагает к инфекционным болезням, вызванных вирусами, микобактериями, грибами и другими внутриклеточными микроорганизмами, типа Pneumocystis carinii и Toxoplasma gondii .
дефицит B-клеток предрасполагает к гнойным бактериальным инфекционным болезням.
Эти инфекционные болезни отражают относительную важность клеточного и гуморального ответов в защите против различных микробных агентов. Саркома Капоши и злокачественные B-клеточные лимфомы – наиболее частые злокачественные новообразования, которые развиваются у больных с иммунодефицитами. Они могут возникать у больных с ВИЧ инфекцией, синдромом Вискотта-Олдрича и атаксией-телеангиоэктазией, а также у больных, получающих длительную иммуносупрессивную терапию после трансплантации органов (наиболее часто – почек). Возникновение злокачественных новообразований может быть связано или с нарушением иммунного ответа, направленного на удаление развивающихся злокачественных клеток, которые возникают в организме (отказ иммунного надзора) или благодаря иммунной стимуляции поврежденной иммунной системы, в которой нормальный механизм контроля клеточной пролиферации нарушен (это приводит к возникновению B-клеточных лимфом). В некоторых случаях, особенно при атаксии-телеангиоэктазии, иммунный дефицит связан с недолговечностью хромосом, что, как полагают, предрасполагает к развитию новообразований. Обратите внимание, что эпителиоидная тимома, первичная опухоль тимусных эпителиальных клеток, приводит к вторичному иммунодефициту.
Медико-социальная экспертиза и инвалидность при гипоплазии вилочковой железыВИЛОЧКОВОЙ ЖЕЛЕЗЫ АПЛАЗИЯ (гипоплазия) (синдром Ди Джорджа) - врожденное недоразвитие вилочковой железы в результате нарушения нормального эмбриогенеза вилочковой железы, сопровождающегося также нарушением формирования соседних органов - околощитовидных желез, аорты и другими аномалиями развития, что клинически проявляется первичным иммунодефицитом и гипопаратиреозом.
Эпидемиология: частота у детей не установлена, однако частота всех дефектов Т-клеточного иммунитета составляет 5- 10% в структуре первичных иммунодефицитов, а суммарная частота первичных форм иммунодефицитов - 2:1000.
Этиология и патогенез. Заболевание связано с нарушением внутриутробного развития плода на сроке около 8 нед; под влиянием тератогенного фактора нарушается закладка органов, развивающихся в этот период из 3-4-й глоточных щелей: вилочковой железы, паращитовидных желез, аорты, а также лицевого черепа, ЦНС. У 80-90% детей с этим синдромом выявляется делеция 22-й хромосомы (частичная моносомия по 22-й хромосоме - дефицит генетического материала), сочетающаяся с симтомокомплексом: врожденные пороки сердца, «расщепление неба» и другие пороки лицевого скелета, гипоплазия вилочковой железы и гипокальциемия из-за гиполалазии паращитовидных желез.
Клиническая картина.
С рождения у ребенка выявляется синдром гипокальцнемии (типичные гипокальциемические судороги), рецидивирующий кандидоз полости рта с трансформацией в хронический кандидоз кожи и слизистых оболочек, аномалия аорты (дуга ее развернута вправо), сепсис. Может быть врожденный порок сердца с соответствующей клинической картиной, аномалия лицевого черепа; в дальнейшем - снижение умственных способностей, задержка полового развития.
Осложнения: СН, нарушение умственного развития разной степени выраженности, поражение внутренних органов грибами Candida (кандидозный бронхит, эзофагит с последующим развитием стриктуры пищевода).
Лабораторные и инструментальные методы, подтверждающие диагноз:
1) исследование содержания паратгормона в крови;
2) биохимический анализ крови (снижение содержания кальция в крови);
3) ЭКГ, ЭхоКГ;
4) консультация психолога, невролога, психиатра;
5) микологическое обследование;
6) иммунограмма (снижение количества и функции Т-лимфоцитов).
Лечение: компенсация недостаточности ларащитовиднх желез препаратами витамина D, пересадка фетальной вилочковой железы, применение гормонов вилочковой железы с заместительной целью, трансплантация костного мозга, коррекция врожденного порока сердца, применение антимикотических средств для лечения кандидоза.
Прогноз относительно благоприятный - дети жизнеспособны, не болеют вирусными и бактериальными инфекциями, но имеют хронический кандидоз кожи и слизистых оболочек с поражением и внутренних органов, нуждаются в постоянном лечении антимикотическими препаратами; гипопаратиреоз требует также постоянной заместительной терапии препаратами витамина D; кроме того, дети отстают в умственном развитии.
Критерии инвалидности: отставание в умственном развитии, требующее обучения ребенка во вспомогательной школе, НК от 1-2ст. и выше при врожденном пороке сердца, рецидивирующий кандидоз бронхов, пищевода и других внутренних органов с нарушением их функций.
Реабилитация: медицинская реабилитация в периоды обострений; социальная, психологическая, педагогическая и профессиональная абилитация в период ремиссии заболевания.
– генетическое заболевание, относящееся к группе первичных иммунодефицитов и, наряду с ослаблением иммунитета, характеризующееся многочисленными пороками развития. Симптомами этого состояния являются частые бактериальные инфекции со склонностью к тяжелому течению, врожденные пороки сердца, аномалии развития лица и другие нарушения. Диагностика синдрома Ди Джорджи основывается на исследовании сердца, щитовидных и паращитовидных желез, изучении иммунологического статуса и данных молекулярно-генетических анализов. Лечение только симптоматическое, включает хирургическую коррекцию пороков сердца и аномалий лица, заместительную иммунологическую терапию, борьбу с бактериальными и грибковыми инфекциями.
Общие сведения
Синдром Ди Джорджи (гипоплазия тимуса и паращитовидных желез, велокардиофациальный синдром) – генетическое заболевание, обусловленное нарушением эмбрионального развития третьего и четвертого фарингеальных мешков. Впервые это состояние было описано в 1965 году американским педиатром Анджело Ди Джорджи, который классифицировал его как врожденную аплазию тимуса и паращитовидных желез. Дальнейшие исследования в области генетики помогли определить, что нарушения при этом заболевании выходят далеко за рамки первичного иммунодефицита. Это дало основание для появления другого названия синдрома Ди-Джорджи. С учетом наиболее часто поражаемых органов (небо, сердце, лицо) некоторые специалисты именуют данную патологию велокардиофациальным синдромом. Ряд современных исследователей разграничивают эти два состояния и считают, что «истинный» велокардиофациальный синдром не сопровождается выраженными иммунологическими нарушениями. Встречаемость синдрома Ди Джорджи составляет 1:3 000-20 000 – такое значительное расхождение данных обусловлено тем, что достоверная и четкая граница между этим заболеванием и велокардиофациальным синдромом до сих пор не установлена. Поэтому один и тот же больной, по мнению разных специалистов, может иметь либо первичный иммунодефицит, сопровождающийся сопутствующими нарушениями, либо многочисленнее пороки развития на фоне снижения иммунитета.
Причины синдрома Ди Джорджи
Генетическая природа синдрома Ди Джорджи заключается в повреждении центральной части длинного плеча 22-й хромосомы, где предположительно располагаются гены, кодирующие ряд важных факторов транскрипции. Удалось идентифицировать один из этих генов – TBX1, продуктом его экспрессии является белок под названием T-box. Он относится к семейству протеинов, контролирующих процессы эмбриогенеза. Доказательством взаимосвязи синдрома Ди Джорджи и TBX1 является тот факт, что незначительный процент больных не имеет выраженных повреждений 22-й хромосомы, присутствуют только мутации в этом гене. Также высказываются предположения о роли делеций иных хромосом в развитии данного заболевания. Так, аналогичные синдрому Ди Джорджи проявления выявлялись при наличии повреждений 10-й, 17-й и 18-й хромосом.
В большинстве случаев синдрома Ди Джорджи делеция 22-й хромосомы захватывает порядка 2-3 миллионов пар оснований. Чаще всего данный генетический дефект возникает спонтанно во время формирования мужских или женских половых клеток – то есть, носит герминативный характер. Лишь десятая часть всех случаев заболевания представляет собой семейную форму с аутосомно-доминантным характером наследования. Патогенез синдрома Ди Джорджи сводится к нарушению формирования особых эмбриональных образований – фарингеальных мешков (главным образом, 3-го и 4-го), которые являются предшественниками ряда тканей и органов. Главным образом, они отвечают за формирование неба, паращитовидных желез, тимуса, сосудов средостения и сердца, поэтому при синдроме Ди Джорджи возникают пороки развития именно этих органов.
Симптомы синдрома Ди Джорджи
Многие проявления синдрома Ди Джорджи определяются сразу после рождения ребенка, отдельные пороки развития (например, сердца) можно выявить еще раньше – на профилактических ультразвуковых исследованиях. Чаще всего первыми обнаруживаются аномалии развития лица – расщепление неба, иногда в сочетании с «заячьей губой », прогнатия нижней челюсти. Зачастую младенцы с синдромом Ди Джорджи имеют небольшой рот, маленький нос с расширенной переносицей, деформированные или недоразвитые хрящи ушных раковин. При относительно легком течении заболевания все вышеперечисленные симптомы могут быть выражены довольно слабо, даже расщепление твердого неба может возникать только в задней его части и выявляться лишь при тщательном осмотре у отоларинголога.
В первые месяцы жизни больного синдромом Ди Джорджи на первый план выступают проявления врожденных пороков сердца – это может быть как тетрада Фалло, так и отдельные нарушения: дефект межжелудочковой перегородки, незаращение артериального протока и ряд других. Они сопровождаются цианозом, сердечно-сосудистой недостаточностью и при отсутствии квалифицированной медицинской помощи (в том числе и хирургической) могут приводить к ранней смерти больных. Другим распространенным нарушением у детей с синдромом Ди Джорджи считаются судороги и тетания, обусловленная гипоплазией паращитовидных желез и последующей гипокальциемией.
Следующим важнейшим проявлением синдрома Ди Джорджи, отличающим его от других разновидностей велокардиофациального синдрома, является выраженный первичный иммунодефицит. Он развивается по причине аплазии или недоразвития тимуса и поэтому в большей степени затрагивает клеточный иммунитет. Однако из-за тесных взаимосвязей между гуморальным и клеточным отделами иммунной системы это приводит к общему ослаблению защитных сил организма. Больные с синдромом Ди Джорджи крайне чувствительны к вирусным, грибковым и бактериальным инфекциям, которые нередко принимают затяжное и тяжелое течение. Некоторые исследователи отмечают наличие умственной отсталости различной степени, иногда могут наблюдаться судороги неврологического происхождения.
Диагностика синдрома Ди Джорджи
Для определения синдрома Ди Джорджи применяют метод физикального общего осмотра, кардиологические исследования (ЭхоКГ, электрокардиограмма), УЗИ щитовидной железы и тимуса, иммунологические пробы. Вспомогательную роль играет проведение общего и биохимического анализов крови, изучение анамнеза больного, генетические исследования. При осмотре больных синдромом Ди Джорджи могут определяться характерные для заболевания нарушения – расщепление твердого неба, аномалии строения лица, патологии ЛОР-органов. В анамнезе, как правило, выявляются частые эпизоды вирусных и грибковых инфекций, принимающих тяжелое течение, судороги, обусловленные гипокальциемией, нередко обнаруживается обширное кариозное поражение зубов.
На ультразвуковых исследованиях вилочковой железы отмечается значительное уменьшение массы или даже полное отсутствие органа (агенезия). ЭхоКГ и другие кардиологические методы диагностики выявляют многочисленные пороки сердца (например, дефект межжелудочковой перегородки) и сосудов средостения. Иммунологические исследования подтверждают значительное падение уровня Т-лимфоцитов. Это же явление наблюдается в периферической крови и нередко сочетается с уменьшением концентрации белков-иммуноглобулинов. Биохимическое изучение крови свидетельствует о снижении уровня кальция и гормонов паращитовидной железы. Врач-генетик может выполнить поиск делеций в 22-й хромосоме посредством флуоресцентной гибридизации ДНК или мультиплексной полимеразной цепной реакции.
Лечение синдрома Ди Джорджи
Специфического лечения синдрома Ди Джорджи на сегодняшний момент не существует, используют только паллиативные и симптоматические методики. Очень важно как можно раньше выявить врожденные пороки сердца и при необходимости произвести их хирургическую коррекцию, поскольку именно сердечно-сосудистые нарушения являются наиболее частой причиной неонатальной смерти при этом заболевании. Значительную опасность представляют собой судорожные приступы, обусловленные гипокальциемией, что требует своевременной коррекции электролитного баланса плазмы крови. Помощь хирургов при синдроме Ди Джорджи также может потребоваться для устранения пороков развития лица и неба.
Из-за выраженного иммунодефицита любые признаки бактериальной, вирусной или грибковой инфекции являются поводом для срочного применения соответствующих препаратов (антибиотиков, противовирусных и фунгицидных средств). Для улучшения иммунного статуса больного синдромом Ди Джорджи может производиться заместительное вливание иммуноглобулинов, полученных из донорской плазмы. В отдельных случаях осуществлялась пересадка вилочковой железы, которая стимулировала образование собственных Т-лимфоцитов – это способствовало улучшению качества жизни больных.
Прогноз и профилактика синдрома Ди Джорджи
Прогноз синдрома Ди Джорджи большинством исследователей оценивается как неопределенный, так как данное заболевание характеризуется значительной вариабельностью симптомов. В тяжелых случаях имеется высокий риск ранней неонатальной смерти из-за сочетания сердечно-сосудистых и иммунологических нарушений. Более доброкачественные формы синдрома Ди Джорджи требуют достаточно интенсивной паллиативной терапии, особенно важно уделять внимание лечению и профилактике вирусных и грибковых инфекций. Интеллектуальное развитие больных несколько замедлено, однако при правильной педагогической и психологической коррекции проявления задержки развития можно нивелировать. Из-за частого спонтанного характера мутаций профилактика синдрома Ди Джорджи не разработана.
В организме детей есть уникальный и до конца еще не разгаданный орган - вилочковая, или зобная, железа. Свое название она получила потому, что по форме действительно напоминает вилку, а расположена в области, где бывает зоб. Медицинское ее название - тимус от греческого thymus - душа, жизненная сила. Видимо, древние врачеватели уже имели представление о ее роли в организме.
Что такое вилочковая железа у детей? Это - смешанный орган, относящийся одновременно и к иммунной, и к эндокринной системе. Ее лимфатическая ткань способствует вызреванию главных защитных клеток организма - Т-лимфоцитов. Клетки железистого эпителия вырабатывают в кровь более 20 гормонов (тимин, тимозин, тимопоэтин, Т-активин и другие).
Эти гормоны стимулируют различные функции организма: состояние иммунной, двигательной, нервно-психической системы, рост тела, общее самочувствие и так далее. Поэтому тимус называют «точкой счастья», и считают, что именно благодаря таким функциям этой железы дети более подвижны, веселы и жизнерадостны, чем взрослые. Считается также, что именно с исчезновением тимуса начинается процесс старения организма.
Важно! Если ребенок вял, утомляем, малоподвижен, часто болеет - это может указывать на недостаточность функции вилочковой железы.
Какие нормальные размеры и расположение железы у детей?
Вилочковая железа формируется еще у плода на 7-й неделе беременности, она активно функционирует первые 5 лет жизни, после чего начинается ее постепенная атрофия. К 25 годам она полностью перестает функционировать, а к 40 годам у большинства людей ее ткань редуцируется, исчезает.
Зобная железа расположена позади грудины на уровне бифуркации трахеи (разделения ее на правый и левый бронхи), состоит из 2-х долей, расположенных справа и слева от трахеи. Размер ее у новорожденных составляет 4×5 см, толщина - 5-6 мм, масса 15-20 г, такие параметры имеет вилочковая железа у детей до года.
Тимус в норме у детей растет параллельно с ростом тела до наступления пубертатного периода (11-14 лет), достигая к этому времени размеров 8×16 см и массы до 30-35 г, после чего рост органа прекращается и начинается его обратное развитие. В целом размеры вилочковой железы у детей зависят от их роста, а масса ее составляет 1/250 часть массы тела.

Когда увеличивается тимус у детей и как проявляется?
Родителям нередко приходится сталкиваться с увеличением (гиперплазией) вилочковой железы у ребенка. Чаще всего это наблюдается в первые 3 года жизни, причинами гиперплазии вилочковой железы у детей могут быть:
- Недостаток аминокислот (белка) в питании ребенка.
- Недостаток витаминов.
- Диатез лимфоидной ткани (разрастание лимфоузлов).
- Частые инфекции.
- Аллергия.
- Наследственный фактор.
У грудничка тимус может быть увеличен еще с внутриутробного периода, в результате неблагоприятных воздействий: инфекционных заболеваний матери, патологического течения беременности.
Тимомегалия (увеличение железы) у младенцев проявляется увеличением веса ребенка, бледностью кожи, повышенной потливостью, приступами кашля, повышением температуры тела. Состояние ребенка ухудшается в положении лежа на спине - усиливается кашель, появляется цианоз (синюшность) носа, затрудняется глотание, появляется срыгивание пищи. Характерным является синюшно-фиолетовый оттенок кожи во время плача малыша.

Важно! Увеличение вилочковой железы у детей грудного возраста может напоминать простудное заболевание, что в этот период бывает редко. Поэтому обследование тимуса в таких случаях обязательно.
Почему развивается гипоплазия железы, каковы ее симптомы?
Гораздо реже встречается гипоплазия вилочковой железы у детей, то есть ее уменьшение. Как правило, это врожденная патология, сочетающаяся с другими врожденными аномалиями:
- недоразвитием грудной клетки;
- пороками органов средостения - сердца, дыхательных путей;
- с синдромом Ди Джорджи - аномалия развития паращитовидных желез и тимуса;
- с синдромом Дауна - хромосомным заболеванием.
Это очень тяжелая патология, которая проявляется отставанием ребенка в росте и весе, снижением всех жизненных процессов, развитием судорожного синдрома, кишечного дисбактериоза, присоединением различных инфекций. Смертность у таких детей очень высока, если своевременно не начато интенсивное лечение.

Какие применяются методы диагностики?
Современный метод исследования вилочковой железы у детей - ультразвуковое сканирование. Оно не сопряжено с облучением и может без опасений выполняться сколько угодно раз, например, для контроля за лечением. Новые допплеровские технологии УЗИ вилочковой железы у детей позволяют получить максимально точные данные о размерах, расположении и структуре железы.
Обязательно выполняется лабораторное исследование: клинический анализ крови, иммунологические тесты, определение количества белка и микроэлементов (электролитов). При врожденной патологии проводятся генетические исследования.

Как проводится лечение железы у детей?
Лечение вилочковой железы у детей зависит от степени изменения ее размеров, состояния иммунитета, общего состояния и возраста ребенка, наличия сопутствующих заболеваний. В общем алгоритм лечения таков:
- Нормализация рациона питания (достаточное количество белка и витаминов).
- Режим дня с достаточными физическими нагрузками и полноценным отдыхом.
- Закаливание, занятия спортом, физкультурой.
- Прием натуральных иммуностимуляторов.
- Обязательный прием антигистаминных препаратов во время простуды, при развитии аллергических реакций.
Важно! Детям с гиперплазией тимуса противопоказан аспирин, он способствует усилению разрастания железы и развитию аспириновой астмы.
В тяжелых случаях гиперплазии тимуса у детей назначается гормональная терапия (Преднизолон, Гидрокортизон, Кортеф).
Если вилочковая железа увеличена у ребенка чрезмерно, по показаниям выполняют операцию - резекцию железы (тимэктомию). После удаления тимуса ребенок несколько лет находится под диспансерным наблюдением.
Ребенка с гиперплазией тимуса нужно тщательно беречь от простудных заболеваний и инфекций, избегать пребывания его в коллективах, местах скопления людей. Плановую вакцинацию проводят как обычно, при этом учитывают состояние ребенка, чтобы у него не было на этот момент простуды, аллергии, диатеза и других заболеваний.

Вилочковая железа играет важную роль для поддержания состояния здоровья у детей раннего возраста. Поэтому часто болеющим детям необходимо пройти ее обследование и, если это необходимо, лечение.
При нарушении функции Т-лимфоцитов инфекционные и другие заболевания протекают, как правило, тяжелее, чем при недостаточности антител. Больные в таких случаях обычно погибают еще в грудном или раннем детском возрасте. Продукты поврежденных генов установлены лишь для некоторых первичных нарушений функции Т-лимфоцитов. Методом выбора при лечении этих больных в настоящее время является трансплантация тимуса или костного мозга от совместимых по HLA сибсов или гаплоидентичных (полусовместимых) родителей.
Гипоплазия или аплазия тимуса (вследствие нарушения его закладки на ранних стадиях эмбриогенеза) часто сопровождается дизморфией паращитовидных желез и других структур, формирующихся в то же время. У больных наблюдаются атрезия пищевода, расщепление нёбного язычка, врожденные пороки сердца и крупных сосудов (дефекты межпредсердной и межжелудочковой перегородки, правосторонняя дуга аорты и др.).
Типичные черты лица больных гипоплазией : укорочение губного желобка, гипертелоризм, антимонголоидный разрез глаз, микрогнатия, низко расположенные уши. Нередко первым указанием на данный синдром служат гипокальциемические судороги у новорожденных. Аналогичные черты лица и аномалии отходящих от сердца крупных сосудов наблюдаются при фетальном алкогольном синдроме.
Генетика и патогенез гипоплазии тимуса
Синдром Ди Джорджи встречается как у мальчиков, так и у девочек. Семейные случаи редки, и поэтому его не относят к наследственным заболеваниям. Однако более чем у 95% больных найдены микроделеции участков сегмента qll.2 хромосомы 22 (специфичный для синдрома Ди Джорджи участок ДНК). Эти делении, по-видимому, чаще передаются по материнской линии.
Их можно быстро обнаружить путем генотипирования с помощью ПЦР микросателлитных ДНК-маркеров, расположенных в соответствующей области. Аномалии крупных сосудов и делении участков длинного плеча хромосомы 22 объединяют синдром Ди Джорджи с велокардиофациальным и конотрункальным лицевым синдромом. Поэтому в настоящее время говорят о синдроме САТСН22 (Cardiac, Abnormal facies, Thymic hypoplasia, Cleft palate, Hypocalcemia - пороки сердца, аномалии строения лица, гипоплазия тимуса, расщепление нёба, гипокальциемия), включающем широкий спектр состояний, связанных с делециями 22q. При синдроме Ди Джорджи и велокардиофациальном синдроме найдены также делеции участков сегмента р13 хромосомы 10.
Концентрация иммуноглобулинов в сыворотке при гипоплазии тимуса обычно нормальная, но уровень IgA бывает сниженным, a IgE - повышенным. Абсолютное число лимфоцитов лишь ненамного ниже возрастной нормы. Число CD Т-лимфоцитов уменьшено в соответствии со степенью гипоплазии тимуса, и поэтому доля В-лимфоцитов оказывается повышенной. Реакция лимфоцитов на митогены зависит от степени недостаточности тимуса.
В тимусе, если он присутствует, обнаруживают тельца Гассаля , нормальную плотность тимоцитов и четкую границу между корковым и мозговым веществом. Лимфоидные фолликулы обычно сохранены, но в парааортальных лимфатических узлах и тимусзависимой области селезенки количество клеток обычно снижено.
Клинические проявления гипоплазии тимуса
Чаще имеет место не полная аплазия, а лишь и паращитовидных желез, называемая неполным синдромом Ди Джорджи. Такие дети растут нормально и не слишком страдают от инфекционных заболеваний. При полном синдроме Ди Джорджи, как и у больных с тяжелым комбинированным иммунодефицитом, повышена восприимчивость к условнопатогенной и оппортунистической флоре, включая грибы, вирусы и P. carinii, а при переливании необлученной крови часто развивается реакция «трансплантат против хозяина».
;Это очень тяжелая патология, которая проявляется отставанием ребенка в росте и весе, снижением всех жизненных процессов, развитием судорожного синдрома, кишечного дисбактериоза, присоединением различных инфекций. Смертность у таких детей очень высока, если своевременно не начато интенсивное лечение.
Какие применяются методы диагностики?
Современный метод исследования вилочковой железы у детей - ультразвуковое сканирование. Оно не сопряжено с облучением и может без опасений выполняться сколько угодно раз, например, для контроля за лечением. Новые допплеровские технологии УЗИ вилочковой железы у детей позволяют получить максимально точные данные о размерах, расположении и структуре железы.
Обязательно выполняется лабораторное исследование: клинический анализ крови, иммунологические тесты, определение количества белка и микроэлементов (электролитов). При врожденной патологии проводятся генетические исследования.

Как проводится лечение железы у детей?
Лечение вилочковой железы у детей зависит от степени изменения ее размеров, состояния иммунитета, общего состояния и возраста ребенка, наличия сопутствующих заболеваний. В общем алгоритм лечения таков:
- Нормализация рациона питания (достаточное количество белка и витаминов).
- Режим дня с достаточными физическими нагрузками и полноценным отдыхом.
- Закаливание, занятия спортом, физкультурой.
- Прием натуральных иммуностимуляторов.
- Обязательный прием антигистаминных препаратов во время простуды, при развитии аллергических реакций.
Важно! Детям с гиперплазией тимуса противопоказан аспирин, он способствует усилению разрастания железы и развитию аспириновой астмы.
В тяжелых случаях гиперплазии тимуса у детей назначается гормональная терапия (Преднизолон, Гидрокортизон, Кортеф).
Если вилочковая железа увеличена у ребенка чрезмерно, по показаниям выполняют операцию - резекцию железы (тимэктомию). После удаления тимуса ребенок несколько лет находится под диспансерным наблюдением.
Ребенка с гиперплазией тимуса нужно тщательно беречь от простудных заболеваний и инфекций, избегать пребывания его в коллективах, местах скопления людей. Плановую вакцинацию проводят как обычно, при этом учитывают состояние ребенка, чтобы у него не было на этот момент простуды, аллергии, диатеза и других заболеваний.

Вилочковая железа играет важную роль для поддержания состояния здоровья у детей раннего возраста. Поэтому часто болеющим детям необходимо пройти ее обследование и, если это необходимо, лечение.
Эта группа заболеваний обусловлена генетическими дефектами иммунной системы.Врожденная, или первичная, аплазия (или гипоплазия) вилочковой железы характеризуется полным отсутствием тимической паренхимы или крайне слабым ее развитием, что определяет наличие тяжелой комбинированной иммунологической недостаточ¬ности вследствие резкого уменьшения содержания Т- и В-лимфоцитов и отсутствием телец вилочковой железы.
Все эти заболевания сопровождаются рецидивирующими воспалительными заболеваниями, чаще легочной или кишечной локализации, которые нередко являются непосредственной причиной гибели больных. Поэтому дети, особенно раннего возраста, страдающие рецидивирующими воспалительными заболеваниями, должны быть тщательно обследованы на функциональное состояние тимуса.
Подобные изменения находят у детей при ряде заболеваний, объединенных в группу иммунодефицитных. Наиболее выраженные дефекты развития вилочковой железы обнаружены при следующих синдромах.
1.
Синдром Ди-Джорджа.
Наряду с аплазией железы возможна аплазия паращитовидных желез с проявлениями гипопаратиреоза. В патогенезе имеет место дефицит циркулирующих Т-лимфоцитов, резкое угнетение реакции клеточного иммунитета, относительное увеличение числа В-лимфоцитов и сохранение реакции гуморального иммунитета (нормальный уровень иммуноглобулинов в крови, гипокальциемия).
Характерными признаками заболевания являются судороги, начиная с неонатального периода, рецидивирующие инфекции дыхательной и пищеварительной систем. Обычно сочетается с аномалиями развития дуги аорты, нижней челюсти, мочек уха, с гипоплазией лимфатических узлов и недоразвитием тимусзависимых зон.
2. Синдром Незелофа
- аутосомно-рецессивная аплазия тимуса с лимфопенией, без аплазии околощитовидных желез, но с недоразвитием тимусзависимых зон в лимфатических узлах и селезенке.
Также выявляется резкое снижение реактивности Т-лимфоцитов (дефицит клеточной системы иммунитета).
С неонатального периода отмечаются рецидивирующие бронхиты, пневмонии, энтероколиты вирусной или грибковой этиологии, герпетические высыпания, сепсис.
Дефицит Т-лимфоцитов и угнетение реакции клеточного иммунитета более выражены, чем при синдроме Ди-Джорджа. Больные погибают в раннем возрасте.
3. Синдром Луи-Бара
- иммунологическая недостаточность при атаксии-телеангиэктазии, характеризуется аутосомно-рецессивным наследованием аплазии железы, протекает с уменьшением лимфоцитов в тимусзависимых зонах лимфатических узлов и селезенке, демиелинизации в мозжечке.
Многосистемные сложные расстройства:
1) неврологические (атаксия, нарушение координации и т. д.);
2) сосудистые (телеаниэктазии кожи и конъюнктивы);
3) психические (умственная отсталость);
4) эндокринные (нарушение функций надпочечников, половых желез). С раннего детства появляются рецидивирующие синусо-пульмональные инфекции.
Нарушение клеточного иммунитета сопровождается поражением Т- и В-систем иммунитета, дефицитом IgA В сыворотке крови оонаруживаются эмориональные оелки (α- и β-фетопротеины). У таких больных чаще развиваются злокачественные новообразования (чаще лимфосаркомы, лимфогранулематоз).
4.
«Швейцарский синдром»
- аутосомно-рецессивная тяжелая комбинированная иммунологическая недостаточность. Лимфопеническая агаммаглобулинемия, аплазия или гипоплазия тимуса сочетаются с гипоплазией всей лимфоидной ткани. Резкая гипоплазия вилочковой железы, гипоплазия лимфатических узлов и лимфоидных образований селезенки, кишечника.
С неонатального периода рецидивирующие грибковые, вирусные и бактериальные поражения кожи и слизистых оболочек носоглотки, дыхательных путей, кишечника. У таких детей вилочковую железу трудно идентифицировать.
Наряду с резким угнетением реакций клеточного иммунитета выявляется дефицит гуморального иммунитета (дефицит Т- и В-лимфоцитов). Дети обычно погибают в первые полгода жизни.
Диагностика.
Врожденная аплазия и гипоплазия вилочковой железы устанавливается на основании клиники рецидивирующих инфекций. Для подтверждения его используются иммунологические исследования: определение количества Т- и В-лимфоцитов и их функциональной активности, концентрации иммуноглобулинов и уровень гормона железы в крови.
С целью ранней диагностики иммунодефицитных состояний, обусловленных аплазией вилочковой железы, используют определение количества лимфоцитов в периферической крови, сывороточных иммуноглобулинов, титра изогемагглютининов.
Лечение. Восстановительная и заместительная иммунотерапия. С этой целью проводится трансплантация вилочковой железы или костного мозга, введение иммуноглобулинов, гормонов вилочковой железы. Применение кортикостероидов, обладающих иммунодепрессивным действием, противопоказано.
Thymic Hypoplasia (DigeorgeSyndrome)
Гипоплазия или аплазия тимуса, паращитовидных желез и аномалии других структур формируются единовременно (например, пороки сердца, почечные патологии, аномалии лицевого черепа, в том числе волчья пасть и др.) и обусловлены делецией в хромосоме 22 q11.
Диагностические критерииВовлечение в процесс > 2 перечисленных ниже органов системы:
- тимус;
- паращитовидная железа;
- сердечно-сосудистая система.
Может наблюдаться транзиторная гипокальциемия, вызывающая судороги у новорожденных.
Сывороточные иммуноглобулины обычно в пределах нормы, но могут быть ниже, особенно IgA; уровень IgEможет быть выше нормы.
Снижено число Т-клеток и относительно повышен процент В-клеток. Соотношение хелперов и супрессоров в норме.
При полной выраженности синдрома пациенты обычно восприимчивы к оппортунистическим инфекциям (.Pneumocystisjiroveci ,грибы, вирусы), и возможен летальный исход при переливании крови вследствие реакции «трансплантат против хозяина». При частичном синдроме (с вариабельной гипоплазией) развитие и ответ на инфекцию могут быть адекватными.
Тимус часто отсутствует; при эктопии тимуса гистология в норме.
Фолликулы лимфатических узлов в норме, но в паракортикальных и тимусзависимых зонах наблюдаются участки клеточного истощения. Риск развития рака и аутоиммунных заболеваний не повышен.
Опухоли тимуса
Более 40% опухолей тимуса сопровождается паратимическими синдромами, развивающимися впоследствии и в трети случаев носящими множественный характер.
Ассоциируются
Большая миастения примерно в 35% случаев, причем в 5% случаев может появляться на 6-й год после иссечения тимомы. Тимома развивается у 15% пациентов с большой миастенией.
Приобретенная гипогаммаглобулинемия. 7-13% взрослых пациентов имеют ассоциированную ти- мому; после тимэктомии состояние не улучшается.
Истинная красно-клеточная аплазия (ИККА) выявляется приблизительно у 5% пациентов с ти- момой.
50% случаев ИККА ассоциировано с тимомой, у 25% улучшение наступает после тимэктомии. Тимома может протекать одновременно или развиться в последующем, но не предшествовать грану- лоцитопении или тромбоцитопении или им обоим в / 3 случаев; тимэктомия в данном случае бесполезна. ИККА встречается у / 3 пациентов с гипогаммаглобулинемий и тимомой.
У ребенка постоянные простудные с характерными симптомами (кашель, насморк, озноб,боль в горле), а врачи ставят один и тот же диагноз - ОРВИ?
По сути все верно, но давайте смотреть вглубь проблемы. Простудные заболевания очень часто возникают на фоне угнетенной иммунной системы организма.
Тимус в детском возрасте как раз таки и является одной из главных причин ослабления иммунитета. И с этим нужно вовремя бороться, дабы не допустить усугубления ситуации.
В данной статье мы поговорим о том, что такое вилочковая железа у, за что она отвечает, как реагировать родителям при проявлении первых симптомов проблем с тимусом и можно ли остановить это заболевание.
Немного теории
Как заявляют врачи, вилочковая железа является одним из самых важных органов в организме. Она защищает людей от многих заболеваний и борется с чужеродными микроорганизмами.
Но давайте подробно разберемся в механизме действия тимуса и рассмотрим принцип его строения в организме ребенка.
Что это и за что отвечает
Тимус (вилочковая железа, зобная железа) - V-образный орган в грудной полости человека, отвечающий за предотвращения аутоиммунных заболеваний.
Слово «тимус» в переводе с греческого означает «жизненная сила». Чаще всего проблемы с вилочковой железой наблюдаются именно в детском возрасте.
Причин тому очень много, и врачи до сих пор не знают точного ответа на вопрос: почему у ребенка увеличена вилочковая железа.
Некоторые сведения говорят о том, что причинами нарушения функционирования вилочковой железы являются: негативное влияние извне (радиационный фон, плохая экология и т.д.), генетические предрасположенности, различные нарушения в организме матери во время, нефропатия, острые инфекционные заболевания матери во время ношения ребенка.
Знаете ли вы? Американские ученые пришли к выводу, что СПИД можно побороть. Для этого необходимо научиться стимулировать выработку Т-хеллеров в зобной железе.
Тимус начинает свой активный рост с первого дня рождения. В этот момент его вес составляет всего 15 грамм. Рост продолжается вплоть до полного полового созревания, и в 15-16 лет этот орган достигает веса в 30-40 г.
С этого момента рост набирает обратный ход, и вилочковая железа постепенно уменьшается. К 70 годам жизни человека она весит не более 7 г.
Вилочковая железа имеет дольчатую форму строения. Внутри ее сохраняются В-лимфоциты и Т-лимфоциты, которые отвечают за охрану организма от чужеродных клеток.
Тимус является центральным и самым важным органом иммунной системы организма. Его угнетенная активность приводит к повышенному риску развития онкологических заболеваний.
Иногда неправильный механизм действия тимуса приводит к тому, что его Т-лимфоциты начинают вести борьбу с нормальными клетками собственного организма.

В любом случае, тимус - важная составляющая любого детского организма, и его нужно своевременно лечить в случае каких-либо патологических нарушений.
Роль вилочковой железы в организме человека была открыта совсем недавно, а именно в 1961 году в Австралии. Тогда ученый по имени Д. Миллер проводил испытания на новорожденных крысах.
В ходе испытаний он удалял вилочковые железы и наблюдал за реакцией организма животных (в частности, на реакцию трансплантации органов).
Как результат: угнетенная выработка антител (Т-лимфоцитов) и полное отторжение организмом любых пересаженных органов.
Вывод из этого такой: тимус способствует выработке и дальнейшему обучению защитных лимфоцитов. Кроме того, он не позволяет лимфоцитам атаковать собственный организм (если, конечно, в этом организме не развивается опухоль).
Где находится
Часто вопросы о том, где находится вилочковая железа, ставят в тупик даже взрослых людей. Тимус расположен в полости грудной клетки.
 Если этот орган развивается в нормальном темпе и при его развитии не наблюдается никаких патологических изменений в организме малыша, то проецируется он на 10-15 мм над рукояткой грудины.
Если этот орган развивается в нормальном темпе и при его развитии не наблюдается никаких патологических изменений в организме малыша, то проецируется он на 10-15 мм над рукояткой грудины.
Нижним концом он может достигать 3 или 4 ребра. В случаях, если у ребенка наблюдается увеличение вилочковой железы, то ее нижний конец может достигать 5 ребра.
Как проходит диагностика
На сегодняшний день самым популярным и точным методом диагностики тимуса является рентгенографическое исследование. Оно проводится только в тех случаях, когда УЗИ дает недостаточно четкое понимание о состоянии вилочковой железы.
При увеличении главного органа иммунной системы на снимках проявляется характерная треугольная или овальная лентовидная тень. Врачи, пользуясь методом J. Gewolb, могут определить степень увеличения тимуса (всего их существует 3).
Важно! Для стимуляции вилочковой железы необходимо регулярно осуществлять тепловые процедуры (посещать бани, сауны и т.д.).
 Существует морфометрическая методика определения уровня увеличения вилочковой железы у детей. Ее суть заключается в расчете коэффициента расширения тени тимуса.
Существует морфометрическая методика определения уровня увеличения вилочковой железы у детей. Ее суть заключается в расчете коэффициента расширения тени тимуса.
То есть, исследователь рассчитывает соотношение величины зобной железы к общему объему грудной клетки. В более сложных ситуациях целесообразно применять импульсную или многоосевую рентгенографию, томографию или пневмомедиастинографию.
Несмотря на такой широкий спектр возможностей современной диагностики, рентгенографические методы не всегда эффективны, так как на выходе часто получаются недостаточно точные результаты.
В большинстве медицинских учреждений России, Украины, Беларуси, Молдовы основным диагностическим методом исследования тимуса является УЗИ.
Если вы приведете своего ребенка в местную клинику, то, в первую очередь (возможно, после пальпации), врачи отправят его на ультразвуковое исследование.
 Диагностика вилочковой железы при помощи УЗИ у детей разных возрастных категорий проходит следующим образом:
Диагностика вилочковой железы при помощи УЗИ у детей разных возрастных категорий проходит следующим образом:
- новорожденных и детей в возрасте до 9 месяцев зачастую укладывают на кушетку и запрокидывают голову назад. Затем проводится процедура УЗИ;
- детей в возрасте от 9 до 18-20 месяцев обследуют в положении «сидя»;
- начиная с двухлетнего возраста процедуру УЗИ можно проводить в положении «стоя».
Многие родители не знают, что такое УЗИ тимуса у детей, как проходит процедура и для чего это вообще нужно.
На самом деле, в данном конкретном случае ультразвуковое исследование (УЗИ) поможет определить состояние вилочковой железы у ребенка (требуется ли дальнейшее лечение, или изменение незначительное и не требует терапевтических вмешательств).
Знаете ли вы? Ученые создали «укол молодости », который заставит организм взрослого человека ощутить новый и мощный прилив сил. Данная процедура подразумевает введение в тимус стволовых клеток. Как говорят эксперты, такой укол омолодит тимус, а соответственно - и стареющий организм.
 Исследование проходит при помощи специального аппарата с линейным датчиком. С помощью такого датчика проводится поперечное сканирование верхнего отдела грудной клетки ребенка.
Исследование проходит при помощи специального аппарата с линейным датчиком. С помощью такого датчика проводится поперечное сканирование верхнего отдела грудной клетки ребенка.
Датчик устанавливается параллельно грудине и рукоятке. Предварительно на грудину наносится специальная гелеобразная консистенция.
После процедуры УЗИ врачи определяют объем тимуса согласно полученным данным (длине, ширине и высоте), затем вычисляется масса органа на основе заранее рассчитанного объема и специальных коэффициентов, которые стандартизированы в медицинской литературе.
Когда известна масса вилочковой железы, врачи могут поставить соответствующий диагноз ребенку.
Нормы и отклонения
После проведенных исследований вилочковой железы врачи ставят диагноз на основе полученных данных.
Зачастую серьезных нарушений этого крошечного органа не наблюдается, и даже самое обычное увеличение тимуса (тимомегалия) не является опасной болезнью. Особо острые случаи (гиперплазия или гипоплазия), к большому счастью, наблюдаются крайне редко.

Нормальные показатели
Неважно, каким именно диагностическим методом проводили исследования тимуса (УЗИ, рентгенография и пр.), все сводится к расчету общего объема и веса данного органа.
На основании этих данных ставится конкретный диагноз. Нормальными показателями размеров тимуса для новорожденного малыша считаются: длина - 41 мм, ширина - 33 мм, толщина - 21 мм, общий объем - 13900 мм³.
Следует уточнить, что приведенные данные являются эталонными, и допускаются небольшие отклонения в ту или иную сторону. Как заявляют опытные специалисты, в нормальном состоянии вес тимуса должен составлять 0,3% от общего веса тела ребенка.
Для допускается вес вилочковой железы в диапазоне от 15 до 45 г, для подростков - от 25 до 30 г. В иных случаях врачи ставят диагноз: тимомегалия.
Увеличение (тимомегалия)
Тимомегалия, в большинстве случаев, является наследственным заболеванием и наблюдается у детей до 6 лет. Частота заболеваний тимомегалией у детей до 3-х лет составляет 13-34%, у детей от 3-х до 6-ти лет - 3-12%.
 После 6-ти лет данное заболевание редко встречается. Однако, в противном случае, таких детей вносят в группу риска по развитию аутоиммунных и онкологических заболеваний.
После 6-ти лет данное заболевание редко встречается. Однако, в противном случае, таких детей вносят в группу риска по развитию аутоиммунных и онкологических заболеваний.
Важно! Замедление роста тимуса происходит только по достижению 12-летнего возраста.
Исследователи в области биологии и медицины выделяют две формы тимомегалии: приобретенную и врожденную.
Первая из них может развиваться на фоне внешних воздействий или перенесенных патологических изменений и заболеваний (аддисонова болезнь, онкология надпочечников, пневмония, ОРВИ, васкулит).
Врожденная тимомегалия подразумевает правильно сформированный тимус, который имеет размеры больше допустимых. Такой порок практически во всех случаях не несет угрозы жизни и здоровью ребенка.
Тимомегалия может быть трех ступеней тяжести. Они отличаются согласно показателям КТТИ (кардиотимикоторакального индекса).
Показатель КТТИ до 0,33 говорит о том, что малыш полностью здоров, показатель в рамках от 0,33 до 0,37 говорит о том, что у ребенка развита первая степень тимомегалии.
 Показатели для установления диагноза тимомегалия второй степени должны находиться в рамках 0,37 – 0,42, третьей степени - свыше 0,42.
Показатели для установления диагноза тимомегалия второй степени должны находиться в рамках 0,37 – 0,42, третьей степени - свыше 0,42.
Гиперплазия и гипоплазия тимуса
Гиперплазия - острое заболевание вилочковой железы. На ее фоне начинают активно разрастаться клетки в мозговой и корковой части с одновременным формированием новых образований в тимусе.
При данном заболевании, в отличие от тимомегалии, размеры тимуса могут оставаться в норме, однако нарушаются структурная и функциональная составляющие.
Для точного определения диагноза УЗ-исследование не подойдет. В этом случае проводят рентгенографическое исследование с последующим определением характера тени вилочковой железы.
Основными причинами гиперплазии принято считать:
- онкологию;
- анемию и сердечно-сосудистые заболевания;
- аутоиммунные и эндокринные заболевания.
Гипоплазия тимуса или синдром Ди Джорджи, в большинстве случаев, возникает в случае внутриутробного инфицирования плода. Вследствие этого у новорожденного ребенка вилочковая железа недоразвита или вообще отсутствует.
 При гипоплазии у ребенка наблюдается поражения лицевой ткани и общие нарушения в строении лицевых органов.
При гипоплазии у ребенка наблюдается поражения лицевой ткани и общие нарушения в строении лицевых органов.
Кроме того, у ребенка наблюдаются нарушения в строении сердца, почек. Некоторые ученые также склонны предполагать, что к синдрому Ди Джорджи существует генетическая предрасположенность.
Знаете ли вы? Если вилочковую железу полностью удалить после пятилетнего возраста ребенка, то это никаким образом не повлияет на качество его жизни. Дело в том, что за первые пять лет тимус успевает выработать такое количество Т-лимфоцитов, которое будет защищать организм человека до глубокой старости.
В любом случае, при недоразвитом тимусе симптомы гипоплазии могут сами исчезнуть после шестилетнего возраста.
Однако все это время ребенок может быть подвержен инфекционным заболеваниям, не переносить процессы переливания крови и трансплантации органов.
Стоит ли переживать
Однозначный ответ на вопрос о том, стоит ли проводить лечение тимуса, может дать только опытный специалист после тщательной диагностики этого крошечного органа.

Симптомы, не требующие дополнительной помощи
Следует отметить, что при любых симптомах любого лучше обращаться к врачу за консультацией. Пусть он скажет, что ваш ребенок здоров, и согласитесь, вам этого будет достаточно для спокойствия на душе.
Мировые специалисты в области иммунологии говорят, что слегка увеличенная вилочковая железа у новорожденных детей - это норма. Увеличение с возрастом приходит в норму и все симптомы исчезают.
Однако в младенческом возрасте могут проявляться следующие симптомы, которые не имеют серьезных последствий:
- слегка увеличены лимфатические узлы;
- небольшое увеличение миндалин и;
- вес ребенка слегка увеличен.
Когда стоит обратиться к врачу
Существует целый ряд симптомов нарушения функциональности или изменения в размерах тимуса.
 Именно в таких случаях необходимо в краткие сроки посетить педиатра, а затем - иммунолога:
Именно в таких случаях необходимо в краткие сроки посетить педиатра, а затем - иммунолога:
- резкие скачки массы тела малыша;
- на груди образовывается венозная сетка (мраморный рисунок);
- частые срыгивания после кормления;
- возникновение кашля в горизонтальном положении;
- сильное увеличение в размерах лимфатических узлов и миндалин;
- частота заболеваний ОРВИ увеличивается в несколько раз;
- во время плача ребенка его кожа приобретает фиолетовый оттенок;
- угнетенный мышечный тонус;
- нарушение сердечного ритма;
- гипергидроз;
- у ребенка постоянно мерзнут окончания рук и ног;
- аномалии развития суставов;
- гипотония;
- крипторхизм, фимоз, гипоплазия;
- бледность (из-за анемии, проявляющейся вследствие недостачи в организме макроэлементов железа);
- потливость и длительная субфебрильная температура.
В более острых случаях, при сильном увеличении тимуса (с показателями КТТИ свыше 0,42), у ребенка могут набухать шейные вены, появляться одышка, цианоз. Такое происходит из-за сдавливания вилочковой железой жизненно важных органов.

Как проходит лечение
При тимомегалии 1 и 2 степени врачи разрешают проводить вакцинации, но только под строгим наблюдением. Помимо этого периодически оценивается состояние здоровья маленького пациента.
Вакцинация при тимомегалии 3 степени запрещена, так как иммунная система организма малыша работает неправильно и не сможет нормально отвергать даже малые количества инородных организмов.
В некоторых конкретных случаях педиатр советуется с эндокринологом и иммунологом, после чего дает добро на вакцинацию (например, вакцина против полиомиелита).
Важно! Крепкий сон и длительное пребывание на свежем воздухе способствуют скорому выздоровлению при тимомегалии.
Лечение ребенка проводят только в острых случаях, когда проблемы с вилочковой железой могут отражаться на других органов и систем организма.
Лечение бывает различных характеров, и назначается только специалистами медицинских учреждений после соответствующей диагностики.
 Ниже приведем основные моменты в лечении проблем с тимусом.
Ниже приведем основные моменты в лечении проблем с тимусом.

Знаете ли вы? Легкие постукивания кончиками пальцев по месту расположения тимуса позволят приобрести заряд энергии на весь день.
Как правило, симптоматика проблем с вилочковой железой пропадает по достижению ребенком 3-6 летнего возраста.
Иногда тимомегалия может переходить в другие заболевания, и чтобы это предотвратить, при первых симптомах болезни необходимо сразу же обращаться к врачу.
Профилактика
На сегодняшний день механизмы развития данного синдрома неизвестны, поэтому профилактические меры не могут дать высокий результат.
Известно, что тимомегалия у детей может развиваться на фоне неправильного образа жизни беременной мамы. Поэтому профилактическими мерами можно считать здоровый образ жизни женщины.
 Профилактические меры увеличенной вилочковой железы у грудничков и детей старших возрастных категорий направлены на избегание стрессовых ситуаций, регулярные занятия спортом (для старших детей).
Профилактические меры увеличенной вилочковой железы у грудничков и детей старших возрастных категорий направлены на избегание стрессовых ситуаций, регулярные занятия спортом (для старших детей).
Напоследок хотелось бы отметить, что родителям не следует пугаться тимомегалии у детей до 3-х лет. Ранее мы приводили некоторые статистические данные, и согласно им, примерно у каждого четвертого ребенка в нашей стране имеются проблемы с вилочковой железой.
Главное в этом деле: своевременное обращение к врачу и целенаправленное лечение (если такая необходимость существует).
Главная » Планирование » Гипоплазия вилочковой. Тимус: вилочковая железа у детей
Вилочковая железа у детей выступает центральным органом, который находится посередине грудной клетки.
Именно он имеет огромное значение в правильном формировании и последующем функционировании иммунной системы ребенка, а любые нарушения в его работе могут привести к различным осложнениям и развитию патологий.
Что представляет собой тимус?
Вилочковая железа или, как ее еще называют, тимус является основным органом иммунитета, поскольку производит, развивает и осуществляет обучение специальных Т-клеток.
Свое название она получила из-за формы, которая подобна вилке с двумя зубьями.
Интересно!
На вилку тимус похож у здорового человека, а при патологиях данной области железа становится похожа на бабочку, приобретая форму щитовидки. За близкое расположение к последней раньше ее также называли зобной железой.
Вилочковая железа у новорожденных имеет массу 12 г и растет до возраста 10 лет. После достижения 18 лет она начинает уменьшаться.
Тимус хорошо прощупывается при нажатии двумя пальцами в зоне верхнего участка грудины, немного ниже ямки ключицы.
Вилочковая железа у детей и взрослых имеет одинаковое расположение, однако она обладает следующими особенностями, обусловленными возрастом:
1. За время от рождения до половой зрелости тимус увеличивается примерно в 3 раза: если у новорожденных он весит около 12 г, то у подростков достигает размера до 40 г.
2. К возрасту 16 лет железа начинает атрофироваться.
3. Приблизительно к 24-25 годам ее размер составляет около 25 г.
4. У людей в возрасте 60 лет тимус весит менее 15 г.
5. После 80 лет его масса не превышает 6 г.
В старости в участках снизу и по бокам тимуса наблюдается атрофия и на их месте образуется жировая ткань, а сама железа удлиняется. Подобные изменения на сегодняшний день необъяснимы наукой.
Многие специалисты полагают, что решение этой загадки может способствовать управлению процессами старения.
Функции тимуса
Вилочковая железа у детей осуществляет формирование всех систем в организме. Основными ее функциями можно назвать следующие:
эндокринная;
лимфопоэтическая;
регулирующая иммунитет.
Железа уничтожает агрессивные клетки, поскольку обеспечивает продуцирование Т-клеток, которые являются главными регуляторами иммунной системы.
Кроме того, тимус контролирует отток крови и осуществляет ее фильтрацию.
Формирование железы у ребенка берет начало на 6-ой неделе беременности.
До годовалого возраста данный орган воздействует на синтез Т-лимфоцитов посредством костного мозга. Они выступают защитой организма малыша от следующих влияний:
инфекции;
бактерии;
вирусы.
Гормоны, продуцируемые вилочковой железой, принимают участие в регуляции практически всех процессов в организме, выполняя следующие важные функции:
уменьшение частоты сердечных сокращений;
усиление синтеза белка;
увеличение клеточного роста и скелета;
замедление работы центральной нервной системы;
улучшение функционирования щитовидки и гипофиза;
ускорение расщепления сахара;
восполнение запасов энергии.
Гормоны тимуса осуществляют обмен следующих веществ:
углеводы;
витамины;
минералы;
жиры;
белки.
Уменьшение или увеличение вилочковой железы приводит к нарушению данных процессов и провоцирует различные патологии.
Важно!
В большинстве случаев сбои в работе тимуса приводят к опухолевым процессам и аутоиммунным болезням. Своевременная диагностика и лечение позволяют предотвратить осложнения.
Гиперфункция вилочковой железы
Такое состояние указывает на увеличение вилочковой железы, которое сопровождается ее гиперфункцией. Как правило, патология передается генетически.
У новорожденных она может быть следствием одного из следующих факторов:
возраст беременной женщины;
нарушения при вынашивании ребенка;
болезни инфекционной природы у беременной.
Если гиперфункция тимуса наблюдается у детей постарше, то причиной может быть нехватка белков в пище, поскольку при их продолжительном дефиците нарушаются функции органа в виде угнетения иммунной системы и понижения содержания лейкоцитов.
Кроме того, гиперплазия вилочковой железы у ребенка может быть вызвана так называемым лимфатическим диатезом.
При данном состоянии склонность лимфоткани к патологическому росту воздействует на внутренние органы, включая тимус.
Симптомы у новорожденных
Диффузное увеличение тимуса у грудничков сопровождается следующими проявлениями:
1. Масса тела при рождении значительно выше среднего.
2. Ребенок резко набирает и теряет вес.
3. Кожа отличается бледностью, а слизистые имеют синеватый отлив.
4. На груди отчетливо видна сеточка из вен.
5. Наблюдается частое срыгивание после кормления.
6. Присутствуют нарушения сердечного ритма.
7. Сохраняется субфебрильная температура, несмотря на отсутствие признаков воспалительного характера.
Часто гиперплазия вилочковой железы у грудничков сопровождается кашлем без дополнительных симптомов простуды и повышенной потливостью.
Симптомы у детей старше
К симптомам у новорожденных с гиперфункцией тимуса в данном случае добавляются следующие проявления:
увеличение лимфатических узлов;
понижение АД;
ожирение при здоровом питании;
холодные конечности;
гипертрофия тканей задней зоны глотки.
При этом нарушения сердечного ритма и повышенная потливость становятся более выраженными.
А понижение иммунитета провоцирует другие патологии в развитии малыша.
Для справки!
У детей женского пола в отдельных случаях стойкое увеличение тимуса приводит к гипоплазии органов половой системы, а у малышей мужского пола – к фимозу.
Гипофункция вилочковой железы
Гипофункция тимуса обычно представляет собой врожденную либо первичную недоразвитость элементов органа. Данное состояние может развиваться на фоне следующих факторов:
болезни вирусной природы;
сахарный диабет;
применение спиртных напитков в период беременности.
В детском возрасте такая патология провоцирует следующие состояния:
ускоренное развитие половых желез;
уменьшение лимфоидных органов;
лимфопения;
уменьшение веса;
гипотрофия;
нарушения роста костей;
Гипофункция вилочковой железы у детей провоцирует сбои иммунологической реактивности.
Диагностика
Заболевания и патологии тимуса у детей выявляются при помощи рентгена или УЗИ с повышенным разрешением.
Необходимость в проведении диагностики может появиться при следующих особенностях у ребенка:
1. Он часто болеет простудой, которая переходит в патологии в тяжелой форме.
2. Наблюдается увеличение лимфоузлов.
3. Имеется большая предрасположенность к аллергии.
Когда есть подозрения на увеличение/уменьшение органа, специалист может назначить эндокринное обследование и КТ. Последний метод позволяет выявить следующие заболевания тимуса:
синдром Ди Джорджи;
тимома;
миастения;
лимфома Т-клеток.
При диагностировании опухолей данной зоны обычно требуется проведение хирургической операции.
Важно!
Поскольку УЗИ по своей информативности не уступает рентгеновскому снимку, многие специалисты рекомендуют не подвергать детей облучению лишний раз и выбрать ультразвуковой метод диагностики.
Лечение
Патологии вилочковой железы обычно встречаются до шестилетнего возраста, после чего проходят самостоятельно без специального лечения.
При этом используются средства, направленные на укрепление иммунитета, а также соблюдается особый режим дня и питания.
Но в отдельных случаях, чтобы избежать дальнейших осложнений, требуется принятие мер и проведение терапии.
Срочная медицинская помощь при болезнях вилочковой железы у ребенка требуется, если присутствуют следующие симптомы:
слабость организма;
брадикардия;
апатия.
Лечение при патологиях тимуса у детей может включать следующие пункты:
физиотерапевтические процедуры;
терапия биостимуляторами;
применение иммуномодуляторов;
диета с высоким содержанием витамина С;
использование препаратов для стимуляции дыхательного центра;
профилактика респираторных заболеваний.
При гиперплазии вилочковой железы в отдельных случаях назначается оперативное вмешательство
, перед которым необходимо контролировать АД. Желательно проводить операцию под местным наркозом.
Без предварительной подготовки перед вмешательством повышается вероятность возникновения надпочечниковой недостаточности у ребенка.
Родители детей, у которых были диагностированы нарушения функционирования вилочковой железы, должны помнить, что им противопоказан аспирин.