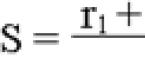Полимеразная цепная реакция (ПЦР) - экспериментальный метод молекулярной биологии, который представляет собой специфическую амплификацию нуклеиновых кислот, индуцируемую синтетическими олигонуклеотидными праймерами in vitro.
Идея разработки метода ПЦР принадлежит американскому исследователю Kary Mullis, который в 1983 г. создал метод, позволивший амплифицировать ДНК в ходе циклических удвоений с помощью фермента ДНК-полимеразы в искусственных условиях. Через несколько лет после опубликования этой идеи, в 1993 г., К. Mullis получил за нее Нобелевскую премию.
В начале использования метода после каждого цикла нагревания- охлаждения приходилось добавлять в реакционную смесь ДНК-полимеразу, так как она быстро инактивировалась при высокой температуре. Процедура была очень неэффективной, требовала много времени и фермента. В 1986 г. ее существенно модифицировали за счет использования ДНК-полимеразы из термофильных бактерий. Эти ферменты способны выдерживать множество циклов реакции, что позволяет автоматизировать проведение ПЦР. Одна из наиболее часто использовавшихся термостабильных ДНК-полимераз была выделена из бактерий Thermus aquaticus и названа Taq -ДНК-полимеразой.
Суть метода. Метод основан на многократном избирательном копировании определенного участка ДНК при помощи фермента Taq- ДНК-полимеразы. Полимеразная цепная реакция позволяет получить амплификаты длиной до нескольких тысяч пар нуклеотидов. Для увеличения длины ПЦР-продукта до 20-40 тыс. пар нуклеотидов применяют смесь различных полимераз, но все равно это значительно меньше длины хромосомной ДНК эукаротической клетки.
Реакция проводится в программируемом термостате (амплификаторе) - приборе, который может проводить достаточно быстро
охлаждение и нагревание пробирок (обычно с точностью не менее 0,1 °С). Амплификаторы позволяют задавать сложные программы, в том числе с возможностью «горячего старта» и последующего хранения. Для ПЦР в режиме реального времени выпускают приборы, оборудованные флуоресцентным детектором. Существуют также приборы с автоматической крышкой и отделением для микропланшет, что позволяет встраивать их в автоматизированные системы.
Обычно при проведении ПЦР выполняется 20-45 циклов, каждый из которых состоит из трех стадий: денатурации, отжига праймеров, элонгации (рис. 6.1 и 6.2). На рис. 6.1 представлена динамика изменения температуры в пробирке при проведении цикла ПЦР.
Рис. 6.1. График изменения температуры в пробирке в течение одного цикла полимеразной цепной реакции
Денатурация ДНК-матрицы проводится с помощью нагревания реакционной смеси до 94-96 °С на 5-90 с, чтобы цепи ДНК разошлись. Следует отметить, что перед первым циклом осуществляют предварительный прогрев реакционной смеси в течение 2-5 мин для полной денатурации исходной матрицы, что позволяет снизить количество неспецифичных продуктов реакции.
Рис. 6.2. Схема первого цикла полимеразной цепной реакции
Стадия отжига праймеров. При плавном снижении температуры праймеры комплементарно связываются с матрицей. Температура отжига зависит от состава праймеров и обычно она на 4-5° ниже расчетной температуры плавления. Длительность стадии - 5-60 с.
Во время следующей стадии - элонгации - происходит синтез дочерней цепи ДНК на матрице материнской. Температура элонгации зависит от полимеразы. Часто используемые ДНК-полимеразы Taq и Pfu наиболее активны при 72 °С. Время элонгации, в основном зависящее от длины ПЦР-продукта, обычно составляет 1 мин на каждую тысячу пар оснований.
Содержание
Тем, кто интересуется новыми способами диагностики, следует узнать, что такое метод ПЦР. Современные технические возможности в области лабораторных исследований предоставляют возможность выявлять множество заболеваний на начальных стадиях. Полимеразная цепная реакция (ПЦР) считается на данный момент самым точным и новым методом.
Анализ методом ПЦР
ПЦР анализ - что это такое? Это метод использует принципы молекулярной биологии. Для исследования материала применяются особые ферменты, которые многократно и быстро копируют ДНК, РНК фрагменты возбудителей болезни. Существует разные виды ПЦР анализа в зависимости от исследуемого материала (кровь, моча, кал и т.д.). После обработки сотрудники лаборатории сравнивают с базой данных полученный результат, выявляют концентрацию, тип возбудителя.
Анализ на ПЦР помещают в специальный амплификатор (прибор), который нагревает и охлаждает пробирки с биоматериалом. Изменения температуры нужны для репликации фрагментов. Точность результата будет зависеть от точности температурного режима. Метод полимеразной цепной реакции помогает выявить:
- инфекционный мононуклеоз;
- цитомегаловирусную инфекцию;
- вирусные гепатиты G, C, B, A;
- инфекции/заболевания, передающиеся половым путем (ИППП/ЗППП): гарднереллез, трихомониаз, уреаплазмоз;
- герпетическую инфекцию;
- онкогенные вирусы;
- листериоз;
- хеликобактерную инфекцию;
- клещевой энцефалит, боррелиоз;
- туберкулез;
- кандидоз.
Крови
На данный момент из-за новизны технологии анализ крови методом ПЦР все еще имеет высокую цену. Для подготовки биоматериала не нужно соблюдать определенные требования. Даже вызванные физическими нагрузками, стрессами, сменой рациона питания изменения состава не влияют на результат исследования. ПЦР анализ крови может испортить только прием антибактериальных средств, поэтому перед сдачей необходимо выдержать паузу между лечением и тестом.
ПЦР исследование крови – самый распространенный вариант диагностики хронических, острых инфекционных патологий при вирусном или атипичном проявлении. Серологические методы исследования имеют определенную трудность при проведении – определение наличия возбудителя проводится по наличию антител в организме человека. Результат мог быть ложноотрицательным, если состояние больного не давало время для их выработки.
Мазка
В сфере гинекологии для исследования наличия инфекционных микроорганизмов используют ПЦР анализ мазка. Работа с материалом проводится по тому же принципу, что и с кровью: многократное увеличение фрагментов ДНК возбудителя, чтобы с легкостью его идентифицировать. Это же помогает обнаружить скрытые инфекции у женщины. Для проведения анализа могут быть взяты разные биологические жидкости: слюна, мокрота, моча, кровь. В гинекологии для точности определения чаще используется мазок со слизистой влагалища из цервикального канала.
Для проведения ПЦР существуют определенные показания. Нередко его нужно сделать, чтобы выявить устойчивый к антибиотикам вид возбудителя. У женщин основными показаниями для диагностики по этому методу выступают:
- беременность, которая протекает тяжело;
- острая фаза ИППП;
- если есть подозрение на переход ИППП в хроническую стадию;
- поиск причин бесплодия.
Кала
Для выявления инфекции может быть назначен со стороны врача анализ кала на ПЦР. Для того, чтобы получить максимально достоверные результаты после теста, необходимо придерживаться следующих правил перед забором биоматериала:
- за несколько суток прекратить прием слабительных препаратов: масла, свечи;
- исключить медикаменты, которые дают специфическую окраску калу, к примеру, с содержанием железа.

Мочи
При необходимости для проведения теста врач может взять для исследования мочу. Высокая точность открывает возможность работать с любой биологической жидкостью, из которой удается извлечь ДНК вируса. Чтобы сдать анализ мочи ПЦР, нужно придерживаться таких ограничений перед забором материала:
- минимум за 1 день до процедуры прекратить половые контакты;
- за 3 недели до сдачи должно быть окончено любое антибактериальное лечение, потому что медикаменты смажут картину;
- сдавать анализ нужно натощак (жидкость тоже запрещена);
- брать нужно первую утреннюю порцию материала.
Результаты анализов ПЦР
Из вышенаписанного понятно, что такое ПЦР анализ и видны явные преимущества такого метода исследования. Еще один плюс данной диагностической процедуры – простота расшифровки результатов. Учитывая, сколько делается анализ ПЦР (сам процесс занимает около 5 часов, но лаборатория выдает данные через 1-2 суток), данный метод диагностики становится лучшим вариантом для определения множества инфекций. По результатам врач может сказать вам, что тест:
- Отрицательный – в исследуемом материале не было искомого возбудителя.
- Положительный – были найдены РНК, ДНК возбудителя.
Иногда проводится количественное определение микроорганизмов. Это необходимо при заболеваниях, которые вызывают условно-патогенные возбудители. Особенность этих вирусов в том, что проявляются они только при избыточном количестве и найти их обычными исследованиями крайне проблематично. Этот фактор важен для выбора терапевтической тактики, чтобы эффективно лечить вирусные инфекции, к примеру, гепатит, ВИЧ.

На 12 инфекций
Чтобы понять до конца, что такое ПЦР диагностика инфекций и насколько она эффективна, нужно узнать, что она способна выделять до 12 возбудителей. Проводится текст только в лабораторных условиях. Для исследования применяют специальные ферменты, которые увеличивают во много раз количество РНК, ДНК фрагментов вируса. Анализ ПЦР на 12 инфекций способен выявить:
- микобактерии туберкулеза;
- цитомегаловирус;
- гепатит C, G, B, A;
- герпес 1, 2 типа;
- вирус Эпштейн-Барра (инфекционный мононуклеоз);
- инфекции, которые передаются половы путем, к примеру, хламидии;
- листериоз;
- кандидозную инфекцию;
- хеликобактер пилори;
- боррелиоз, клещевой энцефалит.
На гепатит С
Этот диагностический метод помогает определить наличие вируса в крови. Это дает врачам возможность говорить о его наличии или отсутствии. Анализ ПЦР на гепатит С бывает двух видов: качественный и количественный. Первый вариант указывает только на его наличие и может иметь формулировку «обнаружен»/«не обнаружен». Этот вид теста имеет чувствительно в 10-500 МЕ/мл. Это говорит о том, что при низком содержании возбудителя в организме анализ будет «не обнаружено».
Количественный анализ более точный и покажет концентрацию инфекции в крови. Обозначается этот показатель как «вирусная нагрузка», измеряется в количестве вирусной РНК на конкретный объем крови. Расшифровка в разных лабораториях может отличаться. Помимо измерения в МЕ/мл используются единицы измерения «копии». Пересчитать копии на МЕ можно по формуле: 1 МЕ = 4 копии. Если в расшифровке значение присутствие вируса превышает 800 000 МЕ/мл (или 800*103), это говорит о высоком содержании возбудителя.

На туберкулез
Делать тест следует в утреннее время. Это важно для того, чтобы не дать всему массиву мокроты, который образовался за ночь, выйти из желудка. Анализ ПЦР на туберкулез так же важен как ИФА, Манту, томографе. Тест помогает выделить наличие микобактерий, состояние мочи, общий иммуноглобулин, СОЭ, определить состояние легких на данный момент. Для точности получения результатов при анализе ПЦР необходимо проводить его с соблюдением следующих правил:
- Осуществляется посев 3 раза, но полную аспирацию содержимого желудка следует проводить только в условиях стационара.
- Выявляет микобактерии посев наличествующих масс в желудке менее чем в 50% диагнозов. Даже при получении оптимальных условий рекомендуется вместо них УЗИ.
- Даже при отрицательном характере результата не может быть полностью исключена вероятность развития туберкулеза с изменением СОЭ, иммуноглобулина или других показателей.
- Посев материалов при ПЦР менее восприимчив на патологические состояния, если получен он в рамках бронхоскопического обследования, который исключает подозрения на ТБ у ребенка.
На ВИЧ
Для многих людей данный диагноз считается смертельным приговором. По этой причине после частых половых связей человек становится более внимателен к сигналам, которые подает его тело (а иногда придумывает их). Самый надежный вариант получить подтверждение или опровержение данного заболевания – ПЦР анализ на ВИЧ. Тест можно использовать для определения следующих возможных проблем со здоровьем:
- Опровержение/подтверждение наличия ВИЧ в период серонегативного кона.
- Определение генотипа ВИЧ-1, ВИЧ-2.
- Уточнение описания патологического процесса при сомнительном результате иммуноблота.
- Заражение после переливания крови.
- Определения ВИЧ-статуса у детей, которые родились от матерей-носителей заболевания.
- Помогает установить наблюдение за вирусной загруженностью организма.

На ВПЧ
Вирус папилломы может быть выявлен у любого человека, долгое время он может находиться в латентном состоянии. Развитие провоцирует ослабление иммунитет, стрессы или эмоциональные всплески. Анализ ПЦР на ВПЧ помогает определить концентрацию вируса в крови. По этой причине рекомендуется проводить количественно определение, а не качественное. Эти данные помогут спрогнозировать вероятность развития злокачественного характера инфекции.
Методика диагностики наличия ВПЧ основывается на основном свойстве ПЦР выделять из материала ДНК вируса. Из-за высокой чувствительности теста даже небольшое количество бактерий будет обнаружено. Количественное исследование открывает врачам возможность установить степень опасности заболевания, составить прогноз на будущее. Эта диагностика обязательна для всех мужчин и женщин, которые обнаружили у себя кондиломы. Количественный анализ ПЦР поможет определить, что послужило причиной развития ВПЧ: временное снижение иммунитета или хроническое заболевание.
На герпес
Данный вид диагностики в микробиологии помогает с высокой точностью проводить анализ ПЦР на герпес. Копирование фрагментов ДНК вируса будет происходить только, если в материале присутствует нужный ген. В данном случае тест по результатам проведения может указать на наличие или отсутствие возбудителя. Выявить его удастся даже при низкой концентрации в крови.
Еще один плюс анализа ПЦР в том, что он может определить герпетическую вирусную инфекцию сразу же после заражения, до появления клинической симптоматики. Можно определить тип герпеса (1 или 2), для сдачи анализа специфической подготовки не требуется, но врачи рекомендуют перед забором крови отказаться от:
- жареного;
- острого;
- алкоголя;
- жирного.

При беременности
При вынашивании ребенка очень важно провести данное исследования, чтобы поставить на учет состояние женщины. ПЦР анализ при беременности входит в перечень самых эффективных методов определения наличия разнообразных заболеваний. Провести тест нужно не только для выявления патологий, но и для определения вероятности заражения ребенка внутриутробно. Только благодаря ПЦР-диагностики стало возможным выявить степень прогрессирования, развитие множества инфекций внутри утробы матери.
Сдача анализов ПЦР
Если вам интересно, как берут анализ ПЦР, то следует рассматривать каждый отдельный случай, учитывая тип биоматериала. Соскоб, мазок или забор крови имеет свои особенности, к примеру:
- плазма сдается утром;
- моча берется только первая утром, в лабораторных условиях в стерильный контейнер;
- мазок или соскоб будет показателен только после воздержания от половых контактов не менее 3 суток;
- нельзя сдавать мазок во время менструации и через 2 суток после нее.

Где сдать анализы на ПЦР
Данный вид исследования относится к современным и высокотехнологическим способам диагностики. Сдавать анализы методом ПЦР следует в лабораториях, которые обладают всем необходимым комплексом для получения полноценных результатов. Не меньшую роль играют квалифицированные, подготовленные кадры. Отдайте предпочтение крупными, серьезным, известным лабораториям. Это поможет не только получить результаты быстро, но и обеспечит их достоверность.
Цена
Еще один вопрос, который часто интересует пациентов: сколько стоит анализ ПЦР? Из-за новизны метода, необходимости приобретения дорогостоящего оборудования цена на тест относительно высокая. На стоимость ПЦР влияет вид инфекции, на которую будут проверять человека. Ориентировочная цена и сроки выполнения тестов следующая:
- ИППП проверят за 1 день, цена – 400-500 рублей.
- Герпес, ВПЧ, вирус Эпштейна-Барра, цитомегловирус выявляют за сутки, цена – 300-500 р.
- Анализ на гепатит проводится за 5 дней, цена на качественный вариант – 500 р., количественный – 2000 р.
- Хеликобактер пилори выявляют за сутки, цена – 400 р.
- Антигены, антитела ВИЧ, цена – от 380 р.
- Качественный анализ РНК ВИЧ, цена – от 3 500 р.
- Количественный анализ РНК ВИЧ, цена – от 11 000 р.
Видео
Внимание! Информация, представленная в статье, носит ознакомительный характер. Материалы статьи не призывают к самостоятельному лечению. Только квалифицированный врач может поставить диагноз и дать рекомендации по лечению, исходя из индивидуальных особенностей конкретного пациента.
Нашли в тексте ошибку? Выделите её, нажмите Ctrl + Enter и мы всё исправим!
Для адекватного и эффективного лечения многих инфекционных заболеваний необходимо своевременное установление точного диагноза. В решении этой задачи в наши дни привлекаются высокотехнологичные методы диагностики основанные на методах молекулярной биологии. В настоящий момент полимеразная цепная реакция (ПЦР) уже достаточно широко применяется в практической медицине как наиболее надежный инструмент лабораторной диагностики .
Чем объясняется популярность ПЦР в настоящее время?
Во-первых, данный метод используется для выявления возбудителей различных инфекционных заболеваний с высокой точностью.Во-вторых, для контроля эффективности проведенного лечения.
В различных руководствах, проспектах, статьях, а также объяснениях врачей-специалистов, мы часто сталкиваемся с употреблением непонятных терминов и слов. Действительно трудно рассказать о высокотехнологичных продуктах науки обыденными словами.
В чем суть и механика ПЦР диагностики?
Каждый живой организм имеет свои уникальные гены. Гены располагаются в молекуле ДНК, которая собственно и является «визитной карточкой» каждого конкретного организма. ДНК (генетический материал) – это очень длинная молекула, которая состоит из «кирпичиков», называемых нуклеотидами. У каждого возбудителя инфекционных заболеваний они расположены строго специфично, то есть в определенной последовательности и комбинации. Когда необходимо понять имеется ли у человека тот или иной возбудитель, забирается биологический материал (кровь, моча, слюна, мазок), который содержит ДНК или фрагменты ДНК микроба. Но количество генетического материала возбудителя очень мало, и невозможно сказать какому именно микроорганизму он принадлежат. Для решения этой задачи и служит ПЦР. Суть полимеразной цепной реакции заключается в том, что берется малое количество материала для исследования, содержащего ДНК, а в процессе ПЦР происходит увеличение количества генетического материала, принадлежащего конкретному возбудителю и, таким образом, его можно идентифицировать.ПЦР диагностика – генетическое исследование биоматериала.
 Идея метода ПЦР принадлежит американскому ученому K.Mullins, которую он предложил в 1983 году. Однако широкое клиническое применение получила лишь в средине 90-х годов XXвека.
Идея метода ПЦР принадлежит американскому ученому K.Mullins, которую он предложил в 1983 году. Однако широкое клиническое применение получила лишь в средине 90-х годов XXвека.Разберемся с терминологией, что же это такое – ДНК и т.д. Каждая клетка любого живого существа (животного, растения, человека, бактерии, вируса) имеет хромосомы. Хромосомы – это хранители генетической информации, которые содержат всю последовательность генов каждого конкретного живого существа.
Каждая хромосома состоит из двух нитей ДНК, закрученных в спираль друг относительно друга. ДНК – химически это дезоксирибонуклеиновая кислота, которая состоит из структурных компонентов – нуклеотидов. Нуклеотидов бывает 5 видов – тимин (Т), аденозин (А), гуанин (Г), цитозин (Ц) и урацил (У). Нуклеотиды располагаются друг за другом в строгой индивидуальной последовательности, образуя гены. Один ген может состоять из 20-200 таких нуклеотидов. Например, ген, кодирующий выработку инсулина, состоит из 60 пар нуклеотидов.
Нуклеотиды имеют свойство комплементарности. Это означает что напротив аденина (А) в одной цепочке ДНК обязательно стоит тимин (Т) в другой цепочке, а напротив гуанина (Г) – цитозин (Ц). Схематически выглядит следующим образом:
Г - Ц
Т - А
А - Т
Данное свойство комплементарности ключевое для проведения ПЦР.
 Помимо ДНК такую же структуру имеет РНК – рибонуклеиновая кислота, отличающаяся от ДНК тем, что вместо тимина в ней используется урацил. РНК – является хранителем генетической информации у некоторых вирусов, которые называются ретровирусами (например, ВИЧ).
Помимо ДНК такую же структуру имеет РНК – рибонуклеиновая кислота, отличающаяся от ДНК тем, что вместо тимина в ней используется урацил. РНК – является хранителем генетической информации у некоторых вирусов, которые называются ретровирусами (например, ВИЧ).
Молекулы ДНК и РНК могут «размножаться» (данное свойство используется для проведения ПЦР). Происходит это следующим образом: две нити ДНК или РНК, отходят друг от друга в стороны, на каждую нить садится специальный фермент, который синтезирует новую цепочку. Синтез идет по принципу комплементарности, то есть, если в исходной цепочке ДНК стоит нуклеотид А, то во вновь синтезированной будет стоять Т, если Г – то Ц и т.д. Этот специальный фермент -«строитель» для начала синтеза нуждается в «затравке» - последовательности из 5-15 нуклеотидов. Данная «затравка» определена для каждого гена (гена хламидии , микоплазмы , вирусов) экспериментально.
Итак, каждый цикл ПЦР состоит из трех стадий. В первую стадию происходит так называемое раскручивание ДНК – то есть разделение связанных между собой двух цепей ДНК. Во вторую - происходит присоединение «затравки» к участку нити ДНК. И, наконец, удлинение данных нитей ДНК, которое производится ферментом-«строителем». В настоящее время весь этот сложный процесс протекает в одной пробирке и состоит из повторяющихся циклов размножения определяемой ДНК с целью получения большого количества копий, которые могут быть, затем выявлены обычными методами. То есть из одной нити ДНК мы получаем сотни или тысячи.
Этапы проведения ПЦР исследования
Забор биологического материала для исследования
В качестве пробы служит различный биологический материал: кровь и ее компоненты, моча, слюна, отделяемое слизистых оболочек, спинномозговая жидкость, отделяемое раневых поверхностей, содержимое полостей тела. Все биопробы собираются одноразовыми инструментами, а набранный материал заключают в пластиковые стерильные пробирки или помещают на культуральные среды, с последующей транспортировкой в лабораторию.В забранные пробы добавляют необходимые реагенты и ставят в программируемый термостат – термоциклер (амплификатор). В амплификаторе 30-50 раз повторяется цикл ПЦР, состоящий из трех этапов (денатурация, отжиг и удлинение). Что это означает? Рассмотрим подробнее.
Этапы непостредственно ПЦР реакции, копирование генетического материала
 I
этап ПЦР - Подготовка генетического материала для копирования.
I
этап ПЦР - Подготовка генетического материала для копирования.
Происходит при температуре 95° С, при этом нити ДНК разъединяются, и на них могут садиться «затравки».
«Затравки» изготавливают промышленным способом различные научно-производственные объединения, а лаборатории покупают уже готовые. При этом «затравка» для выявления, например, хламидии, работает только для хламидии и т.д. Таким образом, если тестируется биоматериал на наличие хламидийной инфекции, то в реакционную смесь помещается «затравка» для хламидий; если тестирование биоматериала на вирус Эпштейн-Барра, то и «затравка» для вируса Эпштейн-Барра.
II
этап – Объединение генетического материала возбудителя инфекции и «затравки».
Если имеется ДНК определяемого вируса или бактерии , «затравка» садится на эту ДНК. Этот процесс присоединения «затравки» и есть второй этап ПЦР. Данная стадия проходит при температуре 75°С.
III
этап - Копирование генетического материала возбудителя инфекции.
Это процесс собственно удлинения или размножения генетического материала, который происходит при 72°С. К «затравкам» подходит фермент- «строитель» и синтезирует новую цепочку ДНК. С окончанием синтеза новой цепочки ДНК, заканчивается и цикл ПЦР. То есть за один цикл ПЦР происходит увеличение количества генетического материала в два раза. Например, в исходной пробе имелось 100 молекул ДНК какого-либо вируса, после первого цикла ПЦР в пробе будет уже 200 молекул ДНК тестируемого вируса. Один цикл длится 2-3 минуты.
Для образования достаточного количества генетического материала для идентификации, обычно производится 30-50 циклов ПЦР, что занимает 2-3 часа.
Этап идентификации размноженного генетического материала
Собственно ПЦР на этом заканчивается и далее идет не менее значимый этап идентификации. Для идентификации используют метод электрофореза или меченые «затравки». При использовании электрофореза полученные нити ДНК разделяются по размерам, и наличие фрагментов ДНК разной длины свидетельствует о положительном результате анализа (то есть о наличии того или иного вируса, бактерии и т.д.). При использовании меченых «затравок», к конечному продукту реакции добавляют хромоген (краситель), вследствие чего ферментативная реакция сопровождается образованием окраски. Развитие окраски прямо свидетельствует, что вирус или другой выявляемый агент присутствуют в исходной пробе.На сегодняшний день, используя меченые «затравки», а также соответствующее программное обеспечение, можно производить сразу и «чтение» результатов ПЦР. Это так называемаяreal-time ПЦР.
Почему ПЦР диагностика обладает такой ценностью?

Одним из существенных преимуществ метода ПЦР является высокая чувствительность – от 95 до 100%. Однако, эти преимущества должны базироваться на непременном соблюдении следующих условий:
- корректный забор, транспортировка биологического материала;
- наличие стерильного, одноразового инструментария, специальных лабораторий и обученного персонала;
- строгое соблюдение методики и стерильности во время проведения анализа
Возможности, заложенные в ПЦР-анализе, позволяют достичь непревзойденной аналитической специфичности. Это означает выявление именно того микроорганизма, который искали, а не похожего или близкородственного.
Диагностическая чувствительность и специфичность метода ПЦР, зачастую превосходят таковые и для культурального метода, называемого «золотым стандартом» для выявления инфекционных заболеваний. Учитывая продолжительность выращивания культуры (от нескольких дней до нескольких недель), преимущество метода ПЦР становится очевидным.
ПЦР в диагностике инфекций
 Преимущества метода ПЦР (чувствительность и специфичность) определяют широкий спектр применения в современной медицине.
Преимущества метода ПЦР (чувствительность и специфичность) определяют широкий спектр применения в современной медицине.
Основные области применения ПЦР-диагностики:
- диагностика острых и хронических инфекционных заболеваний различной локализации
- контроль эффективности проведенной терапии
- уточнение вида возбудителя
Использование ПЦР-диагностики производится в совокупности с другими методами исследования (ИФА, ПИФ, РИФ и др.). Их сочетание и целесообразность определяет лечащий врач.
Возбудители инфекций, обнаруживаемые методом ПЦР
Вирусы:
- ретровирусы HIV-1 и HIV-2
- герпетиформные вирусы
- вирус простого герпеса 1 и 2 типов
Полимеразная цепная реакция (ПЦР) - это метод биохимической технологии в молекулярной биологии, проводящийся с целью увеличения одной или нескольких копий фрагментов ДНК на несколько степеней, что позволяет создать от нескольких тысяч до миллионов копий определенной последовательности ДНК.
Разработанный в 1983 году Кэри Муллисом, метод ПЦР в настоящее время является распространенным и зачастую незаменимым методом, использующимся в медицинских и биологических исследовательских лабораториях для множества различных приложений. Они включают клонирование ДНК для секвенирования, филогению на основе ДНК, или функциональный анализ генов; диагностику наследственных заболеваний; выявление генетических отпечатков пальцев (используется в отраслях судебной медицины и в проведении теста на отцовство), а также выявление и диагностику инфекционных заболеваний. В 1993 году, Муллис был удостоен Нобелевской премии по химии вместе с Майклом Смитом по их работе над ПЦР .
Метод основан на термоциклировании, состоящем из повторяющихся циклов нагрева и охлаждения реакции для денатурации и репликации ДНК ферментами. Праймеры, (короткие фрагменты ДНК), содержащие последовательности, комплементарные с целевым участком наряду с ДНК-полимеразой (на основе чего метод получил название), являются ключевыми компонентами для запуска избирательной и повторной амплификации. В процессе ПЦР, сама синтезированная ДНК используется в качестве матрицы для репликации, приводя в движение цепную реакцию, в которой ДНК-матрица амплифицируется в геометрической прогрессии. ПЦР может значительно модифицироваться для выполнения широкого спектра генетических манипуляций.
Почти все ПЦР-приложения используют термостабильную ДНК-полимеразу, такую как Taq-полимераза, фермент , первоначально выделенный из бактерии Thermus aquaticus . Эта ДНК-полимераза ферментативно собирает новую цепь ДНК из блоков, составляющих ДНК - нуклеотидов, используя одноцепочечную ДНК в качестве матрицы и олигонуклеотиды ДНК (также называемые праймерами ДНК), которые необходимы для инициации синтеза ДНК. Подавляющее большинство методов ПЦР применяют термоциклирование, т. е. попеременное нагревание и охлаждение образца ПЦР по определенному ряду температурных этапов. Эти этапы термоциклирования необходимы сначала для физического разделения двух цепей двойной спирали ДНК при высокой температуре в процессе, называемом денатурацией ДНК. При более низкой температуре, каждая цепь будет использоваться в качестве матрицы в синтезе ДНК ДНК-полимеразой для того, чтобы избирательно амплифицировать целевой участок ДНК. Избирательность результатов ПЦР с использованием праймеров, которые являются комплементарными с участком ДНК - мишенью для амплификации при определенных условиях термоциклирования.
Принципы ПЦР диагностики
ПЦР используется для амплификации определенного участка цепи ДНК (ДНК-мишень). Большинство методов ПЦР обычно амлифицируют фрагменты ДНК до ~ 10000 пар оснований (кб), хотя некоторые методы позволяют увеличивать фрагменты до 40 кб в размере. Реакция производит ограниченное количество конечного амплифицированного продукта, который регулируется имеющимися реактивами в реакции и обратной связью-ингибированием продуктов реакции.
Основной набор ПЦР требует нескольких компонентов и реактивов. Они включают:
- ДНК-матрицу , содержащую целевой участок ДНК, который требуется амплифицировать.
- Два праймера, комплементарные 3"-концам каждой из смысловой и антисмысловой цепей ДНК-мишени.
- Taq-полимераза или иная ДНК-полимераза, действующая при оптимальной температуре около 70 ° C.
- Дезоксинуклеозидтрифосфаты (дНТФ; трифосфатные группы, содержащие нуклеотиды), строительные блоки, из которых ДНК-полимераза синтезирует новую цепь ДНК.
- Буферный раствор , обеспечивающий подходящие химические условия для оптимальной активности и стабильности ДНК-полимеразы.
- Двухвалентные катионы, ионы магния или марганца; обычно используется Mg2 +, но также может использоваться и Mn2 + для ПЦР-опосредованного мутагенеза ДНК, так как более высокие концентрации Mn2 + увеличивают частоту ошибок в процессе синтеза ДНК.
- Одновалентные катионы ионов калия.
ПЦР обычно проводится в реакционном объеме 10-200 мкл в небольших реакционных пробирках (объемом 0.2-0.5 мл) в термоциклере-амплификаторе. Амплификатор нагревает и охлаждает реакционные пробирки для достижения температур, необходимых на каждом этапе реакции. Многие современные амплификаторы используют эффект Пельтье, который позволяет нагревать и охлаждать блок с ПЦР-пробирками просто путем изменения направления электрического тока. Тонкостенные реакционные пробирки способствуют благоприятной теплопроводности для обеспечения быстрого теплового равновесия. Старые амплификаторы, у которых отсутствует нагреваемая крышка, требуют слоя масла на поверхности реакционной смеси или шарика воска в пробирке.
Порядок процедуры
Как правило, ПЦР состоит из серий 20-40 повторяющихся изменений температуры, называемых циклами, причем каждый цикл обычно состоит 2-3 дискретных температурных этапов, обычно трех. Циклирование зачастую начинается и завершается одним температурным этапом (так называемым ожиданием ) при высокой температуре (> 90 ° C) для окончательного расширения продукта или краткого хранения. Использующиеся температуры и длительность времени их применения в каждом цикле зависит от множества параметров. Они включают в себя фермент, используемый для синтеза ДНК, концентрацию двухвалентных ионов и дНТФ в реакции, и температуру плавления (Tm) праймеров.
- Этап инициализации: Этот этап состоит из нагрева реакции до температуры 94-96 ° C (или 98 ° C, если используются высоко термостабильные полимеразы), который проводится на 1-9 минут. Этап требуется только для ДНК-полимераз, которым необходима активация теплом, так называемым горячим стартом ПЦР.
- Этап денатурации: Является первым регулярным событием термоциклирования и состоит из нагревания реакции до 94-98°C в течение 20-30 секунд. Это вызывает расщепление ДНК-матрицы с разрушением водородных связей между комплементарными основаниями и образованием одноцепочечных молекул ДНК.
- Этап отжига: Температура реакции снижается до 50-65°С в течение 20-40 секунд, что позволяет праймерам связаться с одноцепочечной матрицей ДНК. Обычно температура отжига составляет около 3-5 градусов по Цельсию ниже Tm используемых праймеров. Стабильные водородные связи ДНК-ДНК формируются только, когда последовательность праймера точнее соответствует матрице последовательности. Полимераза связывается с гибридом «праймер-матрица» и начинает синтез ДНК.
- Этап расширения / элонгации: Температура на этом этапе зависит от используемой ДНК-полимеразы; Taq-полимераза имеет свою оптимальную температуру активности при 75-80°C; обычно используется температура 72°C для этого фермента. На этом этапе ДНК-полимераза синтезирует новую цепь ДНК, комплементарную цепи ДНК-матрицы, добавляя дНТФ, которые являются комплементарными матрице в направлении 5 "к 3", связывая 5"-фосфатную группу дНТФ с 3"-гидроксильной группой в конце образующейся (расширяющейся) ДНК. Время расширения зависит как от используемой ДНК-полимеразы, так и длины фрагмента ДНК, который необходимо амплифицировать. Как правило, при своей оптимальной температуре, ДНК-полимераза полимеризует тысячу оснований в минуту. При оптимальных условиях, т.е. при отсутствии ограничений вследствие ограничивающих субстратов или реактивов, на каждом этапе расширения, количество ДНК-мишени удваивается, что приводит к экспоненциальной (в геометрической прогрессии) амплификации фрагмента ДНК.
- Финальное удлинение: Это единственный этап, выполняющийся иногда при температуре 70-74°С в течение 5-15 минут после последнего цикла ПЦР для того, чтобы убедиться, что любые оставшиеся одноцепочечные ДНК удлинились полностью.
- Финальное ожидание: Этот этап при температуре 4-15 ° C в течение неопределенного времени может быть использован для кратковременного сохранения реакции. Чтобы проверить, синтезировала ли ПЦР ожидаемый фрагмент ДНК (также иногда называют «амплимер» или «ампликон»), применяется электрофорез в агарозном геле для разделения продуктов ПЦР по размеру. Размер ПЦР-продуктов определяется путем сравнения с лестницей ДНК (маркером молекулярного веса), которая содержит фрагменты ДНК известного размера, выполняется на геле наряду с ПЦР-продуктами.
Стадии полимеразной цепной реакции
Процесс ПЦР можно разделить на три этапа:
- Экспоненциальная амплификация : В течение каждого цикла, количество продукта удваивается (при условии 100% эффективности реакции). Реакция очень чувствительна: необходимо присутствие только незначительного количества ДНК.
- Стадия выравнивания : реакция замедляется, так как ДНК-полимераза теряет активность и потребление реактивов, таких как дНТФ и праймеры, заставляет их стать ограничивающими.
- Плато : Продукт больше не накапливается из-за истощения реактивов и ферментов.
Оптимизация ПЦР
На практике, ПЦР может пройти не успешно по различным причинам, в частности из-за ее чувствительности к загрязнению, что вызывает амплификацию побочных продуктов ДНК. В связи с этим, был разработан ряд методик и процедур для оптимизации условий ПЦР. Загрязнением посторонней ДНК занимаются лабораторные протоколы и процедуры, которые очищают предварительно ПЦР-смеси от потенциальных ДНК-загрязнителей. Это обычно включает пространственное разделение ПЦР-комплектов от областей для анализа или очистки продуктов ПЦР, использование одноразовой пластиковой посуды и тщательную очистку рабочей поверхности между этапами проведения реакции. Методы конструирования праймеров играют важную роль в улучшении выделения продуктов ПЦР и в избегании образования побочных продуктов, а также использование альтернативных компонентов буфера или полимеразных ферментов может помочь в амплификации длинных или иначе проблемных участков ДНК. Добавление реактивов, таких как формамид, в буферные системы может увеличить специфичность и выделение ПЦР. Симуляция на компьютере теоретических результатов ПЦР (электронная ПЦР) может быть выполнена для оказания помощи в конструировании праймеров.
Применение ПЦР
Селективное выделение ДНК
ПЦР позволяет выделять фрагменты ДНК из геномной ДНК с помощью селективной амплификации конкретного участка ДНК. Это применение ПЦР дополняет многие методы, такие как создание зондов гибридизации для методов «саузерн» или «норзерн-блоттинга» и клонирования ДНК, которые требуют больших количеств ДНК, представляющих собой специфический участок ДНК. ПЦР снабжает эти методы высоким содержанием чистой ДНК, что позволяет выполнить анализ образцов ДНК, даже с небольшим количеством исходного материала.
Другие применения ПЦР включают секвенирование ДНК с целью определения неизвестных ПЦР-амплифицированных последовательностей, в которой один из апмлификационных праймеров может быть использован в секвенировании по Сэнгеру, выделении последовательности ДНК для ускорения технологий рекомбинантной ДНК, включающих вставку последовательности ДНК в плазмиду или генетический материал другого организма. Можно быстро провести скрининг колоний бактерий (кишечной палочки) посредством ПЦР для коррекции конструкции векторной ДНК. ПЦР также можно применять для генетической дактилоскопии; методика, используемая в судебной медицине для идентификации личности или организма путем сравнения экспериментальных ДНК с помощью различных ПЦР - методов.
Некоторые методы ПЦР «отпечатков пальцев» имеют высокую дискриминационную силу и могут использоваться для определения генетических связей между людьми, такими как родитель -ребенок или между братьями и сестрами, и используются в выявлении отцовства. Эта методика также может применяться для определения эволюционных взаимоотношений между организмами.
Амплификация и количественная оценка ДНК
Так как ПЦР увеличивает число копий участков ДНК, которые являются мишенями, ПЦР может применяться для анализа очень малых количеств образца. Зачастую это имеет решающее значение для судебно-медицинской экспертизы, когда доступны только следовые количества ДНК в качестве доказательств. ПЦР также может применяться при анализе древних ДНК, которым десятки тысяч лет. Эти ПЦР-методы были успешно использованы на животных, таких как сорокатысячелетний мамонт, а также на ДНК человека, в приложениях, начиная от анализа египетских мумий до идентификации русского царя.
Количественные методы ПЦР позволяют оценить количество заданной последовательности, присутствующей в образце - метод часто применяется для количественного определения уровня экспрессии гена. ПЦР в реальном времени является признанным инструментом для количественного анализа ДНК, который измеряет накопление ДНК продукта после каждого цикла ПЦР-амплификации.
ПЦР в диагностике заболеваний
ПЦР позволяет провести раннюю диагностику злокачественных заболеваний, таких как лейкемия и лимфома, которая в настоящее время является высоко развитой в исследованиях рака и уже используется в плановом порядке. ПЦР может проводиться непосредственно на геномных образцах ДНК для выявления транслокационно-специфичных злокачественных клеток с чувствительностью, которая, по крайней мере, в 10 000 раз выше, чем у других методов.
ПЦР позволяет также выявлять некультивируемые или медленно растущие микроорганизмы, таких как микобактерии, анаэробные бактерии, и вирусы из культуры ткани и моделей животных. Основанием для ПЦР диагностических приложений в области микробиологии является выявление инфекционных агентов и дифференцировка непатогенных штаммов от патогенных в силу специфических генов.
Вирусная ДНК может также выявляться с помощью ПЦР. Праймеры должны быть специфичными к целевым последовательностям ДНК вируса, и ПЦР может применяться для диагностических анализов ДНК или секвенирования генома вируса. Высокая чувствительность ПЦР позволяет обнаружить вирусы вскоре после инфицирования и даже до начала заболевания. Такое раннее выявление вируса может дать врачам значительные возможности в лечении. Количество вируса («вирусная нагрузка») у пациента также может быть определено количественными методом анализа ДНК на основе ПЦР.
Вариации основных методов полимеразной цепной реакции
- Аллель-специфичная ПЦР : метод диагностики или клонирования, основанный на однонуклеотидных полиморфизмах (SNP) (отличиях одного основания в ДНК). Требует предварительных знаний о последовательности ДНК, включая различия между аллелями, и использует праймеры, чьи 3"-концы охватывают SNP. ПЦР-амплификация в жестких условиях гораздо менее эффективна в присутствии несоответствия между матрицей и праймером, поэтому успешная амплификация с SNP-специфическим праймером сигнализирует о наличии специфических SNP в последовательности.
- ПЦР-сборка или сборка циклирования полимеразы (СЦП): искусственный синтез длинных последовательностей ДНК путем проведения ПЦР на резерве длинных олигонуклеотидов с короткими перекрывающимися сегментами. Олигонуклеотиды чередуются между направлениями смысловой и антисмысловой цепей, и перекрывающиеся сегменты определяют порядок ПЦР-фрагментов, тем самым селективно вырабатывая окончательный длинный продукт ДНК.
- Асимметричная ПЦР : преимущественно амплифицирует одну цепь ДНК в матрице двухцепочечной ДНК. Используется в секвенировании и гибридизационного зондирования, где требуется амплификация только одной из двух комплементарных цепей. ПЦР проводится как обычно, но с большим избытком праймеров для цепи, предназначенной для амплификации. Из-за медленной (в арифметической прогрессии) амплификации в конце реакции после использования ограничивающего праймера, требуются дополнительные циклы ПЦР. Последняя модификация этого процесса, известная как «LATE-PCR» (линейность после экспоненциальной фазы - ПЦР) использует ограничивающий праймер с более высокой температурой плавления (Tm), чем избыток праймера для поддержания эффективности реакции, так как концентрация ограничивающего праймера снижается в середине реакции.
- Dial-out ПЦР : высоко параллельный метод с целью получения точных молекул ДНК для синтеза генов. Комплексный резерв молекул ДНК модифицируется уникальными фланговыми метками до массивного параллельного секвенирования. Tag-направленные праймеры затем обеспечивают получение молекул с заданной последовательностью с помощью ПЦР.
- Геликаза-зависимая амплификация: аналогична традиционной ПЦР, но требует постоянную температуру, чем циклирование через циклы денатурации и отжига / расширения. Геликаза ДНК, фермент, который раскручивает ДНК, используется вместо тепловой денатурации.
- Горячий старт ПЦР : методика, которая снижает неспецифическую амплификацию во время начальной настройки этапов ПЦР. Может выполняться вручную путем нагревания компонентов реакции до температуры денатурации (например, 95 ° C) перед добавлением полимеразы. Были разработаны системы специализированных ферментов, которые ингибируют активность полимеразы при комнатной температуре, либо путем связывания антител, либо в присутствии ковалентно связанных ингибиторов, которые диссоциируются только после высокотемпературной стадии активации. «Горячий старт/холодный финиш» ПЦР достигается с помощью новых гибридных полимераз, которые являются неактивными при температуре окружающей среды и мгновенно активируются при температуре элонгации.
- ПЦР, специфичная к межмикросателлитным последовательностям (ISSR): ПЦР-метод ДНК-дактилоскопии, который увеличивает число копий участков между простыми повторяющимися последовательностями для получения уникального отпечатка из амплифицированной длины фрагмента.
- Инвертированная ПЦР широко используется для определения участков последовательности вокруг геномных вставок. Она включает ряд расщеплений ДНК и самостоятельного лигирования, в результате чего образуются известные последовательности на любом конце неизвестной последовательности.
- ПЦР, опосредованная лигированием: Использует небольшие линкеры ДНК, соединенные с интересующей ДНК и несколькими праймерами, связанные с линкерами ДНК; используется для секвенирования ДНК, метода прогулки по геному, и футпринтинга ДНК.
- Метилирование-специфическая ПЦР (MSP): разработана Стивеном Бэйлином и Джимом Германом в Школе Медицины Джона Хопкинса, используется для обнаружения метилирования островков CpG в геномной ДНК. ДНК сначала обрабатывается бисульфитом натрия, который преобразует неметилированные основания цитозина в урацил, распознающийся ПЦР-праймерами как тимин. Затем проводятся две ПЦР на модифицированной ДНК с использованием наборов идентичных праймеров, за исключением в любом островке CpG в пределах последовательности праймеров. В этих точках, один набор праймеров распознает ДНК с цитозинами для увеличения числа копий метилированной ДНК, и один набор распознает ДНК с урацилом или тимином для амплификации неметилированной ДНК. MSP с использованием qPCR также может выполняться с целью получения количественной, нежели качественной информации о метилировании.
- Минипраймер - ПЦР: используются термостабильные полимеразы (S-Tbr), которые могут расширять от коротких праймеров («smalligos»), с числом от 9 или 10 нуклеотидов. Этот метод позволяет ПЦР нацеливаться на регионы, связанные с меньшими праймерами, и используется для амплификации консервативных последовательностей ДНК, таких как ген рРНК 16S (или эукариотическая 18S).
- Амплификация зонда, зависящего от мультиплексного лигирования (MLPA ): позволяет амплифицировать множество мишеней только с одной парой праймеров, таким образом, избегая ограничений разрешения мультиплексной ПЦР.
- Мультиплексная ПЦР состоит из нескольких наборов праймеров в одной смеси ПЦР с целью получения ампликонов разных размеров, которые специфичны к различным последовательностям ДНК. По ориентации на несколько генов одновременно, возможно получить дополнительную информацию при проведении одного теста, что в противном случае потребовало бы больше в несколько раз реагентов и больше времени для выполнения. Температуры отжига для каждого набора праймеров должны быть оптимизированы, чтобы работать правильно в пределах одной реакции, и с размерами ампликона. То есть, длина их пары оснований должна быть достаточно разной с целью образования отдельных полос при визуализации путем электрофореза в геле.
- Вложенная ПЦР : увеличивает специфичность амплификации ДНК, за счет уменьшения фона в связи с неспецифической амплификацией ДНК. Используются два набора праймеров в двух последовательных ПЦР. В первой реакции одна пара праймеров используется для синтеза ДНК-продуктов, которые помимо намеченной цели, могут по-прежнему состоять из неспецифически амплифицированных фрагментов ДНК. Продукты используются затем во второй ПЦР с набором праймеров, чьи сайты связывания полностью или частично отличаются от 3"-концов каждого из праймеров, использованных в первой реакции. Вложенная ПЦР часто наиболее успешна в специфической амплификации длинных фрагментов ДНК, чем традиционная ПЦР, но она требует более подробных знаний о последовательностях-мишенях.
- ПЦР с перекрывающимися расширениями или сращивание перекрывающимися расширениями (SOE): методика генной инженерии, которая применяется для соединения двух или более фрагментов ДНК, которые содержат комплементарные последовательности. Используется для соединения частей ДНК, содержащие гены, регулирующие последовательности, или мутации; техника позволяет создавать специфические и длинные конструкции ДНК.
- Количественная ПЦР (КПЦР): используется для измерения количества продукта ПЦР (обычно в режиме реального времени). Количественно измеряет начальные количества ДНК, кДНК или РНК. КПЦР широко применяется для определения наличия последовательности ДНК в образце, и числа ее копий в пробе. Количественная ПЦР в реальном времени имеет очень высокую степень точности. Методы QRT-PCR (или QF-PCR) используют флуоресцентные красители, такие как «Sybr Green», «EvaGreen» или флюорофор-содержащие ДНК-зонды, такие как «TaqMan», чтобы измерить количество амплифицированного продукта в реальном времени. Иногда упоминается под сокращением RT-PCR (ПЦР в реальном времени) или RQ-PCR. QRT-PCR или RTQ-PCR являются более подходящими сокращениями, так как RT-PCR обычно относится к ПЦР с обратной транскрипцией, часто используемой в сочетании с КПЦР.
- ПЦР с обратной транскрипцией (RT-PCR): для увеличения числа копий ДНК из РНК. Обратная транскриптаза транскрибирует РНК в кДНК, которая затем амплифицируется с помощью ПЦР. RT-PCR широко используется в профилировании экспрессии для выявления экспрессии гена или для определения последовательности РНК-транскрипта, включая сайты старта транскрипции и прекращения. Если известна геномная последовательность ДНК гена, RT-PCR может использоваться для отображения расположения экзонов и интронов в гене. 5"-конец гена (соответствующий сайту старта транскрипции), как правило, определяется RACE-PCR (быстрой амплификацией концов кДНК).
- ПЦР твердой фазы : охватывает несколько значений, в том числе «Амплификация Полонии» (где ПЦР колонии производятся на матрице геля, например), «Bridge ПЦР» (праймеры ковалентно связаны с твердой опорной поверхностью), традиционная ПЦР твердой фазы (где применяется «асимметричная ПЦР» в присутствии праймеров, несущих твердую опору с последовательностью, соответствующей одному из водных праймеров), и ПЦР усиленной твердой фазы (где традиционная ПЦР твердой фазы может быть улучшена за счет применения высоких Tm и вложенных праймеров с твердой опорой с вариантом приложения термического «этапа», чтобы способствовать образованию праймеров с твердой опорой).
- Термическая асимметричная чередующаяся ПЦР (TAIL-PCR): применяется с целью выделения неизвестной последовательности, следующей за известной последовательностью. В известной последовательности, TAIL-PCR использует вложенную пару праймеров с различными температурами отжига; дегенерат праймера используется для амплификации в другом направлении от неизвестной последовательности.
- Touchdown PCR (ступенчатая ПЦР): вариант ПЦР, направленный на уменьшение неспецифического фона путем постепенного снижения температуры отжига по мере прогрессирования циклов ПЦР. Температура отжига на начальных циклах, как правило, на несколько градусов (3-5 ° C) выше Tm используемых праймеров, в то время как на более поздних циклах, температура на несколько градусов (3-5 ° C) ниже Tm праймеров. Более высокие температуры дают большую специфичность для связывания праймера, и более низкие температуры способствуют более эффективной амплификации из специфических продуктов, образующихся во время начальных циклов.
- PAN-AC : использует изотермические условия для амплификации и может применяться на живых клетках.
- Универсальная быстрая прогулка по геному : для прогулки по геному и генетической дактилоскопии с использованием более специфических «двусторонних» ПЦР, чем традиционные "односторонние" подходы (с использованием только один ген-специфического праймера и одного общего праймера - что может привести к артефактному «шуму») в силу механизма, включающего образование структуры лассо. Упрощенными производными UFW являются «Lane RAGE» (лассо-зависимая вложенная ПЦР для быстрой амплификации концов геномной ДНК), «5"RACE Lane» и «3"RACE Lane».
- In silico PCR (цифровая ПЦР, виртуальная ПЦР, электронная ПЦР, е-ПЦР) относится к вычислительным средствам, применяющимся для вычисления результатов теоретической полимеразной цепной реакции с помощью данного набора праймеров (зондов) для амплификации последовательностей ДНК из секвенированного генома или транскриптома.
История ПЦР
В статье в «Journal of Molecular Biology» в 1971 г. Клеппе и его соавторов впервые описан метод с использованием ферментативного анализа с целью репликации короткой матрицы ДНК с праймерами в условиях пробирки. Тем не менее, это раннее проявление основного принципа ПЦР не получило много внимания, и изобретение полимеразной цепной реакции в 1983 году, как правило, приписывается Кэри Муллису.
Когда Муллис разработал ПЦР в 1983 году, он работал в Эмеривилле, Калифорнии на «Cetus Corporation», одной из первых компаний биотехнологии. Там он отвечал за синтез коротких цепочек ДНК. Муллис писал, что он задумал ПЦР во время езды вдоль шоссе Пасифик Кост однажды ночью в своем автомобиле. Он проигрывал в своем сознании новый способ анализа изменений (мутаций) в ДНК, когда он осознал, что он вместо этого изобрел метод увеличения числа копий любого участка ДНК посредством повторяющихся циклов дупликации, обусловленной ДНК-полимеразой. В «Scientific American», Муллис резюмировал процедуру: «Начиная с одной молекулы генетического материала ДНК, ПЦР может генерировать 100 млрд. подобных молекул за один день. Эту реакцию легко выполнить. Она требует не больше, чем пробирку, несколько простых реагентов и источник тепла». Он был награжден Нобелевской премией по химии в 1993 году за свое изобретение, семь лет спустя как он и его коллеги в «Cetus» впервые осуществили его предложение на практике. Тем не менее, остались некоторые противоречия об интеллектуальном и практическом вкладе других ученых в работе Муллиса, и был ли он единственным изобретателем принципа ПЦР.
В основе метода ПЦР лежит использование подходящей ДНК-полимеразы, способной выдерживать высокие температуры> 90°C (194°F), необходимых для расщепления двух цепей ДНК в двойной спирали ДНК после каждого цикла репликации. ДНК-полимеразы, первоначально использовавшиеся для экспериментов в пробирке, предвещая ПЦР, были не в состоянии выдержать такие высокие температуры. Поэтому, ранние процедуры репликации ДНК были очень неэффективны и занимали много времени, а также требовали большого количества ДНК-полимеразы и непрерывной обработки в течение всего процесса.
Открытие в 1976 г. Taq-полимеразы - полимеразы ДНК, выделенной из термофильной бактерии, Thermus aquaticus , которая, естественно, живет в горячих (от 50 до 80°C (122 до 176°F)) средах, таких как горячие источники - проложило путь к кардинальному улучшению метода ПЦР. ДНК-полимераза, выделенная из Т. Aquaticus , стабильна при высоких температурах и остается активной даже после денатурации ДНК, тем самым устраняя необходимость добавления новых ДНК-полимераз после каждого цикла. Это позволило автоматизировать процесс амплификации ДНК на основе амплификатора-термоциклера.
Патентные войны
Предложенный метод ПЦР был запатентован Кэри Муллисом и приписан «Cetus Corporation», где работал Муллис, когда он изобрел методику в 1983 году. Фермент Taq-полимераза был также защищен патентами. Было подано несколько громких исков, связанных с методикой, в том числе безуспешный иск, поданный «DuPont». Фармацевтическая компания «Hoffmann-La Roche» приобрела права на патенты в 1992 году и в настоящее время держит те, которые по-прежнему защищены.
Подобное патентное сражение за фермент Taq-полимеразу все еще продолжается в некоторых юрисдикциях по всему миру между «Roche» и «Promega». Правовые аргументы вышли за рамки сроков действия исходных патентов на ПЦР и Taq-полимеразу, срок действия которых истек 28 марта 2005 года.
Часто используется в качестве экспресс-метода для индикации и идентификации вирусов.
Впервые этот метод разработал К. Мюллис (США) в 1983 т. Благодаря высокой чувствительности, специфичности и простоте выполнения его широко применяют в генетике, судебной медицине, диагностике и других областях.
Суть метода - амплификация, т. е. увеличение числа копий строго определенных фрагментов молекулы ДНК in vitro. В этом методе действуют матричный механизм и принцип комплементарности. Две одинарные полинуклеотидные цепи (нуклеиновой кислоты) способны связываться водородными связями в одну двуспиральную, если последовательности нуклеотидов одной точно соответствуют последовательности нуклеотидов другой так, что их азотистые основания могут образовывать пары аденин-тимин и гуанин-цитозин.
ПЦР основана на амплификации ДНК с помощью термостабильной ДНК-полимеразы, осуществляющей синтез взаимно комплементарных цепей ДНК, начиная с двух праймеров. Праймер - это фрагмент ДНК, состоящий из 20-30 нуклеотидов. Эти праймеры (затравки) комплементарны противоположным цепям ДНК. При синтезе ДНК праймеры встраиваются в цепь новосинтезирующихся молекул ДНК.
Обычно ПЦР ставят в 25-40 циклов. Каждый цикл включает три этапа: первый - денатурация при 92-95 °С. При этом две цепи ДНК расходятся; второй - отжиг, или присоединение праймеров при 50-65 °С; третий - элонгация, или полимеризация при 68-72 °С, при этом ДНК-полимераза осуществляет комплементарное достраивание цепей ДНК-матрицы с помощью четырех видов нуклеотидов. В результате одного цикла происходит удвоение искомого генетического материала. Образовавшиеся в первом цикле цепи ДНК служат матрицами для второго цикла и т. д. После первого цикла амплифицируется только фрагмент между двумя праймерами. Таким образом, идет удвоение числа копий амплифицируемого участка, что позволяет за 25-40 циклов насинтезировать миллионы (2 n) фрагментов ДНК - количество, достаточное для индикации их различными методами (методом гибридизационных зондов, содержащих определенную метку, электрофорезом и т. д.). Чаще для этой цели используют метод электрофореза в агарозном геле с окрашиванием бромистым этидием.
В ПЦР из участков ДНК возбудителя используют праймеры, которые имеют уникальную последовательность нуклеотидов, характерных только для определенного возбудителя.
Методика постановки ПЦР сводится к следующему: из исследуемого материала выделяют ДНК-матрицу; в пробирке соединяют выделенную ДНК с амплификационной смесью, в которую входят ДНК-полимераза, все 4 вида нуклеотидов, 2 вида праймеров, MgCl, буфер, деионизированная вода и минеральное масло. Затем пробирки помещают в амплификатор, и проводят амплификацию в автоматическом режиме по заданной программе, соответствующей виду возбудителя. Результаты регистрируют чаще методом электрофореза в 1-2%-ном агарозном геле в присутствии бромистого этидия, который соединяется с фрагментами ДНК и выявляется в виде светящихся полос при облучении геля УФ-лучами на трансиллюминаторе. Все процедуры ПЦР занимают 1-2 рабочих дня.
С целью повышения специфичности и чувствительности ПЦР применяют различные варианты: гнездовую ПЦР; ПЦР с «горячим стартом» с использованием парафиновой прослойки или блокады активных центров полимеразы моноклональными антителами. Кроме того, некоторые фирмы выпускают лиофилизированные наборы реагентов для проведения амплификации ДНК, которые позволяют ускорить процесс проведения ПЦР и уменьшить возможность появления ложноположительных результатов.
В настоящее время внедряется новая технология ПЦР-ПЦР в реальном времени (Real-Time PCR). Ее принципиальная особенность - мониторинг и количественный анализ накопления продуктов полимеразной цепной реакции и автоматическая регистрация и интерпретация полученных результатов. Этот метод не требует стадии электрофореза, что позволяет снизить предъявляемые к ПЦР требования лаборатории. ПЦР в реальном времени используют флуоресцентно-меченые олигонуклеотидные зонды для детекции ДНК в процессе ее амплификации. ПЦР в реальном времени позволяет провести полный анализ пробы в течение 20-60 мин и теоретически способа детективировать даже одну молекулу ДНК или РНК в пробе.
Система детекции продукта в полимеразной цепной реакции «real-time» (мониторинговая ПЦР) позволяет цикл за циклом следить за накоплением амплифицированной ДНК. Система включает и себя олигонуклеотидный зонд, который способен присоединяться (гибридизироваться) к внутреннему сегменту ДНК-мишени. На 5′-конце зонд помечен флуоресцентным красителем-репортером (reporter dye), а на 3′-конце - блокатором (quencher dye). По мере накопления продукта ПЦР зонд гибридизируется к нему, однако свечения не происходит из-за близости между репортером и блокатором. В результате копирования последовательности полимераза достигает 5′-конца зонда. 5’-3′-экзонуклеазная активность полимеразы отсоединяет флуоресцентную метку с 3′-конца пробы, тем самым освобождая флуоресцирующий репортер от его связи с блокатором сигнала, что и приводит к увеличению флуоресценции. Уровень флуоресценции, таким образом, пропорционален количеству специфичного продукта реакции. Важно, что результаты ПЦР регистрируются по наличию флуоресценции в закрытых пробирках и, таким образом, решается еще одна из основных проблем этого метода - проблема контаминации ампликонами.
Достоинства ПЦР: быстрота анализа; высокие чувствительность и специфичность; минимальное количество исследуемого материала; простота в исполнении и возможность полной автоматизации.
Ввиду того что чувствительность ПЦР может достигать до детекции одной копии ДНК-матрицы, существует высокая степень опасности получения ложноположительных результатов. Поэтому генно-диагностической лабораторией при постановке ПЦР необходимо неуклонно выполнять специальные требования к планировке и режиму работы.
ПЦР является одним из дополняющих методов, существующих в вирусологической диагностике. Эта реакция очень важна для диагностики вирусных инфекций, когда вирусные антигены или вирусспецифические антитела не могут быть обнаружены и когда присутствие вирусной нуклеиновой кислоты может быть единственным свидетельством заражения, особенно при латентно протекающих и смешанных инфекциях.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter .