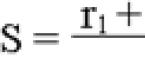Клинико-фармакологическая группа
02.047 (Ноотропный препарат)Форма выпуска, состав и упаковка
Таблетки белого цвета, плоскоцилиндрической формы, с фаской и риской.
Вспомогательные вещества: магния гидроксикарбонат, кальция стеарат, тальк, крахмал картофельный.
10 шт. - упаковки контурные ячейковые (5) - пачки картонные.50 шт. - банки полимерные (1) - пачки картонные.
Фармакологическое действие
Ноотропный препарат. Спектр действия связан с наличием в структуре GABA. Механизм действия обусловлен прямым влиянием пантокальцина на GABAB-рецептор-канальный комплекс. Обладает нейрометаболическими, нейропротекторными и нейротрофическими свойствами.
Повышает устойчивость мозга к гипоксии и воздействию токсических веществ, стимулирует анаболические процессы в нейронах.
Обладает противосудорожным действием, уменьшает моторную возбудимость с одновременным упорядочением поведения. Повышает умственную и физическую работоспособность. Способствует нормализации содержания GABA при хронической алкогольной интоксикации и последующей отмене этанола. Проявляет анальгезирующее действие.
Препарат способен ингибировать реакции ацетилирования, участвующие в механизмах инактивации прокаина (новокаина) и сульфаниламидов, благодаря чему достигается пролонгирование действия последних.
Вызывает торможение патологически повышенного пузырного рефлекса и тонуса детрузора.
Фармакокинетика
Всасывание
Быстро всасывается из ЖКТ. Tmax в плазме крови составляет 1 ч.
Распределение и метаболизм
Наибольшие концентрации создаются в печени, почках, в стенке желудка, коже. Проникает через ГЭБ. Не метаболизируется.
Выведение
Выводится в неизмененном виде в течение 48 ч (67.5% - с мочой, 28.5% - с калом).
Дозировка
Препарат назначают внутрь, через 15-30 мин после еды.
Разовая доза для взрослых составляет 0.5-1 г, для детей - 0.25-0.5 г; суточная доза для взрослых — 1.5-3 г, для детей - 0.75-3 г. Длительность курса лечения - от 1 до 4 мес, в отдельных случаях до 6 месяцев. Через 3-6 мес возможно проведение повторного курса лечения.
При нейролептическом синдроме (в качестве корректора побочного действия нейролептических средств) взрослым назначают по 0.5-1 г 3 раза/сут; детям - 250-500 мг 3-4 раза/сут. Курс лечения -1-3 мес.
При гиперкинезах (тиках) взрослым назначают по 1.5-3 г/сут ежедневно в течение 1-5 месяцев; детям назначают по 250-500 мг 3-6 раз/сут ежедневно в течение 1-4 мес.
При последствиях нейроинфекций и черепно-мозговых травм назначают по 250 мг 3-4 раза/сут.
Для восстановления работоспособности при повышенных нагрузках и астенических состояниях назначают по 250 мг 3 раза/сут.
При эпилепсии взрослым назначают по 0.5-1 г 3-4 раза/сут; детям - по 250-500 мг 3-4 раза/сут. Препарат принимают ежедневно в течение длительного времени (до 6 мес).
При расстройствах мочеиспускания взрослым назначают по 0.5-1 г 2-3 раза/сут, суточная доза 2-3 г; детям - по 250-500 мг, суточная доза - 25-50 мг/кг. Курс лечения - от 2 недель до 3 месяцев (в зависимости от выраженности расстройств и терапевтического эффекта).
Детям при умственной отсталости назначают по 0.5 г 4-6 раз/сут ежедневно в течение 3 мес; при задержке речевого развития — по 500 мг 3-4 раза/сут в течение 2-3 мес.
Передозировка
Данные о передозировке препарата Пантокальцин® не предоставлены.
Лекарственное взаимодействие
Пантокальцин® пролонгирует действие барбитуратов, усиливает эффекты препаратов, стимулирующих ЦНС, противосудорожных средств, действие местных анестетиков (прокаина).
Предотвращает побочное действие фенобарбитала, карбамазепина, антипсихотических средств (нейролептиков).
Действие гопантеновой кислоты усиливается в сочетании с глицином, ксидифоном.
Применение при беременности и лактации
Пантокальцин® противопоказан в I триместре беременности.
Данные о безопасности применения препарата во II и III триместрах беременности и в период лактации не предоставлены.
Побочные действия
Аллергические реакции: возможны - ринит, конъюнктивит, кожные высыпания.
Условия и сроки хранения
Препарат следует хранить в сухом защищенном от света месте при температуре не выше 25°С. Срок годности - 3 года.
Показания
— когнитивные нарушения при органических поражениях головного мозга и невротических расстройствах;
— в составе комплексной терапии цереброваскулярной недостаточности, вызванной атеросклеротическими изменениями сосудов головного мозга; сенильной деменции (начальной формы), резидуальных органических поражений мозга у лиц зрелого возраста и пожилых;
— церебральная органическая недостаточность у больных шизофренией (в комбинации с нейролептиками, антидепрессантами);
— экстрапирамидные гиперкинезы у больных с наследственными заболеваниями нервной системы (в т.ч. хорея Гентингтона, гепатоцеребральная дистрофия, болезнь Паркинсона);
— последствия перенесенных нейроинфекций и черепно-мозговых травм (в составе комплексной терапии);
— для коррекции побочного действия нейролептиков и с профилактической целью одновременно как "терапия прикрытия"; экстрапирамидный нейролептический синдром (гиперкинетический и акинетический);
— эпилепсия с замедлением психических процессов (в комбинации с противосудорожными препаратами);
— психоэмоциональные перегрузки, снижение умственной и физической работоспособности; для улучшения концентрации внимания и запоминания;
— расстройства мочеиспускания: энурез, дневное недержание мочи, поллакиурия, императивные позывы;
— детям при умственной отсталости (задержка психического, речевого, моторного развития или их сочетания), детском церебральном параличе, заикании (преимущественно клоническая форма), эпилепсии (в составе комбинированной терапии с противосудорожными препаратами, особенно при полиморфных приступах и малых эпилептических припадках).
Противопоказания
— острая почечная недостаточность;
— I триместр беременности;
— повышенная чувствительность к компонентам препарата.
Особые указания
|
|||||||
Кальций - один из самых распространенных элементов на Земле. В природе его очень много: из солей кальция образованы горные массивы и глинистые породы, он есть в морской и речной воде, входит в состав растительных и животных организмов.
Кальций постоянно окружает горожан: почти все основные стройматериалы - бетон, стекло, кирпич, цемент, известь - содержат этот элемент в значительных количествах.
Даже пролетая в самолете на многокилометровой высоте, мы не избавляемся от постоянного соседства с элементом №20. Если, допустим, в самолете 100 человек, то, значит, этот самолет несет на борту примерно 150 кг кальция - в организме каждого взрослого человека не меньше килограмма элемента №20. Не исключено, что во время полета количество кальция вблизи нас намного больше: известно, что сплавы кальция с магнием применяются в самолетостроении, и потому не исключено, что в самолете есть не только «органический», но и «собственный» кальций. Словом, от кальция - никуда, и без кальция тоже.
Кальций - элементарный
Несмотря на повсеместную распространенность элемента №20, даже химики и то не все видели элементарный кальций. А ведь этот металл и внешне и по поведению совсем непохож на щелочные металлы, общение с которыми чревато опасностью пожаров и ожогов. Его можно спокойно хранить на воздухе, он не воспламеняется от воды. Механические свойства элементарного кальция не делают его «белой вороной» в семье металлов: по прочности и твердости кальций превосходит многие из них; его можно обтачивать на токарном станке, вытягивать в проволоку, ковать, прессовать.
И все-таки в качестве конструкционного материала элементарный кальций почти не применяется. Для этого он слишком активен. Кальций легко реагирует с кислородом, серой, галогенами. Даже с азотом и водородом при определенных условиях он вступает в реакции. Среда окислов углерода, инертная для большинства металлов, для кальция - агрессивная. Он сгорает в атмосфере CO и CO 2 .
Естественно, что, обладая такими химическими свойствами, кальций не может находиться в природе в свободном состоянии. Зато соединения кальция - и природные и искусственные - приобрели первостепенное значение. О них (хотя бы самых важных) стоит рассказать подробнее.
Кальций - углекислый
Карбонат кальция СаCO 3 - одно из самых распространенных на Земле соединений. Минералы на основе СаCO 3 покрывают около 40 млн км 2 земной поверхности. Мел, мрамор, известняки, ракушечники - все это СаCO 3 с незначительными примесями, а кальцит - чистый СаCO 3 .
Самый важный из этих минералов - известняк. (Правильнее говорить не об известняке, а об известняках: известняки разных месторождений отличаются по плотности, составу и количеству примесей.) Известняки есть практически везде. В европейской части СССР известняки встречаются в отложениях почти всех геологических возрастов. Ракушечники - известняки органического происхождения - особенно распространены на северном побережье Черного моря. Знаменитые Одесские катакомбы - это бывшие каменоломни, в которых добывали ракушечник. Из известняков главным образом сложены и западные склоны Урала.
В чистом виде известняки - белого или светло-желтого цвета, но примеси придают им более темную окраску.
Наиболее чистый СаCOз образует прозрачные кристаллы известкового или исландского шпата, широко применяемого в оптике. А обычные известняки используются очень широко - почти во всех отраслях народного хозяйства.
Больше всего известняка идет на нужды химической промышленности. Он незаменим в производстве цемента, карбида кальция, соды, всех видов извести (гашеной, негашеной, хлорной), белильных растворов, цианамида кальция, известковой воды и многих других полезных веществ.
Значительное количество известняка расходует и металлургия - в качестве флюсов.
Без известняка не обходится ни одно строительство. Во-первых, из него самого строят, во-вторых, из известняка делают многие строительные материалы.
Известняками (щебенкой) укрепляют дороги, известняками (в виде порошка) уменьшают кислотность почв. В сахарной промышленности известняк используют для очистки свекловичного сока.
Другая разновидность углекислого кальция - мел. Мел - это не только зубной порошок и школьные мелки. Его используют в бумажной и резиновой промышленности - в качестве наполнителя, в строительстве и при ремонте зданий - для побелки.
Третья разновидность карбоната кальция - мрамор - встречается реже. Считается, что мрамор образовался из известняка в давние геологические эпохи. При смещениях земной коры отдельные залежи известняка оказывались погребенными под слоями других пород. Под действием высокого давления и температуры там происходил процесс перекристаллизации, и известняк превращался в более плотную кристаллическую породу - мрамор.
Естественный цвет мрамора - белый, но чаще всего различные примеси окрашивают его в разнообразные цвета. Чистый белый мрамор встречается не часто и идет в основном в мастерские скульпторов. Из менее ценных сортов белого мрамора делают распределительные щиты и панели в электротехнике. В строительстве мрамор (всех цветов и оттенков) используют не столько как конструкционный, сколько как облицовочный материал.
И, чтобы покончить с углекислым кальцием, несколько слов о доломите - важном огнеупорном материале и сырье для производства цемента.
Это двойная магние-кальциевая соль угольной кислоты, ее состав - СаCO 3 · MgCO 3 .
Кальций - сернокислый
Сульфат кальция СаSO 4 тоже широко распространен в природе. Известный минерал гипс - это кристаллогидрат СаSO 4 · 2Н 2 О. Как вяжущее гипс используют уже много веков, чуть ли не со времен египетских пирамид. Но природному гипсу (гипсовому камню) несвойственна способность твердеть на воздухе и при этом скреплять камни.
Это свойство гипс приобретает при обжиге.
Если природный гипс прокалить при температуре не выше 180°C, он теряет три четверти связанной с ним воды. Получается кристаллогидрат состава CaSО 4 · 0,5H 2 O. Это алебастр, или жженый гипс, который и используется в строительстве. Помимо вяжущих свойств у жженого гипса есть еще одно полезное свойство. Затвердевая, он немного увеличивается в объеме. Это позволяет получать хорошие слепки из гипса. В процессе твердения жженого гипса, смешанного с водой (гипсового теста), полторы молекулы воды, потерянные при обжиге, присоединяются, и снова получается гипсовый камень CaSO 4 · 2H 2 O.
Если обжиг гипсового камня вести при температуре выше 500°C, получается безводный сернокислый кальций - «мертвый гипс». Он не может быть использовал в качестве вяжущего.
«Оживить» мертвый гипс можно. Для этого нужно прокалить его при еще более высоких температурах - 900...1200°C. Образуется так называемый гидравлический гипс, который, будучи замешанным с водой, вновь дает затвердевающую, массу, очень прочную и стойкую к внешним воздействиям.
Кальций - фосфорнокислый
Кальциевая соль ортофосфорной кислоты - основной компонент фосфоритов и апатитов. Эти минералы (тоже достаточно распространенные) - сырье для производства фосфорных удобрений и некоторых других химических продуктов. Поскольку полезнейшая часть фосфоритов и апатитов - не кальций, а фосфор, мы не будем подробно рассказывать о них, отослав читателя к статье об элементе №15. Упомянем только, что кальциевые соли фосфорных кислот, прежде всего трикальцийфосфат Са 3 (РO 4) 2 , всегда есть в организмах людей и животных. Са 3 (РO 4) 2 - главный «конструкционный материал» наших костей.
Кальций - хлористый
Эта соль кальция встречается в природе намного реже, чем карбонат, сульфат или фосфаты кальция. Ее получают как побочный продукт в производстве соды аммиачным способом. Природный хлористый кальций это обычно кристаллогидрат СаСl 2 · 6Н 2 O, который при нагревании теряет сначала четыре молекулы воды, а затем и остальные.
Безводный хлористый кальций сильно гигроскопичен, его применяют для сушки жидкостей и газов.
Хлористый кальций хорошо растворяется в воде. Если полить таким раствором грунтовую или щебеночную дорогу, она останется влажной намного дольше, чем после поливки водой. Это происходит потому, что упругость пара над раствором хлористого кальция очень мала; такой раствор поглощает влагу из воздуха и поэтому долго не высыхает.
Другое применение этой соли связано с низкими температурами замерзания растворов хлористого кальция. Эти растворы используют в холодильных системах. А смеси этой соли со снегом или мелко истолченным льдом плавятся при температурах намного ниже нуля. Точка плавления холодильной смеси состава 58,8% CaCl 2 · 6Н 2 О и 41,2% снега минус 55°C.
Хлористый кальций широко применяют и в медицине. В частности, внутривенные инъекции растворов CaCl 2 снимают спазмы сердечно-сосудистой системы, улучшают свертываемость крови, помогают бороться с отеками, воспалениями, аллергией. Растворы хлористого кальция врачи прописывают не только внутривенно, но и просто как внутреннее лекарство. Хлорид кальция стал также одним из компонентов витамина B 15 .
Кальций - фтористый
В отличие от CaCl 2 и других галогенидов кальция эта соль практически нерастворима в воде. Фтористый кальций входит в состав апатита, там это бесполезная примесь. Зато чистый кристаллический дифторид кальция - вещество очень полезное. Это один из главных металлургических флюсов - веществ, помогающих отделять металлы от пустой породы. В этом качестве фтористый кальций используют очень давно, и не случайно одно из названий этого минерала - плавиковый шпат. Плавиковый - от «плавить».
Иногда в природе встречаются крупные, весом до 20 кг, абсолютно прозрачные кристаллы этой соли. У них другое минералогическое название - флюорит. Такие кристаллы представляют чрезвычайную ценность для оптики, потому что они пропускают ультрафиолетовые и инфракрасные лучи намного лучше, чем стекло, кварц или вода. Спрос на кристаллы флюорита намного превышает запасы разведанных месторождений, и не случайно флюорит стали получать в промышленных масштабах искусственным путем.
Искусственным путем...
Природные соединения кальция не всегда и не во всем удовлетворяют человека. Поэтому многие из них превращают в другие вещества. Некоторые соединения кальция, получаемые искусственным путем, стали даже более известными и привычными, чем известняки или гипс. Так, гашеную Са(OH) 2 и негашеную СаО известь применяли еще строители древности.
Цемент - это тоже соединение кальция, полученное искусственным путем. Сначала обжигают смесь глины или песка с известняком и получают клинкер, который затем размалывают в тонкий серый порошок. О цементе (вернее, о цементах) можно рассказывать очень много, это тема самостоятельной статьи.
То же самое относится и к стеклу, в состав которого тоже обычно входит элемент №20.
А карбид кальция - вещество, открытое случайно при испытании новой конструкции печи! Еще недавно карбид кальция CaCl 2 использовали главным образом для автогенной сварки и резки металлов. При взаимодействии карбида с водой образуется ацетилен, а горение ацетилена в струе кислорода позволяет получать температуру почти 3000°C. В последнее время ацетилен, а вместе с ним и карбид все меньше расходуются для сварки и все больше - в химической промышленности.
Искусственным путем получают и гидрид кальция - сильнейший восстановитель, и активные окислители - хлорную известь Са(СlO)Сl и гипохлорит кальция Са(СlO) 2 .
Число примеров, подтверждающих первостепенную важность элемента №20 и его соединений - природных и искусственных, - можно еще увеличить. Но вряд ли в этом есть необходимость.
Изотопы кальция
Природный кальций состоит из шести изотопов с массовыми числами 40, 42, 43, 44, 46 и 48. Основной изотоп - 40 Са; его содержание в металле около 97%. Полученные искусственным путем изотопы с массовыми числами 39, 41, 45, 47 и 49 - радиоактивны. Один из них - 45 Са может быть получен облучением металлического кальция или его соединений нейтронами в урановом реакторе. Наша промышленность выпускает следующие препараты с изотопом 45 Са: кальций металлический, СаCO 3 , СаО, CaCl, Ca(NO 3) 2 , CaSO 4 , CaC 2 O 4 .
Радиоактивный кальций широко используют в биологии и медицине в качестве изотопного индикатора при изучении процессов минерального обмена в живом организме. С его помощью установлено, что в организме происходит непрерывный обмен ионами кальция между плазмой, мягкими тканями и даже костной тканью. Большую роль сыграл 45 Са также при изучении обменных процессов, происходящих в почвах, и при исследовании процессов усвоения кальция растениями. С помощью этого же изотопа удалось обнаружить источники загрязнения стали и сверхчистого железа соединениями кальция в процессе выплавки.
Зубы и металлы чистит разный мел
Природный мел в виде порошка входит в составы для полировки металлов. Но чистить зубы порошком из природного мела нельзя, так как он содержит остатки раковин и панцирей мельчайших животных, которые обладают повышенной твердостью и разрушают зубную эмаль. Поэтому зубной порошок готовят только из химически осажденного мела.
Жесткая вода
Комплекс свойств, определяемых одним словом «жесткость», воде придают растворенные в ней соли кальция и магния. Жесткая вода непригодна во многих случаях жизни. Она образует слой накипи в паровых котлах и котельных установках, затрудняет окраску и стирку тканей, но годится для варки мыла и приготовления эмульсий в парфюмерном производстве. Поэтому раньше, когда способы умягчения воды были несовершенны, текстильные и парфюмерные предприятия обычно размещались поблизости от источников «мягкой» воды.
Различают жесткость временную и постоянную. Временную (или карбонатную) жесткость придают воде растворимые гидрокарбонаты Са(НCO 3) 2 и Mg(HCO 3) 2 . Устранить ее можно простым кипячением, при котором гидрокарбонаты превращаются в нерастворимые в воде карбонаты кальция и магния.
Постоянная жесткость создается сульфатами и хлоридами тех же металлов. И ее можно устранить, но сделать это намного сложнее.
Сумма обоих жесткостей составляет общую жесткость воды. Оценивают ее в разных странах по-разному. В СССР принято выражать жесткость воды числом миллиграмм-эквивалентов кальция и магния в одном литре воды. Если в литре воды меньше 4 мг-экв, то вода считается мягкой; по мере увеличения их концентрации - все более жесткой и, если содержание превышает 12 единиц, - очень жесткой.
Жесткость воды обычно определяют с помощью раствора мыла. Такой раствор (определенной концентрации) прибавляют по каплям к отмеренному количеству воды. Пока в воде есть ионы Са 2+ или Mg 2+ , они будут мешать образованию пены. По затратам мыльного раствора до появления пены вычисляют содержание ионов Са 2+ и Mg 2+ .
Интересно, что аналогичным путем определяли жесткость воды еще в Древнем Риме. Только реактивом служило красное вино - его красящие вещества тоже образуют осадок с ионами кальция и магния.
«Кипелка» и «пушонка»
Еще в I в. н.э. Диоскорид - врач при римской армии - в сочинении «О лекарственных средствах» ввел для окиси кальция название «негашеная известь», которое сохранилось и в наше время. Строители ее называют «кипелкой» - за то, что при гашении выделяется много тепла, и вода закипает. Образующийся при этом пар разрыхляет известь, она распадается с образованием пушистого порошка. Отсюда строительное название гашеной извести - «пушонка». В зависимости от количества воды, добавляемой к извести, гашение идет до получения пушонки, известкового теста, известкового молока или известковой воды. Все они нужны для приготовления вяжущих растворов.
Бетону - две тысячи лет
Бетон - важнейший строительный материал наших дней. Но это вещество (точнее, одну из его разновидностей - смесь дробленого камня, песка и извести) применяют с давних пор. Плиний Старший (I в. н.э.) так описывает постройку цистерн из бетона: «Для постройки цистерн берут пять частей чистого гравийного песка, две части самой лучшей гашеной извести и обломки силекса (твердая лава. - Ред.) весом не больше фунта каждый, после смешивания уплотняют как следует нижнюю и боковые поверхности ударами железной трамбовки».
Почему кальций - кальций
В латинском языке слово «calx» обозначает известь и сравнительно мягкие, легко обрабатываемые камни, в первую очередь мел и мрамор. От этого слова и произошло название элемента №20.
Что такое «арболит»?
Так назван материал, в состав которого входят отходы древесины, цемент, хлористый кальций и вода. После смешения компонентов и уплотнения вибрационным способом получается строительный материал с исключительно ценными свойствами: он не горит, не гниет, легко пилится пилой, обрабатывается на станке. Стоимость такого материала невелика. Плиты из арболита используют в строительстве малоэтажных зданий.
Как хранят кальций
Металлический кальций длительно хранить можно в кусках весом от 0,5 до 60 кг. Такие куски хранят в бумажных мешках, вложенных в железные оцинкованные барабаны с пропаянными и покрашенными швами. Плотно закрытые барабаны укладывают в деревянные ящики. Куски весом меньше 0,5 кг подолгу хранить нельзя - они быстро превращаются в окись, гидроокись и карбонат кальция.
Как получают кальций
Кальций впервые получен Дэви в 1808 г. с помощью электролиза. Но, как и другие щелочные и щелочноземельные металлы, элемент №20 нельзя получить электролизом из водных растворов. Кальций получают при электролизе его расплавленных солей.
Это сложный и энергоемкий процесс. В электролизере расплавляют хлорид кальция с добавками других солей (они нужны для того, чтобы снизить температуру плавления СаСl 2).
Стальной катод только касается поверхности электролита; выделяющийся кальций прилипает и застывает на нем. По мере выделения кальция катод постепенно поднимают и в конечном счете получают кальциевую «штангу» длиной 50...60 см. Тогда ее вынимают, отбивают от стального катода и начинают процесс сначала. «Методом касания» получают кальций сильно загрязненный хлористым кальцием, железом, алюминием, натрием. Очищают его переплавкой в атмосфере аргона.
Если стальной катод заменить катодом из металла, способного сплавляться с кальцием, то при электролизе будет получаться соответствующий сплав. В зависимости от назначения его можно использовать как сплав, либо отгонкой в вакууме получить чистый кальций. Так получают сплавы кальция с цинком, свинцом и медью.
Не только электролизом
Другой метод получения кальция - металлотермический - был теоретически обоснован еще в 1865 г. известным русским химиком Н.Н. Бекетовым. Кальций восстанавливают алюминием при давлении всего в 0,01 мм ртутного столба. Температура процесса 1100...1200°C. Кальций получается при этом в виде пара, который затем конденсируют.
В последние годы разработан еще один способ получения элемента №20. Он основан на термической диссоциации карбида кальция: раскаленный в вакууме до 1750°C карбид разлагается с образованием паров кальция и твердого графита.
Применение кальция
До последнего времени металлический кальций почти не находил применения. США, например, до второй мировой войны потребляли в год всего 10...25 т кальция, Германия - 5...10 т. Но для развития новых областей техники нужны многие редкие и тугоплавкие металлы. Выяснилось, что кальции - очень удобный и активный восстановитель многих из них, и элемент №20 стали применять при получении тория, ванадия, циркония, бериллия, ниобия, урана, тантала и других тугоплавких металлов.
Способность кальция связывать кислород и азот позволила применить его для очистки инертных газов и как геттер (Геттер - вещество, служащее для поглощения газов и создания глубокого вакуума в электронных приборах.) в вакуумной радиоаппаратуре.
Кальций используют и в металлургии меди, никеля, специальных сталей и бронз; им связывают вредные примеси серы, фосфора, избыточного углерода. В тех же целях применяют сплавы кальция с кремнием, литием, натрием, бором, алюминием.
Хорошо растворимы в воде. Нерастворимы в воде фторид CaF 2 , карбонат CaCO 3 , сульфат CaSO 4 , ортофосфат Ca 3 (PO 4) 2 , оксалат СаС 2 О 4 и некоторые другие.
Область применения
Значение солей кальция для организма
Имеются данные, что добавки кальция могут уменьшить минимальную дозу эстрогена для сохранения и поддержания массы костной ткани у женщин в постменопаузе. С другой стороны большинство исследователей считает, что только добавки кальция не могут предотвратить потерю массы кости в постменопаузе. В Бюллетене медицинских наук, опубликованном Ассоциацией фармацевтической информации США (1994 г.) было проанализировано 43 исследования, проведенные после 1988 г., посвященных взаимосвязи между потреблением кальция, массой кости и ее потерями. Среди 19 из 43 исследований, где строго контролировалось потребление кальция, в 16 из них показано, что назначение солей кальция замедляет потери массы кости. По данным R. Неапеу в течение первых 5 лет менопаузы потери массы кости главным образом обусловлены резким снижением секреции эстрогенов, а не дефицитом кальция, который также может присутствовать. В 12 из 19 исследований, где было проконтролировано содержание кальция в рационе и исключены из анализа женщины, которые были в постменопаузе менее 5 лет, был продемонстрирован убедительный профилактический эффект солей кальция. В работе 1. R. Reid и соавт. было показано (122 женщины, плацебо-контролируемое исследование в течение 2-х лет, минимум 3 года после наступления менопаузы, 750 мг кальция в рационе и 1000 мг добавка кальция или плацебо), что в контрольной группе потери костной массы составляли 1 % в год, а в исследуемой группе почти в два раза меньше. В другой работе этого автора представлены результаты 4-х летнего плацебо-контролируемого исследования по применению 1000 мг кальция у 84 женщин в менопаузе: отмечено достоверное уменьшение скорости потери массы кости в группе пациентов, получавших кальций при измерении МПК как во всем скелете, так и в шейке бедра и трохантере; за время наблюдения было выявлено 7 новых переломов костей в контрольной группе и только 2 перелома в исследуемой группе . Таким образом, приведенные выше данные подтверждают роль солей кальция в замедлении потерь массы кости и даже в уменьшении частоты переломов костей. Также все авторы отмечают безопасность профилактики солями кальци и небольшую стоимость.
Примечания
См. также
Ссылки
Литература
- Доронин. Н. А. Кальций, Госхимиздат, 1962. 191 стр. с илл.
Cтраница 1
Кальциевые соли фосфорной кислоты получают так.
Из кальциевых солей фосфорной кислоты растворяется в воде лишь монофосфат кальция Са (Н2РО4) 2 - Дифосфат СаНРО4 и фосфат Са.
Из кальциевых солей фосфорных кислот наибольшее практическое значение имеют соли ортофосфорной кислоты - трикальцийфосфат, дикальцийфосфат и монокальций-фосфат.
Упомянем только, что кальциевые соли фосфорных кислот, прежде всего трикальцийфосфат Сал (Р04) 2, всегда есть в организмах людей и животных.
На бромеодержащие фосфаты синергическое действие оказывают кальциевые соли фосфорных кислот. Согласно патенту , бромеодержащие фосфаты в сочетании с нерастворимыми кальциевыми солями фосфорных кислот диспергируют в водные растворы ZnCl2 с 10 % - ной концентрацией полиакрилонитрила в присутствии 5 - 17 % пове.
В результате этих реакций образуется взвесь хлопьевидных частиц фтористого кальция, кальциевых солей фосфорной кислоты и гидратированной двуокиси кремния, и ранее осветленная вода вновь превращается в суспензию. Развитая поверхность полученных хлопьевидных частиц должна обеспечить практически полное соосаждение высокодисперсной фосфорсодержащей взвеси, не удаленной из сточной воды при первичном осветлении.
| Схема производства аммиакатов. |
Простые (односторонние) фосфорные удобрения и ксрмопые фосфаты представляют собой, главным образом, кальциевые соли фосфорной кислоты. Кормовые фосфаты отличаются от удобрений практически полным отсутствием вредных примесей фтора, мышьяка и тяжелых металлов.
Тройная система СаО - Р2О5 - Н2О является основой для изучения процесса получения суперфосфата (двойного суперфосфата) и других кальциевых солей фосфорной кислоты.
Главное значение при защелачивании организма имеют соли кальция. Именно кальций играет ведущую роль в сложной буферной системе, поддерживающей постоянный кислотно-щелочной баланс.
Кальциевые препараты, например мицеллат углекислого кальция , повышают ОВП (окислительно-восстановительный потенциал) внутренней среды организма. Для использования при метаболических процессах вода должна обладать окислительно-восстановительным потенциалом, который равен ОВП организма. Чем значительнее разница между ОВП воды и ОВП организма, тем больше энергии затрачивается на проникновение воды в клетку.
Если поступающая в организм питьевая вода имеет ОВП, близкий по значению к ОВП внутренней среды, то электрическая энергия клеточных мембран (жизненная энергия организма) не расходуется на коррекцию активности электронов воды и вода сразу же усваивается, поскольку обладает биологической совместимостью.
Если ОВП воды меньше ОВП организма, то она подпитывает его энергией, которая используется клетками в качестве энергетического резерва для антиоксидантной защиты от неблагоприятного влияния внешней среды.
Многие исследователи пытались использовать соли кальция для лечения опухолей у животных и человека. При этом в ряде случаев отмечалось уменьшение размеров экспериментальных злокачественных новообразований, ослаблялась их способность разрушать окружающие ткани (С. Яковлев, 1980), увеличивалась продолжительность жизни больных раком.
Применение препаратов кальция на фоне облучения иногда приводило к полному излечению рака вульвы и исчезновению опухолей костей. Использование кальциевых препаратов при остеогенной саркоме 3-й стадии вызывало увеличение срока жизни пациентов в 1,5 раза (В. Прошин, 1977).
Во избежание возрастного остеопороза и для укрепления костей при раке надо употреблять богатые кальцием и витамином D продукты, тем более что витамин D – эффективное средство для профилактики рака.
В 1967 году О. Варбург провел исследование, чтобы определить возможность предупреждения рака с помощью ионов кальция, и обнаружил, что соли кальция могут способствовать избавлению от рака.
Был сделан биохимический анализ крови неизлечимо больных людей (рак 3-й и 4-й стадии). У всех пациентов наблюдалась нехватка кальция. В результате приема препаратов кальция и витаминов для их лучшего усвоения в некоторых случаях наблюдалось полное излечение. Рак исчез!
Особенно эффективен мицеллат в сочетании с химиотерапией. Он ослабляет ее вредное воздействие на организм: уменьшается выпадение волос, улучшается состояние печени, мозга, почек и других органов. Эти результаты, крайне удивившие врачей, были получены при испытании мицеллата в клинике Pranakor в Будапеште. Мицеллат продлевает жизнь больных раком, существенно уменьшает боли, интоксикацию, снижает слабость и истощение. В связи с этим всем больным, согласившимся на химиотерапию, рекомендую в качестве сопровождающего лечения принимать мицеллат.
Иштван K. (родился в 1926 году). Ошибочная операция на желчных протоках. После операции поставлен диагноз – рак поджелудочной железы. Самочувствие очень плохое, остановилось мочеиспускание, сильный отек всего тела. От еды и питья больной отказывался. Родные начали каждые полчаса капать Иштвану под язык 2–3 капли мицеллата. Через некоторое время полностью восстановилось мочеиспускание, прошел отек.
Особые формы органического кальция в сверхбольших дозах (многократно выше рекомендуемых) могут выводить из крови кислотные и щелочные вредные метаболиты.
Для ощелачивания хорошо пить воду с древесной золой – березовый щелок.
Березовый щелокВозьмите 1 ст. ложку березовой золы и растворите в 1 л кипящей воды. Кипятите примерно полчаса и дайте отстояться. Чистую щелочную воду слейте. Используйте в теплом виде как внутрь, так и наружно.
Кроме того, можно употреблять органические соли кальция.
Углекислый кальций наиболее удобен для защелачивания организма. Он не только служит в качестве строительного материала для формирования костной ткани, но также обеспечивает сопротивляемость организма, защищает от действия кислот. Натуральный порошок можно получить из скорлупы сырых яиц, где его содержание доходит до 90 %.
Способ примененияУдалите белую пленку с внутренней стороны скорлупы. Растолките ее в ступке. Для повышения иммунитета и при обычных заболеваниях порошок принимают по 1/3-1 ч. ложке. При раке доза повышается в 2–3 раза и составляет 2–3 ч. ложки. Можно растворить порошок в воде.Углекислый кальций следует принимать утром натощак и вечером перед сном (обязательно спустя 4–5 часов после ужина). Есть можно не раньше чем через 40–60 минут после приема карбоната кальция.
Для преодоления болей, которые связаны с кислотным типом опухолей и интоксикацией, указанную дозу увеличивают еще на несколько ложек. Показателем достаточного количества является уменьшение болей. Карбонат кальция, полученный из скорлупы, усваивается на 100 %. Можно приобрести его в аптеках.
Препараты кальция надо принимать вместе с рыбьим жиром и йодсодержащими таблетками. Прием рыбьего жира приводит к закислению, поэтому его доза не должна превышать 1–2 ч. ложки.
Не забывайте побольше бывать на солнце. Солнечный свет стимулирует выработку витамина D самим организмом.
Кальциевая соль лимонной кислоты хорошо всасывается в желудочно-кишечном тракте. Ее употребление связано с наименьшим риском образования камней.
Способ примененияПорошок, полученный из скорлупы яиц, полейте раствором лимонной кислоты, соком лимона или яблочным уксусом, размешайте и дождитесь полного растворения. Проще всего на 1 ст. ложку порошка капнуть 2–3 капли сока лимона.Ежедневно принимайте раствор порошка, приготовленного из скорлупы 1–2 яиц.
Возникает закономерный вопрос: не повредит ли организму кальций в больших дозах? Некоторые ученые считают, что избыток кальция может частично закупорить красный костный мозг и вызвать ухудшение состава крови.
Чтобы избежать этого, надо употреблять «живой» кальций, который не подвергался температурному воздействию. Например, кальций, содержащийся в кипяченом молоке, не подходит.
Самое главное: кальций, присутствующий в крови, должен быть уравновешен органическими кислотами, кальциевые соли которых легко растворяются в воде. Чем больше кальция надо ввести, тем больше потребуется органических кислот. В этом случае кальций в мегадозах не опасен для почек и не оседает в виде атеросклеротических отложений на стенках сосудов.
Избытка кальция не бывает, так как его излишки быстро выводятся почками. Камни в почках и отложения кальция на стенках сосудов связаны не с избытком кальция в крови, а с нарушением обмена веществ. Удивительно, что в регионах, где содержание кальция в воде минимально, помимо большого числа больных раком наблюдается и максимальное количество долгожителей.
Кальций, как и натрий, препятствует обезвоживанию организма, поэтому их следует употреблять вместе. Хорошо принимать кальций с соленым раствором, это позволит решить проблему недостатка воды в организме.
При использовании кальциевых препаратов не следует забывать о двух фазах гликолиза, а значит, о двойственном действии кислот и щелочей. Иногда они могут привести к торможению роста раковых клеток, а в других случаях, наоборот, способны спровоцировать этот рост. Все зависит от глубины гликолиза, который может быть кислотным (поверхностным) или щелочным (глубоким). Очевидно, что при глубоком гликолизе кальциевые препараты еще больше усилят степень защелачивания, что приведет к нежелательным последствиям.
Поскольку применение кальция позволяет добиться положительной динамики течения болезни (если размеры опухоли невелики), можно предположить, что на начальных стадиях в раковой клетке происходит поверхностный (кислотный) гликолиз. В этом случае препараты кальция положительно влияют на течение болезни, защелачивая среду организма.
Как только опухоль переходит в другую фазу развития – щелочную, кальций может оказать лишь частичную помощь, вытесняя избыток вредных щелочных метаболитов, образующихся в ходе гликолиза. При этом с помощью кальция нельзя добиться прекращения глубокого щелочного гликолиза.
Исходя из сказанного выше можно утверждать, что во время глубокого гликолиза следует принимать больше органических кислот и меньше кальция. Это поможет превратить глубокий гликолиз в опухоли в поверхностный, чтобы затем ликвидировать опухоль путем применения антиоксидантов.
Обычно щелочи вводятся в форме минералов, а не органических веществ. Минералы не выполняют пластическую и энергетическую функции (не участвуют в синтезе и не расщепляются с выделением энергии), а значит, не способны поддерживать анаболический процесс.
Это особенно важно, поскольку заставляет раковую опухоль «голодать» и использовать в качестве энергопластических веществ преимущественно катаболики – органические кислоты. В результате опухоли не успевают произвести ресинтез органических кислот и превратить их в питательные углеводы для получения энергии и аминокислот, необходимых для построения клеток. Необходимы органические щелочи, а их не хватает.