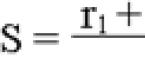О.А. Воробьева (Иркутский институт усовершенствования врачей)
Российская Федерация относится к числу стран с высоким уровнем заболеваемости туберкулезом, хотя с 2003 года стала отмечаться некоторая тенденция к стабилизации эпидемической ситуации. Наиболее неблагополучной по туберкулезу была в 1999 году территория Западной Сибири, где показатели заболеваемости занимали первое место среди всех субъектов России. Неуклонный рост показателей заболеваемости туберкулезом представляет значительную угрозу для общества.
Однако еще более серьезной для современной фтизиатрии является проблема лекарственной устойчивости (ЛУ) возбудителя туберкулеза, поскольку является одним из факторов, ограничивающих эффективность антибактериальной терапии. Лекарственная устойчивость - природная или приобретенная способность возбудителя заболевания сохранять жизнедеятельность при воздействии на него лекарственных препаратов.
Согласно классификации ВОЗ (1998), микобактерии туберкулеза (МБТ) могут быть:
- монорезистентные - устойчивые к одному противотуберкулезному препарату;
- полирезистентные - к двум и более противотуберкулезным препаратам (ПТП);
- множественно лекарственно резистентные - устойчивые как минимум к сочетанию изониазида и рифампицина, независимо от наличия или отсутствия устойчивости к другим ПТП.
В международной практике выделяют понятия первичной и вторичной лекарственной устойчивости (ЛУ). В первом случае, это устойчивость, обусловленная инфицированием штаммом микобактерий, выделенных больным с приобретенной устойчивостью. Во втором - устойчивость, возникшая в результате нерациональной химиотерапии. Выделяют так же понятия «истинной», «ложной», «скрытой» и «полной» лекарственной устойчивости. Истинная резистентность чаще выявляется у постоянных бактериовыделителей. При истинной лекарственной устойчивости одна МБТ устойчива к нескольким антибактериальным препаратам (АБП). Чаще наблюдается ложная резистентность, когда одни МБТ устойчивы к одним препаратам, а другие
- к другим.
Вопрос скрытой лекарственной устойчивости требует дальнейшего изучения. Достоверная идентификация этого вида лекарственной устойчивости возможна лишь при микробиологическом исследовании каверн, т.к. при бактериологическом исследовании мокроты у данных больных обнаруживают лекарственно-чувствительные МБТ. Последний вид лекарственной устойчивости, встречается довольно редко. В настоящее время, когда для лечения применяется много новых резервных препаратов, необходимо помнить о наличии перекрестной лекарственной устойчивости.
Появление первых антибиотико-резистентных штаммов микобактерий туберкулеза (МБТ) связывают с открытием в 1943 г. и широким применением стрептомицина как эффективного противотуберкулезного препарата. Уже первые системные данные о распространенности первичной лекарственной устойчивости к изониазиду и стрептомицину были получены в 50-е годы за рубежом при проведении эпидемиологических исследований. Были выделены страны с высоким до 9,4% (Япония и Индия) и низким - от 0,6 до 2,8% (США и Великобритания) уровнем лекарственной устойчивости к этим двум препаратам. При этом показатели устойчивости к стрептомицину были несколько выше устойчивости к изониазиду.
В России подобные исследования по изучению уровня лекарственной устойчивости к стрептомицину, ПАСК, препаратам группы ГИНК стали проводиться с середины 50-х годов Центральным НИИ туберкулеза. Полученные за шестилетний период (1956-1963 гг.) данные свидетельствовали об изменении за этот период структуры лекарственной устойчивости в сторону уменьшения штаммов МБТ, устойчивых к стрептомицину, и увеличения доли резистентности к препаратам группы ГИНК, а так же к 2 и 3 препаратам одновременно.
Открытие и внедрение в практику новых противотуберкулезных препаратов (в 50-х годах - препараты группы ГИНК, пиразинамид, циклосерин, этионамид, канамицин и каприомицин; в 60-х - рифампицин и этамбутол; в 80-х - препараты группы фторхинолонов), а так же использование схем химиотерапии, включающих одновременное применение 4-5 ПТП, позволяло хотя бы временно решать проблему лекарственной устойчивости. Возможно, поэтому до конца 80-х годов суммарные показатели лекарственной устойчивости в России сохранялись на относительно невысоком уровне, а ее колебания были незначительными.
Крупномасштабное изучение тенденции развития лекарственной устойчивости в России за 20-летний период (1979-1998 гг.) к ПТП показало, что самый высокий уровень ЛУ за эти годы был зарегистрирован к стрептомицину (37%) и изониазиду (34%). Несколько ниже были показатели устойчивости к рифампицину (21%), канамицину (19%), этионамиду и этамбутолу (16%). Самый низкий уровень лекарственной устойчивости наблюдался к ПАСК (8%). Данные этого исследования хорошо согласуются с тем, что такие препараты, как стрептомицин и изониазид, имеющие самые высокие показатели лекарственной устойчивости, имели наиболее длительную историю применения, а ПАСК - не входил в стандартные схемы химиотерапии. Синтезированный одним из последних, этамбутол оставался наиболее «надежным» препаратом, к которому резистентность возбудителя держалась на относительно невысоком уровне.
Анализ данных лекарственной устойчивости к стрептомицину, изониазиду, рифампицину и этамбутолу (1991-2001 гг.), проводимый на Северо-Западе России, показал, что уровень устойчивости к последнему за этот период вырос более чем в 2 раза, хотя и продолжает оставаться ниже по сравнению с остальными препаратами. Уровень устойчивости к рифампицину лишь немногим уступает устойчивости изониазиду, а частая ассоциация лекарственной устойчивости этих двух препаратов делает рифампицин маркером множественной лекарственной устойчивости (МЛУ).
Являясь одним из основных препаратов, воздействующих на активно размножающуюся фракцию МБТ, рифампицин входит в состав всех схем химиотерапии, применяемых для лечения вновь выявленных больных активным туберкулезом, что делает особенно актуальной проблему мультирезистентности. Обсуждаются тревожные данные о вспышках мультирезистентного туберкулеза в тесных коллективах. С увеличением МЛУ связывают рост смертности от туберкулеза в мире. Наряду с этим имеются сведения о том, что больные, выделяющие микобактерии, устойчивые к изониазиду и рифампицину, являются менее заразными, чем другие пациенты.
Рост общей частоты лекарственной устойчивости, наблюдаемый при всех локализациях туберкулеза, сопровождается значительным утяжелением ее структуры за счет снижения монорезистентности и увеличения количества полирезистентных форм. Показатели лекарственной устойчивости МБТ распределены неравномерно по всей территории России и колеблются в достаточно широком диапазоне. Уже с конца 90-х годов отмечено отчетливое увеличение удельного веса показателя первичной лекарственной устойчивости от 18 до 61% по различным регионам России, показатели же вторичной лекарственной устойчивости практически повсеместно превышают 50-70, достигая в отдельных областях до 80-86%. Резистентность МБТ к основным препаратам более характерна для впервые выявленных больных с ограниченной распространенностью процесса. Развитие резистентности МБТ к сочетанию основных и резервных препаратов - для рецидивов и хронического течения туберкулеза легких.
Частота встречаемости МЛУ у вновь выявленных больных являются невысокой (2-10%), поэтому не может оказывать серьезного влияния на основные эпидемиологические показатели по туберкулезу. Большее эпидемиологическое значение имеет вторичная резистентность. Воздействие противотуберкулезных средств рано или поздно приводит к созданию популяции высокоустойчивых к лекарственному воздействию бактерий. Существует достаточно большая вероятность того, что массивное лекарственное воздействие не приводит к полной элиминации патогена из организма человека, а является дополнительным фактором его направленной эволюции.
Причины формирования лекарственной устойчивости различны . В индустриально развитых странах это может быть связано с врачебными ошибками при разработке схем лечения; в слаборазвитых - с недостатком финансирования и применением менее эффективных, более дешевых лекарственных препаратов. Группами риска по формированию лекарственно-устойчивого туберкулеза являются больные, нарушающие режим лечения и прерывающие основной курс лечения самовольно, либо по причине аллергических или токсических осложнений; злоупотребляющие алкоголем, наркотическими средствами; лица, контактирующие с больным туберкулезом, выделяющим лекарственно-устойчивые МБТ.
Лекарственная устойчивость формируется в результате одной или нескольких спонтанных мутаций в независимых генах МБТ, происходящих преимущественно при применении неадекватных схем химиотерапии. Эмпирическое назначение стандартной комбинации химиопрепаратов при наличии первичной лекарственной устойчивости, с последующей их заменой, а также прерывистые курсы терапии приводят к накоплению мутаций и являются основной причиной развития мультирезистентности.
Подобные мутации могут встречаться в микобактериальной популяции еще до контакта МБТ с противотуберкулезными препаратами. Частота возникновения спонтанных мутаций природных штаммов МБТ, влекущих за собой развитие лекарственной устойчивости к антибактериальным препаратам, вариабельна. В литературе описывается феномен кросс-резистентнтности - состояния, при котором наблюдается лекарственная устойчивость, генетически обусловленная к нескольким препаратам одновременно. Кросс-резистентность характерна для изониазида и этионамида, рифампицина и его производных, а также стрептомицина, канамицина, амикацина. Бурное развитие молекулярной генетики, наблюдаемое в последние годы, открыло возможности для изучения генов МБТ, контролирующих лекарственную устойчивость и механизмов ее развития. Наиболее полно изучены гены и механизмы формирования лекарственной устойчивости к препаратам первого ряда.
Устойчивость к изониазиду кодируется несколькими генами : kat G - осуществляет контроль клеточной каталазно-пероксидазной активности; inh A - контроль синтеза миколитических кислот; kas A - контроль протеиновых взаимодействий. Устойчивость к рифампицину связывают с единственным геном rpo B, контролирующим процесс транскрипции (синтеза РНК). Rps L и rrs - гены, кодирующие процессы трансляции и связанные с синтезом клеточного белка. Мутации в этих генах являются ключевыми при формировании устойчивости к стрептомицину и канамицину. Устойчивость к этамбутолу кодируется геном emb B, контролирующим процесс нормального построения клеточной стенки при конверсии глюкозы в моносахариды. Ген pcn A - отвечает за работу фермента энзимпиразимидазы, который осуществляет трансформацию пиразинамида в активный комплекс (пиразинодоновую кислоту).
Попадая в организм, препарат или его метаболиты вмешиваются в цикл работы микобактериальной клетки, нарушая ее нормальную жизнедеятельность. В результате приобретения клеткой генов лекарственной устойчивости метаболиты препарата становятся неактивными по отношению к своим мишеням, что и приводит к развитию картины лекарственно-устойчивого туберкулеза.
Влияние характера лекарственной резистентности на течение и исход заболевания является несомненным . Остро текущие формы туберкулеза легких в большинстве случаев развиваются на фоне множественной лекарственной устойчивости и сопровождаются большой распространенностью специфического и неспецифического воспаления в легочной ткани, отставанием темпов репарации очагов поражения и значительными нарушениями в иммунном статусе. Наличие резистентности к 1-2 препаратам практически не отражается на результатах лечения. Устойчивость к 3 и более препаратам, а особенно МЛУ, затрудняет процесс лечения и снижает его эффективность. Это выражается в замедлении темпов негативации мокроты, рассасывания инфильтративных и ликвидации деструктивных изменений, в связи с чем, наблюдается большая нуждаемость в хирургическом лечении.
Проблема повышения эффективности профилактических мероприятий, для предотвращения заражения лекарственно-устойчивым туберкулезом вызывает широкий интерес. Заболеваемость туберкулезом контактных лиц в семьях больных, выделяющих лекарственно-устойчивые штаммы МБТ, в 2 раза выше по сравнению с заболеваемостью контактов в семьях бактериовыделителей лекарственно-чувствительных МБТ.
Предпринимаются попытки совершенствования профилактических и лечебных мероприятий. Подтверждено совпадение спектра лекарственной устойчивости МБТ заболевших из контакта детей и взрослых с источником инфекции. Предпринимаются попытки разработки модели больного с лекарственно-устойчивым туберкулезом легких. Получен тренд линейности между возрастом и резистентностью. Дальнейшее изучение проблемы лекарственной устойчивости создает перспективные возможности для ограничения туберкулезной инфекции.
Несмотря на высокий уровень развития современной фармакологии и медицины, человечеству так и не удается победить туберкулез. Обычную форму заболевания научились успешно лечить, вплоть до полного выздоровления. Но из-за способности бактерии мутировать она часто становится нечувствительной к антибиотикам. Такая форма заболевания получила название «туберкулез МЛУ».
Туберкулез является инфекционным бактериальным заболеванием. В схему его лечения обязательно входит несколько антибиотиков. Если провести лечение до конца, возможно полное излечение от недуга.
Множественная лекарственная устойчивость туберкулеза – это приобретенная устойчивость микобактерий палочки Коха к противотуберкулезным препаратам первого ряда. Изониазид и Рифампицин считаются самыми эффективными медикаментами в борьбе с туберкулезом. Длительность лечения посредством этих препаратов составляет больше 6 месяцев.
Виды ЛУ туберкулеза
Если пройти лечение до конца, не делая перерывы и не прекращая прием медикаментов, зачастую удается полностью устранить данный недуг, но в некоторых случаях, чаще при неправильной схеме терапии, бактерия становится нечувствительной к этим средствам.
В целом, симптомы заболевания не отличаются от обычного туберкулеза. Он может протекать как в закрытой, так и в открытой форме, возможно скрытое течение. Возможно образование каверн и инфильтрация бактерией всего органа. В редких случаях возможна внелегочная форма туберкулеза МЛО. Но лечение данного заболевания будет в разы дольше и тяжелее.

Несмотря на потерю чувствительности к двум антибиотиком, ТБ-МЛУ удается лечить рядом препаратов второго ряда. Они, несмотря на длительность лечения и множественные побочные действия, способны подавить и уничтожить патогенную флору.
Существует более тяжелая форма заболевания – туберкулез ШЛУ. Данное заболевание с широкой лекарственной устойчивостью вызывает огромные трудности в лечении. В данном случае спектр препаратов, к которому у палочки развилась устойчивость, значительно расширяется. Чаще всего предшественником этого заболевания является туберкулез МЛУ.
Причины и проявления
Одной из основных причин возникновения устойчивости к препаратам является недостаточно полное соблюдение врачебных рекомендаций, в частности, прекращение не доведенного до конца курса лечения. Часто это происходит из-за значительного улучшения состояния, и пациент принимает этот «период благополучия» за полное выздоровление.

На самом деле это не так. Не уничтоженная до конца бактерия, которая испытала влияние препарата, начинает претерпевать генные мутации, направленные на ее защиту от воздействия препарата. Это происходит не со всеми бактериями, но измененные бактерии в скором времени вытеснят неустойчивые микроорганизмы.
Через некоторое время заболевание вновь начнет себя проявлять, в некоторых случаях его течение будет скрытое. Но препараты, которые применялись в предыдущей схеме терапии, уже не будут работать.
ШЛУ – это следствие не до конца доведенного лечения множественного туберкулеза. В данном случае устойчивость инфекции наблюдается к препаратам, которые подобрали для терапии МЛУ. Таким образом, количество эффективных препаратов значительно уменьшается после каждого срыва лечения.
Также множественный туберкулез может стать причиной повторного заражения после выздоровления. Зачастую это возникает у людей из группы риска. С каждым новым заражением список устойчивых препаратов может увеличиваться. Возможно заражение уже устойчивой к лекарствам бактерией. Это происходит при контакте с больным открытой формой МЛУ или ШЛУ. Палочка Коха у таких пациентов передается людям уже с устойчивостью к лекарствам.
Исходя из вышеизложенных причин возникновения, можно выделить факторы, которые способствуют возникновению устойчивости к антибиотикам. Более подвержены развитию МЛУ такие люди:

Часто устойчивость возникает из-за приема препаратов низкого качества (подделок). В данном случае поступление действующего вещества прекращается по независящим от пациента причинам. Подобные события являются севодня достаточно распространенными, несмотря на тщательный контроль фармакологических учреждений.
Иногда прием препаратов прекращается из-за отсутствия лекарства в регионе или в стране. Это происходит, когда препарат находится на перерегистрации или по каким-то другим причинам.
Огромную опасность несут люди, болеющие открытой формой устойчивого туберкулеза. Заражение от них происходит уже невосприимчивой к лечению инфекцией. Из-за этого рекомендуется лечить данных пациентов в изолированных палатах инфекционных больниц.
Это заболевание зачастую протекает как обычный туберкулез. Оно сопровождается потерей веса, повышением температуры, кашлем дольше 2 недель, кровохарканьем и другими симптомами. Отличием является невосприимчивость к стандартному лечению и дальнейшее прогрессирование заболевания. Зачастую, на фоне приема медикаментов пациент начинает себя чувствовать значительно лучше еще после первого месяца лечения. При МЛУ симптоматика будет только усиливаться, а состояние ухудшаться.
Особенности диагностики и лечения
Часто наличие ТБ-МЛУ начинают подозревать после отсутствия положительного эффекта от применяемой терапии. Для выявления устойчивости можно использовать старые методы, которые подразумевают посев на питательные среды с различными антибиотиками.
В зависимости от антибиотика, на котором будет происходить рост бактерии, определяют антибиотик, к которому она не восприимчива. Данное исследование проводится несколько дней.

В настоящее время для постановки диагноза используют специальные тесты, быстро определяющие чувствительность бактерии. Они могут быть молекулярными и культуральными. Наиболее быстрый результат дают молекулярные тесты – от 2 часов до 1-2 дней. Несмотря на высокую эффективность, они не требуют больших финансовых вложений, что дает возможность использовать их даже в бедных регионах.
В случае первичного инфицирования, вначале применяют стандартные способы диагностики:
- проба Манту;
- флюорография;
- рентгенография;
- микроскопическое исследование мокроты.
При обнаружении туберкулеза используют вышеописанные методы для мониторинга эффективности терапии.
Если у пациента обнаруживается устойчивый туберкулез легких, то лечение его становится крайне затруднительным. Обязательной является психологическая работа с пациентом, так как длительная терапия негативно сказывается на психическом здоровье больного.
Из-за невозможности применять менее опасные препараты первого выбора, необходимо принимать препараты второй линии, более опасные для всего организма:
- Хинолины.
- Циклосерин.
- Линезолид.
- Протионамид/Этионамид.
Многие врачи сравнивают терапию данными препаратами с химиотерапией, применяемой в терапии онкологических болезней. Препараты вызывают сильнейшие желудочные расстройства, боли в животе, тошноту, сильные мышечные и суставные боли.
Из-за токсичности страдают печень, почки, сердце и другие органы. Необходимо обязательно применять препараты, защищающие их. В некоторых случаях возможны нарушения со стороны психики пациента, вплоть до попыток суицида. Несмотря на это следует придерживаться назначенной схемы лечения, так как это единственный вариант лечения ТБ-МЛУ.
Риски и прогнозы
Из-за отсутствия безопасного лечения возможно возникновение полиорганной недостаточности, как на фоне заболевания, так и из-за токсичности заболевания. Болезнь может привести к развитию туберкулезного менингита, возможно распространение инфекции по всему организму.

Принципы терапии туберкулеза
Заболевание крайне опасно для общества. Инфекция, характеризующаяся устойчивостью, тяжело поддается терапии.
Наибольшую опасность представляет бактерия, выработавшая устойчивость к препаратам второго ряда. Данные препараты являются последними работающими медикаментами. Фармакология, не смотря на постоянные разработки, еще не разработала препараты, которые сумели бы быстро и эффективно лечить данное заболевание.
Несмотря на проводимое лечение, возникает множество трудностей с устранением данной инфекции. Многие пациенты из-за тяжелых побочных эффектов не выдерживают лечение. Из-за длительного течения болезни, в организме возникает множество функциональных и морфологических изменений, которые в дальнейшем невозможно восстановить.
В случае излечения человека от инфекции, зачастую он остается инвалидом. Также возможно повторное инфицирование. Часто заболевание заканчивается летальным исходом.
Предотвращение развития патологии
Для предотвращения перехода обычного туберкулеза в устойчивый необходимо четко и добросовестно придерживаться лечебной схемы. Значительное улучшение состояния в первые месяцы терапии не является признаком уничтожения инфекции и требует продолжения приема препаратов.
Для снижения количества передачи инфекции от ее источников рекомендуется изолировать пациентов с открытой формой МЛУ и ШЛУ. Но данные меры не всегда удается применять, многие пациенты, чаще из асоциальных слоев населения, отказываются от госпитализации и терапии.

Следует стараться избегать повторного инфицирования. Если есть факторы, способствующие заражению – необходимо их устранять. Обязательными являются своевременные диагностические мероприятия, направленные на раннее выявление заболевания. Важную роль играет общественная пропаганда диагностики заболевания.
Обязательным для профилактики является отказ от вредных привычек, особенно курения.
Необходимо вести здоровый образ жизни с полноценным питанием и физическими упражнениями. В период обострения недуга у носителей (весна, осень) следует избегать многолюдных мест, особенно в закрытом помещении.
Данное заболевание является следствием безответственности, в первую очередь пациентов. Ученые совершили огромный прорыв в терапии туберкулезной инфекции. Если раньше от нее в 100% случаев умирали – сейчас удается полностью излечить больных людей.
Но если в дальнейшем количество прерываемых курсов лечения не снизится – существует огромный риск прогрессирования МЛУ и ШЛУ в обществе, вплоть до развития устойчивости бактерии ко всем существующим препаратам. В таком случае излечение данной патологии будет невозможным.
Лекарственная устойчивость - закономерное и одно из самых значимых проявлений изменчивости МБТ, отражающей основной биологический закон, выражение приспособления биологических видов к окружающей среде.
По последним научным данным, основные механизмы развития лекарственной устойчивости МБТ к противотуберкулезным препаратам - мутации в гене, ответственном за обменные процессы, и синтез белка-фермента, инактивирующего конкретный препарат.
Изучение биологических особенностей, ферментативной активности, химического состава лекарственно-устойчивых МБТ в сравнении с лекарственно-чувствительными, генетически однородными МБТ позволило выделить несколько основных механизмов, обусловливающих резистентность бактериальной клетки к данному антибактериальному агенту:
Появление нового пути обменных процессов, обходящего те обменные процессы, на которые воздействует данный препарат;
Увеличение синтеза фермента, который инактивирует данный препарат;
Синтез измененного фермента, который слабее инактивируется данным препаратом;
Уменьшение проницаемости бактериальной клетки в отношении данного препарата.
Все эти процессы могут происходить внутри бактериальной клетки и на уровне клеточной мембраны МБТ.
К настоящему времени установлены характерные особенности МБТ, устойчивых к различным противотуберкулезным препаратам, и изучены практически все гены, контролирующие лекарственную устойчивость к этим препаратам.
В большой и активно размножающейся микобактериальной популяции всегда имеется небольшое количество лекарственно-устойчивых спонтанных мутантов.
С учетом того что в каверне величина микобактериальной популяции составляет 10 -8… -11 там имеются мутанты ко всем противотуберкулезным препаратам. Поскольку большинство мутаций специфичны для отдельных препаратов, спонтанные мутанты, как правило, устойчивы только к одному препарату. Это явление называют эндогенной (спонтанной) лекарственной устойчивостью МБТ.
При правильном проведении химиотерапии эти мутанты практического значения не имеют, однако в результате неправильного лечения, когда больным назначают неадекватные режимы и сочетания противотуберкулезных препаратов и не дают оптимальные дозы при расчете в мг/кг массы тела больного, изменяется соотношение между количеством лекарственно-устойчивых и чувствительных МБТ. Происходит естественный отбор лекарственно-устойчивых мутантов к противотуберкулезным препаратам при неадекватной химиотерапии, что при длительном воздействии может вести к изменению генома микобактериальной клетки без обратимости чувствительности. В этих условиях происходит размножение главным образом лекарственно-устойчивых МБТ, эта часть бактериальной популяции увеличивается. Это явление
определяется как экзогенная (индуцированная) лекарственная устойчивость.
Наряду с этим выделяют первичную лекарственную устойчивость -
устойчивость МБТ, определяемую у больных туберкулезом, не принимавших противотуберкулезные препараты. В данном случае больной заразился МБТ с устойчивостью к противотуберкулезным препаратам.
Первичная лекарственная устойчивость МБТ у больного туберкулезом характеризуется состоянием микобактериальной популяции, циркулирующей в данном регионе или стране, и ее показатели важны для оценки степени напряженности эпидемической ситуации и выработки региональных режимов химиотерапии.
Вторичная (приобретенная) лекарственная устойчивость определяется как устойчивость МБТ, развивающаяся в процессе химиотерапии у конкретного больного туберкулезом. Приобретенную лекарственную устойчивость следует рассматривать у тех больных, которые имели в начале лечения чувствительные МБТ, с развитием устойчивости через 3-6 мес.
Вторичная лекарственная устойчивость МБТ - объективный клинический критерий неэффективно проводимой химиотерапии. В клинической практике необходимо исследовать лекарственную чувствительность МБТ и по результатам этих данных подбирать соответствующий индивидуальный режим химиотерапии, а его эффективность сопоставлять с динамикой туберкулезного процесса.
По эпидемиологической классификации ВОЗ (2008) МБТ могут быть:
монорезистентными (МР) - к одному противотуберкулезному препарату;
полирезистентными (ПР) - к двум и более противотуберкулезным препаратам, но не к сочетанию изониазида и рифампицина;
множественно лекарственно-резистентными (МЛУ) - как минимум к сочетанию изониазида и рифампицина;
широко лекарственно-резистентными (ШЛУ) - как минимум к сочетанию изониазида, рифампицина, фторхинолонов и инъекционных препаратов (канамицина, амикацина и капреомицина).
Данная классификация дает представление о частоте распространенности региональной первичной и вторичной лекарственной устойчивости МБТ к трем самым эффективным противотуберкулезным препаратам - изониазиду, рифампицину и фторхинолонам, особенно при их сочетании. Это обусловлено тем, что частота распространенности МЛУ и ШЛУ в каждой стране различна.
Туберкулез легких - инфекционное заболевание, при котором развитие эпидемиологического процесса и химиотерапия больных зависят от частоты и характера лекарственной устойчивости МБТ, циркулирующих в данном регионе, что обусловливает региональный подбор наиболее эффективной комбинации противотуберкулезных препаратов.
Региональный подбор комбинации противотуберкулезных препаратов для химиотерапии больных туберкулезом должен соответствовать уровню распространенности МЛУ МБТ в конкретном регионе и стране.
В клинических условиях для эффективного проведения химиотерапии у конкретного больного необходимо знать индивидуальный спектр лекарственной чувствительности МБТ.
По клинической классификации В.Ю. Мишина (2002) больных, выделяющих МБТ, разделяют на три группы:
Больные с МБТ, чувствительными ко всем противотуберкулезным препаратам;
Больные с ПР и МЛУ МБТ к основным противотуберкулезным препаратам;
Больные с ПР и МЛУ МБТ к сочетанию основных и резервных противотуберкулезных препаратов.
Эта классификация определяет индивидуальную устойчивость МБТ. Такое деление лекарственной устойчивости имеет клиническое значение в плане адекватности режимов химиотерапии, что позволяет персонально подбирать дозу и комбинации основных и резервных противотуберкулезных препаратов у конкретного больного.
Лекарственная устойчивость МБТ и режимы химиотерапии туберкулеза Лекарственная устойчивость микобактерий туберкулеза и режимы химиотерапии туберкулеза, а также применение продуктов на основе личинок восковой моли для лечения туберкулеза. Администратор сайт
Лекарственная устойчивость МБТ и режимы химиотерапии туберкулеза
Лекарственная устойчивость микобактерий туберкулёза (МБТ)
Лекарственная устойчивость микобактерий туберкулёза (МБТ) – одна из самых главных причин неэффективности химиотерапии.
Основным фактором риска развития лекарственной устойчивости микобактерий туберкулёза - является неэффективное лечение, особенно прерванное или незаконченное.
Лекарственную устойчивость подразделяют на:
- первичную устойчивость
, отмечающуюся у больных, ранее не принимавших химиопрепараты или принимавших в течение месяца или менее;
- приобретенную устойчивость
, развившуюся во время лечения, наблюдается у больных, имевших в начале лечения чувствительные МБТ и ставшие устойчивыми через 6 месяцев.
Лекарственная устойчивость микобактерий туберкулёза может быть:
монорезистентной
– устойчивость к одному из противотуберкулёзных препаратов (при комплексной терапии встречается редко)
;
полирезистентной
– устойчивость к двум и более препаратам, например: одновременную устойчивость к изониазиду и рифампицину следует трактовать как полирезистентность (или множественную лекарственную устойчивость)
.
В последние годы в связи с ухудшением эпидемической ситуации существенно увеличилось число больных, выделяющих штаммы МБТ, устойчивые к основным противотуберкулёзным препаратам.
Прием экстракта личинок восковой моли помогает подавить лекарственную устойчивость микобактерий туберкулёза к различным противотуберкулёзным препаратам (в том числе и полирезистентную/множественную
).
Экстракт личинок восковой моли повышает эффективность химиотерапии и тем самым позволяет уменьшить лекарственную нагрузку на больного.
Режимы химиотерапии туберкулёза
В связи с разным состоянием бактериальной популяции на разных этапах течения болезни в процессе химиотерапии весь период лечения химиопрепаратами делят на два этапа (или фазы).
Первый этап
характеризуется проведением интенсивной насыщенной химиотерапии четырьмя-пятью противотуберкулёзными препаратами. Его назначение заключается в подавлении размножающейся бактериальной популяции и уменьшении ее количества.
Второй этап
- менее интенсивная химиотерапия. Ее назначение состоит в воздействии на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий. На этом этапе главными задачами являются предупреждение размножения оставшихся микобактерий, в том числе резистентных штаммов микобактерий.
Приказ Минздрава РФ № 109 от 21 марта 2003 года, утверждает несколько стандартных схем лечения туберкулёза: I, IIа, IIб, III и IV. Согласно этому приказу лечение подразделяется на две фазы: интенсивную и пролонгированную фазу лечения.
1 режим (1 категория больных)
- больные с впервые выявленным бациллярным туберкулёзом легких разной протяженности;
- больные распространенными формами впервые выявленного туберкулёза легких, но без деструкции и бактериовыделения (милиарным туберкулёзом, диссеминированным туберкулёзом легких, полисерозитом, экссудативным плевритом) ;
- больные тяжелыми формами внелегочного туберкулёза (менингитом, осложненным туберкулёзом позвоночника, осложненным туберкулёзом костей и суставов, распространенным и/или осложненным туберкулёзом мочеполовой системы, распространенным и/или осложненным туберкулёзом женских гениталий, распространенным и/или осложненным абдоминальным туберкулёзом, осложненным туберкулёзным перикардитом, туберкулёзом надпочечников с гормональной недостаточностью) ;
- больные с сочетанием активного внелегочного туберкулёза любой локализации и туберкулёза органов дыхания любой активности.
В фазе интенсивной терапии назначают четыре основных препарата: изониазид, рифампицин, пиразинамид и стрептомицин или этамбутол. Интенсивную фазу химиотерапии продолжают не менее двух месяцев. За этот срок больной должен принять 60 доз комбинации из четырех основных препаратов. В случае пропуска приема полных доз длительность фазы интенсивной терапии увеличивают до 60 доз.
Через 2 месяца от начала лечения вопрос о переходе ко второму этапу решает экспертная комиссия на основании данных рентгенологического и микробиологического исследований.
При сохраняющемся после двух месяцев химиотерапии бактериовыделении фазу интенсивной терапии можно продолжить еще на месяц (30 доз) до получения данных о лекарственной чувствительности возбудителя. В зависимости от результата проводят коррекцию химиотерапии и продолжают фазу интенсивной терапии. При невозможности исследования лекарственной чувствительности и/или при отрицательной клинико-рентгенологической динамике процесса после трех месяцев химиотерапии больного направляют в вышестоящее учреждение для исследования лекарственной чувствительности и определения дальнейшей тактики лечения. В ожидании результатов лечение проводят в соответствии с интенсивной фазой терапии.
При тяжелом и осложненном течении туберкулёза любой локализации продолжительность фазы интенсивной терапии может быть увеличена.
При отрицательных результатах микроскопии мокроты после двух месяцев химиотерапии и положительной клинико-рентгенологической динамике переходят к фазе продолжения химиотерапии.
В фазе продолжения терапии назначают два основных препарата изониазид и рифампицин - в течение 4 месяцев (при туберкулёзе органов дыхании) или в течение 6 месяцев (при внелегочном туберкулёзе) ежедневно или в интермиттируюшем режиме (3 раза в неделю).
Во второй фазе лечения применяют изониазид и рифампицин в течение 4 месяцев ежедневно или интермиттирующим методом 3 раза в неделю. Как альтернативная комбинация в фазе долечивания может использоваться сочетание изониазида и этамбутола при их ежедневном приеме в течение 6 мес.
Интерминирующий режим назначают больным при амбулаторном проведении фазы продолжения терапии, при хронической почечной и печеночной недостаточности, больным с токсическими реакциями и неудовлетворительной переносимостью лечения, преклонного возраста.
2a режим (2а категория больных)
IIa режим химиотерапии назначают
при повторном курсе химиотерапии после перерыва в лечении или по поводу рецидива при невысоком риске лекарственной устойчивости микобактерий туберкулёза.
В фазе интенсивной терапии назначают 5 основных препаратов: изониазид, рифампицин, пиразинамид, этамбутол и стрептомицин. Через 2 месяца (60 принятых суточных доз) терапию продолжают четырьмя препаратами (изониазидом, рифампицином, пиразинамидом, этамбутолом) в течение еще одного месяца (30 доз). Общая длительность интенсивной фазы - не менее трех месяцев (90 суточных доз комбинации лекарств). В случае пропуска приема полных доз длительность интенсивной фазы увеличивают до приема 90 доз.
Через 3 месяца от начала фазы интенсивной терапии, вопрос о переходе ко второму этапу лечения решает комиссия на основании данных клинико-рентгенологического и микробиологического исследований.
При отрицательных результатах микроскопии мокроты через 3 месяца химиотерапии и положительной клинико-рентгенологической динамике приступают к фазе продолжения химиотерапии. К этому сроку, как правило, получают данные о лекарственной чувствительности микобактерий туберкулёза, которые могут потребовать коррекции химиотерапии.
При сохранении бактериовыделения и невозможности исследования лекарственной чувствительности микобактерий туберкулёза и/или при отрицательной клинико-рентгенологической динамике процесса через 3 месяца больного направляют в вышестоящее учреждение для исследования лекарственной чувствительности и определения дальнейшей тактики ведения. До получения результатов лечение проводят как в интенсивной фазе терапии.
При чувствительности микобактерий туберкулёза к основным химиопрепаратам в фазу продолжения терапии еще в течение 5 месяцев назначают изониазид, рифампицин и этамбутол ежедневно в интермиттирующем режиме (3 раза в неделю). Общая продолжительность терапии 8 месяцев.
2б режим (2б категория больных)
IIб режим химиотерапии назначают
больным с высоким риском лекарственной устойчивости микобактерий до получения результатов микробиологического исследования.
К 2б категории относятся:
- больные, у которых отсутствует эффект от химиотерапии либо обострен или прогрессирует процесс на фоне лечения;
- больные, не получавшие ранее противотуберкулёзные препараты, но у которых имеются веские основания для предположений о лекарственной устойчивости по анамнестическим и/или клиническим данным (контакт с больными, выделяющими микобактерий туберкулёза с множественной лекарственной устойчивостью, остропрогрессирующее течение) .
В фазе интенсивной терапии в течение 3 месяца назначают комбинацию из четырех основных препаратов (изониазида, рифампицина/рифабутина, пиразинамида, этамбутола) и двух-трех резервных (в зависимости от данных о лекарственной устойчивости по региону).
Дальнейшее лечение корректируют на основании данных о лекарственной чувствительности микобактерий туберкулёза и проводят в соответствии с режимами I, IIа или IV.
3 режим (3 категория больных)
III режим химиотерапии назначают:
- впервые выявленным больным без бактериовыделения;
- больным с малыми (ограниченными) и неосложненными формами туберкулёза;
- больным с туберкулёзом внутригрудных лимфатических узлов (поражение одной-двух групп лимфатических узлов) , ограниченным плевритом при отсутствии кислотоустойчивых бактерий при микроскопии мазка мокроты или иного диагностического материала;
- больным менее тяжелыми формами внелегочного туберкулёза (неосложненным туберкулёзом позвоночника, костей и суставов, мочеполовой системы, ограниченным и неосложненным туберкулёзом женских гениталий, туберкулёзом периферических лимфатических узлов, ограниченным и неосложненным абдоминальным туберкулёзом, туберкулёзом кожи, глаз, ограниченным и неосложненным туберкулёзным перикардитом, туберкулёзом надпочечников без явлений гормональной недостаточности) .
В фазе интенсивной терапии назначают четыре основных препарата: изониазид, рифампицин, пиразинамид, этамбутол. Интенсивную фазу продолжают 2 месяца. За этот срок больной должен принять 60 доз комбинации из четырех (у детей из трех) основных препаратов. В случае пропуска приема полных доз длительность фазы интенсивной терапии увеличивают до приема 60 доз.
Через 2 месяца от начала интенсивной фазы терапии вопрос о переходе ко второму этапу лечения решает комиссия на основании данных исследований.
При появлении бактериовыделения и в случае отрицательной клинико-ренттенологической динамики процесса после двух месяцев лечения необходимы определение лекарственной чувствительности микобактерий туберкулёза и соответствующая коррекция химиотерапии. В ожидании результатов лечение не меняют в течение месяца. При невозможности исследования лекарственной чувствительности больного направляют в вышестоящее учреждение. Режим дальнейшего лечения определяют с учетом лекарственной чувствительности возбудителя.
В фазе продолжения терапии назначают два основных препарата - изониазид и рифампицин - 4 месяца ежедневно или в интермиттирующем режиме (3 раза в неделю). Другим режимом в фазе продолжения может быть прием изониазида и этамбутола в течение 6 месяцев.
4 режим (4 категория больных)
IV режим химиотерапии назначают больным с выделением микобактерий, устойчивых к изониазиду и рифампицину одновременно.
В фазе интенсивной терапии назначают комбинацию как минимум из пяти противотуберкулёзных препаратов, чувствительность к которым сохранена, например: пиразинамид, препарат из группы фторхинолонов, канамицин/амикацин или капреомицин, протионамид/этионамид и этамбутол. Назначение препаратов резервного ряда зависит отданных исследования лекарственной чувствительности выделяемых больным микобактерий туберкулёза, причем необходимо также учитывать данные о лекарственной устойчивости микобактерий по региону.
При положительной клинико-ренттенологической динамике и отрицательных результатах культурального исследования мокроты после 6 месяцев химиотерапии переходят к фазе продолжения.
В фазе продолжения назначают не менее трех препаратов из числа тех, чувствительность к которым сохранена. Длительность фазы продолжения - не менее 12 мес.
Применение продуктов на основе личинок восковой моли для лечения туберкулёза
Экстракт , гомогенат и настойка личинок восковой моли , а также настойка ПЖВМ и оказывают губительное влияние на микобактерии туберкулёза, разрушая их восковые оболочки.
В экстракте, настойке и гомогенате ЛВМ, а также в настойке ПЖВМ и мёде с гомогенатом личинок восковой содержится специфический пищеварительный фермент личинок восковой моли - фермент цераза (химически синтезированного аналога фермента цераза - НЕТ
)
, который способствует рассасыванию очаговых изменений и препятствует их дальнейшему распространению в организме.
Под воздействием фермента цераза увеличивается проницаемость клеток микобактерий туберкулёза для противотуберкулёзных препаратов всех видов, что помогает подавить лекарственную устойчивость микобактерий.
Применение гомогената, экстракта, настойки личинок восковой моли, а также настойки ПЖВМ и мёда с гомогенатом личинок восковой моли в комплексной терапии туберкулёза позволяет значительно снизить лекарственную нагрузку на организм, оказать разноплановое лечебное воздействие и повысить эффективность химиотерапии (сократив срок приема противотуберкулёзных препаратов) .
Продукты пчеловодства на основе личинок восковой моли является мощными природными иммуностимуляторами.
Прием продуктов на основе личинок восковой моли значительно усиливает процесс фагоцитоза.
Фагоцитоз - процесс, при котором специально предназначенные для этого клетки иммунной системы организма - фагоциты защищают организм путем поглощения вредных чужеродных частиц, бактерий, мертвых /погибающих клеток. Осуществляется двумя разновидностями клеток: циркулирующими в крови зернистыми лейкоцитами (гранулоцитами) и тканевыми макрофагами.
В продуктах на основе личинок восковой моли присутствуют незаменимые природные компоненты (аланин , лейцин , треонин , валин , изолейцин , гистидин и др.), стимулирующие сопротивляемость организма, рост и размножение клеток.
Продукты пчеловодства на основе личинок восковой моли увеличиваут сопротивляемость ткани к туберкулёзной инфекции и способствуют заживлению туберкулёзных каверн в легких.
По мере затихания туберкулёзного процесса величина бактериальной популяции уменьшается вследствие подавления размножения микобактерий. В условиях продолжающейся химиотерапии и снижения бактериальной популяции в организме больного сохраняется часть микобактерий, которые находятся в состоянии персистирования. Персистируюшие микобактерий часто называют спящими или дремлющими. На этом этапе, когда интенсивное размножение бактериальной популяции сменяется состоянием персистирования оставшейся ее части, микобактерий находятся, главным образом, внутриклеточно (внутри фагоцитов - клеток иммунной системы).
Противотуберкулёзными препаратами очень трудно оказать воздействие действие на микобактерии расположенные внутриклеточно.
Применение продуктов на основе личинок восковой моли позволяет подавить жизнедеятельность внутриклеточно локализованных микобактерий.
Высокую лечебную эффективность продукты пчеловодства на основе личинок восковой моли проявляют и при лечении внелегочной туберкулёзной патологии и других органов человеческого организма: лимфатической и пищеварительной системы, костей и суставов, мочеполовых органов, кишечника, кожи, глаз, центральной нервной системы и мозговых оболочек.
Продукты на основе личинок восковой моли эффективны и против грибковых заболеваний легких (и прочих побочных реакций организма)
, являющихся частыми осложнениями химиотерапевтических курсов лечения туберкулёза.
Содержащаяся в продуктах на основе личинок восковой моли аспарагиновая кислота помогает печени выводить из организма остаточные продукты лекарств после курсов химиотерапии.
О совместимости спиртосодержащих настоек/экстрактов и антибиотиков
В течение десятилетий в обывательской и медицинской среде, существует мнение, что прием спиртосодержащих экстрактов и настоек и антибиотиков несовместимы, т. к. при этом снижается эффективность антибиотиков, и возникают различные побочные эффекты.
Однако анализ существующих научных исследований показывает, что в большей части это выдуманный миф, не имеющий за собой никаких доказательств.
Британские исследователи считают, что миф возник во время второй мировой войны, когда производство антибиотика пенициллина было трудоемким и дорого стоило. Поэтому пенициллин повторно извлекали из мочи раненых и больных военнослужащих. Для того чтобы уменьшить объем мочи и ускорить выделение пенициллина, им было запрещено принимать пиво, входящее в ежедневное довольствие.
Последние исследования, в которых определялось влияние алкоголя (до 30мг чистого этанола)
на некоторые фармокинетические показатели различных антибиотиков, показывающих распределение их по организму, не выявили их изменений либо они были незначительны.
Небольшие дозы алкоголя
(до 15мг чистого этанола)
не влияют на фармокинетику большинства
(включая все противотуберкулёзные препараты
)
антибиотиков в организме.
15мг чистого этанола – это, например, 44мл 40% алкоголя.
Одновременный прием экстракта личинок восковой моли и противотуберкулёзных препаратов
При туберкулёзе предпочтительней принимать 25% экстракт личинок восковой моли или 50% гомогенат личинок восковой моли
(при нормальной переносимости - настойку продуктов жизнедеятельности личинок восковой моли, причем концентрация фермента цераза в 20% настойке ПЖВМ выше, чем в настойке, 25% экстракте личинок восковой моли и даже чем в 50% гомогенате личинок восковой моли!
)
, т. к. они имеет большую концентрацию полезных веществ при меньшем содержании этанола (спирта)
в конечной дозе (при полной непереносимости или неприятия спиртосодержащих продуктов подойдет
мёд с гомогенатом личинок восковой моли)
.
Содержание этанола
(спирта)
в разовой дозе 25% экстракта личинок восковой моли
(на 1 прием)
- не изменит эндогенную концентрацию этанола в организме
(эндогенное - естественное содержание алкоголя в крови – в норме составляет до 0,3 промилле)
.
Максимальная разовая доза 25% экстракта личинок восковой моли для человека любого веса и дозировки - поднимает концентрацию алкоголя в крови на 0,098 промилле (т. к. в формуле расчета концентрации, также учитывается вес)
.
В среднем эндогенная (естественная и постоянно присутствующая)
концентрация этанола в организме составляет - 0,18 промилле. Непосредственно после приема экстракта личинок восковой моли концентрация увеличится до 0,278 промилле, что является допустимой нормой - можно управлять автомобилем, принимать при кодировке от алкоголизма и совместно с любым дисульфирамом (Антабус, Тетурам, Эспераль и др.)
.
Через 30 минут после приема 25% экстракта личинок восковой моли 0,098 промилле будут полностью переработаны организмом и концентрация придет к изначальному значению.
Практически во всех (95%), известных нам за 8 лет случаях приема экстракта личинок восковой моли для лечения туберкулёза, больные принимали экстракт личинок восковой моли одновременно с курсом противотуберкулёзных препаратов (в том числе и по рекомендации лечащих врачей). Случаев возникновения побочных реакций (аллергий и пр.) не было.
При правильном систематическом приеме – результат применения экстракта личинок восковой моли удивлял даже опытных врачей-фтизиатров!
Свойства МБТ
1) Размножение происходит достаточно медленно, деление клетки происходит за 20 – 24 часа. На жидких питательных средах при tº 37 С º видимый рост проявляется на 5-7 сутки, твёрдых питательных средах - на 14-15 сутки.
2) Обладают устойчивостью:
· к воздействию факторов окружающей среды, не боятся холода (выживают при температуре -269˚ С.),
· к высоким концентрациям кислот, щелочей, спиртов (кислотоустойчивость).
3) Отличаются большой жизнеспособностью , т.е. свои патогенные свойства могут сохранять в:
- высохшей мокроте в темноте, без доступа солнечного света, в течение 10 – 12 месяцев,
- закрытом помещении, на страницах книг, одежде, мебели, стенах до 3- 4-х месяцев,
- уличной пыли до 2-х недель,
- сырой земле от 4-х до 12 месяцев.
- воде до 5 месяцев,
- сливочном масле - до 8месяцев, сыре – до 7 месяцев.
На МКБ губительно действуют прямые солнечные лучи, под воздействием которых, они погибают через несколько часов.
Быстро гибнут:
· при кипячении (через 15 мин.),
· от воздействия УФО, хлорной извести, хлорамина, йода, формалина. Для обеззараживания используют препараты, содержащие хлор в высоких концентрациях.
В сухожаровом шкафу – при tº 100 С º , погибают через 45 мин.
4).Проявляют изменчивость и приспособляемость к неблагоприятным воздействиям.
Изменчивость МКБ проявляется в следующих формах:
- Морфологическая изменчивость
- Изменчивость к красящим веществам
- Биологическая изменчивость – изменение вирулентности в сторону повышения или снижения дл полной утраты вирулентности.
Морфологическая изменчивость проявляется в виде полиморфизма , т. е. способности к образованию разных форм. Могут полностью или частично утрачивать клеточную мембрану (так называемые L формы) и становятся недоступными для действия лекарственных препаратов или естественных механизмов защиты человека.
Это позволяет микобактериям годами и десятилетиями незаметно существовать в условиях живого организма, но при этом постоянно сохраняется опасность, что они вновь трансформируются в обычные микобактерии и вызовут повторное заболевание туберкулезом.
Атипичные формы МБТ могут вызывать заболевания человека и животных, неотличимые от клинических, рентгенологических и морфологических проявлений туберкулёза. Такие заболевания называются микобактериозами.
иагностика туберкулеза основывается на данных клинических, гистологических, микробиологических исследований, оценке результатов туберкулиновых проб и тест-терапии. Из этих методов самым надежным является обнаружение микобактерий туберкулеза (МБТ), остальные же информативны только в комплексе. Современная микробиологическая диагностика туберкулеза состоит из нескольких основных групп анализов, направленных на:
выявление (обнаружение) возбудителя;
определение лекарственной устойчивости;
типирование микобактерий туберкулеза.
Бактериоскопические методы
. Обнаружение возбудителя начинается с наиболее простых и быстрых бактериоскопических методов: световой микроскопии с окраской по Цилю–Нильсену и люминесцентной микроскопии с окраской флюорохромами. Преимущество бактериоскопии – в быстроте получения результата, однако возможности ее ограничены из-за низкой чувствительности. Этот метод является наиболее экономичным и рекомендован Всемирной организацией здравоохранения в качестве основного для выявления заразных больных.
Культуральные исследования
. «Золотым стандартом» выявления МБТ признаны культуральные исследования. В России для посева патологического материала используют яичные среды: Левенштейна–Йенсена, Финна-II, Мордовского и др. Для повышения процента выделения микобактерий посевы патологического материала проводят на несколько сред, в том числе и на жидкие, что позволяет удовлетворить все культуральные потребности возбудителя. Посевы инкубируют
до 2,5 месяцев, при отсутствии роста к этому времени посев считается отрицательным.
Метод биологической пробы
. Наиболее чувствительным способом обнаружения МБТ считается метод биологической пробы – заражение диагностическим материалом высокочувствительных к туберкулезу морских свинок.
Молекулярно-генетическая диагностика
. Развитие молекулярной биологии позволило значительно повысить эффективность обнаружения микобактерий. Базовым методом молекулярно-генетических исследований являетсяполимеразная цепная реакция
(ПЦР), направленная на выявление ДНК микобактерий в диагностическом материале. ПЦР дает экспоненциальную амплификацию специфического участка ДНК возбудителя: 20 циклов ПЦР приводят к увеличению содержания исходной ДНК в 1 миллион раз, что позволяет визуализировать результаты методом электрофореза в агарозном геле. Роль молекулярной диагностики в клинической практике повышается, поскольку увеличивается число больных со скудным бактериовыделением. Однако при установлении диагноза результаты ПЦР являются дополнительными и должны сопоставляться с данными клинического обследования, рентгенографии, микроскопии мазка, посева и даже ответа на специфическое лечение.
Лекарственная устойчивость МБТ:
· первичная (у нелеченых больных);
· вторичная (при неадекватности терапии).
Выделяют монорезистентность (к одному препарату),
· полирезистентность (к 2 и более),
· мультирезистентность (лек.уст-ть к HR) - к изониазиду, рифампицину.
Именно мультирезистетность или множественная лекарственная устойчивость (МЛУ) возбудителя туберкулеза имеет эпидемиологическое и клиническое значение в современных условиях.
Клиническое значение выявления больных туберкулезом с МЛУ заключается в том, что данная категория больных характеризуется:
· большой распространенностью процесса,
· прогрессирующим течением заболевания,
· иммунодефицитом,
· отсутствием эффекта от проводимой стандартной химиотерапии.
Важным признаком изменчивости МБТ. является устойчивость к одному или нескольким противотуберкулезным препаратам. Виды лекарственной устойчивости:
Первичная - устойчивость МБТ к противотуберкулезным препаратам(ПТП) у больных туберкулезом, которые ранее не получали специфической терапии.
Начальная - устойчивость МБТ к ПТП у больных туб., которые ранее могли их получать. Включает
первичную и не выявленную приобретенную.
Приобретенная (вторичная) -устойчивость у больных, которым ранее проводилась специфическая терапия.
Монорезистснтность - устойчивость к одному ПТП.
Полирезистснтносгь - устойчивость к двум и более ПТП, но не к сочетанию изониазида и рифампицина.
Множественная - -//- + сочетание изониазида и рифампицина
Перекрестная (полная и неполная)
Основные механизмы развития лекарственной устойчивости
I .Мутация
2.Селекция
Поэтому для химиотерапии применяют не менее 4-х препаратов; если препарат = 40 мкг/мл и МБТ устойчива-что нужно исключать.
Методы определения лекарственной устойчивости
1 .Классические: -м-д пропорций
М-д коэффициента устойчивости -м-д абсолютных концентраций
2.Ускоренные:
Радиометрический м-д системы ВАС ГЕС
3.Перспективные: -молекулярно-генетические.