TEEMA: ANTIKEHADE ÜLDISED OMADUSED.
Antikehad- ühte või teise immunoglobuliinide klassi kuuluvad valgud, mille süntees stimuleeritakse pärast antigeeni parenteraalset manustamist; antikehadel on võime antud antigeeniga spetsiifiliselt interakteeruda.
Tänu uusimale kvaliteedile antikehad on immuunsuse üks peamisi spetsiifilisi tegureid suunatud just selle võõra aine vastu, mis oli nende esinemise põhjuseks.
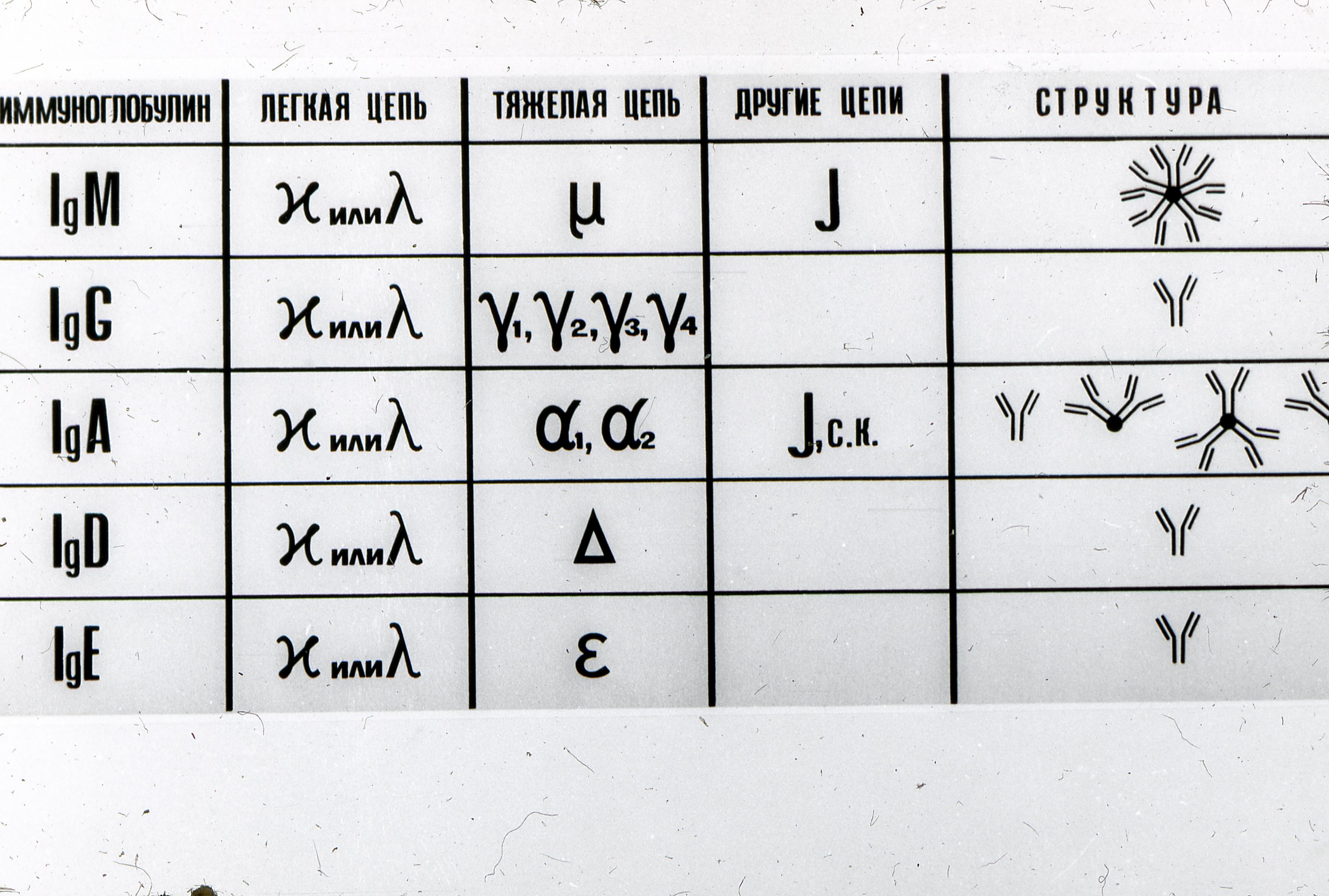
Tuntud on viis immunoglobuliinide klassi: IgM, IgG, IgA, IgE ja IgD.
Immunoglobuliinide koguhulk vereseerumis on umbes 2,5% (kuivjääk), s.o rohkem kui 1/3 kõigist valkudest.
Antikehi toodavad lümfoidorganite rakud ja need ringlevad veres ja teistes kehavedelikes. Teatud tüüpi antikehad, nn A-klassi sekretoorsed immunoglobuliinid, ulatuvad limaskestadest kaugemale soole luumenisse, hingamisteed ja teised, olles keha "esimene kaitseliin".
Antikeha (AT)- Ig klassi kuuluv glükoproteiin. AT suhtleb spetsiifiliselt täiendava Ag-ga. Abs eksisteerib miljonites sortides ja igal molekulil on ainulaadne piirkond antigeense determinandi seondumine. Antikehi sünteesivad plasmarakud humoraalse immuunvastuse käigus. Ig on üks peamisi verevalkude klasse, moodustades 20% plasmavalkude massist. Tuntud Ig klasside sünteesi kodeerivad geenid asuvad kromosoomides 2, 14 ja 22.
Struktuur. Erinevate klasside immunoglobuliinide molekulid on üles ehitatud samadest monomeeridest, millel on kaks rasket ja kaks kerget ahelat.
Ig molekul koosneb kahest kergest ahelast (L-ahel) ja kahest raskest ahelast (H-ahel). Ahelates eristatakse N-terminaalses osas muutuvat piirkonda (V-piirkond) ja konstantset ehk konstantset piirkonda (C-piirkond). V-piirkond on erinevate antikehade vahel erinev. Moodustuvad L- ja H-ahelate V-piirkonnad Ag - sidumiskeskus , või suurepärane fragment . Ig molekuli konstantsel piirkonnal on Fc - fragment .
Ag-sidumiskeskuse moodustavad L- ja H-ahela varieeruvad piirkonnad. Immunogeeni antigeenne determinant (epitoop) interakteerub Ag-sidumiskeskusega.
Fc fragment määrab Ig molekuli seondumise spetsiifilisuse efektorrakkudega (näiteks makrofaagid, polümorfonukleaarsed leukotsüüdid, nuumrakud), mis kannavad oma pinnal Fc fragmendi retseptoreid.
riis. 1. Immunoglobuliini struktuur. Molekul koosneb kahest identsest raskest (H) ja kahest identsest kergest (L) ahelast. L- ja H-ahela N-terminaalsed piirkonnad moodustavad kaks Ar-sidumiskeskust. Molekuli Fc fragment interakteerub oma retseptoriga erinevate rakutüüpide membraanis (makrofaagid, neutrofiilid, nuumrakk).
ANTIKEHADE TOOTMISE DÜNAAMIKA.
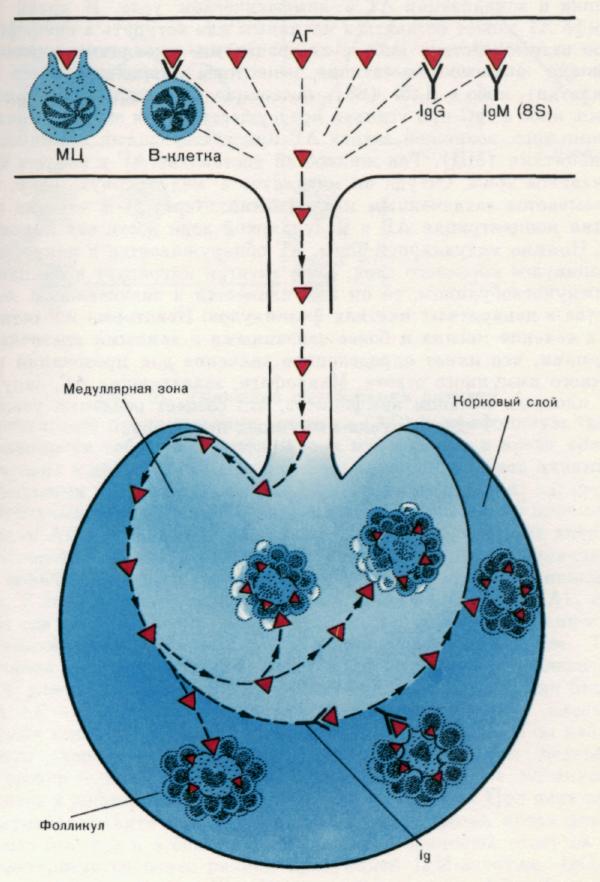
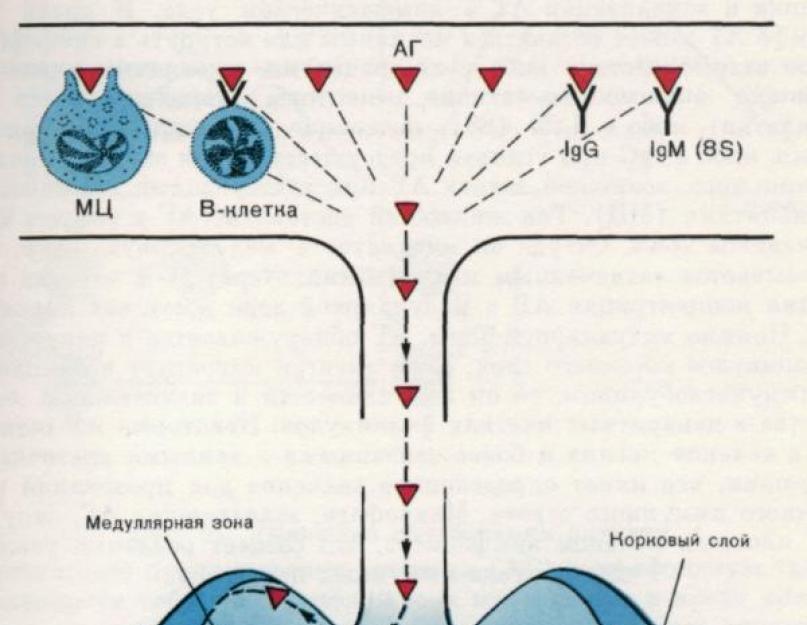
Riis. 2. Antigeeni lokaliseerimine lümfisõlmes.
Antigeeni (AG) kogunemine lümfomüeloidkompleksi teatud organitesse sõltub AG kehasse tungimise meetodist.
1. Otse verre süstimisel kontsentreerub AG märkimisväärses koguses põrnas.
2. Subkutaansel manustamisel jõuab AG lähimate lümfisõlmedeni vere ja lümfisoonte kaudu. Joonisel on näidatud AG kohaletoimetamise viis ja lokaliseerimine lümfisõlmes. Veres või lümfis võib AG jääda natiivseks või astuda spetsiifilisse interaktsiooni kas lümfotsüütidega, millel on vastavad antigeeni siduvad retseptorid (tõenäoliselt on need B-rakud), või IgM-iga, mida B-rakud pidevalt sekreteerivad, või IgG-ga. eeldusel, et see on kehas juba olemas. Lisaks võivad AG-d kinni püüda vedelikes esinevad monotsüüdid (MC). Vedelikuvool toimetab hüpertensiooni marginaalse tsooni siinustesse. Sealt rändab ta medullaarsesse tsooni, kus ta püüavad kinni makrofaagid.
1-2 tundi pärast manustamist saavutab AG kontsentratsioon medullaarses tsoonis maksimumi. Lisaks medullaarsele tsoonile leidub AG-d kortikaalse kihi folliikulite makrofaagides. Kui antigeen migreerub koos immunoglobuliiniga, koguneb see märkimisväärses koguses folliikulite dendriitrakkudesse. Mõni AH jääb nende rakuvormidega seotuks kuuks või kauemaks, mis on sekundaarse immuunvastuse esilekutsumisel teatud tähtsusega. AG kinni püüdnud makrofaagid on ümbritsetud tiheda lümfotsüütide ringiga, mis loob reaalsed tingimused immuunprotsesside käivitamiseks.
Ig klassid. Sõltuvalt H-ahelate struktuurist on tuvastatud viis erinevat antikehade klassi (isotüüpi) - Ig A, Ig D, Ig E, Ig G ja Ig M.
Erinevad immunoglobuliinide klassid erinevad üksteisest bioloogiliste omaduste poolest. Esiteks viitab see nende võimele siduda homoloogseid antigeene. Selles reaktsioonis hõlmavad IgD ja IgE monomeerid kahte antigeeni siduvat saiti (aktiivset keskust), mis määravad kindlaks antikehade kahevalentsuse. Sel juhul seondub iga aktiivne keskus ühe polüvalentse antigeeni epitoobiga, moodustades võrgustiku struktuuri, mis sadestub. Lisaks kahevalentsetele antikehadele on olemas monovalentsed antikehad, milles toimib ainult üks kahest aktiivsest keskusest, mis on võimelised seonduma ainult ühe antigeense determinandiga, ilma et tekiks sellele järgnev immuunkomplekside võrgustik. Selliseid antikehi nimetatakse mittetäielikeks, need tuvastatakse vereseerumis Coombsi reaktsiooni abil.
1. IgG – domineeriv antikehade klass, toodetakse suures koguses immuunvastuse (sekundaarse) reaktsiooni käigus ning kaitseb kudesid bakterite, viiruste ja toksiinide eest. Ig G suurendab fagotsütoosi opsoniseerimise kaudu. Kõigist igidest
ainult IgG suudab läbida platsentaarbarjääri.
G-klassi immunoglobuliinid (Ig G) moodustavad ligikaudu 80% seerumi immunoglobuliinidest (keskmiselt 12 g/l), molekulmassiga 160 000 ja settimiskiirusega 7S. Need moodustuvad esmase immuunvastuse kõrgusel ja taastutvustamist antigeen (sekundaarne reaktsioon).
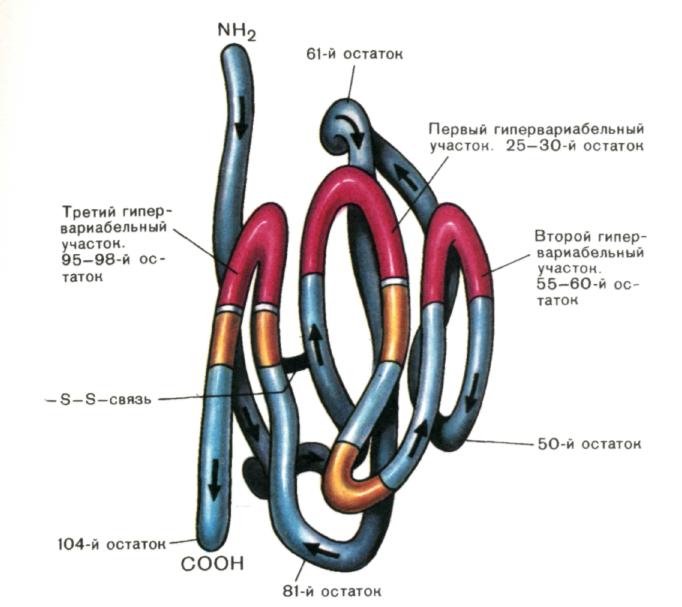
Riis. 3. Inimese IgG1 (müeloomi valk) H-ahela V-domeeni ruumiline korraldus Uus).
V-domeeni ruumiline korraldus tehti kindlaks röntgendifraktsioonianalüüsiga. V-domeeni moodustava polüpeptiidi pakkimine gloobulisse toimub nii, et hüpervarieeruvad piirkonnad on "välise" NH2-otsa küljelt üksteise vahetus läheduses. Kollased segmendid on ahela lõigud, mis puutuvad kokku VL domeeniga aktiivse tsentri antigeeni siduva piirkonna moodustumise ajal.
Ig G-l on üsna kõrge aviidsus, st suhteliselt kõrge seondumismäär antigeeniga, eriti bakteriaalse iseloomuga. Kui Ig G aktiivsed keskused seonduvad antigeeni epitoopidega selle Fc fragmendi piirkonnas, paljastatakse komplemendisüsteemi esimese fraktsiooni fikseerimise eest vastutav sait, millele järgneb komplemendi süsteemi aktiveerimine mööda klassikalist rada. See määrab Ig G võime osaleda bakteriolüüsi kaitsereaktsioonides. Ig G on ainus antikehade klass, mis läbib platsentat lootele. Mõni aeg pärast lapse sündi selle sisaldus vereseerumis langeb ja saavutab minimaalse kontsentratsiooni 3-4 kuuga, pärast mida hakkab see oma Ig G kogunemise tõttu suurenema, saavutades normi 7 aastaga. Kõigist organismis leiduvatest Ig klassidest sünteesitakse kõige rohkem Ig G. Umbes 48% Ig G-st leidub koevedelikus, millesse see verest difundeerub. Ig G, nagu ka teiste klasside Ig, läbib kataboolse lagunemise, mis toimub maksas, makrofaagides ja põletikulises fookuses proteinaaside toimel.
2. IgM - pentameer, viis subühikut on omavahel seotud disulfiidsidemetega. Üksik J-ahel, mis on disulfiidseotud raskete ahelatega, käivitab pentameeri kokkupaneku. Ig M on esimene antikehade klass, mida toodavad B-rakud Ag esmasel kehasse neelamisel. Suur Ig M molekul aktiveerib kergesti komplemendi ja toimib fagotsütoosi ajal opsoniinina. Paljud gramnegatiivsete bakterite vastased antikehad on Ig M.
M-klassi immunoglobuliinid (Ig M) sünteesitakse esimestena loote kehas ja ilmuvad esimesena vereseerumis pärast inimeste immuniseerimist enamiku antigeenidega. Need moodustavad ligikaudu 13% seerumi immunoglobuliinidest keskmise kontsentratsiooniga 1 g/l. Molekulmassi poolest ületavad nad oluliselt kõiki teisi immunoglobuliinide klasse See on tingitud asjaolust, et Ig M on pentameerid, st koosnevad 5 subühikust, millest igaühe molekulmass on Ig G-le lähedane. Enamiku normaalsete antikehade vastu on isohemaglutiniinid, mis esinevad vereseerumis vastavalt inimese kuuluvusele teatud veregruppidesse. Need Ig M allotüüpsed variandid mängivad vereülekandes olulist rolli. Nad ei läbi platsentat ja neil on kõrgeim aviidsus. In vitro koostoimel antigeenidega põhjustavad nad nende aglutinatsiooni, sadenemist või komplemendi sidumist. Viimasel juhul viib komplemendisüsteemi aktiveerimine korpuskulaarsete antigeenide lüüsini.
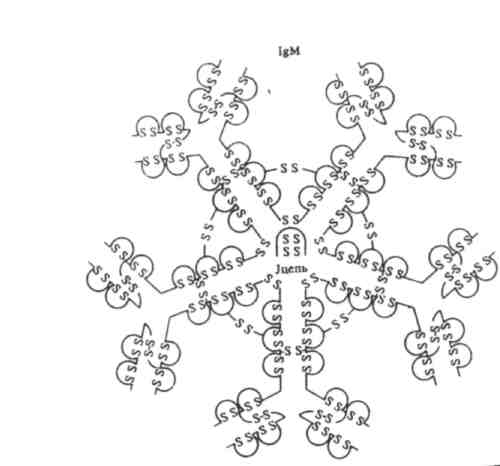
Riis. 4. Immunoglobuliini M pentameeri struktuur.
3. Ig A - peamine antikehade klass saladustes (sülg, pisarad, piim). See vabaneb limaskestade pinnale, kus see interakteerub Ag-ga. Seetõttu osaleb Ig A keha kaitsefunktsioonis, tugevdades barjääri limaskestal seedetrakt, hingamisteede, suguelundite ja kuseteede. Saladuse koostises olev Ig A molekul on dimeer, mis sisaldab ühte, J-ahelat ja täiendavat polüpeptiidahelat, mida nimetatakse sekretoorseks komponendiks. Seda komponenti sünteesib epiteelirakk, mille pinnalt vabaneb dimeer. Tõenäoliselt ei osale sekretoorne komponent mitte ainult Ig A molekulide sidumises ja nende intratsellulaarses transpordis, vaid ka Ig A molekuli kaitsmises seedimise eest. proteolüütilised ensüümid saladusi.
A-klassi immunoglobuliine (Ig A) leidub vereseerumis ja limaskestade pinnal olevas sekretsioonis. Seerum sisaldab Ig A monomeere settimiskonstandiga 7S kontsentratsioonis 2,5 g/l. See tase saavutatakse 10-aastaselt. Seerumi Ig A sünteesitakse põrna plasmarakkudes. lümfisõlmed ja limaskestad. Nad ei aglutineeri ega sadesta antigeene, ei ole võimelised aktiveerima komplementi klassikalisel viisil ega lüüsi seetõttu antigeene.
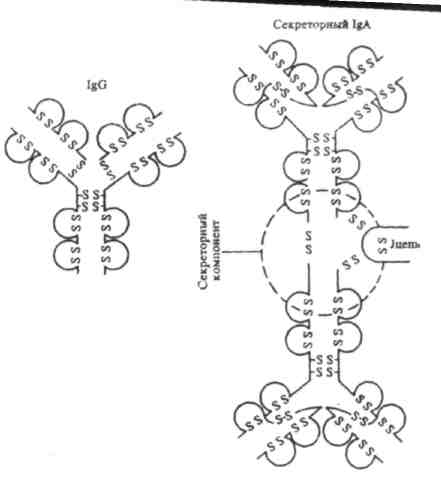
Joonis 5. Immunoglobuliini Ig A struktuur (sekretoorne) - dimeer. Võrdluseks IgG immunoglobuliini struktuur.
Ig A /S Ig A / klassi sekretoorsed immunoglobuliinid erinevad seerumi omadest 2 või 3 immunoglobuliini A monomeeriga seotud sekretoorse komponendi olemasolu poolest. Sekretoorseks komponendiks on (β-globuliin molekulmassiga 71000 D. See on sünteesitakse sekretoorse rindkere epiteeli poolt ja võivad toimida nende retseptorina ning ühinevad IgA-ga, kui viimane läbib epiteelirakke.
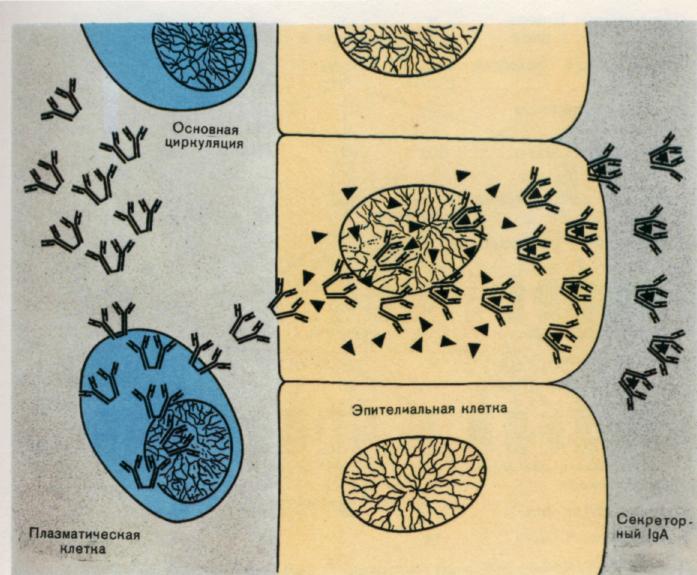
Riis. 6. Sekretoorse Ig A süntees ja transport.
Ig A ringleb tavaliselt monomeerses (7S) või dimeerses (9S) vormis; on ka suuremaid kooslusi - tri- ja tetrameerid. Ig A. on immunoglobuliinide peamine esindaja kehasaladuses (sülg, soolesekret, pisarad, ternespiim). Tungides epiteelirakkudesse, moodustab Ig A kompleksi "sekretsioonifaktoriga", mis ilmselt kaitseb seda hüdrolüütiliste ensüümide toime eest ja aitab siseneda subepiteliaalsesse ruumi. Kuigi Ig A ei seo komplementi ega oma seetõttu bakteritsiidset toimet, mängib see ilmselgelt olulist rolli bakteriaalsete toksiinide neutraliseerimisel ja viiruste lokaliseerimisel, takistades nende tungimist organismi.
Sekretoorne IgA mängib olulist rolli kohalikus immuunsuses, kuna see takistab mikroorganismide kleepumist suu, soolte, hingamisteede ja limaskestade epiteelirakkudele. kuseteede. Samal ajal aktiveerib SIgÀ agregeeritud kujul komplemendi alternatiivse raja kaudu, mis viib kohaliku fagotsüütilise kaitse stimuleerimiseni. Sekretoorne Ig takistab viiruste adsorptsiooni ja paljunemist limaskesta epiteelirakkudes, näiteks kui adenoviiruse infektsioon, poliomüeliit, leetrid. Umbes 40% kogu Ig-st leidub veres.
4. Ig E interakteerub spetsiifiliselt nuumrakkude ja basofiilsete leukotsüütidega. Need rakud sisaldavad graanulites kontsentreeritud bioloogiliselt aktiivseid amiine. Nende ainete vabanemine rakust (degranulatsioon) põhjustab veenide valendiku järsu laienemise ja nende seinte läbilaskvuse suurenemise. Sarnast pilti võib täheldada allergiliste reaktsioonide korral. E-klassi immunoglobuliinid (IgE). Tavaliselt sisaldub veres kontsentratsioonis 0,00025 g / l. Seda sünteesivad plasmarakud bronhide ja kõhukelme lümfisõlmedes, limaskestades seedetrakti kiirusega 0,02 mg/kg kehakaalu kohta päevas. E-klassi immunoglobuliine nimetatakse ka reagiindeks, kuna nad osalevad anafülaktilistes reaktsioonides, millel on väljendunud tsütofiilsus.
5. Ig D. Selle bioloogiline olemus ei ole kindlaks tehtud, see esineb seerumis äärmiselt madalates kontsentratsioonides, ilmub arenevate B-lümfotsüütide pinnale.
D-klassi immunoglobuliinid (IgD). Kuni 75% IgD-st sisaldub veres, saavutades kontsentratsiooni 0,03 g / l. Selle molekulmass on 160 000 ja settimiskiirus umbes 7S. IgD ei läbi platsentat ega seo komplementi. Siiani on ebaselge, milliseid funktsioone see täidab. Arvatakse, et see on üks B-lümfotsüütide prekursorite retseptoreid.
LOENG 5
Antikehade struktuur ja omadused
1 Antikehade molekulaarne struktuur
2 Antikehade füüsikalis-keemilised omadused
3 Immunoglobuliinide antigeensed omadused, allotüüpide, idiotüüpide ja isotüüpide mõiste.
Esimese spetsiifilise antikeha avastasid Bering ja Kitazato aastal 1890. Samal ajal ei saanud avastatud teetanuse antitoksiini olemuse kohta midagi kindlat öelda, välja arvatud selle spetsiifilisus ja esinemine immuunse looma seerumis. Immuniseeritud loomadelt saadud vereseerumi (1937) elektroforeesi käigus täheldati gammaglobuliini fraktsiooni olulist suurenemist. Sellise seerumi adsorptsioon immuniseerimiseks kasutatud antigeeni poolt vähendab selle fraktsiooni valgusisaldust tervetele loomadele iseloomuliku tasemeni.
Immunoglobuliinide struktuuri ja funktsiooni analüüsimisel tuleks eristada kahte mõistet: heterogeensus ja varieeruvus.
Heterogeensus määrab immunoglobuliinide omadused tänu molekuli konstantsele (C) osale, s.o. need struktuuriomadused, mis võimaldavad jagada kogu nende valkude rühma klassideks, alamklassideks, allotüüpideks ja kergete ahelate tüüpideks. Heterogeensus hõlmab ka erinevusi funktsionaalne aktiivsus erinevat klassi immunoglobuliinid, välja arvatud nende omadused spetsiifiliseks interaktsiooniks antigeeniga.
Muutlikkus on samasse klassi või alamklassi kuuluvate immunoglobuliinide individuaalne omadus. See väljendub spetsiifilises antigeeni siduvas aktiivsuses ja on tingitud aminohappejääkide järjestusest molekuli N-terminaalses osas, mis on valguti erinev. Immunoglobuliinide kaks omadust - heterogeensus ja varieeruvus - määravad selle valgumolekulide rühma funktsionaalse dualismi.
Igal immunoglobuliini molekulil on aktiivne (antigeeni siduv) keskus (paratoop) ja sait, mis ei ole seotud antikehade peamise antigeeni äratundva omadusega, vaid täidab efektorfüsioloogilisi funktsioone. Kaks immunoglobuliini molekuli, mis tunnevad ära sama antigeeni, võivad omada erinevat füsioloogilist aktiivsust. Samal ajal võivad erinevate antigeenide suhtes spetsiifilised immunoglobuliinid olla füsioloogiliselt identsed.
Antikehad võivad neutraliseerida bakterite toksiine ja viiruseid (antitoksiinid ja viirust neutraliseerivad antikehad), sadestada lahustuvaid antigeene (pretsipitiinid), kleepida kokku korpuskulaarseid antigeene (aglutiniinid), suurendada leukotsüütide fagotsüütilist aktiivsust (opsoniinid), siduda antigeene ilma nähtavaid reaktsioone põhjustamata (blokeerimine). antikehad) koos komplemendiga, mis lüüsib baktereid ja teisi rakke, nagu punased verelibled (lüsiinid).
Antikehade molekulaarne struktuur
Imetajatel on teada viis immunoglobuliinide klassi: IgM, IgG, IgA, IgE ja IgD, millel on ühine struktuuriplaan, kuid mis erinevad raskete (H) ahelate struktuursete tunnuste poolest.
Esimese sammu immunoglobuliinide struktuuri mõistmise suunas tegi inglise teadlane R. Porter 1959. aastal. Ta näitas, et küüliku IgG-klassi antikehade töötlemine ensüümiga. papaiin jagab molekuli muuliga kaheks põhifragmendiks. massidega 45 kD ja 50 kD. Üks neist fragmentidest säilitas võime antigeeni siduda ja seetõttu nimetati seda Fab fragmendiks (ingliskeelsest sõnast "antigen bound"). Teine fragment ei interakteerunud antigeeniga. See oli kergesti kristalliseeritav, mis oli aluseks selle nimetamisel Fc fragmendiks (inglise keelest "ciystallizable"). Kvantitatiivses mõttes on Fab fragmente kaks korda rohkem kui Fc fragmente. Oli loomulik eeldada, et IgG molekulil on kaks piirkonda, mis interakteeruvad antigeeniga, ja üks piirkond on antigeenselt inertne. Selgus, et papaiin hävitab immunoglobuliini hingepiirkonnas, ahelatevahelised disulfiidsidemed, mis viib kahe identse ja ühe erineva sektsiooni moodustumiseni (joonis).
Tööl pepsiiniga eraldati üks kahevalentne antigeeni siduv fragment. Fc fragmendile vastav IgG molekuli osa hävib täielikult. Kahevalentse immunoglobuliini fragmendi saamine, mis saadakse pepsiini toimel hingepiirkonna distaalses otsas. Selle tulemusena jääb molekuli N-otsa pool puutumatuks. Sellist kahevalentset fragmenti nimetatakse F(ab)2-ks.
merkaptoetanool
Riis. AT struktuuri määramine proteolüütiliste ensüümide abil
Edelmani uuringud, mis viidi läbi merkaptoetanooli ja mitmete teiste ahelatevahelisi ahelaid hävitavate ühendite abil -S-S- lingid, näitas immunoglobuliini molekulis kahe raske (H) ahela olemasolu mol. igaüks neist kaalub umbes 50 kD ja kaks kopsu (L) koos mooliga. kaaluga 25 kD.
Et saada teavet antikehade struktuuri ja spetsiifilisuse molekulaarse aluse kohta, oli vaja märkimisväärsel hulgal täiesti identseid immunoglobuliine. Uuringud normaalsete doonorite seerumi antikehadega ei andnud sellist võimalust, kuna sellised antikehad, mis on mitmete rakukloonide derivaadid, võivad antigeeni siduva keskuse peenspetsiifilisuse poolest erineda ja lisaks kuuluda erinevatesse immunoglobuliinide klassidesse. Vaja oli eksperimentaalset mudelit, mis võimaldaks töötada immunoglobuliinidega, mida toodab üks rakukloon ja mis seega esindavad täiesti identseid molekule. Selline mudel on müeloomiga patsientide pahaloomuliselt transformeeritud plasmarakud.
Erinevate müeloomivalkude täieliku aminohappejärjestuse uurimine paljastas immunoglobuliinide struktuuri põhijooned. Iseloomustab erinevate klasside immunoglobuliine üldplaneering hooned.

Joonisel on kujutatud IgG organisatsiooni skeem.
See immunoglobuliin sisaldab kahte rasket (H) ahelat ja kahte kerget (L) ahelat, mis on kovalentsete ahelatevaheliste disulfiidsidemete (-S-S-) kaudu ühendatud neljaahelaliseks molekuliks.
Iga ahel sisaldab varieeruvat piirkonda (V- ja H-ahelate puhul vastavalt VL ja V H), millest sõltub immunoglobuliinide kui antikehade spetsiifilisus, ja konstanti (C), mis on jagatud homoloogseteks piirkondadeks: C n 1, C n 2 , C n 3. L-ahelal on üks konstantne piirkond (C 1). CH1 ja CH2 vahel on niinimetatud hingepiirkond, mis on rikastatud proliinijääkidega. Suurenenud proliini sisaldus selles piirkonnas tagab molekuli konformatsioonilise paindlikkuse, mis on vajalik paremaks interaktsiooniks antigeensete determinantidega, mis on rakupinnal rohkem väljendunud.
Esimest korda 1969. aastal, isegi enne röntgenkiirte struktuuriandmete saamist, pakkus J. Edelman välja, et iga homoloogne piirkond on organiseeritud suletud sfääriks - Kodun pooltsüsteiini jääkidest moodustunud ahelasiseste disulfiidsidemete tõttu. Disulfiidside seob umbes 60 aminohapet. Ligikaudu 20 aminohapet, mis ei sisaldu saidi suletud osas, toimivad koostoimes naaberdomeenidega.
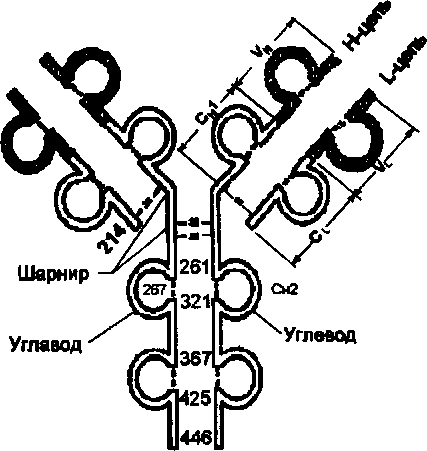
Riis. Immunoglobuliinide domeenikorralduse põhimõte.
Numbrid näitavad polüpeptiidide aminohappejääkide järjestust.
Röntgendifraktsioonianalüüs kinnitas üldpõhimõte immunoglobuliinide polüpeptiidahelate domeenikorraldus ja paljastas struktuuri peened üksikasjad.
Inimese IgG ruumilises korralduses moodustavad rasked ja kerged ahelad üksteisega interakteerudes kolmest osast koosneva tihedalt pakitud struktuuri: kaks Fab fragmenti ja üks Fc fragment.
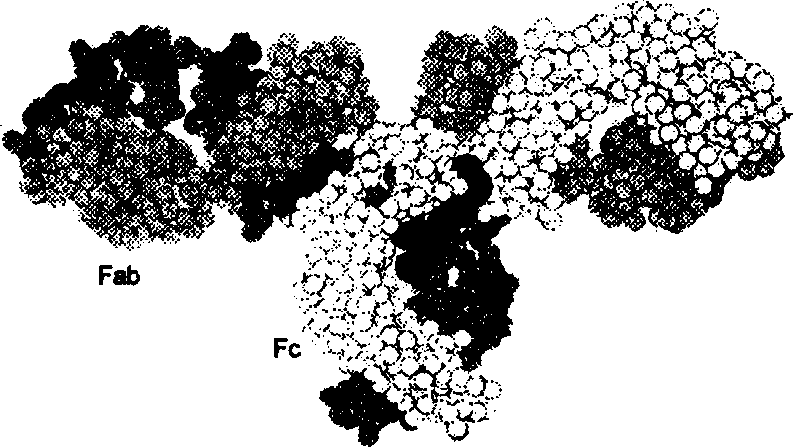
Riis. 2.7. Inimese IgG kolmemõõtmeline struktuur.
Hele- ja tumehallid kujutised esindavad raskeid ahelaid; helehall - valgusketid; must - süsivesikud
IMMUNOGLOBULIINIDE MUUTUVUS
Antigeeni siduv sait ehk antikehade aktiivne keskus moodustub VH- ja VL-domeenide interaktsioonil. Muutused nende domeenide aminohappejääkide järjestuses valgust valguks määravad antikehade tegeliku muutuva spetsiifilisuse.
Immunoglobuliinide V-domeenide klassifikatsioon
Kõik V-domeenid on jagatud kolme põhirühma: vastavalt κ- ja λ-tüüpi kergete ahelate jaoks ning VH - raskete ahelate jaoks. Igasse rühma kuulub omakorda mitu alarühma: Vκ - kolm, Vλ - viis ja V H - neli. Ühe alarühma valkudes on ligikaudu 75% identsed jäägid, samas kui erinevate alarühmade valgud on identsed vaid 50% positsioonidest. Kõigi nelja V H alarühma üksikvariantide arv on üle 30 000, Vκ- üle 1000.
V-domeenide aminohappejääkide üldises lineaarses järjestuses on konservatiivsed positsioonid, kus mõne aminohappe asendused teistega on ebaolulised või puuduvad, ja sagedaste asendustega positsioonid. Neid viimaseid nimetatakse hüpervariavalge krundid.
Hüpervarieeruvate positsioonide arv suhteliselt muutumatute positsioonide arvu suhtes on ebaoluline ja moodustab ainult 15-20% V-domeeni aminohappejääkide koguarvust.
Antigeeni siduva saidi ruumiline korraldus
V-domeenide "morfoloogia" selgitati välja kristalliseerunud valkude röntgendifraktsioonanalüüsi meetodil.
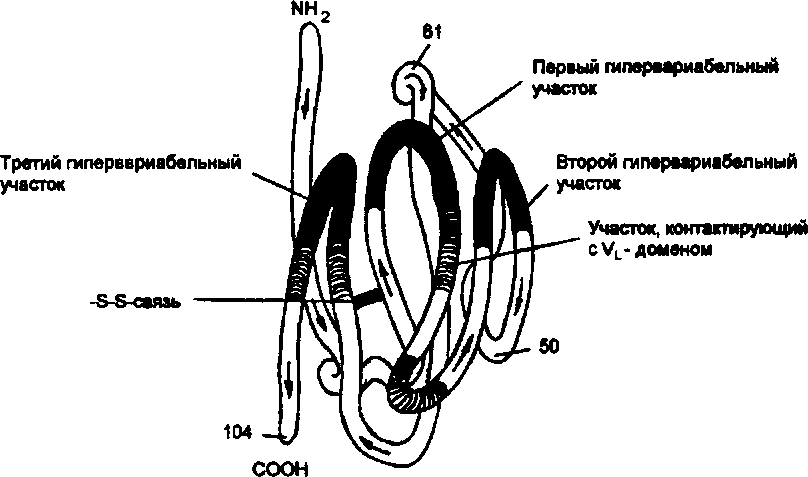
Riis. Inimese IgG (müeloomivalgu) raske ahela V-domeeni hüpervarieeruvate piirkondade ruumiline seos.
V domeeni konformatsiooniline tunnus on see, et kõik hüpervarieeruvad piirkonnad on tertsiaarse struktuuri moodustumise tulemusena (joonisel mustad alad) üksteise vahetus läheduses. Raam (invariantsed) sektsioonid interakteeruvad VL - domeeni vastavate osadega antigeeni siduva keskuse moodustumise ajal (joonisel varjutatud alad)
IMMUNOGLOBULIINIDE HETEROGEENSUS
Immunoglobuliinide kuulumine ühte või teise klassi ja alamklassi sõltub H-ahela konstantse (C) piirkonna struktuuri iseloomulikest tunnustest (aminohappejääkide arv ja järjestus, molekulmass, domeenide arv ja ahelatevahelised disulfiidsildad). , oligosahhariidide sidumine ja muud omadused). 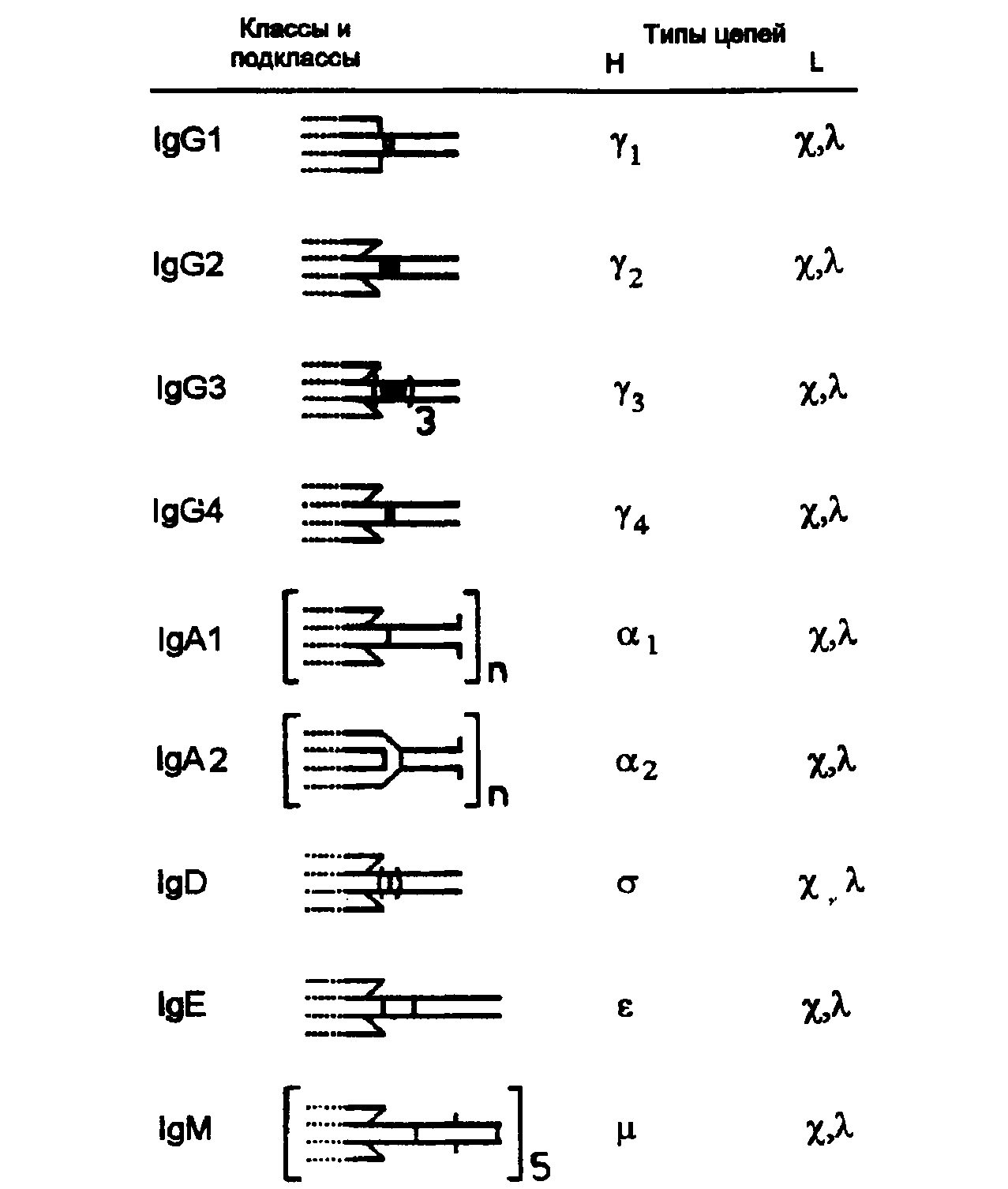
Inimese immunoglobuliinide füüsikalis-keemilised ja bioloogilised põhiomadused
|
Kinnisvara |
IgM |
IgG |
IgA |
IgD |
IgE |
|
Molekulaarvalem |
pentamer |
monomeer |
monomeer, dimeer |
monomeer |
monomeer |
|
Nimetused: | |||||
|
H-ketid | |||||
|
L-ketid | |||||
|
Molekulaarvalem | |||||
|
Täiendavad ketid |
J-kett |
J-ahel, sekretoorne komponent | |||
|
Alamklassid |
IgG 1, IgG2, IgG3, IgG 4 |
IgA1, IgA2 | |||
|
Domeenide arv |
5 |
4 |
4 |
4 |
5 |
|
Molekulmass |
950 000 |
150 000 |
160 000 |
175 000 |
190 000 |
|
Antikeha valents | |||||
|
Seerumikontsentratsioon (mg/100 ml) |
125±50 |
1250±300 |
210±50 |
4 |
0,03 |
|
Protsent kogusummast |
5-10 |
75-85 |
7-15 |
0,3 |
0,003 |
|
Poolväärtusaeg (päevades) |
5,1 |
23 |
5,8 |
2,8 |
2,5 |
|
Sünteesi kiirus (mg/kg päevas) |
6,7 |
33 |
24 |
0,4 |
0,016 |
|
Aglutineeriv aktiivsus |
100 |
1 |
- |
- |
- |
|
Komplemendi fikseerimine |
+ |
+ |
- |
- |
- |
|
Muud bioloogilised omadused |
primaarne immuunvastus, reumatoidfaktor |
sekundaarne immuunvastus; kandumine läbi platsenta |
iseloomulikud antikehad saladuses |
lümfotsüütide peamine pinnamolekul |
anafülaksia; allergia |
Antigeenne struktuur Nagu kõik valgud, on ka immunoglobuliinid antigeenid ja toodetakse nendega seoses. antiimmunoglobuliinid st - antikehade vastased antikehad.
Immunoglobuliini molekulides on kolme tüüpi determinante:
isotoop,
allotüüpne
ja idiootne.
Isotüüpsed ja allotüüpsed determinandid lokaliseeritud immunoglobuliinide C-piirkondades ja spetsiifilised teatud tüüpi H- ja L-ahelatele.Immunoglobuliinide eristumine klassideks ja alamklassideks oleneb raskete ahelate struktuuri erinevusest. On teada 9 isotüüpi, mida iseloomustavad rasked ahelad γl, γ 2, γ W jaγ 4 , μ, α1 ja α2, σ, ε.
Erinevate immunoglobuliinide klasside isotüüpsed determinandid (isotüüp) on identsed teatud liigi kõigi isendite puhul;
Allotüüpsed determinandid (allotüüp) – kodeeritud alleelgeenide poolt ja mõnel indiviidil on see olemas, teistel aga mitte.
Idiotüüpsed determinandid (idiotüüp) paiknevad antigeeni siduvates keskustes ja on sageli seotud immunoglobuliinide hüpervarieeruvate piirkondadega. Idiotüüp - antigeeni siduva keskuse struktuursed tunnused, mis määravad antikeha spetsiifilisuse. Antikehi, mis kuuluvad samasse isotüüpi, kuid toodetakse erinevate antigeenide jaoks, nimetatakse idiotüübiks.
Idiotüüpsed determinandid Teatud antikehade antigeeni siduvate saitide struktuurile ainulaadne, leidub teatud populatsiooni indiviididel ja tuvastatakse anti-idiotüüpsete antikehade abil.
Immuniseerides loomi teatud idiotüübiga antikehadega, on võimalik saada antikehi, mis reageerivad spetsiifiliselt selle idiotüübiga (anti-idiotüüpsed Ab-d) ja antiidiotüüpsete Ab-de antigeeni siduvad piirkonnad peegeldavad tegelikult selle antigeense determinandi struktuuri, millel on põhjustati kindlaksmääratud idiotüübiga antikehade süntees.
IS toimib arenenud ja stabiilse idiotüüp-anti-idiotüübi võrgustikuna. Antiidiotüüpsed antikehad mängivad immuunvastuse reguleerimisel olulist rolli.
Antitelamiinid on seerumivalgud, mis moodustuvad vastusena antigeeni toimele. Need kuuluvad seerumi globuliinide hulka, seetõttu nimetatakse neid immunoglobuliinideks (Ig). Nende kaudu realiseeritakse humoraalset tüüpi immuunvastus.
Antikehadel on kaks omadust:
Spetsiifilisus, st võime interakteeruda antigeeniga, mis on sarnane sellega, mis indutseeris (põhjustanud) nende moodustumise;
Heterogeensus füüsikalise ja keemilise struktuuri, spetsiifilisuse, hariduse geneetilise determinismi (päritolu järgi).
Kõik immunoglobuliinid on immuunsed, see tähendab, et need moodustuvad immuniseerimise, kokkupuutel antigeenidega. Päritolu järgi jagunevad need siiski järgmisteks osadeks:
Tavalised (anamnestilised) antikehad, mis leitakse koduse immuniseerimise tulemusena mis tahes organismist;
Nakkuslikud antikehad, mis kogunevad kehas ajal nakkushaigus;
Infektsioonijärgsed antikehad, mis leitakse kehas pärast kannatusi nakkushaigus;
Vaktsineerimisjärgsed antikehad, mis tekivad pärast kunstlikku immuniseerimist.
Antikehad (immunoglobuliinid) on alati spetsiifilised selle antigeeni suhtes, mis nende moodustumist esile kutsus. Sellegipoolest jagunevad antimikroobsed immunoglobuliinid spetsiifilisuse järgi samadesse rühmadesse kui vastavad mikroobsed antigeenid:
rühmaspetsiifiline;
Liigispetsiifiline;
Optsioonipõhine;
Ristreageerimine.
Praegu saadakse ühe rakuklooni poolt toodetud immunoglobuliine üsna sageli biotehnoloogia ja/või geenitehnoloogia meetoditega. Neid nimetatakse monoklonaalseteks antikehadeks. Nende tootjad on hübridoomirakud, mis on B-lümfotsüüdi (plasmaraku) ristamisel kasvajarakuga saadud järglased. Plasma rakult pärib hübridoom võime sünteesida antikehi ja kasvajarakult võime kultiveerida pikka aega väljaspool keha.
Lisaks spetsiifilisusele on immunoglobuliinide üheks peamiseks omaduseks nende heterogeensus, st immunoglobuliinide populatsiooni heterogeensus nende tekke geneetilise determinismi ja füüsikalis-keemilise struktuuri poolest.
Teema: Immunoglobuliinid
1. Immunoglobuliinide struktuur (immunoglobuliini G molekuli näitel)
Vastavalt oma keemilisele struktuurile on immunoglobuliinid glükoproteiinid.
Füüsikalis-keemiliste ja antigeensete omaduste järgi jagunevad immunoglobuliinid klassidesse: G, M, A, E, D.
Immunoglobuliini G molekul koosneb kahest raskest (H-ahelast) ja kahest kergest polüpeptiidahelast (L-ahelast). Iga polüpeptiidahel koosneb muutuvatest (V), stabiilsetest (konstant, C) ja nn liigendosadest. Erinevate klasside immunoglobuliinide rasked ahelad on üles ehitatud erinevatest polüpeptiididest (vastavalt gamma, mu, alfa, delta, epsilon) ja on seetõttu erinevad antigeenid. Need on immunoglobuliinide isotüüpsed erinevused. Erinevate klasside immunoglobuliinide kerged ahelad on esindatud kahte tüüpi polüpeptiididega - kappa ja lambda.
Muutuvad piirkonnad on palju lühemad kui konstantsed piirkonnad. Iga kergete ja raskete polüpeptiidahelate paar C-osades, samuti rasked ahelad on omavahel ühendatud disulfiidsildadega. Ei rasketel ega kergetel ahelatel ei ole antikehade omadusi (koostoime hapteenidega). Papaiiniga hüdrolüüsil laguneb immunoglobuliini G molekul 3 fragmendiks – 2 Fab fragmendiks ja Fc fragmendiks. Viimane on raskete ahelate jäägid, nende konstantsed osad. Sellel ei ole antikeha omadust (ei interakteeru antigeeniga), kuid tal on afiinsus komplemendi suhtes, see on võimeline seda fikseerima ja aktiveerima. Sellega seoses nimetatakse seda fragmenti Fc fragmendiks (komplemendi fragment). Sama Fc fragment tagab immunoglobuliinide G läbimise läbi hematoentsefaal- või platsentaarbarjääri.
Ülejäänud kaks immunoglobuliini G fragmenti on raske ja kerge ahela jäägid koos nende muutuvate osadega. Need on üksteisega identsed ja neil on antikehade omadus (interakteeruvad antigeeniga), seoses sellega nimetatakse neid fragmente Fab-ks (antikeha fragment).
Kuna ei rasketel ega kergetel ahelatel ei ole antikeha omadusi, kuid see tuvastatakse Fab fragmentides, on ilmne, et antigeeniga interaktsiooni eest vastutavad raskete ja kergete ahelate varieeruvad osad. Need moodustavad ainulaadse struktuuri ja ruumilise organisatsiooni struktuuri - antikeha aktiivse keskuse. Iga immunoglobuliini aktiivne keskus vastab vastava antigeeni determinantrühmale kui „luku võti”.
Immunoglobuliini G molekulil on 2 aktiivset keskust. Kuna sama klassi, kuid erineva spetsiifilisusega immunoglobuliinide aktiivsete tsentrite struktuur ei ole sama, on need molekulid (sama klassi, kuid erineva spetsiifilisusega antikehad) erinevad antikehad. Neid erinevusi nimetatakse idiotüüpseteks immunoglobuliinide erinevusteks või idiotüüpideks.
Teiste klasside immunoglobuliinide molekulid on üles ehitatud samal põhimõttel nagu Ig G, st kahe raske ja kahe kerge ahelaga monomeeridest, kuid klassi M immunoglobuliinid on pentameerid (mis on valmistatud 5 sellisest monomeerist) ja A-klassi immunoglobuliinid on dimeer- või tetrameer.
Monomeeride arv, mis moodustavad teatud immunoglobuliini klassi molekuli, määrab selle molekulmassi. Kõige raskemad on Ig M, kergemad Ig G, mille tulemusena läbivad nad platsentat. Samuti on ilmne, et erinevate klasside immunoglobuliinidel on erinev arv aktiivseid keskusi: Ig G-l on neid 2 ja Ig M-l 10. Sellega seoses on nad võimelised siduma erineva arvu antigeenimolekule ja selle kiirust. sidumine on erinev. Immunoglobuliinide antigeeniga seondumise kiirus on nende aviidsus. Selle ühenduse tugevust nimetatakse afiinsuseks. Ig M on väga innukas, kuid madala afiinsusega, Ig G, vastupidi, on madala innuga, kuid kõrge afiinsusega.
Kui antikehamolekulis toimib ainult üks aktiivne tsenter, võib see seostuda ainult ühe antigeense determinandiga, ilma et tekiks sellele järgnev antigeen-antikeha komplekside võrgustik. Selliseid antikehi nimetatakse mittetäielikeks. Need ei anna silmale nähtavaid reaktsioone, kuid pärsivad antigeeni reaktsiooni täielike antikehadega. Mittetäielikud antikehad mängivad olulist rolli Rh-konflikti tekkes, autoimmuunhaigused(kollagenoosid) ja teised ning tuvastatakse Coombsi reaktsiooni (antiglobuliini test) abil.
2. Erinevate klasside immunoglobuliinide kaitsev roll
Erinevate klasside immunoglobuliinide kaitsev roll ei ole samuti sama.
E-klassi immunoglobuliinid (reaginid) realiseerivad vahetut tüüpi allergiliste reaktsioonide (vahetut tüüpi ülitundlikkuse - HNT) arengu. Organismi sisenevad allergeenid (antigeenid) kinnituvad kudedes fikseeritud reagiinide Fab-fragmentidele (Fc fragment on seotud koe basofiili retseptoritega), mis viib bioloogiliselt toimeaineid provotseerib allergiliste reaktsioonide arengut. Allergiliste reaktsioonide korral kahjustatakse koe basofiile antigeeni-antikeha kompleksi toimel ja vabanevad graanulid, mis sisaldavad histamiini ja teisi bioloogiliselt aktiivseid aineid.
A-klassi immunoglobuliinid võivad olla:
Seerum (sünteesitakse põrna, lümfisõlmede plasmarakkudes, on monomeerse ja dimeerse molekulaarstruktuuriga ning moodustab 80% seerumis sisalduvast Ig A-st);
Sekretoorne (sünteesitakse limaskestade lümfielementides).
Viimaseid eristab sekretoorse komponendi (beeta-globuliini) olemasolu, mis kinnitub limaskesta epiteelirakke läbides immunoglobuliini molekuli a külge.
Sekretoorsed immunoglobuliinid mängivad olulist rolli kohalikus immuunsuses, takistades mikroorganismide adhesiooni limaskestadele, stimuleerivad fagotsütoosi ja aktiveerivad komplemendi ning võivad tungida süljesse ja ternespiima.
M-klassi immunoglobuliinid on esimesed, mis sünteesitakse vastusena antigeensele stimulatsioonile. Nad suudavad ühendada suur hulk antigeenid ja mängivad olulist rolli antibakteriaalse ja antitoksilise immuunsuse kujunemisel.
Enamik seerumi antikehi on klassi G immunoglobuliinid, mis moodustavad kuni 80% kõigist immunoglobuliinidest. Need moodustuvad primaarse ja sekundaarse immuunvastuse kõrgusel ning määravad bakterite ja viiruste vastase immuunsuse intensiivsuse. Lisaks on nad võimelised tungima läbi platsentaarbarjääri ja hematoentsefaalbarjääri.
Erinevalt teiste klasside immunoglobuliinidest sisaldavad D-klassi immunoglobuliinid N-atsetüülgalaktoosamiini ega ole võimelised komplementi fikseerima. Ig D tase suureneb hulgimüeloomi ja krooniliste põletikuliste protsesside korral.
TEEMA: Immuunseisund
Antikehade moodustumine,
immunoloogiline mälu,
immunoloogiline tolerantsus,
vahetut tüüpi ülitundlikkus,
hiline ülitundlikkus,
Immuunmakrofaagide ja lümfotsüütide immuunfagotsütoos ja tapjafunktsioon.
Eristage rakulist ja humoraalset immuunvastust.
Rakuline immuunvastus tekib T-lümfotsüütide osalusel. Efektor-T-lümfotsüüdid – T-killerid on võimelised hävitama rakke otsese tsütotoksilisuse ja lümfokiinide sünteesi kaudu, mis osalevad immunokompetentsete rakkude interaktsiooni protsessides. Immuunvastuse reguleerimises osalevad kaks T-rakkude alatüüpi – T-abistajad võimendavad immuunvastust, T-supressorid, vastupidi, pärsivad.
Humoraalse immuunvastuse üldine skeem näeb välja järgmine:
Antigeen (nakkustekitaja) fagotsüteeritakse makrofaagide poolt. Makrofaag töötleb antigeeni nii, et see omandab võime T-abistajate poolt ära tunda. Kokkupuutel võõra ainega, antigeen, makrofaag (fagotsüüt) aktiveerub ja hakkab tootma immunotsütokiine, sealhulgas IL-1. T-helpers tunneb spetsiaalse retseptori abil ära antigeeni ja vabastab IL-2 keskkonda. Selle retseptorile vastav B-rakk seondub antigeeniga.
B-lümfotsüütide aktiveerimine nõuab kolmekordne signaal: antigeenispetsiifilisest retseptorist, fagotsüüdist (IL-1) ja T-helperist (IL-2). Selle tulemusena moodustuvad rakud, mis sünteesivad antikehi. Saadud antikehad interakteeruvad antigeeniga, moodustades antigeeni-antikeha kompleksi, mis käivitab mittespetsiifilised kaitsereaktsiooni mehhanismid. Need kompleksid aktiveerivad komplemendi süsteemi.
Antikehad. Omadused antikehad.
Antikehad nimetatakse seerumiks moodustuvad valgud (kaitsvate omadustega). vastuseks antigeenile . Need kuuluvad seerumi globuliinide hulka ja seetõttu nimetatakse neid immunoglobuliinideks (Ig). Nende kaudu realiseeritakse humoraalset tüüpi immuunvastus.
Antikehade oluline omadus on nende spetsiifilisus. , need. võime interakteeruda antigeeniga, mis sarnaneb antigeeniga, mis indutseeris (põhjustanud) nende moodustumise.
Sõltuvalt antikeha ja antigeeni interaktsiooni nähtavatest ilmingutest eristatakse:
Aglutiniinid - antikehad, mis põhjustavad mikroorganismide adhesiooni;
Pretsipitiinid on antikehad, mis sadestavad antigeeni;
Antitoksiinid – eksotoksiine neutraliseerivad antikehad;
Lüsiinid - põhjustavad bakterite, spiroheetide jne lüüsi;
Opsoniinid on antikehad, mis suurendavad fagotsütoosi jne.
Päritolu järgi jagunevad antikehad järgmisteks osadeks:
normaalsed (anamnestilised) antikehad, mis leitakse koduse immuniseerimise tulemusena mis tahes organismis, need on antikehad, mille ilmumine ei ole seotud infektsiooni ega kunstliku immuniseerimisega;
nakkuslikud antikehad, mis kogunevad kehasse nakkushaiguse perioodil;
infektsioonijärgsed antikehad, mis leitakse organismis pärast nakkushaigust;
vaktsineerimisjärgsed antikehad mis tekivad pärast kunstlikku immuniseerimist.
Antikehad (immunoglobuliinid) on alati spetsiifilised selle antigeeni suhtes, mis nende moodustumist esile kutsus. Samas antimikroobsed immunoglobuliinid vastavalt oma spetsiifilisusele jagunevad nad samadesse rühmadesse kui vastavad mikroobide antigeenid.
rühmaspetsiifiline;
liigispetsiifiline;
variandispetsiifiline;
ristreaktiivne.
Praegu saadakse ühe rakuklooni poolt toodetud immunoglobuliine üsna sageli biotehnoloogia ja/või geenitehnoloogia meetoditega. Neid kutsutakse monoklonaalsed antikehad. Nende tootjad on hübridoomirakud, mis on B-lümfotsüüdi (plasmaraku) ristamisel kasvajarakuga saadud järglased. Plasma rakult pärib hübridoom võime sünteesida antikehi ja kasvajarakult võime kultiveerida pikka aega väljaspool keha.
Lisaks spetsiifilisusele on immunoglobuliinide üks peamisi omadusi nende heterogeensus, st immunoglobuliinide populatsiooni heterogeensus nende tekke geneetilise determinismi ja füüsikalis-keemilise struktuuri poolest.
Immunoglobuliinide struktuur
Vastavalt selle keemilisele struktuurile immunoglobuliinidon glükoproteiinid. Immunoglobuliinid erinevad struktuuri, antigeense koostise ja funktsioonide poolest. Immunoglobuliini molekulide struktuuri ja struktuuri määrasid teadlased Edelman ja Porter (1959)
Füüsikalis-keemiliste ja antigeensete omaduste järgi jagunevad immunoglobuliinid 5 klassi, mida tähistatakse tähtedega G, M, A, E, D.
Elektronmikroskoopiline uuring näitab, et immunoglobuliini molekulil on Y "y" kuju, mille ülemiste segmentide vaheline nurk muutub (joonis 4).
Molekul koosneb 4-st 2 tüüpi polüpeptiidahelast: rasked (Rasked) või H-ahelad molekulmassiga 50-55000 ja kerged (Light) - L-ahelad molekulmassiga 20-25000.
Rasked ketid on 2 korda pikemad kui kerged ketid ja on keskelt painutatud nagu nuiad. Kerged ahelad paiknevad y-molekuli pöörde moodustavate raskete ahelate ülemistest segmentidest väljapoole. Immunoglobuliini molekul on disulfiidsidemetega ühendatud ühtseks struktuuriks koos raskete ahelate pöördega ning H- ja ahelate vahel. L-ahelad.Mõlemad immunoglobuliini polüpeptiidahelate paarid neis olevate aminohapete järjekorras jagunevad 2 osaks: üks neist - COOH-terminal kõigi immunoglobuliini molekulide jaoks on sama aminohappejärjestusega (konstantne osa) ja teine NH 2 - terminaalne on muutuv osa, milles aminohapete paigutus muutub sõltuvalt antigeenist, mis põhjustas antikehade moodustumist.alad on suuruselt ja konfiguratsioonilt aktiivsed antikehade keskused, mis kordavad determinantrühmade ruumilist reljeefi.Iga immunoglobuliini aktiivne keskus vastab vastava antigeeni determinantide rühmale "luku võtmeks".
Antikehad on kahevalentsed (kahevalentsed). Seda on tõestatud ensüümi papaiiniga. Selle ensüümi mõjul jagunes immunoglobuliini y-molekul - 3 fragmendiks. Kaks ülemist Fab-fragmenti, mis sisaldavad kumbki ühte tsentrit, mis seovad antigeeni ja alumist konstantset Fc-fragmenti (kristalliline fragment), mis ei suuda antigeeniga interakteeruda ja esindavad konstantset COOH-terminali.
Immunoglobuliini G molekulil on 2 aktiivset keskust. Kuna sama klassi, kuid erineva spetsiifilisusega immunoglobuliinide aktiivsete tsentrite struktuur ei ole sama, on need molekulid (sama klassi, kuid erineva spetsiifilisusega antikehad) erinevad antikehad. Neid erinevusi nimetatakse idiotüüpseteks immunoglobuliinide erinevusteks või idioodid.
molekulid immunoglobuliinid teised klassid on üles ehitatud samale põhimõttele nagu Ig G, st kahe raske ja kahe kerge ahelaga monomeeridest, näiteks M-klassi immunoglobuliinid on pentameerid(ehitatud 5 sellisest monomeerist) ja A-klassi immunoglobuliinid - dimeerid või tetrameerid.
Monomeeride arv, mis moodustavad teatud immunoglobuliini klassi molekuli, määrab selle molekulmassi. Kõige raskemad on Ig M, kergemad Ig G, mille tulemusena läbivad nad platsentat. Samuti on ilmne, et erinevate klasside immunoglobuliinidel on erinev arv aktiivseid keskusi: Ig G-l on neid 2 ja Ig M-l 10. Sellega seoses on nad võimelised siduma erineva arvu antigeenimolekule ja selle kiirust. sidumine on erinev. Aktiivsete keskuste arv määrab antikehade valentsuse. Seetõttu on Ig G, Ig E, Ig D kahevalentsed, Ig M on 10 valentsed, gv Ig A on 2 või 4.
Immunoglobuliinide antigeeniga seondumise kiirus on nende aviidsus. Selle ühenduse tugevust määratletakse kui afiinsust.
afiinsus- antikeha ja antigeeni spetsiifilise interaktsiooni tugevus. See omadus oleneb ruumilisest vastavusest (komplementaarsusest), antigeeni siduva keskuse struktuurist ja antigeense määrajast. Mida kõrgem nende komplementaarsus, st mida rohkem nad omavahel kokku sobivad, seda rohkem tekib molekulidevahelisi sidemeid, seda suurem on immuunkompleksi moodustumise stabiilsus. Monoklonaalsetel antikehadel on kõrgeim afiinsus, samas kui tavalistel antikehadel on see madalaim.
Avidaalsus See termin viitab antigeeni seondumistugevusele antikehaga. Selle tunnuse määrab afiinsus ja antigeeni siduvate tsentrite arv. Võrdse afiinsusega on Ig M kõrgeim aviidsus, kuna neil on 10 antigeeni siduvat keskust.
Kui antikehamolekulis toimib ainult üks aktiivne tsenter, võib see seostuda ainult ühe antigeense determinandiga, ilma et tekiks sellele järgnev antigeen-antikeha komplekside võrgustik. Selliseid antikehi nimetatakse mittetäielik. Need ei anna silmale nähtavaid reaktsioone, kuid pärsivad antigeeni reaktsiooni täielike antikehadega. Mittetäielikud antikehad mängivad olulist rolli reesuskonflikti, autoimmuunhaiguste (kollagenooside) ja teiste tekkes ning tuvastatakse Coombsi reaktsiooni (antiglobuliini test) abil.
Immunoglobuliinide lühikirjeldus
Immunoglobuliinid G on kõige levinumad antikehad, mis moodustavad 70–80% kõigist inimese antikehadest. Molekulmass 160 000. Settimiskonstant 7s. Keskmine sisaldus inimese vereseerumis on 12 g/l. Ig G on monomeer, sellel on 2 antigeeni siduvat tsentrit – seega on see kahevalentne. Need antikehad seovad aktiivselt bakterite, viiruste, eksotoksiinide lahustuvaid antigeene. Väikese molekulmassiga läbivad nad platsentat ja mängivad olulist rolli vastsündinu kaitsmisel nakkuste eest esimese 3-4 kuu jooksul. Ig G on kõrge afiinsus võib olla mittetäielik antikeha. (joon.5)
Ig M on esimesed antikehad, mis ilmuvad antigeense stimulatsiooni ajal. Koguse järgi moodustavad need 5-15% kõigist seerumi immunoglobuliinidest. Neil on suur molekul (molekulmass 960 000). Settimiskonstant 19s. Keskmine sisaldus seerumis on 1 g/l. Pentameer, koosneb 5 subühikust, millest igaühe molekulmass on lähedane Ig G-le. See ei liigu läbi platsenta emalt lootele. Loode sünteesib emakasisese infektsiooni ajal pärast 20 rasedusnädalat.
See avaldab mõju Gram-bakteritele, aktiveerib fagotsütoosi. Ig M on kõrge agarus seob komplementi, osaleb seerumi ja sekretoorse humoraalse immuunsuse moodustamises. Lg M on mitu korda aktiivsem kui Ig G, kuna neil on 10 aktiivset keskust. Enamik isoaglutiniinidest ja normaalsetest antikehadest kuulub Ig M-le.
Ig A – eristab seerumit ja sekretoorset Ig A-d.
Vadak Ig A moodustab umbes 10-15% seerumi immunoglobuliinidest. Seerumi Ig A on monomeer, millel on 2 antigeeni siduvat keskust, st. 2-valentne. molekulaarne kaal 170 000.
Settimiskonstant on 7 s. Seerumis 2,5 g/l. Seerumi Ig A neutraliseerib vereringesse sattunud mikroobid ja nende toksiinid. Ig A on kõrge afiinsusega, võib olla mittetäielik antikeha, ei seo komplimenti, ei läbi platsentaarbarjääri.
Sekretär Ig A - toodetakse hingamisteede, suuõõne, soolte, kuseteede limaskestade lümfoidrakkude poolt. Sagedamini esineb see ditrimeeri kujul (st 4 või 6 valentsiga). Mol. kaal 350 000 ja rohkem. Settimiskonstant 13 s ja üle selle. Sisaldub ternespiimas, süljes, pisaravedelikus, soole limas, higis. Mängib olulist rolli kohalikus immuunsuses. Sekretoorne Ig A aktiveerib komplemendi ja stimuleerib fagotsüütilist vastust limaskestadel.
Ig E – esindab olulist antikehade klassi, mida nimetatakse reagiinidena. Molekulmass umbes 190 000, settimiskonstant 8s Ig E - monomeer. See moodustab umbes 0,002% kõigist ringlevatest antikehadest. Ig E sünteesitakse küpsete B-lümfotsüütide ja plasmarakkude poolt peamiselt bronhipuu ja seedetrakti lümfoidkoes. Ig E ei seo komplementi ega läbi platsentat. Sellel on väljendunud tsütofiilsus - tropism nuumrakkudele ja basofiilidele, osaleb 1. tüüpi allergiliste reaktsioonide tekkes.
Ig D - selle immunoglobuliini kohta on vähe teavet. See moodustab umbes 0,2% seerumis ringlevate immunoglobuliinide koguhulgast. Monomeer, molekulmass 160 000, settimiskonstant -7 s . Funktsioonist pole hästi aru saadud. Arvatakse, et see põhjustab kilpnäärmehaiguste korral mitmeid autoallergilisi reaktsioone.
Antikehade moodustumise dünaamika
Antikehade moodustumise dünaamika on erineva iseloomuga, sõltuvalt antigeense toime tugevusest ja sagedusest, organismi immuunsüsteemi seisundist (joonis 6).
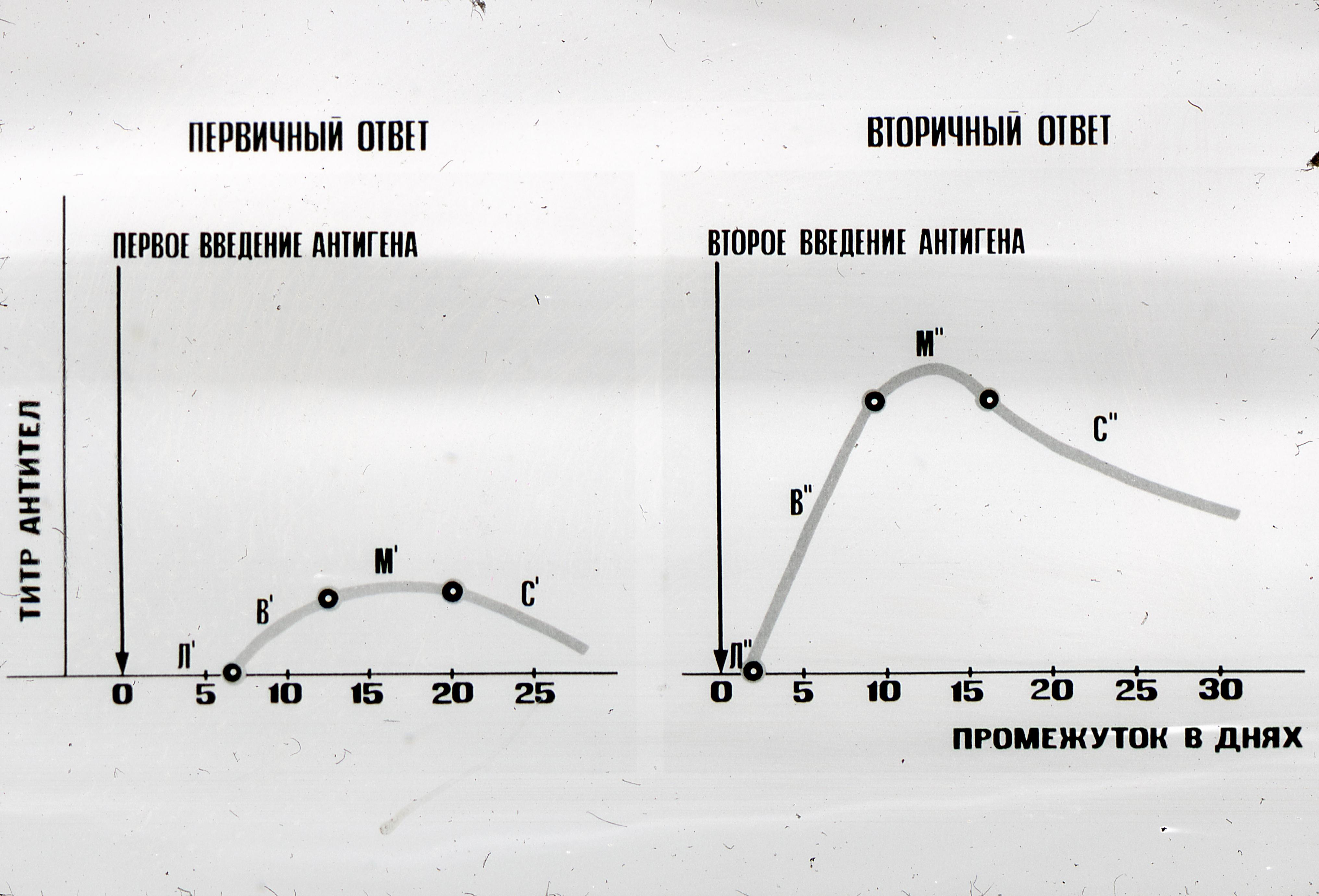
Antigeeni esmasel ja korduval manustamisel on antikeha moodustumise dünaamika erineva iseloomuga ja toimub mitmes etapis. Antikehade moodustumisel on induktiivsed (latentsed) ja produktiivsed etapid. Induktiivne etapp kestab hetkest, kui antigeen siseneb kehasse kuni antikehade ilmumiseni veres. Primaarse immuunvastuse induktiivse etapi kestus on 3-5 päeva. Seejärel tuleb produktiivne etapp, milles nad eristavad:
Logaritmiline faas - kui veres ja lümfis toimub intensiivne plasmatsiididest sünteesitud antikehade tarbimine;
Statsionaarses faasis saavutab spetsiifiliste antikehade kogus maksimumi, selle faasi kestus on 15-30 päeva;
Languse faas, kui antikehade tiitrid vähenevad järk-järgult. Selle faasi kestus on 1-6 kuud või rohkem.
Sellist antikeha moodustumise dünaamikat täheldatakse esmasel kokkupuutel antigeeniga ja nimetatakse esmaseks immuunvastuseks. Korduv kokkupuude sama antigeeniga tekitab sekundaarse immuunvastuse.
Sekundaarset immuunvastuse kõverat iseloomustab varjatud faasi lühenemine mitmelt tunnilt 1-2 päevani. Logaritmilist faasi iseloomustab intensiivsem kasvudünaamika jm kõrge tiiter antikehad. Statsionaarset faasi ja langusfaasi iseloomustab pikaajalisem dünaamika - mitu kuud ja isegi aastaid. Antikehade moodustumise dünaamikat primaarse ja sekundaarse immuunvastuse ajal saab kujutada kõverana (tabel ... ..).
Vaktsiinide manustamisel kasutatakse sekundaarse immuunvastuse nähtust. juureskordaskohtudes sama antigeeniga, reageerib keha aktiivsema ja kiirema immuunvastuse moodustumisega. Seda nähtust nimetatakse immunoloogiliseks mäluks. Immunoloogiline mälu laieneb nii humoraalsele kui ka rakulisele immuunsusele ning püsib aastaid ja isegi aastakümneid.
Seda immuunvastuse vormi viivad läbi B-lümfotsüüdid, mis moodustavad umbes 1% kõigist lümfotsüütidest ja mida nimetatakse mälu B-lümfotsüütideks. Need rakud ei erine morfoloogiliselt teistest B-lümfotsüütidest, vaid neil on spetsiaalne aktiivne geen.
Mälurakke iseloomustab kõrgem spetsiifilisus konkreetse antigeense determinandi suhtes ja pikk eluiga kuni 10 aastat või rohkem.
Immunoloogiline tolerantsus- immuunvastuse ja immunoloogilise mälu vastandlik nähtus.
Immunoloogiline tolerantsus väljendub selles, et immuunsuse väljakujunemise asemel reageerib organism antigeenide uuesti sissetoomisele reageerimatusega ehk ei reageeri antigeenile, on selle suhtes tolerantne.
Immunoloogilise tolerantsuse fenomeni avastasid P. Medawar ja M. Hasek 1953. aastal.
Medawar ja tema kaastöötajad näitasid, et kui embrüosse sisestatakse antigeen, on sündinud loom selle antigeeni suhtes tundlik. Antigeene, mis indutseerivad immunoloogilist tolerantsust, nimetatakse tolerogeenid. Peaaegu kõik antigeenid võivad olla tolerogeenid, polüsahhariidid on kõige tolerogeensemad.
Immunoloogiline taluvus võib olla kaasasündinud või omandatud.
Kaasasündinud tolerantsus - immuunsüsteemi suutmatus reageerida oma antigeenidele.
Omandatud tolerants saab luua immuunsüsteemi pärssivate ainete (immunosupressandid) organismi viimisega või antigeeni sisseviimisega embrüonaalses perioodis.
Tolerantsuse mehhanism on mitmekesine ja pole täiesti selge.
Immunoloogilise tolerantsuse nähtusel on suur praktiline tähtsus. Seda kasutatakse paljude oluliste meditsiiniliste probleemide lahendamiseks, nagu elundite ja kudede siirdamine, autoimmuunreaktsioonide mahasurumine, allergiate ravi jne.