farmakológiai hatás
Az imipenem egy béta-laktám antibiotikum széles választék hatású, a tienamicin származéka és a karbapenemek csoportjába tartozik. Elnyomja a bakteriális sejtfalak szintézisét, és baktericid hatást fejt ki a Gram-pozitív és Gram-negatív baktériumok széles skálájával szemben. aerob és anaerob mikroorganizmusok. A cilasztatin-nátrium gátolja a dehidropeptidázt, egy olyan enzimet, amely az imipenemet a vesében metabolizálja, ami jelentősen megnöveli a változatlan imipenem koncentrációját a húgyúti rendszerben. A cilastatinnak nincs saját antibakteriális hatása, és nem gátolja a bakteriális béta-laktamázokat.
Az imipenem + cilasztatin ellenáll a bakteriális béta-laktamázok által okozott pusztulásnak, ami hatásossá teszi a legtöbb béta-laktamázt termelő mikroorganizmussal szemben, mint például a Pseudomonas aeruginosa, Serratia spp. és Enterobacler spp., rezisztens penicillinek és cefalosporinok.
Az imipenem + cilasztatin in vivo baktericid hatással rendelkezik a következő mikroorganizmusokra:
Enterococcus faecalis, Staphylococcus aureus (beleértve a penicillináz-termelő törzseket), Slaphylococcus epidermidis (beleértve a penicillináz-termelő törzseket is). Streptococcus agalactiae, Streptococcus pneumoniae, Streptococcus pyogenes;
Acinetobacter spp., Citrobacter spp., Enterobacter spp., Escherichia coli, gardnerella vaginalis, haemophilus influenzae, haemophilus paranfluenzae, Klebsiella spp., Morg. ANELLA Morganii, Proteus Vulgaris Spp. Serratia MarcesCens;
Gram-pozitív anaerob baktériumok: Bifidobacterium spp., Clostridium spp., Eubacterium spp., Peptococcus spp., Peptostreptococcus spp., Propionibacterium spp.
Gram-negatív anaerob baktériumok: Bacleroides spp., beleértve a Bacteroides fragilist, Fusobacterium spp.
Az imipenem in vitro baktericid hatást fejt ki a következő mikroorganizmusokkal szemben:
Gram-pozitív aerob baktériumok: Bacillus spp., Listeria monocytogenes, Nocardia spp., Staphylococcus saprophyticus, Streptococcus C, G csoport és viridans csoport;
Gram-negatív aerob baktériumok: Aeromonas hydrophila, Alcaligenes spp., Capnocytophaga spp., Haemophilus ducreyi, Neisseria gonorrhoeae, beleértve a penicillináz-termelő törzseket, Pasteurella spp., Providencia stuartii; Gram-negatív anaerob baktériumok: Prevotella bivia, Prevotella disiens, Prevotella melaninogenica, Veillonella spp.
Érzéketlen: Enterococcus faecium, meticillinrezisztens Staphylococcus spp., Xanthomonas maltophilia, Pseudomonas cepacia.
In vitro szinergikusan hat az aminoglikozidokkal a Pseudomonas aeruginosa egyes törzsei ellen.
Farmakokinetika
Az imipenem maximális koncentrációja (Cmax) intravénásan 250 mg, 500 mg, 1000 mg dózisban 20 percig - 14-24 μg/ml, 21-58 μg/ml, 41-83 μg/ml. A cilasztatin C max intravénásan 250 mg, 500 mg, 1000 mg dózisban 20 percig - 15-25 μg/ml, 31-49 μg/ml, 56-80 μg/ml. Az imipenem beadott adagjának 20%-a és a cilasztatin 40%-a reverzibilisen kötődik a plazmafehérjékhez.
Az imipenem jól és gyorsan eloszlik a legtöbb szövetben és testnedvben. A legmagasabb koncentrációt a pleurális folyadékban, a peritoneális és intersticiális folyadékokban, valamint a reproduktív szervekben érik el. Alacsony koncentrációban megtalálható a cerebrospinális folyadékban (CSF). A megoszlási térfogat felnőtteknél 0,23-0,31 l/kg, 2-12 éves gyermekeknél - 0,7 l/kg, újszülötteknél -0,4-0,5 l/kg. A gyógyszer mindkét komponense elsősorban a vesén keresztül választódik ki (70-76% 10 órán belül) glomeruláris filtrációval (2/3) és aktív tubuláris szekrécióval (1/3): 1-2% a belekben és 20-20- 25%-a extrarenális úton (mechanizmus ismeretlen).
Intravénás beadás esetén az imipenem és a cilasztatin felezési ideje (T 1/2) felnőtteknél 1 óra, 2-12 éves gyermekeknél - 1-1,2 óra, újszülötteknél az imipenem T 1/2 - 1,7-2,4 óra , cilasztatin -3,8-8,4 óra; károsodott veseműködés esetén imipenem T1/2 - 2,9-4 óra Cilastatin - 13,3-17,1 óra.
Az imipenem és a cilasztatin gyorsan és hatékonyan (73-90%) ürül ki hemodialízissel (a 3 órás időszakos hemofiltráció a beadott adag 75%-át eltávolítja).
Javallatok
A gyógyszerre érzékeny mikroorganizmusok által okozott fertőző és gyulladásos betegségek:
- az alsó fertőzések légutak;
- fertőzések húgyúti;
- intraabdominalis fertőzések;
- nőgyógyászati fertőzések;
- bakteriális szepszis;
- csontok és ízületek fertőzései;
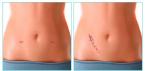
- a bőr és a lágyszövetek fertőzései;
- bakteriális endocarditis.
A posztoperatív fertőzéses szövődmények megelőzése.
Adagolási rend
Intravénás csepegtető.
Dózisforma intravénás beadáshoz nem szabad intramuszkulárisan beadni.
Átlagos terápiás dózis a felnőttek 70 kg vagy annál nagyobb testtömeg és normális vesefunkció (kreatinin-clearance 70 ml/perc/1,73 m2 vagy több) - 1-2 g/nap (imipenem alapján), 3-4 adagra osztva.
A maximális napi adag 4 g vagy 50 mg/kg, attól függően, hogy melyik az alacsonyabb.
Nál nél enyhe fertőzések és szövődménymentes húgyúti fertőzések- 250 mg naponta négyszer (teljes napi adag 1 g);
Nál nél mérsékelt pálya- 500 mg naponta háromszor vagy 1000 mg naponta kétszer (a teljes napi adag 1,5-2 g);
Nál nél súlyos és bonyolult húgyúti fertőzések- 500 mg naponta négyszer (teljes napi adag 2 g);
Nál nél fertőzés, amely veszélyezteti a beteg életét- 1000 mg naponta 3-4 alkalommal (teljes napi adag 3-4 g).
Mert posztoperatív fertőzések megelőzése- 1000 mg az altatás beindításakor és 1000 mg 3 óra után. műtéti beavatkozás a fertőzés kialakulásának magas kockázatával (vastag- és végbélműtét) további 500 mg-os adagot kell beadni 8 órával és 16 órával az általános érzéstelenítés után.
A betegek számára CC kisebb, mint 70 ml/perc/1,73 m2és/vagy testtömeg kevesebb, mint 70 kg az adagot arányosan csökkenteni kell (az adagszámítás imipenem alapján):
Maximális napi adag 1,0 g
| Testsúly, kg | ||||
| ≥71 | 41-70 | 21-40 | 6-20 | |
| ≥70 | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként | 250 mg 12 óránként |
| 60-69 | 250 mg 8 óránként | 125 mg 6 óránként | 250 mg 12 óránként | 125 mg 12 óránként |
| 50-59 | 125 mg 6 óránként | 125 mg 6 óránként | 125 mg 8 óránként | 125 mg 12 óránként |
| 40-49 | 125 mg 6 óránként | 125 mg 8 óránként | 125 mg 12 óránként | 125 mg 12 óránként |
| 30-39 | 125 mg 8 óránként | 125 mg 8 óránként | 125 mg 12 óránként | 125 mg 12 óránként |
Maximális napi adag 1,5 g
| Testsúly kg | Kreatinin-clearance, ml/perc/1,73 m2 | |||
| ≥71 | 41-70 | 21-40 | 6-20 | |
| ≥70 | 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
| 60-69 | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
| 50-59 | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként | 250 mg 12 óránként |
| 40-49 | 250 mg 8 óránként | 125 mg 6 óránként | 125 mg 8 óránként | 125 mg 12 óránként |
| 30-39 | 125 mg 6 óránként | 125 mg 8 óránként | 125 mg 8 óránként | 125 mg 12 óránként |
Maximális napi adag 2,0 g
| Testsúly, kg | Kreatinin-clearance, ml/perc/1,73 m2 | |||
| ≥71 | 41-70 | 21-40 | 6-20 | |
| ≥70 | 500 mg 6 óránként | 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 12 óránként |
| 60-69 | 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
| 50-59 | 250 mg 6 óránként | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
| 40-49 | 250 mg 6 óránként | 250 mg X óránként | 250 mg 12 óránként | 250 mg 12 óránként |
| 30-39 | 250 mg 8 óránként | 125 mg 6 óránként | 125 mg 8 óránként | 125 mg 12 óránként |
Maximális napi adag 3,0 g
| Testsúly, kg | Kreatinin clearance. ml/perc/1,73 m2 | |||
| ≥71 | 41-70 | 21-40 | 6-20 | |
| ≥70 | 1000 mg 8 óránként | 500 mg 6 óránként | 500 mg 8 óránként | 500 mg 12 óránként |
| 60-69 | 750 mg óránként | 500 mg 8 óránként | 500 mg 8 óránként | 500 mg 12 óránként |
| 50-59 | 500 mg 6 óránként | 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 12 óránként |
| 40-49 | 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
| 30-39 | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
Maximális napi adag 4,0 g
| Testsúly, kg | Kreatinin-clearance, ml/perc/1,73 m2 | |||
| ≥71 | 41-70 | 21-40 | 6-20 | |
| ≥70 | 1000 mg 6 óránként | 750 mg 8 óránként | 500 mérföld 6 óránként | 500 mg 12 óránként |
| 60-69 | 1000 mg 8 óránként | 750 mg 8 óránként | 500 mg 8 óránként | 500 mg 12 óránként |
| 50-59 | 750 mg 8 óránként | 500 mg 6 óránként | 500 mg 8 óránként | 500 mg 12 óránként |
| 40-49 | 500 mg 6 óránként | 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 12 óránként |
| 30-39 | 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
Azoknál a betegeknél CC kisebb, mint 5 ml/perc/1,73 m2 a gyógyszert csak akkor adják be, ha a hemodialízist legkésőbb 48 órával később végzik el.
Azoknál a betegeknél CC kisebb, mint 5 ml/perc/1,73 m2 Hemodializált betegeknél a gyógyszert a CC 6-20 ml/perc/1,73 m2-es betegeknek ajánlott adagban kell beadni, közvetlenül a hemodialízis után, és a beavatkozás befejezését követő 12 órás időközönként. A hemodialízis alatt álló betegeket, különösen a központi idegrendszeri betegségben szenvedőket szorosan ellenőrizni kell. A gyógyszer alkalmazása hemodializált betegeknél csak olyan esetekben javasolt, amikor a kezelés előnyei meghaladják a görcsrohamok lehetséges kockázatát. Jelenleg nem áll rendelkezésre elegendő adat ahhoz, hogy a peritoneális dialízis alatt álló betegeknél javasolják a gyógyszer alkalmazását.
Nál nél gyermekek 3 hónapos kortól 40 kg-ig, egyszeri adagja 15 mg/ttkg, amelyet 6 óránként kell beadni A maximális napi adag 2 g.
40 kg vagy annál nagyobb súlyú gyermekek ugyanazokat az adagokat írják fel, mint a felnőtteknek (lásd a táblázatokat).
Az infúziós oldat elkészítése és beadása
Adjon 10 ml vagy 20 ml megfelelő oldószert a gyógyszert tartalmazó palackba. Jól rázza fel az üveget, hogy homogén szuszpenziót kapjon.
Az így kapott szuszpenzió beadásra nem használható!
A kapott szuszpenziót az oldószer maradékával (80-90 ml) egy üvegbe töltjük. Az oldat teljes térfogata 100 ml. A gyógyszer teljes átviteléhez (a gyógyszer maradékai a palack falán), adjunk hozzá 20 ml-t az előzőleg kapott oldatból a palackhoz, jól rázzuk fel, majd keverjük össze mindkét oldatot. A kapott oldatot alaposan keverjük, amíg kitisztul. Csak ezt követően az oldat készen áll a használatra. Az oldat teljes térfogata 100 ml. Az oldat színének különbségei a színtelentől a sárgáig nem befolyásolják a gyógyszer aktivitását.
Intravénásan beadva.
Az infúzió időtartama a választott adagtól függ: 250-500 mg-ot 20-30 perc alatt kell beadni; 500 mg felett - 40-60 percen belül. Azoknak a betegeknek, akik az infúzió alatt hányingert tapasztalnak, csökkenteniük kell a gyógyszeradagolás sebességét.
Az elkészített infúziós oldatok (imipenem koncentrációja 5 mg/ml) 4 órán át szobahőmérsékleten vagy 24 órán át hűtőszekrényben tárolhatók.
A táblázat számos infúziós oldat alapján készített gyógyszeroldatok stabilitási idejére vonatkozó adatokat közöl.
Mellékhatás
A központi oldalról idegrendszer: szédülés, álmosság, myoclonus, mentális zavarok, hallucinációk, zavartság, görcsök, paresztézia, encephalopathia, tremor, fejfájás, szédülés.
Az érzékszervekből: halláskárosodás, fülzúgás, ízérzészavar.
A húgyúti rendszerből: oliguria, anuria, polyuria, akut veseelégtelenség, a vizelet színének megváltozása.
Az emésztőrendszerből: hányinger, hányás, hasmenés, pszeudomembranosus colitis, vérzéses vastagbélgyulladás, hepatitis (beleértve a fulminánst is), májelégtelenség, sárgaság, gyomor-bélhurut, hasi fájdalom, glossitis, a nyelvpapillák hipertrófiája, a fogak vagy a nyelv elszíneződése, torokfájdalom,, hyperzalis gyomorégés.
A légzőrendszerből: kellemetlen érzés a mellkasban, légszomj, hiperventiláció.
A vérképző szervekből: eozinofília. leukopenia, neutropenia, agranulocytosis, thrombocytopenia, thrombocytosis, monocytosis, limfocitózis, leukocitózis, basophilia, pancytopenia, csontvelői vérképzés gátlása, hemolitikus anémia.
Laboratóriumi mutatók: a „máj” transzaminázok fokozott aktivitása és alkalikus foszfatáz, laktát-dehidrogenáz, hiperkreatininémia, hiperbilirubinémia, megnövekedett karbamid-nitrogén-koncentráció; hamis pozitív közvetlen Coombs-teszt; a hemoglobin és a hematokrit csökkenése, a protrombin idő megnyúlása; az alacsony sűrűségű lipoproteinek fokozott koncentrációja; hyponatraemia, hyperkalaemia, hypochloraemia; fehérje, vörösvértestek, leukociták, gipsz megjelenése, megnövekedett bilirubin koncentráció a vizeletben.
Allergiás reakciók: bőrkiütés, viszketés, csalánkiütés, exudatív erythema multiforme, Stevens-Johnson szindróma, angioödéma, toxikus epidermális nekrolízis, hámló dermatitis, láz, anafilaxiás reakciók.
Oldalról a szív-érrendszer: hanyatlás vérnyomás, szívdobogásérzés, tachycardia.
Helyi reakciók: bőrhiperémia, fájdalmas beszűrődés az injekció beadásának helyén, phlebitis/thrombophlebitis.
Egyéb: candidiasis, hüvelyi viszketés, cianózis, hyperhidrosis, polyarthralgia, asthenia, égő érzés a szegycsont mögött, fájdalom mellkasi régió gerinc.
A használat ellenjavallatai
- túlérzékenység a gyógyszer egyik összetevőjére, valamint más karbapenemekre, béta-laktám antibiotikumokra, penicillinekre és cefalosporinokra;
— krónikus veseelégtelenség CC-vel kevesebb, mint 5 ml/perc/1,73 m2 hemodialízis nélkül;
- korai gyermekkor (legfeljebb 3 hónap);
- gyermekeknél - súlyos veseelégtelenség (szérum kreatinin koncentráció több mint 2 mg/dl).
Gondosan
Központi idegrendszeri (CNS) betegségek, pszeudomembranosus colitis, gyomor-bélrendszeri betegségben szenvedő betegek, akiknél a kreatinin-clearance kevesebb, mint 70 ml/perc/1,73 m2, hemodializált betegek, antikonvulzív terápia valproinsavval (a terápia csökkent hatékonysága), idős kor.
Használata terhesség és szoptatás alatt
Terhesség alatti alkalmazása csak akkor megengedett, ha a kezelés lehetséges előnye az anyára nézve meghaladja a magzatra gyakorolt lehetséges kockázatot.
Az imipenem és a cilasztatin kis mennyiségben átjut az anyatejbe, ezért megfontolandó a kezelés abbahagyása. szoptatás gyógyszeres kezelés során.
Használata gyermekeknél
Korai szakaszban ellenjavallt gyermekkor(legfeljebb 3 hónapig); gyermekeknél - súlyos veseelégtelenség(a szérum kreatinin koncentrációja több mint 2 mg/dl)
Túladagolás
Gyógyszerkölcsönhatások
Gyógyszerészetileg összeférhetetlen a tejsav sóival és más antibiotikumok oldataival.
Penicillinek és cefalosporinok egyidejű alkalmazása esetén keresztallergia lehetséges; antagonizmust mutat más béta-laktám antibiotikumokkal (penicillinek, cefalosporinok és monobaktámok) szemben.
Ha a ganciklovirrel egyidejűleg alkalmazzák, nő a generalizált rohamok kialakulásának kockázata. Ezeket a gyógyszereket nem szabad együtt alkalmazni, kivéve, ha a lehetséges előnyök meghaladják a lehetséges kockázatokat.
A tubuláris szekréciót gátló gyógyszerek kismértékben növelik az imipenem plazmakoncentrációját és felezési idejét (ha nagy imipenem koncentrációra van szükség, használja ezeket gyógyszerek ugyanakkor nem ajánlott).
A gyógyszer alkalmazása során a valproinsav szérumkoncentrációja csökken, ami a görcsoldó terápia hatékonyságának csökkenéséhez vezet, ezért a kezelési időszak alatt javasolt a valproinsav szérumkoncentrációjának monitorozása.
A gyógyszertári kiadás feltételei
Recept szerint kapható.
Tárolási feltételek és időtartamok
Fénytől védett helyen, 25°C-ot meg nem haladó hőmérsékleten. Gyermekek elől elzárva tartandó. Legjobb megadás dátuma. 2 év.
Használata vesekárosodás esetén
ellenjavallt krónikus veseelégtelenségben, ha a CC kevesebb, mint 5 ml/perc/1,73 m2 hemodialízis nélkül
Alkalmazása idős betegeknél
A gyógyszert óvatosan kell előírni idős betegek számára
Az ajánlott adagolás és adagolási rend szigorú betartása szigorúan szükséges, különösen a görcsrohamokra hajlamos betegeknél. Terápia görcsoldók Azoknál a betegeknél, akiknek anamnézisében epilepszia szerepel, a gyógyszeres kezelés teljes időtartamát folytatni kell. Ha helyi tremort, myoclonust vagy görcsrohamokat észlelnek, a betegeket neurológiai vizsgálatnak kell alávetni, és görcsoldó terápiát kell felírni. Ebben az esetben a gyógyszer adagját felül kell vizsgálni annak eldöntésére, hogy csökkenteni kell-e, vagy abba kell hagyni a gyógyszer szedését.
Az adagolási forma 37,56 mg (1,63 mEq) nátriumot tartalmaz.
A kezelés megkezdése előtt alapos kórtörténetet kell felvenni a béta-laktám antibiotikumokkal szembeni korábbi allergiás reakciókról. Ha allergiás reakció alakul ki, a gyógyszert azonnal le kell állítani.
Azoknál a személyeknél, akiknek a kórtörténetében gyomor-bélrendszeri betegségek (különösen vastagbélgyulladás) szerepelnek, meg kell jegyezni megnövekedett kockázat pszeudomembranosus colitis kialakulása.
A gyógyszer alkalmazása során, mind a beadás alatt, mind 2-3 hét után. a kezelés leállítása után Clostridium difficile (pszeudomembranosus colitis) okozta hasmenés alakulhat ki. Enyhe esetekben elegendő a kezelés abbahagyása és az ioncserélő gyanták (kolesztiramin, kolesztipol) alkalmazása, súlyos esetekben a folyadék-, elektrolit- és fehérjeveszteség pótlása, vankomicin és metronidazol kijelölése javasolt. Ne használjon olyan gyógyszereket, amelyek gátolják a bélmozgást.
Más béta-laktám antibiotikumokhoz hasonlóan a Pseudomonas aeruginosa is gyorsan rezisztenciát alakíthat ki a gyógyszerrel szemben a kezelés során. Ezért a Pseudomonas aeruginosa által okozott fertőzések kezelése során a klinikai helyzetnek megfelelően időszakos antibiotikum érzékenységi vizsgálat elvégzése javasolt.
Az idős betegek valószínűleg életkorral összefüggő vesekárosodásban szenvednek, ami dóziscsökkentést tehet szükségessé.
A vizeletet vörösesre színezi.
Hatás a vezetési képességre járművekés gépekkel dolgozni
Óvatosan kell eljárni, ha autót vezet és olyan potenciálisan veszélyes tevékenységet folytat, amely fokozott figyelmet és a pszichomotoros reakciók sebességét igényli.
Adagolási forma: por oldatos infúzióhozÖsszetett:1 üveghez/üveghez:
Steril keverék, amely:
imipenem-monohidrát - 530,0 mg (imipenem tekintetében - 500,0 mg), cilasztatin-nátrium - 532,0 mg (cilasztatin tekintetében - 500,0 mg);segédanyag: nátrium-hidrogén-karbonát - 20,0 mg.
Leírás: B fehér vagy fehér por, sárgás árnyalattal. Farmakoterápiás csoport:Antibiotikum-karbapenem+dehidropeptidáz inhibitor ATX:J.01.D.H.51 Imipenem és dehidropeptidáz inhibitor
Farmakodinamika:A gyógyszer két összetevőből áll:
1) imipenem, egy széles spektrumú béta-laktám antibiotikum, a tienampcin származéka, amely a karbaienem csoportba tartozik;
2) cilastatin-nátrium - az imipenem vesében történő metabolizmusának enzimgátlója, és jelentősen növeli a változatlan imipenem koncentrációját a húgyúti rendszerben.
Az imipenem gátolja a bakteriális sejtfal szintézisét, és baktericid hatást fejt ki a Gram-pozitív és Gram-negatív aerob és anaerob mikroorganizmusok széles körében.
A Cilastinnak nincs saját antibakteriális hatása, és nem gátolja a bakteriális béta-laktamázt.
Az imipenem ellenáll a bakteriális béta-laktamáz által okozott pusztulásnak, így számos mikroorganizmus ellen hatásos, mint pl. Pseudomonasaeruginosa, Serratiaspp. És Enterobacterspp ., amelyek rezisztensek a legtöbb béta-laktám antibiotikummal szemben.
Az antibakteriális spektrum szinte minden klinikailag jelentős patogén mikroorganizmust tartalmaz.
In vitro a következő mikroorganizmusok ellen aktív: és in vivo is:
Gram-negatív aerob baktériumok : A cinetobacter spp., Citrobacter spp., Enterobacter spp., Escherichia coli, Gardnerella vaginalis, Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella spp., Morganella morganii, Proteus vulgaris, Providenciaris retardomas, Sergeronas a Peruginose., beleértve Serratia marcescens;
Gram-pozitív aerob baktériumok
: Enterococcusszékletvan, Staphylococcus aureus Staphylococcus epidermidis(beleértve a penicillináz-termelő törzseket), Streptococcus agalactiae, Streptococcus pneumoniae, Streptococcus pyogenes;Gram-negatív anaerob baktériumok :Bacteroides spp., beleértve Baeteroides fragilis, Fusobacterium spp;
Gram-pozitív anaerob baktériumok : Bifidobacterium spp., Clostridium spp., Eubaeterium spp., Peptocoecus spp., Peplostreptococcus spp., Propionibacterium spp.
Az imipenem in vitro baktericid hatást fejt ki a következő mikroorganizmusokkal szemben: klinikai hatékonyságát nem állapították meg):
Gram-pozitív aerobok : Bacillus spp., Listeria monocytogenes, Nocardia spp., Staphylococcus saprophyticus, Streptococcus C, G csoport és viridán csoport;
Gram-negatív aerobok : Aeromonas hydrophila, Alcaligenes spp., Capnocytophaga spp., Haemophilus ducreyi, Neisseria gonorrhoeae, beleértve a penicillinázt termelő törzseket, Pasteurella spp., Providencia stuartii;
Gram-negatív anaerobok : Prevotella bivia, Prevotella disiens, Prevotella melaninogenica, Veillonella spp.;
Érzéketlen : Enterococcus faecium, meticillin-rezisztens Staphylococcus spp., Xanthomonas maltophilia, Burkholderia cepacia.
Ban benvitro egyes törzsekkel szemben szinergikusan hat az aminoglikozidokkal Pseudomonasaeruginosa .
Farmakokinetika:A gyógyszeroldat intravénás beadása után mindkét komponens esetében a maximális koncentráció (TC m ax) elérésének ideje a plazmában 20 perc. Ebben az esetben a maximális koncentráció (C m ax) eléri a 21 és 58 μg ml közötti értéket az imipenem és a 21 és 55 μg/ml közötti értéket a cilasztatin esetében. A gyógyszer 4-6 órás beadása után az imipenem Cmax értéke 1 mcg/ml-re vagy az alá csökken.
Mindegyik komponens felezési ideje 1 óra.
A plazmafehérjékhez való kötődése az imipenem esetében 20%, a cilasztatin esetében pedig 40%.
Az intravénásan beadott imipenem körülbelül 7%-a ürül ki a vesén keresztül 10 órán belül. Az imipenem 10 mcg/ml feletti vizeletkoncentrációja a gyógyszer intravénás beadása után 8 órán át fennmaradhat. A cilasztatin körülbelül 70-80%-a a vesén keresztül választódik ki a gyógyszer beadása után 10 órán belül.
Ha a gyógyszert 6 óránként intravénásan adták be normális vesefunkciójú betegeknek, nem figyelték meg az imipenem/cilasztatin felhalmozódását a plazmában vagy a vizeletben.
A gyógyszer 1 g-os dózisának beadása után a következő átlagos imipenem koncentrációkat határozták meg az emberi test szöveteiben és környezetében:
| Szövet vagy közepes | Imipenem koncentrációja µg/ml vagy µg/g | Mérési idő (h) |
| A szemgolyó üvegteste | ||
| Intraokuláris folyadék | ||
| Tüdőszövet | ||
| Pleurális folyadék | ||
| Peritoneális folyadék | ||
| Szeszes ital (gyulladás nélkül) | ||
| Szeszes ital (gyulladásra) | ||
| Prosztata szekréció | ||
| Textil prosztata | ||
| Endometrium | ||
| Myometrium | ||
| Csont | ||
| Intersticiális folyadék | ||
| Kötőszöveti |
A gyógyszert a rá érzékeny mikroorganizmusok által okozott súlyos fertőzések kezelésére, valamint empirikus terápiára használják. fertőző folyamat még bakteriális kórokozóinak azonosítása előtt is.
által okozott intraabdominalis fertőzések Enterococcusfaccalis, Staphylococcusaureus Staphylococcus epidermidis, Citrobacter spp., Enterobacter spp., Escherichia coli, Klebsiella spp., Morganella morganii, Proteus spp., Pseudomonas aeruginosa, Bifidobacterium spp., Clostridium spp., Eubacteriums, Pecctopptopp. Propioni baktérium spp., Bacteroides spp., beleértve
által okozott alsó légúti fertőzések Streptococcus pneumoniae, Staphylococcus aureus (penicillináz-termelő törzsek), Acinetobacter spp., Enterobacter spp., Escherichia coli, Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella spp., Serratia marcescens.
Húgyúti fertőzések (szövődményes és szövődménymentes), amelyeket a Enterococcus faecalis, Staphylococcus aureus(penicillináz-termelő törzsek), E nterobacterspp., Escherichia coli, Klebsiella spp., Morganella morganii, Proteus vulgaris, Providencia rettgeri. Pseudomonas aeruginosa.
által okozott bőr- és lágyrészfertőzések Streptococcus pyogenes, Enterococcus faecalis, Staphylococcus aureus(penicillináz-termelő törzsek), Staphylococcus epidermidis, Acinetobacter spp., Citrobacter spp., Enterobacter spp., Escherichia coli, Klebsiella spp., Morganella morganii, Proteus vulgaris, Providencia rettgeri, Pseudomonas aeruginosa; Serratia spp., Peptococcus spp., Peptostreptococcus spp., Bacteroides spp., beleértve B. fragilis, Fusobacterium spp.
által okozott csont- és ízületi fertőzések Enterococcus faecalis, Staphylococcus aureus(penicillináz-termelő törzsek), Staphylococcus epidermidis, Enterobacter spp., Pseudomonas aeruginosa.
által okozott bakteriális vérmérgezés Streptococcus pneumoniae, Enterococcus faecalis, Staphylococcus aureus(penicillináz-termelő törzsek), Enterobacter spp., Escherichia coli. Klebsiella spp., Pseudomonas aeruginosa, Serratia spp., Bacteroides spp., beleértve Bacteroides fragilis.
Fertőző endocarditis. okozta Staphylococcus aureus (penicillináz-termelő törzsek).
által okozott nőgyógyászati fertőzések
Enterococcus faecalis, Staphylococcus aureus(penicillináz-termelő törzsek).Staphylococcus epider midis, Streptococcus agalactiae (Streptococcus spp. B csoport), Enterobacter spp., Escherichia coli, Gardnerella vaginalis, Klebsiella spp., Proteus spp., Bifidobacterium spp., Peptococcus spp., Peptostreptococcus spp., Propionibacterium spp., Bacteroides spp., beleértve B. fragilis.Megelőzés posztoperatív szövődmények kockázatnak kitett betegeknél, akiknél nagy valószínűséggel alakul ki posztoperatív fertőző szövődmény, valamint nagy kockázat intraoperatív fertőzés a műtét során.
Ellenjavallatok:A gyógyszer bármely összetevőjével szembeni túlérzékenység; túlérzékenység más karbapenemekkel szemben.
Súlyos túlérzékenységi reakciók (pl. anafilaxiás reakciók, súlyos bőrreakciók) bármely más béta-laktám antibiotikummal (pl. penicillinek vagy cefalosporinok) szemben.
3 hónaposnál fiatalabb gyermekek.
Károsodott veseműködésű gyermekek (szérum kreatinin több mint 2 mg/dl).
Azok a betegek, akiknél a kreatinin-clearance (CC) kisebb, mint 5 ml/perc/1,73 m2 (kivéve azokat az eseteket, amikor a hemodialízisre legkésőbb 48 órával a gyógyszerinfúzió beadása után kerül sor).
Gondosan:Központi idegrendszeri betegségek, 70 ml/perc alatti CC 1,73 m2, hemodializált betegek, betegségekben szenvedők gyomor-bél traktus pszeudomembranosus colitis anamnézisében.
Terhesség és szoptatás:Terhes nőkön nem végeztek vizsgálatokat. A gyógyszert terhesség alatt csak akkor szabad alkalmazni, ha a kezelés előnyei igazolják a magzatra gyakorolt potenciális kockázatot.
Az imipenem megtalálható az anyatejben. Ha a gyógyszer alkalmazását szükségesnek tartják, a szoptatást le kell állítani.
Használati utasítás és adagolás:AZ INTRAVÉNÁLIS ALKALMAZÁSRA VONATKOZÓ ADAGOLÁSI FORMÁT NEM HASZNÁLJA INTRAMUSZKULÁRIS.
A gyógyszer teljes napi adagjának kiszámítását a fertőzés súlyosságán kell alapul venni, és több alkalmazásra egyenlő adagokban kell elosztani, figyelembe véve egy vagy több kórokozó mikroorganizmus érzékenységének mértékét, a vesefunkciót és a testtömegét.
Adagolási rend normál vesefunkciójú felnőtt betegek számára
Az 1. táblázatban megadott dózisok normál vesefunkciójú (kreatinin-clearance több mint 70 ml/perc/1,73 m2) és 70 kg-nál nagyobb testtömegű betegekre vonatkoznak.
Azoknál a betegeknél, akiknél a kreatinin-clearance ≤70 ml/perc/1,73 m2 (lásd 2. táblázat) és/vagy a testtömegük kevesebb, mint 70 kg (lásd a 3. táblázatot), az adag csökkentésére van szükség. Különösen fontos az adag testtömegtől függő csökkentése azoknál a betegeknél, akiknek testtömege jelentősen kisebb, mint 70 kg, és közepes vagy súlyos vesekárosodásban szenved.
Az átlagos napi terápiás adag 1-2 g imipenem, 3-4 alkalmazásra osztva (lásd 1. táblázat). Közepes fokú fertőzések kezelésére a gyógyszer napi kétszer 1 g-os adagban is alkalmazható.
Kevésbé érzékeny mikroorganizmusok által okozott fertőzések esetén az intravénás infúziós gyógyszer napi adagja legfeljebb napi 4 g-ra (imipenem) vagy napi 50 mg/ttkg-ra emelhető, attól függően, hogy melyik az alacsonyabb.
Az intravénás infúzióhoz használt gyógyszer minden adagját, legfeljebb 500 mg-ot, intravénásan kell beadni 20-30 perc alatt. Minden 500 mg-nál nagyobb adagot intravénásan kell beadni 40-60 perc alatt.
Azoknak a betegeknek, akiknél hányinger jelentkezik az infúzió beadása közben, le kell lassítaniuk a gyógyszer beadási sebességét.
1. táblázat: Adagolási rend intravénás infúzióhoz normál vesefunkciójú és ≥70 kg testtömegű felnőtt betegeknél
| A fertőzés súlyossága | Dózis imipenem, mg | Szünet infúziók között | Teljes napi adag |
| Súlyos (érzékeny kórokozók) | |||
| Súlyos és/vagy életveszélyes | |||
| Súlyos és/vagy életveszélyes, amelyet kevésbé érzékeny szervezetek (elsősorban egyes törzsek) okoznak P. aeruginosa) |
* 70 kg-nál kisebb testtömegű betegeknél a beadott dózis további arányos csökkentésére van szükség.
A gyógyszer magas antimikrobiális aktivitása miatt javasolt, hogy a teljes napi adag ne haladja meg az 50 mg kg-ot vagy a 4 g-ot (imipenem) naponta, attól függően, hogy melyik az alacsonyabb adag.
Bár a normális vesefunkciójú cisztás fibrózisban szenvedő betegeket legfeljebb napi 90 mg/ttkg adaggal kezelték, több alkalmazásra osztva, a teljes dózis nem haladta meg a napi 4 g-ot (imipenem).
A gyógyszert sikeresen alkalmazták monoterápiaként immunhiányos rákos betegeknél, akiknek igazolt vagy gyanított fertőzése van, például szepszis.
Adagolási rend károsodott vesefunkciójú felnőtt betegek számára
Károsodott vesefunkciójú felnőtt betegek kezelésében a gyógyszer adagjának módosításához szükséges:
- A fertőzés jellemzői alapján válassza ki a gyógyszer teljes napi adagját az 1. táblázatból.
- A 2. táblázatból válassza ki a gyógyszer megfelelő csökkentett adagját a napi adag (1. táblázat) és a beteg kreatinin clearance-e alapján. (Az infúziós idő kiszámításához lásd: Adagolási rend normál veseműködésű felnőttek számára).
- A 3. táblázatból válassza ki a bal oldali oszlopban a páciens testtömegéhez (kg) legközelebb eső testtömeg-értéket.
2. táblázat: Adagolási rend intravénás infúzióhoz károsodott funkciójú felnőtt betegeknél vesék és testtömeg ≥70 kg*
| Tábornok az imipenem napi adagját, az 1. táblázatból | |||
| 41-70 | 21-40 | 6-20 |
|
| 1,0 g naponta | 250 mg 8 óránként | 250 mg 12 óránként | 250 mg 8 óránként |
| 1,5 g naponta | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
| 2,0 g naponta | 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 12 óránként |
| 3,0 g naponta | 500 mg 6 óránként | 500 mg 8 óránként | 500 mg 12 óránként |
| 4,0 g naponta | 750 mg 8 óránként | 500 mg 6 óránként | 500 mg 12 óránként |
* 70 kg-nál kisebb testtömegű betegeknél a beadott dózis további arányos csökkentésére van szükség.
3. táblázat: Adagolási rend intravénás infúzióhoz károsodott vesefunkciójú és/vagy 70 kg-nál kisebb testtömegű felnőtt betegeknél
Maximális napi adag 1,0 g
| Testtömeg (kg) | Kreatinin-clearance (ml/perc/1,73 m2) |
|||
| ≥71 kg | 41-70 | 21-40 | 6-20 |
|
| 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként | 250 mg 12 óránként |
|
| de 250 mg 8 óra múlva | 125 mg 6 óránként | 250 mg 12 óránként | 125 mg 12 óránként |
|
| 125 mg 6 óránként | 125 mg 6 óránként | 125 mg 8 óránként | 125 mg 12 óránként |
|
| 125 mg 6 óránként | 125 mg 8 óránként | 125 mg 12 óránként | 125 mg 12 óránként |
|
| 125 mg 8 óránként | 125 mg 8 óránként | 125 mg 12 óránként | 125 mg 12 óránként |
|
Maximális napi adag 1,5 g
| Testtömeg (kg) | Kreatinin-clearance (ml/perc/1,73 m2) |
|||
| >71 kg | 41-70 | 21-40 | 6-20 |
|
| 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
|
| 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
|
| 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként | 250 mg 12 óránként |
|
| 250 mg 8 óránként | 125 mg 6 óránként | 125 mg 8 óránként | 125 mg 12 óránként |
|
| 125 mg 6 óránként | 125 mg 8 óránként | 125 mg 8 óránként | 125 mg 12 óránként |
|
Maximális napi adag 2,0 g
| Testtömeg(kg) | Kreatinin clearance a (ml/perc/1,73 m2) |
|||
| ≥71 kg | 41-70 | 21-40 | 6-20 |
|
| 500 mg 6 óránként | 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 12 óránként |
|
| 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
|
| 250 mg 6 óránként | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
|
| 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként | 250 mg 12 óránként |
|
| 250 mg 8 óránként | 125 mg 6 óránként | 125 mg 8 óránként | 125 mg 12 óránként |
|
Maximális napi adag 3,0 g
| Testtömeg (kg) | Kreatinin-clearance (ml/perc/1,73 m2) |
|||
| ≥71 kg | 41-70 | 21-40 | 6-20 |
|
| 1000 mg 8 óránként | 500 mg 6 óránként | 500 mg 8 óránként | 500 mg 12 óránként |
|
| 750 mg 8 óránként | 500 mg 8 óránként | 500 mg 8 óránként | 500 mg 12 óránként |
|
| 500 mg 6 óránként | 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 12 óránként |
|
| 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
|
| 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
|
Maximális napi adag 4,0 g
| Testtömeg (kg) | Kreatinin-clearance (ml/perc/1,73 m2) |
|||
| ≥71 kg | 41-70 | 21-40 | 6-20 |
|
| 1000 mg 6 óránként | 750 mg 8 óránként | 500 mg 6 óránként | 500 mg 12 óránként |
|
| 1000 mg 8 óránként | 750 mg 8 óránként | 500 mg 8 óránként | 500 mg 12 óránként |
|
| 750 mg 8 óránként | 500 mg 6 óránként | 500 mg 8 óránként | 500 mg 12 óránként |
|
| 500 mg 6 óránként | 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 12 óránként |
|
| 500 mg 8 óránként | 250 mg 6 óránként | 250 mg 8 óránként | 250 mg 12 óránként |
|
Ha 6-20 ml/perc/1,73 m2 kreatinin-clearance-ű betegeknél 500 mg-os adagot adnak be, a görcsrohamok kockázata megnőhet.
Az Imipenem + Cilastatin nem adható intravénásan olyan betegeknek, akiknek kreatinin-clearance-e kisebb, mint 5 ml/perc/1,73 m2, kivéve, ha hemodialízist végeznek legkésőbb 48 órával az Imipenem + Cillastatin infúzió beadása után.
Hemodialízis
Az 5 ml / perc / 1,73 m 2 -nél kisebb kreatinin-clearance-ú, hemodialízisben részesülő betegek kezelésekor be kell tartani az Imipenem + Cilastatin gyógyszer adagolási rendjét 6-20 ml / perc / 1,73 m 2 kreatinin-clearance esetén. alkalmazták (lásd "Adagolási rend vesekárosodásban szenvedő felnőtt betegek számára" című részt).
Az imipenemhez hasonlóan a gak és a cilasztatin is kiürül a hemodialízis során a keringési rendszerből. Ezzel összefüggésben az Imipenem + Cillastatin intravénás infúziót hemodialízis után, majd az eljárás végétől számított 12 órás időközönként kell beadni a betegeknek. A hemodializált betegeket, különösen, ha központi idegrendszeri betegségeik vannak, szoros megfigyelés alatt kell tartani; Az Imipenem + Cillastatin gyógyszer kinevezése hemodialízis alatt álló betegeknél csak olyan esetekben javasolt, amikor a kezelés előnyei meghaladják a görcsrohamok lehetséges kockázatát (lásd az "Óvatosan" részt).
Jelenleg nem áll rendelkezésre elegendő adat az Imipenem + Cilastatin intravénás adagolásának ajánlásához peritoneális dialízisben részesülő betegeknél.
Idős betegek veséinek állapota nem határozható meg teljes mértékben csak a maradék vér nitrogén- vagy kreatininszintjének mérése alapján. Az ilyen betegeknél az adagok kiválasztásához javasolt a kreatinin-clearance meghatározása.
Idős betegek
Normális veseműködésű idős betegeknél az adag módosítása nem szükséges.
Májműködési zavar
Károsodott májműködésű betegeknél nincs szükség dózismódosításra.
Megelőzés
Adagolási rend felnőtt betegek számára
A posztoperatív fertőzések megelőzésére felnőtteknél az Imipenem + Cillastatin intravénás infúziót 1 g adagban kell beadni az érzéstelenítés beindítása alatt, majd 1 g adagban 3 óra elteltével. Nagy kockázatú műtéteknél (pl. vastag- és végbélműtétnél) az érzéstelenítés beindítása után 8 és 16 órával további két 500 mg-os adagot kell beadni.
Adagolási rend gyermekeknek 3 hónapos kortól
- A 40 kg-nál nagyobb testtömegű gyermekeknek ugyanolyan adagokat kell kapniuk, mint a felnőtt betegeknek.
- A 3 hónaposnál idősebb és 40 kg-nál kisebb testtömegű gyermekeknek 15 mg/ttkg adagot kell kapniuk 6 órás időközönként. A maximális napi adag nem haladhatja meg a 2 g-ot.
Oldat elkészítése intravénás infúzióhoz
Az Imipenem + Cillastatin intravénás infúzióhoz nem keverhető vagy adható hozzá más antibiotikumokhoz.
Az Imipenem + Cillastatin gyógyszer intravénás infúzióhoz való adagolási formája kémiailag összeférhetetlen a tejsavval (laktáttal), és nem szabad laktátot tartalmazó oldószerek alapján elkészíteni. Az intravénás Imipenem + Cillastatin azonban ugyanazon az infúziós rendszeren keresztül is beadható, mint a laktátot tartalmazó oldat.
Az Imipenem + Cillastatin intravénás infúziós oldatát az alábbi 4. táblázat szerint kell elkészíteni.. A végső infúziós oldatot addig kell rázni, amíg tiszta oldatot nem kapunk. Az Imipenem + Cillastatin gyógyszer oldatainak színe színtelentől sárgáig változik (a színváltozások ezen határokon belül nem befolyásolják a gyógyszer aktivitását).
4. táblázat: Imipenem + Cilastatin gyógyszer oldatának elkészítése intravénás infúzióhoz
| Az Imipenem + Cilastatin gyógyszer adagja (mg imipenem) | A hozzáadott oldószer térfogata (ml) | A gyógyszer infúziós oldatának átlagos koncentrációja Imipenem+Cilastatin (mg/ml imipenem) |
20 ml-es, 25 ml-es flakonhoz
Az Imipenem + Cilastatin gyógyszert tartalmazó injekciós üvegbe először 10 ml megfelelő oldószert kell hozzáadni az 5. táblázatban található listából. A kapott elsődleges szuszpenziót alaposan fel kell rázni, és egy 90 ml infúziós oldószert tartalmazó infúziós palackba kell tölteni.
AZ ELSŐDLEGES SZUSZPENZIÓT NEM HASZNÁLHATÓ BEADÁSHOZ.
A gyógyszer teljes átadása érdekében az eljárást meg kell ismételni. Az infúziós palackból az előzőleg kapott oldatból 10 ml-t a por maradványait tartalmazó üvegbe adva.
A kapott szuszpenziót alaposan fel kell rázni, és egy 90 ml infúziós oldószert tartalmazó infúziós palackba kell tölteni. Az oldószer teljes térfogata 100 ml.
A kész infúziós oldatot addig kell rázni, amíg tiszta oldatot nem kapunk.
Az 5. táblázat az Imipenem + Cilastatin gyógyszer infúziós oldatának alkalmazásának időzítésével kapcsolatos adatokat mutatja be. különféle infúziós hígítókból készítik, és szobahőmérsékleten vagy hűtőszekrényben tárolják.
5. táblázat
| Oldószer | A gyógyszer stabilitási időszaka |
|
| Szobahőmérséklet (25 °C) | Hűtő |
|
| 0,9%-os nátrium-klorid oldat | ||
| 5%-os dextróz oldat | ||
| 10%-os dextróz oldat | ||
| 5%-os dextróz oldat és 0,9 % nátrium-klorid oldat | ||
| 5%-os dextróz oldat és 0,45%-os nátrium-klorid oldat | ||
| 5%-os dextróz oldat és 0,225%-os nátrium-klorid oldat | ||
| 5%-os dextróz oldat és 0,15%-os kálium-klorid oldat | ||
| 5%-os és 10%-os mannitoldat | ||
A klinikai vizsgálatok során az Imipenem+[Cilastatin]-t 1723 betegnek adták intravénásan. A gyógyszer alkalmazásával összefüggő leggyakoribb szisztémás mellékhatások a következők voltak: hányinger (2,0%), hasmenés (1,8%), hányás (1,5%), bőrkiütés (0,9%), láz (0,5%), vérnyomáscsökkenés (0,4%). %), görcsrohamok (0,4%) (lásd a " Különleges utasítások"), szédülés (0,3%), viszketés (0,3%), csalánkiütés (0,2%), álmosság (0,2%).
A leggyakoribb helyi mellékhatások a következők voltak: phlebitis, thrombophlebitis (3,1%), fájdalom az injekció beadásának helyén (0,7%), erythema az injekció beadásának helyén (0,4%) és a véna falának hegesedése (0,2%). Gyakran beszámoltak a szérum transzaminázok és az alkalikus foszfatáz aktivitásának növekedéséről is.
Alább listázva mellékhatások alatt regisztrált klinikai vizsgálatokés a regisztráció utáni használati tapasztalatban.
A regisztrált mellékhatások gyakorisága szerint vannak osztályozva: nagyon gyakran (≥14 0), gyakran (≥1/100,<110), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1 1000), очень редко (< 1/10000), частота неизвестна.
Ritkán: pszeudomembranosus colitis, candidiasis.
Nagyon ritka: gastroenteritis.
A vérből és a nyirokrendszerből
Gyakori: eozinofília.
Nem gyakori: pancytopenia, neutropenia, leukopenia, thrombocytopenia, thrombocytosis.
Ritkán: agranulocytosis.
Nagyon ritka: hemolitikus anaemia, a csontvelő vörös vonalának elnyomása.
Az immunrendszertől
Ritkán: anafilaxiás reakciók.
Mentális oldalról
Nem gyakori: mentális zavarok, beleértve a hallucinációkat és a zavartság állapotát.
Az idegrendszerből
Nem gyakori: görcsök, myoclonus, szédülés, álmosság.
Ritkán: encephalopathia, paresztézia, remegés, ízérzészavar.
Nagyon ritka: a myasthenia gravis súlyosbodása, fejfájás.
Ismeretlen gyakoriság:
izgatottság, dyskinesia.Hallás- és labirintuszavarok
Ritkán: halláskárosodás.
Nagyon ritka: szédülés, fülzúgás.
A szív oldaláról
Nagyon ritka: cianózis, tachycardia, szívdobogásérzés.
Az erek oldaláról
Gyakori: thrombophlebitis.
Nem gyakori: csökkent vérnyomás.
Nagyon ritka: hőhullámok.
A légzőrendszerből, a mellkasi szervekből és a mediastinumból
Nagyon ritka: légszomj, hiperventiláció, torokfájás.
A gyomor-bél traktusból
Gyakori: hasmenés, hányás, hányinger. Az Imipenem + [Cilastatin] gyógyszer alkalmazásakor hányingert és/vagy hányást gyakrabban figyeltek meg granulocitopéniában szenvedő betegeknél.
Ritkán: a fogak és/vagy a nyelv elszíneződése.
Nagyon ritka: vérzéses vastagbélgyulladás, hasi fájdalom, gyomorégés, glossitis, a nyelvpapillák hipertrófiája, fokozott nyálfolyás.
A májból és az epeutakból
Ritkán: májelégtelenség, hepatitis.
Nagyon ritka: fulmináns hepatitis.
A bőrből és a bőr alatti szövetekből
Gyakori: kiütések (beleértve az exantémás kiütéseket is).
Nem gyakori: csalánkiütés, viszketés.
Ritka: toxikus epidermális nekrolízis, angioödéma, Stevens-Johnson szindróma, erythema multiforme, exfoliatív dermatitis.
Nagyon ritka: hyperhidrosis, bőrszerkezeti változások.
A mozgásszervi és a kötőszöveti oldalról
Nagyon ritka: polyarthralgia, fájdalom a mellkasi gerincben.
A vesékből és a húgyutakból
Ritka: akut veseelégtelenség, oliguria/anuria, poliuria, a vizelet színének megváltozása (biztonságos és nem tévesztendő össze a hematuria-val). Az Imipenem+Cilastatin vesefunkció változásában betöltött szerepét nehéz felmérni, mivel általában jelen vannak más, prerenális azotémiára vagy a vesefunkció romlására hajlamosító tényezők.
A nemi szervekből és a mellből
Nagyon ritka: nemi szervek viszketése.
Általános és az alkalmazás helyén fellépő rendellenességek
Nem gyakori: láz, fájdalom és keményedés az injekció beadásának helyén, bőrpír az injekció beadásának helyén.
Nagyon ritka: mellkasi kényelmetlenség, gyengeség/gyengeség.
Laboratóriumi mutatók
Gyakran: a szérum transzaminázok fokozott aktivitása, az alkalikus foszfatáz fokozott aktivitása.
Nem gyakori: pozitív közvetlen Coombs-teszt, megnövekedett protrombin idő, csökkent hemoglobin, megnövekedett szérum bilirubin koncentráció, emelkedett szérum kreatinin koncentráció, megnövekedett vér karbamid nitrogén koncentrációja.
Gyermekek (3 hónapos kor felett)
Egy 178, 3 hónaposnál idősebb gyermek bevonásával végzett klinikai vizsgálatban a megfigyelt mellékhatások hasonlóak voltak a felnőtt betegeknél észleltekhez.
Túladagolás:A túladagolás tünetei összhangban vannak a mellékhatásprofillal, és lehetnek görcsök, zavartság, remegés, hányinger, hányás, csökkent vérnyomás és bradycardia.
Nincs konkrét információ a kábítószer-túladagolás kezeléséről. A nátrium a hemodialízis során kiválasztódik, de ennek az eljárásnak a hatékonysága gyógyszertúladagolás esetén nem ismert.
Kölcsönhatás:A gyógyszer gyógyszerészetileg inkompatibilis a tejsavval (laktáttal), ezért nem szabad azt tartalmazó oldószerekből előállítani. A gyógyszer azonban beadható intravénásan ugyanazon az infúziós rendszeren keresztül, mint a laktátot tartalmazó oldat.
Ha a ganciklovirrel egyidejűleg alkalmazzák, nő a generalizált rohamok kialakulásának kockázata. Ezeket a gyógyszereket nem szabad együtt alkalmazni, kivéve, ha a lehetséges előnyök meghaladják a lehetséges kockázatokat.
A probeneciddel történő egyidejű alkalmazás az imipenem plazmakoncentrációjának és felezési idejének minimális növekedésével jár. ezért a probenecid és a gyógyszer egyidejű alkalmazása nem javasolt.
Ha a gyógyszert valproinsavval vagy nátrium-divalproáttal együtt alkalmazzák, a valproinsav plazmakoncentrációja csökken. E kölcsönhatás eredményeként a valproinsav koncentrációja a terápiás szint alá csökkenhet, ami növeli a görcsrohamok kockázatát.
Bár a kölcsönhatás mechanizmusa nem ismert, adatok ban benvitro és állatkísérletek azt sugallják, hogy a karbapenemek gátolhatják azt a hidrolízist, amely a valproinsav (VPA-g) glükuronid metabolitját valproinsavvá alakítja vissza, ami a valproinsav plazmakoncentrációjának csökkenését eredményezi (lásd: Óvintézkedések).
Antibakteriális gyógyszerek warfarinnal történő egyidejű alkalmazása fokozhatja annak véralvadásgátló hatását. Számos jelentés érkezett az orálisan alkalmazott antikoagulánsok fokozott véralvadásgátló hatásáról, beleértve az egyidejűleg antibakteriális szereket szedő betegeket is.
A kockázat a fertőző kórokozótól, a beteg életkorától és általános állapotától függően változhat, ezért nehéz felmérni, hogy az antibiotikumok milyen hatással vannak a nemzetközi normalizált arány (INR) növelésére. Az antibakteriális gyógyszerek orális antikoagulánsokkal történő egyidejű alkalmazása során és közvetlenül azt követően ajánlott időszakonként ellenőrizni az INR értéket.
A gyógyszert nem szabad ugyanabban a fecskendőben más antibiotikummal keverni, de más antibiotikumokkal (aminoglikozidokkal) egyidejű - izolált - beadása megengedett.
Különleges utasítások:A vizeletet vörösesre színezi (biztonságos, és nem szabad összetéveszteni a vérvizeléssel).
Az intravénás beadásra szánt adagolási forma nem alkalmazható intramuszkuláris beadásra.
A gyógyszer és más béta-laktám antibiotikumok - penicillinek és cefalosporinok - alkalmazása során részleges keresztallergiára utaló jelek vannak. A kezelés megkezdése előtt alapos kórtörténetet kell felvenni a béta-laktám antibiotikumokkal szembeni korábbi allergiás reakciókról. Ha allergiás reakció alakul ki, a gyógyszert azonnal le kell állítani, és meg kell tenni a megfelelő intézkedéseket.
Ha a gyógyszert valproinsavval vagy nátrium-divalproáttal együtt alkalmazzák, a valproinsav plazmakoncentrációja csökken, ami a görcsoldó terápia hatékonyságának csökkenéséhez vezet. Előfordulhat, hogy a valproesav vagy nátrium-divalproát adagjának növelése nem elegendő a kölcsönhatás hatásainak leküzdéséhez. Az imipenem és a valproesav/nátrium-divalproát egyidejű alkalmazása nem javasolt. Valproinsavval vagy nátrium-divalproáttal görcsoldó kezelésben részesülő betegeknél fontolóra kell venni a fertőzések karbapenemektől eltérő antibakteriális gyógyszerekkel történő kezelését. Szükség esetén a gyógyszer alkalmazása további görcsoldó terápiát igényelhet.
Szinte az összes antibakteriális gyógyszer alkalmazásakor pszeudomembranosus colitis kialakulása lehetséges, amelynek súlyossága az enyhétől az életveszélyesig változhat. Ebben a tekintetben a gyomor-bélrendszeri betegségek, különösen a vastagbélgyulladás kórtörténetében szenvedő betegeknek óvatosan kell antibiotikumokat felírniuk. Fontos figyelembe venni a pszeudomembranosus colitis lehetőségét azoknál a betegeknél, akiknél antibakteriális gyógyszerek alkalmazása után hasmenés jelentkezik. Bár a kutatások azt mutatják, hogy az "antibiotikum-asszociált vastagbélgyulladás" fő oka egy toxin által termelt Clostridiumdifficile egyéb lehetséges okokat is figyelembe kell venni. Ha a pszeudomembranosus colitis diagnózisát gyanítják vagy megerősítik, mérlegelni kell a gyógyszeres kezelés megszakításának és a specifikus terápia lefolytatásának lehetőségét. Ne használjon olyan gyógyszereket, amelyek gátolják a bélmozgást.
Más béta-laktám antibiotikumokhoz hasonlóan, Rseudo felsősaeruginosa gyorsan rezisztenciát szerezhet az imipenemmel szemben. Ezért a kezelés során rendszeresen meg kell határozni az érzékenységet Pseudomonas aeruginosa antibiotikumra a klinikai helyzetnek megfelelően.
A rezisztencia kialakulásának megelőzése és az imipenem hatékonyságának a klinikai gyakorlatban való megőrzése érdekében a gyógyszert csak olyan fertőzések kezelésére szabad alkalmazni, amelyeket olyan mikroorganizmusok okoztak, amelyek bizonyítottan (vagy feltételezetten) imipenemre érzékenyek. Ha van információ az azonosított kórokozóról és annak antibiotikum-érzékenységéről, az orvost ez irányítja az optimális antibiotikum kiválasztásához, ennek hiányában pedig regionális epidemiológiai adatok alapján empirikusan választják ki az antibakteriális szert. és érzékenységi adatok.
A májtoxicitás (májtranszaminázok fokozott aktivitása, májelégtelenség, fulmináns hepatitis) kockázata miatt a gyógyszer alkalmazása során a májfunkciót gondosan ellenőrizni kell.
Májbetegségben szenvedő betegeknél a májfunkció állapotát a gyógyszer alkalmazásának időtartama alatt ellenőrizni kell. Nincs szükség dózismódosításra.
Más béta-laktám antibiotikumokhoz hasonlóan központi idegrendszeri (CNS) mellékhatásokról számoltak be: myoclonus, zavartság és görcsrohamok, különösen a vesefunkció és a testtömeg alapján javasolt adagok túllépése esetén. Az ilyen jelenségeket jellemzően központi idegrendszeri károsodásban szenvedő betegeknél (agysérülés vagy görcsrohamok anamnézisében) és/vagy károsodott vesefunkciójú betegeknél figyelték meg, akiknél lehetséges a gyógyszer felhalmozódása. Ebben a tekintetben, különösen az ilyen betegeknél, rendkívül szükséges az ajánlott adagok szigorú betartása (lásd az "Adagolás és alkalmazás" részt).
A görcsrohamban szenvedő betegeknél az antikonvulzív kezelést folytatni kell.
Remegés, myoclonus vagy görcsrohamok esetén a betegeket neurológiai kivizsgálásra kell irányítani, és antikonvulzív kezelést kell előírni, ha azt még nem kezdték el. Ha a központi idegrendszerből származó tünetek továbbra is fennállnak, a gyógyszer adagját csökkenteni kell vagy abba kell hagyni.
A gyógyszer nem alkalmazható olyan betegeknél, akiknél a kreatinin-clearance ≤ 5 ml/perc/1,73 m2, kivéve, ha hemodialízist végeznek legkésőbb 48 órával a gyógyszerinfúzió beadása után. A gyógyszer alkalmazása hemodialízis alatt álló betegeknél csak olyan esetekben javasolt, amikor a kezelés előnyei meghaladják a görcsrohamok kialakulásának lehetséges kockázatát.
3 hónaposnál idősebb gyermekeknél a gyógyszert ugyanazokra az indikációkra használják, mint a felnőtt betegeknél.
Nem áll rendelkezésre elegendő adat az intravénás imipenem-cilasztatin hatásosságára és biztonságosságára vonatkozóan 3 hónaposnál fiatalabb és károsodott vesefunkciójú (szérum kreatinin több mint 2 mg/dl) gyermekeknél.
Az adagolási forma 35,7 mg (1,55 mekv.) nátriumot tartalmaz.
A járművezetési képességre gyakorolt hatás. vö. és szőrme:A gyógyszer vezetési képességre gyakorolt hatásának kutatása járműveket és gépeket nem végezték el. Egyes gyógyszerekkel kapcsolatos mellékhatások (például hallucinációk, szédülés, álmosság és szédülés) befolyásolhatják a gépjárművezetéshez és gépek kezeléséhez szükséges képességeket.
Kiadási forma/adagolás:Por oldatos infúzióhoz, 500 mg+500 mg.
Csomag:500 mg + 500 mg hatóanyag 20 ml vagy 25 ml űrtartalmú, gumidugóval hermetikusan lezárt, alumínium kupakkal préselt üvegcsöves üvegekben vagy 500 mg + 500 mg hatóanyag, vér, infúziós üvegben és 100 ml űrtartalmú transzfúziós gyógyszerek, gumidugóval lezárva és alumínium kupakkal préselve.
1, 5 vagy 10 palack 20 ml vagy 25 ml űrtartalmú gyógyszert különálló kartondobozokba helyeznek a használati utasítással együtt.
1 db 100 ml-es kábítószer-palack egyedi kartondobozba kerül a használati utasítással együtt.
25 db 20 ml-es vagy 25 ml-es palack a gyógyszerből, a palackok számának megfelelő használati utasítással, kartondobozba kerül fogyasztói csomagoláshoz (kórházak számára).
35 100 ml-es palackot a gyógyszerből hullámkarton dobozokba helyeznek, a palackok számának megfelelő használati utasítással (kórházak számára).
Tárolási feltételek:Fénytől védett helyen, 25 °C-ot meg nem haladó hőmérsékleten.
Gyermekek elől elzárva tartandó.
Legjobb megadás dátuma:3 év.
Ne használja a lejárati idő után.
Kraspharma OJSCSzármazási ország
OroszországTermékcsoport
Antibakteriális gyógyszerekAntibiotikum, karbapenem + dehidropeptidáz inhibitor
Kiadási űrlapok
- ind/csomag
Az adagolási forma leírása
- Az oldatos infúzió elkészítéséhez használt por fehér vagy fehér, sárgás árnyalattal.
Farmakokinetika
Az imipenem maximális koncentrációja (Cmax) intravénásan 250 mg, 500 mg, 1000 mg dózisban 20 perc alatt 14-24 mcg/ml, 21-58 mcg/ml, illetve 41-83 mcg/ml. A cilasztatin Cmax-értéke intravénásan 250 mg, 500 mg, 1000 mg dózisban 20 percig - 15-25 mcg/ml, 31-49 mcg/ml, 56-80 mcg/ml. Az imipenem beadott adagjának 20%-a és a cilasztatin 40%-a reverzibilisen kötődik a plazmafehérjékhez. Az imipenem jól és gyorsan eloszlik a legtöbb szövetben és testnedvben. A legmagasabb koncentrációt a pleurális folyadékban, a peritoneális és intersticiális folyadékokban, valamint a reproduktív szervekben érik el. Alacsony koncentrációban megtalálható a cerebrospinális folyadékban (CSF). A megoszlási térfogat felnőtteknél 0,23-0,31 l/kg, 2-12 éves gyermekeknél - 0,7 l/kg, újszülötteknél -0,4-0,5 l/kg. A gyógyszer mindkét komponense elsősorban a vesén keresztül választódik ki (70-76% 10 órán belül) glomeruláris filtrációval (2/3) és aktív tubuláris szekrécióval (1/3): 1-2% a belekben és 20-20- 25%-a extrarenális úton (mechanizmus ismeretlen). Intravénás beadás esetén az imipenem és a cilasztatin felezési ideje (T1/2) felnőtteknél 1 óra, 2-12 éves gyermekeknél - 1-1,2 óra, újszülötteknél az imipenem T1/2 - 1,7-2,4 óra, cilasztatin -3,8-8,4 óra; károsodott veseműködés esetén imipenem T1/2 - 2,9-4 óra Cilastatin - 13,3-17,1 óra Az imipenem és a cilastatin gyorsan és hatékonyan (73-90%) ürül hemodialízissel (3 órás kezelés eredményeként) időszakos hemofiltráció esetén a beadott dózis 75%-a).Különleges körülmények
Nem ajánlott agyhártyagyulladás kezelésére. Az ajánlott adagolás és adagolási rend szigorú betartása szigorúan szükséges, különösen a görcsrohamokra hajlamos betegeknél. Azoknál a betegeknél, akiknek anamnézisében epilepszia szerepel, a görcsoldó terápiát a gyógyszeres kezelés teljes időtartama alatt folytatni kell. Ha helyi tremort, myoclonust vagy görcsrohamokat észlelnek, a betegeket neurológiai vizsgálatnak kell alávetni, és görcsoldó terápiát kell felírni. Ebben az esetben a gyógyszer adagját felül kell vizsgálni annak eldöntésére, hogy csökkenteni kell-e, vagy abba kell hagyni a gyógyszer szedését. Az adagolási forma 37,56 mg (1,63 mEq) nátriumot tartalmaz. A kezelés megkezdése előtt alapos kórtörténetet kell felvenni a béta-laktám antibiotikumokkal szembeni korábbi allergiás reakciókról. Ha allergiás reakció alakul ki, a gyógyszert azonnal le kell állítani. Azoknál az egyéneknél, akiknek a kórtörténetében gyomor-bélrendszeri betegségek (különösen a vastagbélgyulladás) szerepelnek, fokozott a pszeudomembranosus colitis kialakulásának kockázata. A gyógyszer alkalmazása során, mind a beadás alatt, mind 2-3 hét után. a kezelés leállítása után Clostridium difficile (pszeudomembranosus colitis) okozta hasmenés alakulhat ki. Enyhe esetekben elegendő a kezelés abbahagyása és az ioncserélő gyanták (kolesztiramin, kolesztipol) alkalmazása, súlyos esetekben a folyadék-, elektrolit- és fehérjeveszteség pótlása, vankomicin és metronidazol kijelölése javasolt. Ne használjon olyan gyógyszereket, amelyek gátolják a bélmozgást. Más béta-laktám antibiotikumokhoz hasonlóan a Pseudomonas aeruginosa is gyorsan rezisztenciát alakíthat ki a gyógyszerrel szemben a kezelés során. Ezért a Pseudomonas aeruginosa által okozott fertőzések kezelése során a klinikai helyzetnek megfelelően időszakos antibiotikum érzékenységi vizsgálat elvégzése javasolt. Az idős betegek valószínűleg életkorral összefüggő vesekárosodásban szenvednek, ami dóziscsökkentést tehet szükségessé. A vizeletet vörösesre színezi. A gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre gyakorolt hatás Óvatosan kell eljárni, ha gépjárművet vezet és olyan potenciálisan veszélyes tevékenységet folytat, amely fokozott figyelmet és a pszichomotoros reakciók sebességét igényli.Összetett
- 1 fl.
- imipenem (monohidrát) 500 mg
- cilastatin (cilasztatin-nátrium formájában) 500 mg
- Segédanyagok: 20 mg nátrium-hidrogén-karbonát.
Imipenem+Cilastatin használati javallatok
- A gyógyszerre érzékeny mikroorganizmusok által okozott fertőző és gyulladásos betegségek:
- - alsó légúti fertőzések;
- - Húgyúti fertőzések;
- - intraabdominalis fertőzések;
- - nőgyógyászati fertőzések;
- - bakteriális szepszis;
- - csontok és ízületek fertőzései;
- - a bőr és a lágyszövetek fertőzései;
- - bakteriális endocarditis.
- A posztoperatív fertőzéses szövődmények megelőzése
Imipenem+Cilastatin ellenjavallatok
- - túlérzékenység a gyógyszer egyik összetevőjére, valamint más karbapenemekre, béta-laktám antibiotikumokra, penicillinekre és cefalosporinokra;
- - krónikus veseelégtelenség CC-vel kevesebb, mint 5 ml/perc/1,73 m2 hemodialízis nélkül;
- - korai gyermekkor (legfeljebb 3 hónap);
- - gyermekeknél - súlyos veseelégtelenség (szérum kreatinin koncentráció több mint 2 mg/dl).
- Gondosan
- Központi idegrendszeri (CNS) betegségek, pszeudomembranosus colitis, gyomor-bélrendszeri betegségben szenvedő betegek, akiknél a kreatinin-clearance kevesebb, mint 70 ml/perc/1,73 m2, hemodializált betegek, antikonvulzív terápia valproinsavval (a terápia csökkent hatékonysága), idős kor.
- Használata terhesség és szoptatás alatt
- Terhesség alatti alkalmazása csak akkor megengedett, ha a kezelés lehetséges előnye az anyára nézve meghaladja a magzatra gyakorolt lehetséges kockázatot.
- Az imipenem és a cilasztatin kis mennyiségben átjut az anyatejbe, ezért mérlegelni kell a szoptatás leállításának kérdését.
Imipenem+Cilastatin adagolás
- 500 mg+500 mg
Imipenem+Cilastatin mellékhatások
- A központi idegrendszer részéről: szédülés, álmosság, myoclonus, mentális zavarok, hallucinációk, zavartság, görcsök, paresztézia, encephalopathia, remegés, fejfájás, vertigo.
- Érzékszervekből: halláscsökkenés, fülzúgás, ízérzés zavara.
- A húgyúti rendszerből: oliguria, anuria, polyuria, akut veseelégtelenség, a vizelet színének megváltozása.
- Az emésztőrendszer részéről: hányinger, hányás, hasmenés, pszeudomembranosus vastagbélgyulladás, vérzéses vastagbélgyulladás, hepatitis (beleértve a fulminánst is), májelégtelenség, sárgaság, gyomor-bélhurut, hasi fájdalom, glossitis, a nyelvpapillák hipertrófiája, a fogak vagy a nyelv elszíneződése, fájdalom torok, fokozott nyálfolyás, gyomorégés.
- A légzőrendszerből: mellkasi kellemetlenség, légszomj, hiperventiláció.
- A vérképző szervekből: eosinophilia. leukopenia, neutropenia, agranulocytosis, thrombocytopenia, thrombocytosis, monocytosis, limfocitózis, leukocitózis, basophilia, pancytopenia, csontvelői vérképzés gátlása, hemolitikus anémia.
- Laboratóriumi mutatók: megnövekedett máj transzaminázok és alkalikus foszfatáz aktivitás, laktát-dehidrogenáz, hypercreatininaemia, hyperbilirubinémia, megnövekedett karbamid-nitrogén-koncentráció; hamis pozitív közvetlen Coombs-teszt; a hemoglobin és a hematokrit csökkenése, a protrombin idő megnyúlása; az alacsony sűrűségű lipoproteinek fokozott koncentrációja; hyponatraemia, hyperkalaemia, hypochloraemia; fehérje, vörösvértestek, leukociták, gipsz megjelenése, megnövekedett bilirubin koncentráció a vizeletben.
- Allergiás reakciók: bőrkiütés, viszketés, csalánkiütés, erythema multiforme, Stevens-Johnson szindróma, angioödéma, toxikus epidermális nekrolízis, exfoliatív dermatitis, láz, anafilaxiás reakciók.
- A szív- és érrendszerből: csökkent vérnyomás, szívdobogásérzés, tachycardia.
- Helyi reakciók: bőrhiperémia, fájdalmas beszűrődés az injekció beadásának helyén, phlebitis/thrombophlebitis.
- Egyéb: candidiasis, hüvelyi viszketés, cianózis, hyperhidrosis, polyarthralgia, asthenia, égő érzés a szegycsont mögött, fájdalom a mellkasi gerincben.
Gyógyszerkölcsönhatások
Gyógyszerészetileg összeférhetetlen a tejsav sóival és más antibiotikumok oldataival. Penicillinek és cefalosporinok egyidejű alkalmazása esetén keresztallergia lehetséges; antagonizmust mutat más béta-laktám antibiotikumokkal (penicillinek, cefalosporinok és monobaktámok) szemben. Ha a ganciklovirrel egyidejűleg alkalmazzák, nő a generalizált rohamok kialakulásának kockázata. Ezeket a gyógyszereket nem szabad együtt alkalmazni, kivéve, ha a lehetséges előnyök meghaladják a lehetséges kockázatokat. A tubuláris szekréciót gátló gyógyszerek kismértékben növelik az imipenem plazmakoncentrációját és T1/2-ét (ha nagy imipenemkoncentrációra van szükség, ezeknek a gyógyszereknek az egyidejű alkalmazása nem javasolt). A gyógyszer alkalmazása során a valproinsav szérumkoncentrációja csökken, ami a görcsoldó terápia hatékonyságának csökkenéséhez vezet, ezért a kezelési időszak alatt javasolt a valproinsav szérumkoncentrációjának monitorozása.Túladagolás
Túladagolás esetén javasolt a gyógyszer abbahagyása és tüneti és szupportív terápia előírása. Az imipenem hemodialízissel ürül ki.Tárolási feltételek
- gyerekektől távol tartandó
- fénytől védett helyen tároljuk
Kereskedelmi név:
Imipenem cilasztatinnal.
Nemzetközi név:
Imipenem + [Cilastatin] - Imipenem + [Cilastatin]
Csoporttagság:
Antibiotikum - karbapenem + dehidropeptidáz inhibitor.
A hatóanyag leírása (INN):
Imipenem + [Cilastatin]
Dózisforma:
Por intravénás beadásra szánt oldat készítéséhez; por oldatos infúzió készítéséhez; por intramuszkuláris beadásra szánt oldat készítéséhez.
Farmakológiai hatás:
A gyógyszer széles spektrumú béta-laktám antibiotikum. Hatásának köszönhetően a baktériumsejtfal szintézise elnyomódik, és baktericid hatást fejt ki a Gram-negatív és Gram-pozitív mikroorganizmusok széles skálájával szemben, anaerob és aerob. Az imipenem a tienamicin származéka, és a karbapenemek csoportjába tartozik. A dehidropeptidázt (az imipenemet a vesében metabolizáló enzim) a cilasztatin-nátrium gátolja, ezáltal jelentősen megnöveli a változatlan imipenem koncentrációját a húgyúti rendszerben. A cilasztatinnak nincs saját antibakteriális hatása, és nem gátolja a bakteriális béta-laktamázt. Élő szervezetben (in vivo) érzékenységet mutatnak: Gram-pozitív anaerobok - Propionibacterium spp., Peptostreptococcus spp., Peptococcus spp., Eubacterium spp., Clostridium spp., Bifidobacterium spp.; Gram-negatív anaerobok - Bacteroides spp., beleértve a B. fragilist, Fusobacterium spp.; Gram-pozitív aerobok - Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus agalactiae (B-csoportú streptococcusok), Staphylococcus epidermidis (beleértve a penicillináz-képző törzseket), Enterococcus faecalis, Staphylococcus penicillinase (beleértve a penicillinse formát is); Gram-negatív aerobok - Serratia spp. (beleértve a S. Marcescenst), Pseudomonas aeruginosa, Providencia rettgeri, Morganella morganii, Proteus vulgaris, Klebsiella spp., Haemophilus parainfluenzae, Haemophilus influenzae, Gardnerella vaginalis, Escherichia coli, Citrobacterppobaccin. In vitro érzékenységet mutatnak (a klinikai hatékonyságot nem állapították meg): Gram-negatív anaerobok - Veillonella spp., Prevotella melaninogenica, Prevotella disiens, Prevotella bivia; Gram-pozitív aerobok - Streptococcus spp. C, G és viridans, Staphylococcus saprophyticus, Nocardia spp., Listeria monocytogenes, Bacillus spp.; gram-negatív aerobok - Providencia stuartii, Pasteurella spp., Neisseria gonorrhoeae (beleértve a penicillináz-képző törzseket), Haemophilus ducreyi, Capnocytophaga spp., Alcaligenes spp., Aeromonas hydrophila. A gyógyszer hatására érzéketlenek: Pseudomonas cepacia, Xanthomonas maltophilia, meticillinrezisztens Staphylococcus spp., Enterococcus faecium. In vitro szinergikusan hat az aminoglikozidokkal a Pseudomonas aeruginosa egyes törzsei ellen.
Javallatok:
Intramuszkuláris beadásra: érzékeny mikroorganizmusok által okozott enyhe és közepes fertőzések - bőr alatti szövetek és bőr fertőzései, nőgyógyászati és intraabdominalis fertőzések, alsó légúti fertőzések kezelésére. Intravénás beadásra: érzékeny mikroorganizmusok által okozott súlyos fertőzések kezelése - bőr alatti szövetek és bőr fertőzései, szuper- és társfertőzések, endocarditis, ízületi és csontfertőzések, vérmérgezés, nőgyógyászati és intraabdominalis fertőzések, húgyúti fertőzések ( szövődménymentes és bonyolult), alsó légutak.
Ellenjavallatok:
Túlérzékenység (beleértve a karbapenemeket és más béta-laktám antibiotikumokat), terhesség esetén (kizárólag „létfontosságú” indikációk esetén); központi idegrendszeri fertőzések gyermekeknél, krónikus veseelégtelenség legfeljebb 30 kg testtömegű gyermekeknél, krónikus veseelégtelenség (a kreatinin-clearance kevesebb, mint 5 ml/perc hemodialízis nélkül). Az intramuszkuláris injekciós szuszpenziók esetében, amelyeket lidokain mint oldószer hozzáadásával készítenek, fokozott érzékenység figyelhető meg az amidcsoport helyi érzéstelenítőivel szemben, az intrakardiális vezetés és a sokk károsodása figyelhető meg. Tilos további alkalmazása intramuszkuláris beadásra 12 év alatti gyermekek számára.
Mellékhatások:
Helyi reakciók: thrombophlebitis, fájdalmas infiltrátum az injekció beadásának helyén, bőrhiperémia.
Allergiás reakciók: anafilaxiás reakciók, láz, exfoliatív dermatitis (ritka), toxikus epidermális nekrolízis (ritka), angioödéma, Steven-Johnson szindróma, exudatív erythema multiforme, csalánkiütés, viszketés, bőrkiütés.
A vérképző szervekből: hemolitikus anémia, a csontvelő vérképzésének elnyomása, pancytopenia, basophilia, limfocitózis, monocitózis, thrombocytosis, thrombocytopenia, agranulocytosis, neutropenia, leukopenia, eosinophilia.
Az érzékszervekből: halláskárosodás, fülzúgás, halláscsökkenés.
Az emésztőrendszer részéről: fokozott nyálfolyás, torokfájás, a nyelv és a fogak elszíneződése, a nyelvpapillák hipertrófiája, glossitis, hasi fájdalom, gastroenteritis, sárgaság, májelégtelenség, vérzéses vastagbélgyulladás, pszeudomembranosus vastagbélgyulladás, hasmenés, hányás, hányinger; hepatitis (ritka esetekben).
A húgyúti rendszerből: a vizelet színének megváltozása, polyuria, anuria, oliguria; akut veseelégtelenség (ritka esetekben).
A szív- és érrendszerből: szívdobogásérzés, tachycardia, csökkent vérnyomás.
Az idegrendszer részéről: szédülés, fejfájás, remegés, encephalopathia, álmosság, szédülés, paresztézia, görcsök, zavartság, hallucinációk, mentális zavarok, myoclonus.
Egyéb: égő érzés a szegycsont mögött, asthenia, polyarthralgia, hyperhidrosis, cianózis, hüvelyi viszketés, candidiasis.
Laboratóriumi mutatók: gipsz, leukociták, fehérje, eritrociták megjelenése a vizeletben; hyperchloraemia, hyperkalaemia, hyponatraemia; a protrombin idő megnyúlása, a hematokrit és a Hb csökkenése; közvetlen pozitív Coombs-teszt; a karbamid-nitrogén megnövekedett koncentrációja, hiperkreatininémia, hiperbilirubinémia, LDH, a „máj” transzaminázok és az alkalikus foszfatáz fokozott aktivitása.
Használati utasítás és adagolás:
Beadás intramuszkulárisan és intravénásan. Az adagokat az imipenemben adják meg. Bakteriális szepszis, endocarditis és más súlyos és életveszélyes fertőzések, köztük a Pseudomonas aeruginosa által okozott alsó légúti fertőzések kezelésének kezdeti szakaszában, valamint súlyos szövődmények esetén.
Az infúziós oldatot palackban készítik 100 ml oldószer hozzáadásával - 0,9% -os nátrium-klorid-oldat (NaCl), 10% -os vizes dextrózoldat, 5% -os dextrózoldat stb. A kapott oldatban az imipenem koncentrációja 5 mg/1 ml legyen. Minden 250-500 mg-ot intravénásan kell beadni 20-30 perc alatt, és minden 750-1000 mg-ot 40-60 perc alatt. Ha az oldat befecskendezésekor hányinger lép fel, csökkenteni kell az adagolás sebességét. Az alábbiakban megadott dózisok a páciens 70 kg-os testtömegétől és CC 70 ml / perc / 1,73 négyzetmétertől számítva. m és így tovább. 70 ml/perc/1,73 nm-nél kisebb CC-vel rendelkező betegek. vagy/vagy alulsúlyosnak arányosan csökkentett adagot kell kapnia.
70 kg vagy annál nagyobb testtömegű és CC 71 ml / perc / 1,73 négyzetméteres betegeknél. m, az adagolási rend a következő: kórokozók túlérzékenysége esetén (beleértve a gram-pozitív és gram-negatív anaerobokat és aerobokat): enyhe súlyosság esetén - 250 mg 6 óránként (napi adag - 1 g); mérsékelt súlyosság esetén 500 mg-ot vegyen be 6 vagy 8 óránként (napi adag - 2 vagy 1,5 gramm); életveszélyes fertőzések esetén - 0,5 g-ot vegyen be 6 óránként (napi adag - 1 g); szövődmények nélküli húgyúti fertőzések esetén - vegyen be 250 mg-ot 6 óránként (napi adag - 2 g); szövődményekkel járó húgyúti fertőzések esetén - vegyen be 500 mg-ot 6 óránként (napi adag - 2 g). A kórokozók (főleg a Pseudomonas aeruginоsa bizonyos törzsei) mérsékelt érzékenysége esetén: enyhe súlyosság esetén 500 mg-ot kell bevenni 6 óránként (napi adag - 2 g); közepes súlyosság esetén - 0,5 g 6 óránként (napi adag - 2 g) vagy 1 g 8 óránként (napi adag - 3 g); életveszélyes fertőzések esetén 1 g-ot vegyen be 6 vagy 8 óránként (napi adag - 4 vagy 3 g); szövődmények nélküli húgyúti fertőzések esetén 250 mg-ot vegyen be 6 óránként (napi adag - 1 g); szövődményekkel járó húgyúti fertőzések esetén 0,5 g-ot kell bevenni 6 óránként (napi adag – 2 g). Tekintettel arra, hogy a gyógyszer nagy antimikrobiális hatással rendelkezik, a dózis nem adható 50 mg/ttkg/nap (vagy napi 4 g) felett. A 12 évesnél idősebb, cisztás fibrózisban szenvedő betegek napi 90 mg/ttkg-ig, de legfeljebb 4 g-ig írhatók fel naponta.
Legfeljebb 70 kg-os vagy 71 ml/perc/1,73 négyzetméternél kisebb CC-vel rendelkező betegeknél. m) Először meg kell határozni a teljes napi adagot, amely megfelel a 70 kg-os és krónikus veseelégtelenségben szenvedő betegeknek. 1 g/nap teljes napi adagban alkalmazva: 71 / ml / perc / 1,73 négyzetméter feletti CC-vel. m. és 70 kg feletti testtömegű, vegyen be 250 mg-ot 6 óránként; 71 feletti CC és 60 kg testsúly esetén 250 mg-ot vegyen be 8 óránként; 71 év feletti CC-vel és 40-50 kg testtömeggel - 125 mg 6 óránként; 71 feletti CC-vel és 30 kg súlyú - 125 mg 8 óránként. 41-től 70-ig terjedő CC-vel és 70 kg-os testtömeggel 250 mg-ot vegyen be 8 óránként; CC-vel 41-70 és súly 50-60 kg - 125 mg 6 óránként; CC-vel 41-70 és testtömeg 50-60 kg - 125 mg 8 óránként. 21 és 40 közötti és 60 kg feletti testtömegű CC esetén naponta kétszer 250 mg-ot vegyen be; 21-40 CC-vel és 50 kg súlyú - 125 mg 8 óránként; 21-40 CC-vel és 30-40 kg testtömeggel - 125 mg 12 óránként. 6-20 közötti CC-vel és 70 kg feletti testtömeggel 250 mg-ot vegyen be naponta kétszer; CC-vel 6-20 és 30-60 kg súlyú - 125 mg naponta kétszer. 1,5 g/nap teljes napi adag esetén: 71 CC és 70 kg testtömeg esetén 8 óránként 500 mg-ot vegyen be; CC-vel 71-től és súlya 50-60 kg - 250 mg 6 óránként; CC-vel 71 éves kortól és 40 kg testtömeggel - naponta háromszor, 250 mg; 71 CC-vel és 30 kg súllyal - 125 mg 6 óránként. CC-vel 41-től 70-ig és súlya 70-ig - 6 óránként, 250 mg; CC-vel 41-70 és súly 50-60 kg - 250 mg naponta háromszor; CC-vel 41-70 és súly 40 kg - 6 óránként, 125 mg; CC-vel 41-70 és 30 kg súlyú - 8 óránként, 125 mg. Minőségellenőrzéssel 21-től 40-ig és 60 kg-os tömeggel - 8 óránként, 250 mg; 21-40 CC-vel és 50 kg súlyú - 250 mg naponta kétszer; CC-vel 21-40 és 30-40 kg súlyú - 8 óránként, 125 mg. 6-20 CC-vel és 50 kg súlyú - 250 mg naponta kétszer; 6-20 CC-vel és 30-40 kg súlyú - 125 mg naponta kétszer. 2 g/nap teljes napi adag alkalmazása esetén: CC 71-től és 70 kg-tól - 500 mg 6 óránként; CC 71-től és súlya 60 kg - 500 mg 8 óránként; CC 71 és 40 és 50 kg között - 250 mg 6 óránként; 71 CC-vel és 30 kg súllyal - 250 mg 8 óránként. 41-től 70-ig terjedő CC-vel és 70 kg-os testtömeggel 8 óránként 500 mg-ot vegyen be; 41-70 CC-vel és 50-60 kg súlyú - 250 mg 6 óránként; 41-70 CC-vel és 40 kg súlyú - 250 mg 8 óránként; CC-vel 41-70 és 30 kg súlyú - 125 mg 6 óránként. 21-től 40-ig terjedő CC és 70 kg-os testsúly esetén 250 mg-ot vegyen be 6 óránként; 21-40 CC-vel és 50-60 kg súlyú - 250 mg 8 óránként; 21-40 CC-vel és 40 kg súlyú - 250 mg naponta kétszer; CC-vel 21-40 és 30 kg súlyú - 125 mg 8 óránként. 6-tól 20-ig terjedő CC-vel és 40 kg-os testtömeggel 250 mg-ot vegyen be naponta kétszer; 6-20 CC-vel és 30 kg testtömeggel - naponta kétszer, 125 mg. 3 g/nap teljes napi adag alkalmazása esetén: 71 CC és 70 kg testtömeg esetén 8 óránként 1 g-ot vegyen be; 71 CC-vel és 60 kg tömeggel - 750 mg 8 óránként; 71 CC-vel és 50 kg tömeggel - 500 mg 6 óránként; CC 71-től és súlya 40 kg - 500 mg 8 óránként; 71 CC-vel és 30 kg súllyal - 250 mg 6 óránként. 41-70 CC-vel és 70 kg-os testtömeggel 500 mg-ot vegyen be 6 óránként; 71 CC-vel és 50-60 kg testtömeggel - 500 mg 8 óránként; 71 CC-vel és 40 kg tömeggel - 250 mg 6 óránként; 71 CC-vel és 30 kg súllyal - 250 mg 8 óránként. 21-40 CC-vel és 60 kg-os testtömeggel - 500 mg 8 óránként; 21-40 CC-vel és 50 kg súlyú - 250 mg 6 óránként; CC-vel 21-40 és 30-40 kg súlyú - 250 mg 8 óránként. 6-tól 20-ig terjedő és 60 kg-os testtömegű CC esetén 500 mg-ot vegyen be naponta kétszer; 6-20 CC-vel és 30-50 kg súlyú - 250 mg naponta kétszer. 4 g/nap teljes napi adag esetén: 71 CC és 70 kg testtömeg esetén 1000 mg-ot 6 óránként; CC 71-től és súlya 60 kg - 1000 mg 8 óránként; 71 CC-vel és 50 kg tömeggel - 750 mg 8 óránként; 71 CC-vel és 40 kg tömeggel - 500 mg 6 óránként; 71 CC-vel és 30 kg súllyal - 500 mg 8 óránként. CC-vel 41-70 és súlya 60-750 mg 8 óránként; 41-70 CC-vel és 50 kg súlyú - 500 mg 6 óránként; 41-70 CC-vel és 40 kg súlyú - 500 mg 8 óránként; CC-vel 41-70 és 30 kg súlyú - 250 mg 6 óránként. 21-40 CC-vel és 70 kg-os testtömeggel - 500 mg 6 óránként; 21-40 CC-vel és 50-60 kg súlyú - 500 mg 8 óránként; 21-40 CC-vel és 40 kg súlyú - 250 mg 6 óránként; CC-vel 21-40 és 30 kg súlyú - 250 mg 8 óránként. 6-tól 20-ig terjedő CC-vel és 50 kg-os testtömeggel - 500 mg 12 óránként; 6-20 CC-vel és 30-40 kg súlyú - 250 mg 12 óránként. A CC 6-20 betegeknek a legtöbb esetben 125-500 mg-ot írnak fel 12 óránként, mivel ha 12 óránként 500 mg-ot írnak fel, megnő a görcsrohamok kockázata. Azok a betegek, akiknek kreatinin-clearance-e kisebb, mint 6 ml/perc/1,73, az előírás szerint kapják a gyógyszert, ha 2 napig hemodialízist végeznek, és az adagok megfelelnek a 6-20 ml/perc/1,73 négyzetméteres kreatinin-clearance-ű betegeknek előírt adagoknak. m) A hemodialízis során az imipenem és a cilasztatin eltávolításra kerül, így a gyógyszert a beavatkozás után adjuk be, majd naponta kétszer ismételjük. A központi idegrendszeri fertőzésben szenvedő és hemodialízis alatt álló betegek az előírás szerint kapják a gyógyszert, ha a valószínű kockázat kisebb, mint a várt haszon. Gyermekek 3 hónapos kortól. 15-25 mg/ttkg adagot vegyen be 6 óránként (kivétel: központi idegrendszeri fertőzések). Kórokozókkal szembeni túlérzékenység esetén a teljes napi adag nem haladhatja meg a 2 g-ot, közepes érzékenység esetén a 4 g-ot Cisztás fibrózis esetén 90 mg/ttkg/nap feletti adagokat írnak elő. 3 hónaposnál fiatalabb (1,5 kg-os testtömegű) gyermekek számára: korai neonatális időszakban (7 napos korig) - 12 óránként, 25 mg/kg; a késő újszülöttkori időszakban (8-28 napos kor között) - 8 óránként, 25 mg / kg; 1-3 hónapos korban - 6 óránként, 25 mg / kg. 500 mg-ig terjedő adagot 15-30 perc alatt, 500 mg felett 40-60 perc alatt adnak be. A gyógyszert nem írják fel központi idegrendszeri fertőzésben vagy krónikus veseelégtelenségben szenvedő gyermekeknek (30 kg-ig). Ha intravénásan adják be az alsó légúti, a bőr alatti szövetek és a bőr fertőzéseiben, valamint enyhe vagy közepes súlyosságú nőgyógyászati fertőzésekben szenvedő betegeknek, 500-750 mg-ot írnak fel 12 óránként (az adag a betegség súlyosságától függ). . Az intraabdominális fertőzések kezelése esetén a gyógyszert 750 mg-os adagban írják fel 12 óránként. A gyógyszert 2-es átmérőjű és legalább 21-es méretű tűvel adják be mélyen egy nagy izomba. A port 2 ml 1%-os lidokain-hidroklorid oldattal (adrenalin nélkül), 0,9%-os NaCl-oldattal vagy injekcióhoz való vízzel keverjük addig, amíg homogén, enyhén sárga vagy fehér szuszpenziót nem kapunk. A maximális megengedett napi adag 1,5 g A kezelést a betegség tüneteinek megszűnése után további 2 napig kell folytatni. A kezelés biztonsága és hatékonysága 20 ml/perc/1,73 négyzetméteres CC-s betegeknél. m., valamint a gyógyszer 2 hetes alkalmazása után nem vizsgálták.
Különleges utasítások:
A gyógyszer nem javasolt meningitis kezelésére. A gyógyszer alkalmazása után a vizelet vörös színűvé válik. Az intravénás beadásra szánt adagolási forma nem használható intramuszkuláris beadásra és fordítva. A kezelés megkezdése előtt a béta-laktám antibiotikumokkal szembeni korábbi allergiás reakciók alapos anamnézisét kell felvenni. Azoknál a személyeknél, akiknek kórtörténetében gyomor-bélrendszeri betegségek (különösen vastagbélgyulladás) szerepelnek, fokozott a pszeudomembranosus colitis kialakulásának kockázata. A központi idegrendszeri mellékhatások megelőzése érdekében a gyógyszeres kezelés minden szakaszában be kell tartani az antiepileptikus gyógyszeres kezelés folytatását azoknál a betegeknél, akiknek anamnézisében görcsrohamok vagy traumás agysérülés szerepel. Nem szabad megfeledkezni arról, hogy az idős betegek vesekárosodásban szenvedhetnek, ami miatt szükség lehet az adag csökkentésére.
Kölcsönhatás:
A gyógyszer gyógyszerészetileg nem kompatibilis az antibakteriális gyógyszerekkel, beleértve a tejsav sóit. Cefalosporinokkal és penicillinekkel történő egyidejű alkalmazás esetén keresztallergia léphet fel. Antagonizmust mutat más béta-laktám antibiotikumokkal (monobaktámok, cefalosporinok és penicillinek) szemben. A generalizált (általános) rohamok kialakulásának kockázata nő, ha a ganciklovirral párhuzamosan alkalmazzák. A gyógyszer hatása miatt a vaplproinsav koncentrációja a vérben jelentősen csökken, ami a görcsrohamok megállítására (előfordulásának megelőzésére) irányuló terápia hatékonyságának csökkenéséhez vezethet. A tubuláris szekréciót gátló gyógyszerek enyhén növelik az imipenem plazmakoncentrációját és T1/2-ét (ha szükséges az imipenem magas koncentrációja, ezeknek a gyógyszereknek az egyidejű alkalmazása nem javasolt).
Az Imipenem és a cilasztatin gyógyszer ezen leírása gyógyszerészeti és egészségügyi szakemberek számára készült, és nem használható útmutatóként az önkezeléshez. Az információkat nem szabad hivatalosnak tekinteni, mivel csak tájékoztató jellegűek.
5R,6S)-6-[(1R)-1-hidroxi-etil]-3-((2-[(imino-metil)-amino]-etil)-tio)-7-oxo-1-azabiciklohept-2-én-2-karbonsav
Kémiai tulajdonságok
Ez az antibiotikum a karbapenemek, a béta-laktamát antibakteriális szerek csoportjába tartozik. Általában az ilyen típusú anyagok jobban ellenállnak béta-laktamázok , széles hatásspektrummal rendelkeznek. Ez az anyag származék tienamicin . Gyakran más gyógyszerekkel együtt alkalmazzák. A kémiai vegyület molekulatömege = 299,3 gramm/mol. Az Imipenem felszabadulási formája oldat (liofilizátum az oldat elkészítéséhez) intravénás vagy intramuszkuláris beadásra.
farmakológiai hatás
Bakteriális , antibakteriális , antimikrobiális .
Farmakodinamika és farmakokinetika
Az imipenem gátolja a bakteriális sejtfalak szintézisét. Az anyag a felé aktív aerobic És anaerob mikroorganizmusok , azonban nincs hatással a gombavilágra. Az antibiotikumot nem lehet lebontani bakteriális béta-laktamáz enzimek , cefalosporinázok És penicillináz , ezért hatásos olyan esetekben, amikor más, azonos típusú gyógyszerek tehetetlenek.
Ez az anyag hatással van a staphylococcusok , Listeria monocytogenes , streptococcusok B, C csoportja És G , Eneterococcusok , Bacillus spp. , Nocardia spp. , viridans streptococcusok amelyek a csoporthoz tartoznak Viridans , Citrobacter spp. , Acinetobacter spp . és néhányan ellenállnak törzsek.
A Gram-pozitív anaerob baktériumok is érzékenyek a termék hatására - Eubacterium spp. , Bifidobacterium spp. , Peptococcus spp. , Clostridium spp. , Propionibacterium spp. . és gram-negatív anaerobok - Bacteroides spp. , Prevotella disiens , Prevotella bivia , Fusobacterium spp. , Prevotella melaninogenica , VeiIlonella spp. Az antibiotikumnak nincs hatása az életciklusra mikoplazmák , chlamydia , Enterococcus faecium , Xanthomonas maltophilia , gombát , törzsek P. sepacia , vírusok , meticillin-rezisztens staphylococcusok.
Az Imipenem intravénás injekciói lehetővé teszik a gyógyszer maximális plazmakoncentrációjának elérését a beadást követő 15-20 percen belül. A gyógyszer az infúzió után 5 órán keresztül fejti ki hatását. Intramuszkuláris injekciókkal a gyógyszer biológiai hozzáférhetősége körülbelül 95%, a felezési idő pedig 60 perc. A gyógyszer viszonylag alacsony mértékben kötődik a plazmafehérjékhez - akár 20%.
Az anyag metabolizmusa a vesékben történik egy enzim segítségével dehidropeptidáz , amely a béta-laktám gyűrűt hasítja. Ezután a gyógyszer gyorsan és teljesen eloszlik a legtöbb szövetben, szervben és folyadékban (intraokuláris folyadék, üvegtest, köpet, epe, agy-gerincvelői folyadék, myometrium, bőr stb.). Az intravénásan alkalmazott imipenem körülbelül 72%-a 10 órán belül eliminálódik a szervezetből.
Használati javallatok
A gyógyszert felírják:
- a húgyúti rendszer, a hasi szervek, a légutak fertőzéseinek kezelésére;
- nőgyógyászati gyakorlatban;
- nál nél vérmérgezés ;
- ízületi és csontfertőzések kezelésére;
- fertőző betegséggel;
- az antibiotikumokra érzékeny mikroorganizmusok által okozott bőr- és lágyszöveti betegségekre;
- műtét utáni szövődmények megelőzésére.
Ellenjavallatok
A gyógyszer ellenjavallt:
- ha jelen van a hatóanyagon, penicillinek, cefalosporinok , Egyéb béta-laktám antibiotikumok ;
- gyermekek 3 hónapos korig (intravénás) és 12 éves korig (intramuszkulárisan);
- szoptatás alatt;
- veseelégtelenségben szenvedő gyermekek.
Mellékhatások
Kialakulhat:
- bőrkiütések, eozinofília ;
- hányás, az ízérzés torzulása, a májenzimek fokozott aktivitása, pszeudomembranosus vastagbélgyulladás , hányinger;
- fokozott rohamaktivitás, epilepsziás rohamok ;
- nemzetséghez tartozó gomba által okozott bőr- és nyálkahártya-károsodás Candida , anafilaxiás reakciók ;
- fájdalom és kellemetlen érzés az injekció beadásának helyén a gyógyszer intravénás alkalmazása során.
Imipenem, használati utasítás (Módszer és adagolás)
Az adagolás és az alkalmazás módja a betegség súlyosságától, magasságától, súlyától és a beteg testének egyéni jellemzőitől függ. A gyógyszert intravénásan vagy intramuszkulárisan írják fel, a kezelőorvos javaslata alapján.
Az intravénás infúziókat lassan, csepegtetve adják be. Leggyakrabban ezt az adagolási módot alkalmazzák az elején vérmérgezés , endokarditisz vagy egyéb életveszélyes fertőzések fiziológiai károsodás miatt (pl. döbbent ).
Intravénásán a felnőttek és a 12 évesnél idősebb gyermekek napi 1-4 gramm gyógyszert írnak fel. Az infúziókat 6 óránként adják be. 3 hónaposnál idősebb, 4 kg-nál nagyobb testtömegű gyermekek esetében a napi adagot 60 mg/ttkg alapján számítják ki.
Az intramuszkuláris injekciókat 12 éves kortól írják fel. A gyógyszert mélyen az izomba fecskendezik, napi 1-1,5 gramm sebességgel (2 adagban).
A felnőttek maximális napi adagja 4 gramm intravénásan és 1,5 gramm intramuszkulárisan. Gyermekek nem adhatnak be intravénásan 2 grammnál többet a gyógyszerből a nap folyamán.
A 65 év feletti betegeknél a vese- és májfunkció csökken, a szív- és érrendszer működése károsodik. Ezért ennek a betegcsoportnak a kezelését rendkívül óvatosan kell végezni, a minimális aktív és hatásos dózisok előírásával. A vesefunkció gondos ellenőrzése is szükséges.
Túladagolás
Nincsenek adatok a kábítószer-túladagolás eseteiről. Javasolt a gyógyszer abbahagyása és fenntartó terápia előírása. Úgy gondolják, hogy az imipenem kiürül .
Kölcsönhatás
Kombináció Imipenem + Cilasztatin vagy görcsrohamokhoz vezethet.
Eladási feltételek
Receptre.
Különleges utasítások
Különös óvatossággal kell eljárni, amikor a gyógyszert központi idegrendszeri vagy vesebetegségben szenvedő betegeknek írják fel. Az adagolás módosítása javasolt.
Nem szabad elfelejteni és figyelembe kell venni, hogy ha a beteg korábban allergiás reakciókat tapasztalt a béta-laktám antibiotikumok , allergiája alakulhat ki az Imipenemre.
A gyógyszer alkalmazásakor és , ez utóbbi vesegátló dehidropeptidáz . Ez a kombináció az imipenem felhalmozódásához vezethet a vizeletben.
A gyógyszeres kezelés során álpozitív Coombs reakciója .
Gyerekeknek
Gyermekgyógyászati gyakorlatban antibiotikum intravénás injekció formájában alkalmazzák. Szükséges a napi adag módosítása.
Idős
Terhesség és szoptatás alatt
Terhes nők csak akkor írják fel a gyógyszert, ha a várható előny jelentősen meghaladja a magzatra gyakorolt kockázatot. A kezelés ideje alatt jobb, ha abbahagyja a szoptatást.
Imipenem analógokat tartalmazó gyógyszerek
A 4-es szintű ATX kód egyezik:Kombináció Imipenem + Cilasztatin a következő gyógyszerekben szerepel: Aquapenem , Imipenem És Cilasztatin , , Imipenem És cilasztatin-nátrium , Imipenem +Cilastatin injekciós üveg , Cilapenem ,Grimipenem , Cilaspen , Tiepenem .